核黄疸模型大鼠脑细胞损伤及行为学后遗症的研究
2016-07-22刘祎肖农毛振沙
刘祎,肖农,毛振沙
核黄疸模型大鼠脑细胞损伤及行为学后遗症的研究
刘祎,肖农,毛振沙
[摘要]目的探讨核黄疸模型大鼠脑细胞损伤及行为学改变情况。方法25只5日龄Sprague-Dawley大鼠随机分为对照组(n=11)和模型组(n=14)。模型组予小脑延髓池内注射胆红素溶液10μg/g,对照组注射等量生理盐水。观察注射后大鼠的神经行为变化,并记录其体质量;建模后第1天予TUNEL法观察模型组(n=3)脑基底节纹状体神经细胞凋亡情况;余下大鼠均在生后19d行步态分析及横木行走测试,30d行水迷宫实验。结果模型组出现明显神经行为异常,如握拳、角弓反张,且体质量显著低于对照组(F>27.707,P<0.001)。TUNEL染色示模型组基底节纹状体神经细胞凋亡。步态分析中,模型组左右后肢步长均短于对照组(t>4.129,P<0.01),步长差值显著大于对照组(t=-4.415,P<0.001),但步宽与对照组无显著性差异(t=0.462,P=0.649)。横木行走测试中,模型组得分明显低于对照组(t=-3.644,P=0.004)。Morris水迷宫实验中,模型组各时间点逃避潜伏期均长于对照组(F>6.206,P<0.05);穿越平台次数少于对照组(t=3.297,P=0.004)。结论核黄疸模型大鼠具有多项运动功能异常和学习记忆障碍,可分别使用步态分析、横木行走测试及水迷宫实验进行评价。
[关键词]核黄疸;步态分析;横木行走测试;水迷宫实验;大鼠
[本文著录格式]刘祎,肖农,毛振沙.核黄疸模型大鼠脑细胞损伤及行为学后遗症的研究[J].中国康复理论与实践,2016,22 (6):640-644.
CITED AS:Liu Y,Xiao N,Mao ZS.Brain cell injuries and behavioral changes in rats with kernicterus[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(6):640-644.
新生儿高胆红素血症是全球性疾病,影响60%~80%的新生儿[1]。严重的高胆红素血症可导致核黄疸,即高胆红素血症时,游离胆红素通过血脑屏障,沉积于基底节、脑干、小脑及海马等部位造成的脑损伤[2]。核黄疸致死率高,存活率为30%~50%,其中有75%~90%患儿遗留永久神经系统后遗症[3],如肌张力障碍的锥体束外运动失调、手足徐动、听力丧失、智力低下等[2,4]。严重的神经系统后遗症明显影响患儿日常生活质量,给患者、家庭及社会带来巨大精神压力及经济负担。目前,国内外胆红素脑损伤的实验研究多集中于损伤机制、如何有效预防和减轻损伤程度方面,脑损伤神经系统后遗症行为学方面的研究较少。
本实验采用5日龄新生大鼠小脑延髓池注射胆红素溶液的方法构建核黄疸模型[5],探讨该模型行为学改变情况,以期为今后胆红素脑损伤神经系统后遗症运动功能及学习记忆的损伤机制、康复治疗疗效及方案选择的研究奠定基础。
1 材料与方法
1.1实验动物与分组
5日龄Sprague-Dawley大鼠25只,雌雄不限,体质量9~14g,由重庆医科大学实验动物中心提供,许可证号:SCXK(渝)2012-0001。所有动物标准实验室内饲养,自由进水、进食,24h昼夜交替(12h:12h),室温(23±2)℃,湿度约60%。采用随机数字表法将大鼠分为生理盐水对照组(对照组,n=11)和核黄疸模型组(模型组,n=14)。
建模1d后取模型组大鼠3只脑组织行石蜡切片,TUNEL染色,其余大鼠均放回母鼠笼内饲养至19d行步态分析、横木行走测试,30d行水迷宫实验。每项测验两组均为11只大鼠,若实验过程中出现大鼠死亡,则补充至每组11只。
1.2造模
1.2.1胆红素溶液配置
避光称取胆红素(SIGMA)10mg溶于0.5mol/L氢氧化钠0.1ml中,加入双蒸水0.9ml,用0.5mol/L盐酸调至pH 8.5,避光,-20℃放置[6]。
1.2.2模型制作
模型组新生鼠乙醚麻醉,用微量注射器经小脑延髓池处释放适量脑脊液后注入胆红素溶液10μg/g;对照组同样方法注射等量生理盐水[5]。
1.3观察神经行为学改变及体质量
根据Rose等[7]及Song等[5]对大鼠胆红素脑损伤神经行为学改变的描述,观察两组大鼠分别在注射胆红素溶液和生理盐水后是否出现活动减少、握拳、肌张力障碍、转圈、俯伏、角弓反张、吃奶困难等神经行为学表现。注射后连续3d按时记录两组的体质量。
1.4TUNEL染色
模型组于6日龄(建模后1d,n=3)断头取脑,常规固定,脱水包埋,切片,获取基底节纹状体石蜡切片后行TUNEL染色(德国ROCHE公司),细胞核呈棕黄色或棕褐色为阳性细胞。
1.5步态分析
参考Chaniary等的步态分析方法[8]评价大鼠的步态参数。有机玻璃盒(100×6×12cm)架高90cm,一侧放置一个盒子。透明坐标纸粘附于有机玻璃盒底面。数码相机(NIKON)放置于有机玻璃盒下方,调节镜头使其包含实验所需的有机玻璃盒底面像。用红色标记笔在大鼠腹面画一条矢状线作为行走方向的参照线,并在双后足中间指骨处点下标记。实验前训练大鼠至可不停顿地通过有机玻璃盒到达另一侧的盒子内。录制每只大鼠至少有3步不停顿的行走视频,使用Adobe Premiere Pro CS6处理后备用。步态参数如下。①步宽:经过双后肢中间指骨所作的与行走方向参照线平行的两线之间的距离。②步长:行走中一侧后肢着地时的中间指骨到紧接着的对侧后肢着地时的中间指骨之间在参照线方向的距离。③步长差异值:行走中右后肢到左后肢步长(左步长)减去左后肢到右后肢步长(右步长)之差的绝对值。
1.6横木行走测试
参考Puurunen等的方法[9],测试装置由横木(100×2.5cm,高50cm)及与其一端连接的一个盒子组成。采用0~6分法进行评价。0分:鼠不能站立在平衡木上,掉下。1分:鼠能站立在平衡木上,但不能移动。2分:鼠试图穿过平衡木,但掉下。3分:鼠能穿过平衡木,受影响后肢脚滑或失足大于50%的步数。4分:鼠能穿过平衡木,受影响后肢脚滑或失足次数大于1次但小于50%的步数。5分:鼠穿过平衡木,后肢脚滑或失足仅出现1次。6分:鼠穿过平衡木无脚滑或失足。
1.7Morris水迷宫实验
参考Morris的方法[10],圆形水池分为4个象限,其中1个象限内放置平台。水池内放水,水平面高于平台1cm,倒入墨汁使平台隐藏,水温维持在(25±1)℃。实验共7d,第1天为适应期,撤去平台让大鼠自由游泳60s以适应环境。第2~6天将平台重新放置到水池中,记录大鼠的逃避潜伏期,若大鼠找平台时间超过60s,引导大鼠游至平台并停留10s,逃避潜伏期记录为60s,以上潜伏期数据用于评价定位导航能力。第7天再次撤去平台,记录大鼠在迷宫内自由游泳60s过程中穿越平台位置的次数,以评价空间探索能力。
1.8统计学分析
采用SPSS 17.0统计学软件分析。水迷宫逃避潜伏期采用重复测量方差分析和多因素方差分析;体质量及体质量增长值采用简单效应分析;其余数据采用t检验。显著性水平α=0.05。
2 结果
2.1神经行为学改变及体质量情况
2.1.1神经行为学改变
模型组建模后0.5~1h内出现活动减弱、握拳、角弓反张,部分出现俯伏、侧卧、转圈、对外界刺激无反应,4只死亡,予重新建模补充。对照组没有出现明显异常的神经行为学改变。
2.1.2体质量
建模后第1天模型组体质量负增长,而对照组体质量显著增加(F=145.876,P<0.001),建模后第2天(F=31.779,P<0.001)及第3天(F=33.594,P<0.001)模型组体质量逐渐增加,但仍显著低于对照组。见表1。
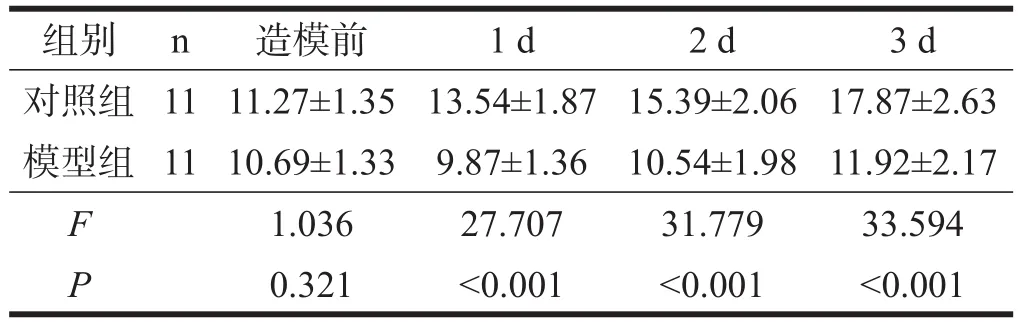
表1 两组大鼠造模前及造模后连续3d体质量情况(kg)
2.2细胞病理变化
模型组断头取脑后可见不同程度黄染,无明显损伤出血;TUNEL染色后光镜下可见凋亡现象。见图1。
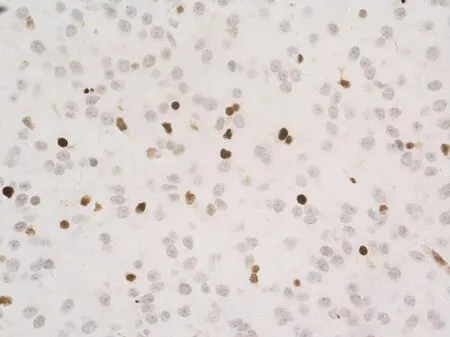
图1 模型组基底节纹状体神经细胞凋亡(光学显微镜,400×)
2.3步态分析
模型组左后肢步长和右后肢步长均明显小于对照组(P<0.01),左右后肢步长差值显著大于对照组(P<0.001),两组步宽无显著性差异(P>0.05)。见表2。

表2 两组大鼠步态参数(cm)
2.4横木行走测试
与对照组相比,模型组在通过横木时,踌躇犹豫,探索行为较多,双后肢滑落次数明显增多,部分大鼠在通过途中掉下,有的则不能在横木上行走甚至站立,测试评分明显偏低(P<0.01)。见表3。

表3 两组大鼠横木行走实验得分
2.5Morris水迷宫实验
2.5.1定位航行能力
两组大鼠逃避潜伏期随着训练时间增加均出现逐渐缩短趋势。总体上两组间的逃避潜伏期存在非常高度显著性差异(P<0.001)。与对照组相比,模型组各时间点逃避潜伏期均延长(P<0.05)。见表4。
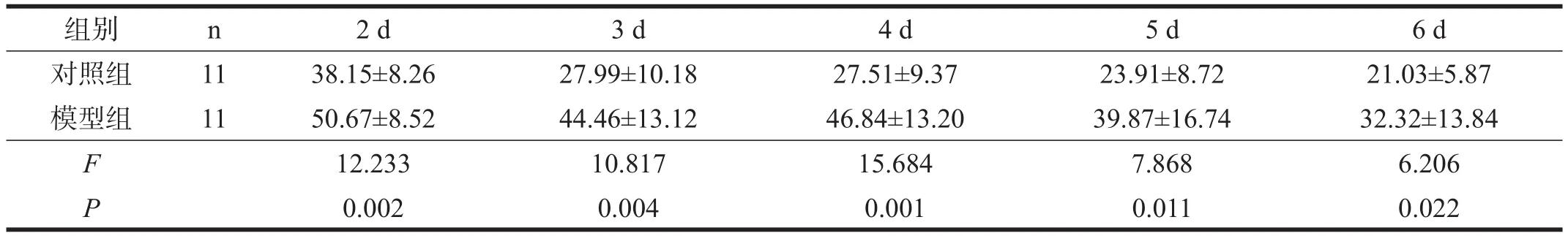
表4 两组大鼠逃避潜伏期(s)
2.5.2空间探索能力
与对照组比较,模型组穿越平台次数明显减少(P<0.01)。见表5。
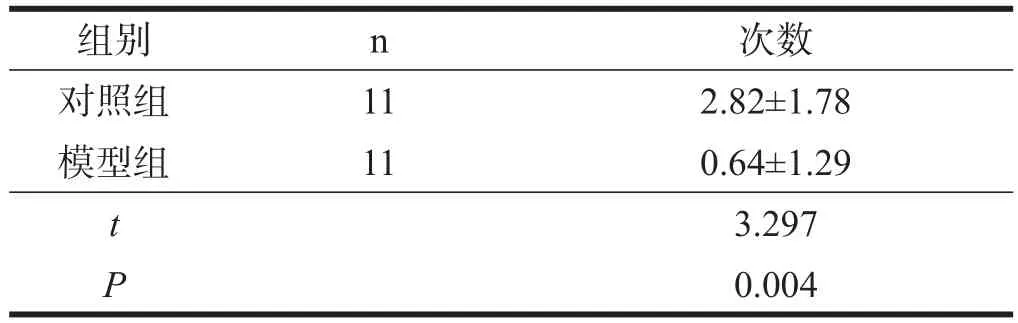
表5 两组大鼠穿越平台次数(n)
3 讨论
实验研究发现核黄疸模型鼠出现步态异常,运动协调及整合能力下降,学习记忆障碍。注射胆红素溶液后模型组出现自主活动减少、握拳、角弓反张、体质量不增甚至下降,与急性胆红素脑病模型鼠的症状[5-7,11]及新生儿急性胆红素脑病的临床表现[12-13]相符,且基底节纹状体细胞凋亡,提示出现胆红素脑损伤。
研究显示,胆红素入脑后主要选择性沉积于基底节(主要为苍白球)、丘脑底核、脑干神经核、小脑及海马[14-16]。苍白球及丘脑底核是锥体外系系统的主要组成部分,胆红素损伤后可造成锥体外系病变[16],导致肌张力障碍、姿势异常、平衡协调不能、运动异常、手足徐动等表现[17-18]。海马受损则导致学习记忆障碍。故本实验采用步态分析、横木行走测试及水迷宫实验评价核黄疸鼠的运动功能及学习记忆情况。
步态分析广泛用于量化评价啮齿动物模型的运动障碍,如帕金森病[19]、坐骨神经损伤[20],是一种客观、精细的评价方法。本实验发现,与对照组相比,模型组双后肢步长变短且左右步长差值变大。提示模型组因胆红素神经毒性导致肌张力障碍,后肢运动协调不能,以致步态异常。以上结果与Chaniary等的研究结果[8]相符。有学者提出步宽增加是机体运动时为了维持平衡与稳定的补偿形式[19],但本实验中模型组与对照组的步宽无显著性差异,分析可能是本实验模型建模时间为大鼠生后第5天,注入胆红素可明显影响生长发育而不能显示出步宽变长的代偿模式。因此5日龄大鼠核黄疸模型可出现步态异常,其中步长差异值为评价该模型步态的敏感参数。
横木行走测试是评价动物运动协调及整合能力的客观方法[21]。与对照组相比,模型组在行走时出现踌躇、后肢滑步,甚至不能行走或站立,提示胆红素神经毒性导致模型组运动协调及整合能力受损,该测试结果与步态分析结果相对应。
Morris水迷宫实验是评价啮齿动物空间学习和记忆能力的常用方法[22-24]。实验中,模型组逃避潜伏期明显长于对照组,且找平台能力也低于对照组,提示模型组学习能力下降,空间记忆能力受损。
本研究仍存在着一些不足:①样本量不大,为了达到更小的抽样误差在今后实验中可加大实验动物的样本量;②当前应用于啮齿动物行为学缺陷评价的方法繁多,各有利弊,本研究仅选取其中3种常见的评价方法进行评价;③模型组大鼠出现运动功能受损,但步态分析中的一项参数,即步宽,与对照组相比无显著性差异。因此下一步的实验研究可增加其他评价方法以获得更多核黄疸动物模型的行为学数据,为相关的研究提供更多选择。
综上所述,5日龄Sprague-Dawley大鼠核黄疸模型出现步态异常,运动协调及整合能力下降和学习记忆障碍,符合新生儿核黄疸的特征,且可使用步态分析、衡木行走测试及水迷宫实验分别进行评价。因此该模型可能为今后胆红素脑损伤神经系统后遗症运动功能、学习记忆方面的损伤机制及康复治疗方法研究奠定基础。
[参考文献]
[1]Olusanya BO,Ogunlesi TA,Slusher TM.Why is kernicterus still a major cause of death and disability in low- income and middle- income countries?[J].Arch Dis Child,2014,99(12):1117-1121.
[2]Brites D,Fernandes A.Bilirubin-induced neural impairment:a special focus on myelination,age-related windows of susceptibility and associated co-morbidities[J].Semin Fetal Neonatal Med,2015,20(1):14-19.
[3]黄国盛,廖燕,闭雪兰,等.钦州地区足月新生儿胆红素脑病的病因分析及防治研究[J].中国妇幼保健,2014,29(6):896-899.
[4]Watchko JF,Tiribelli C.Bilirubin-induced neurologic damage--mechanisms and management approaches[J].N Engl J Med,2013,369(21):2021-2030.
[5]Song S,Hu Y,Gu X,et al.A novel newborn rat kernicterus model created by injecting a bilirubin solution into the cisterna magna[J].PLoS One,2014,9(5):e96171.
[6]胡影,田巧红,华子瑜,等.小脑延髓池注射胆红素溶液建立新生大鼠胆红素脑病模型的评价[J].重庆医科大学学报,2008,33(2):177-181.
[7]Rose AL,Wisniewski H.Acute bilirubin encephalopathy induced with sulfadimethoxine in Gunn rats[J].J Neuropathol Exp Neurol,1979,38 (2):152-164.
[8]Chaniary KD,Baron MS,Rice AC,et al.Quantification of gait in dystonic Gunn rats[J].J Neurosci Methods,2009,180(2):273-277.
[9]Puurunen K,Jolkkonen J,Sirvio J,et al.An alpha(2)-adrenergic antagonist,atipamezole,facilitates behavioral recovery after focal cerebral ischemia in rats[J].Neuropharmacology,2001,40(4):597-606.
[10]Morris R.Developments of a water-maze procedure for studying spatial learning in the rat[J].J Neurosci Methods,1984,11(1):47-60.
[11]Schutta HS,Johnson L.Clinical signs and morphologic abnormalities in Gunn rats treated with sulfadimethoxine[J].J Pediatr,1969,75(6):1070-1079.
[12]Johnson LH,Bhutani VK,Brown AK.System-based approach to management of neonatal jaundice and prevention of kernicterus[J].J Pediatr,2002,140(4):396-403.
[13]Shapiro SM.Chronic bilirubin encephalopathy:diagnosis and outcome[J].Semin Fetal Neonatal Med,2010,15(3):157-163.
[14]Vaz AR,Silva SL,Barateiro A,et al.Selective vulnerability of rat brain regions to unconjugated bilirubin[J].Mol Cell Neurosci,2011,48 (1):82-93.
[15]Morioka I,Iwatani S,Koda T,et al.Disorders of bilirubin binding to albumin and bilirubin-induced neurologic dysfunction[J].Semin Fetal Neonatal Med,2014,20(1):31-36.
[16]Przekop A,Sanger TD.Birth-related syndromes of athetosis and kernicterus[J].Handb Clin Neurol,2011,100:387-395.
[17]Rose J,Vassar R.Movement disorders due to bilirubin toxicity[J].Semin Fetal Neonatal Med,2015,20(1):20-25.
[18]Lanska DJ.Early controversies over athetosis:I.Clinical features,differentiation from other movement disorders,associated conditions,and pathology[J].Tremor Other Hyperkinet Mov(N Y),2013,3.
[19]Hsieh TH,Chen JJ,Chen LH,et al.Time- course gait analysis of hemiparkinsonian rats following 6-hydroxydopamine lesion[J].Behav Brain Res,2011,222(1):1-9.
[20]Jang SH,Lee JH.Effects of physical exercise on the functional recovery of rat hindlimbs with impairments of the sciatic nerve as assessed by 2D video analysis[J].J Phys Ther Sci,2015,27(3):935-938.
[21]Yu K,Wu Y,Hu Y,et al.Neuroprotective effects of prior exposure to enriched environment on cerebral ischemia/reperfusion injury in rats:the possible molecular mechanism[J].Brain Res,2013,1538:93-103.
[22]Lekic T,Hartman R,Rojas H,et al.Protective effect of melatonin upon neuropathology,striatal function,and memory ability after intracerebral hemorrhage in rats[J].J Neurotrauma,2010,27(3):627-637.
[23]Ge JF,Xu YY,Li N,et al.Resveratrol improved the spatial learning and memory in subclinical hypothyroidism rat induced by hemi-thyroid electrocauterization[J].Endocr J,2015,62(10):927-938.
[24]Ma L,Lu ZN,Hu P,et al.Neuroprotective effect of escitalopram oxalate in rats with chronic hypoperfusion[J].J Huazhong Univ Sci Technolog Med Sci,2015,35(4):514-518.
Brain Cell Injuries and Behavioral Changes in Rats with Kernicterus
LIU Yi,XIAO Nong,MAO Zhen-sha
1.Ministry of Education Key Laboratory of Child Development and Disorders,Key Laboratory of Pediatrics in Chongqing,Chongqing International Science and Technology Cooperation Center for Child Development with Disorders,Children's Hospital of Chongqing Medical University,Chongqing 400014,China;2.Department of Rehabilitation in Children's Hospital of Chongqing Medical University,Chongqing 400014,China
Correspondence to XIAO Nong.E-mail:xiaonongwl@163.com
Abstract:Objective To study the brain cell injuries and behavioral changes of newborn rats with kernicterus.Methods Twenty-five 5-day-old Sprague-Dawley rats were divided into control group(n=11)and model group(n=14)radomly.The model group was injected with bilirubin solution 10μg/g in the cisterna magna,while the control group was injected with equal volume of normal saline.The neurobehavioral changes were observed and the body mass were recorded.TUNEL staining was used to check the apoptosis of striatal nerve cells of basal ganglia in the model group(n=3)on the first day after modeling.The remaining rats were assessed by gait analysis and beam-walking test 19 days after birth,and Morris water maze test was performed 30 days after birth.Results The model group showed apparently abnormal neurobehavioral changes,such as clenched fists,opisthotonos and the body mass were significantly lower in the model group than in the control group(F>27.707,P<0.001).TUNEL staining showed striatal nerve cells apoptosis in the model group.For the gait analysis,the step lengths of both hind legs were shorter(t>4.129,P<0.01),and the difference of step length was longer(t=-4.415,P<0.001)in the model group than in the control group,however,there was no significantly difference in the step width between two groups(t=0.462,P=0.649).For the beam-walking test,the score was lower in the model group than in the control group(t=-3.644,P=0.004).For the Morris water maze test,the escape latency was longer(F>6.206,P<0.05),and the number of crossing platform was less(t=3.297,P=0.004)in the model group than in the control group.Conclusion The newborn rats' model of kernicterus showed deficits in multiple motor functions and learning and memory ability,which could be assessed by gait analysis,beam-walk test and Morris water maze test,respectively.
Key words:kernicterus;gait analysis;beam-walking test;Morris water maze test;rats
[中图分类号]R722.1
[文献标识码]A
[文章编号]1006-9771(2016)06-0640-05
DOI:10.3969/j.issn.1006-9771.2016.06.004
基金项目:2014年重庆市研究生科研创新项目(No.CYS14126)。
作者单位:1.重庆医科大学附属儿童医院儿童发育疾病研究教育部重点实验室,儿科学重庆市重点实验室,重庆市儿童发育重大疾病诊治与预防国际科技合作基地,重庆市400014;2.重庆医科大学附属儿童医院康复科,重庆市400014。
作者简介:刘祎(1991-),女,汉族,河南驻马店市人,硕士研究生,主要研究方向:儿科神经康复。通讯作者:肖农(1961-),男,汉族,四川内江市人,硕士,教授,主要研究方向:神经康复。E-mail:xiaonongwl@163.com。
收稿日期:(2015-11-03修回日期:2016-01-25)
