牛蒡子苷元对四氯化碳致大鼠肝纤维化的治疗作用
2016-07-21张晓珣张景耀重庆理工大学药学与生物工程学院重庆400054
张晓珣,王 俊,赵 宇,张景耀,李 傲(重庆理工大学药学与生物工程学院,重庆 400054)
牛蒡子苷元对四氯化碳致大鼠肝纤维化的治疗作用
张晓珣,王 俊,赵 宇,张景耀,李 傲
(重庆理工大学药学与生物工程学院,重庆 400054)
摘要:目的 研究牛蒡子苷元(ATG)对四氯化碳(CCl4)诱导的大鼠肝纤维化的防治作用及可能的作用机制。方法 成年Sprague-Dawley大鼠随机分为溶剂对照组、ATG 3.0 mg·kg-1、CCl4模型组、CCl4+ATG 1.0和3.0 mg·kg-1组和CCl4+秋水仙碱(COL)0.1 mg·kg-1阳性对照组,采用sc的方法复制大鼠CCl4肝纤维化模型,造模8周。从第5周开始,ig给予ATG和COL,连续治疗4周。测定各组大鼠血清中谷丙转氨酶(GPT)、谷草转氨酶(GOT)的活性以及白蛋白(ALB)、总胆红素(TBIL)的水平,肝组织中羟脯氨酸(HYP)的含量;HE和Masson染色观察肝组织病理改变,并采用组织免疫荧光法检测活化的肝星状细胞增殖,Western蛋白质印迹法检测细胞周期相关蛋白的表达。结果 与CCl4模型组比较,ATG 1.0和3.0 mg·kg-1可显著升高纤维化大鼠血清中ALB含量(P<0.05),降低血清中GPT,AST和TBIL水平(P<0.05),从而降低肝损伤的程度;ATG 1.0和3.0 mg·kg-1还能显著降低纤维化大鼠肝组织中HYP的含量(P<0.05),减少肝内纤维组织的形成。同时,ATG 1.0和3.0 mg·kg-1还能抑制纤维化大鼠肝组织中活化的HSC增殖,显著降低细胞周期相关调控蛋白细胞周期蛋白D1(cyclin D1)、细胞周期蛋白依赖性蛋白激酶(CDK)2和4及增殖细胞核抗原的表达(P<0.05),同时上调细胞周期阻抑物蛋白p27kip1的表达水平(P<0.05)。结论 ATG对CCl4诱导的大鼠肝损伤和肝纤维化具有显著的治疗作用,其作用机制可能与抑制活化的HSC增殖相关。
关键词:牛蒡子苷元;肝纤维化;肝星状细胞;细胞周期
DOl:10.3867/j.issn.1000-3002.2016.01.008
肝纤维化系肝组织内细胞外基质(extracellular matrix,ECM)过度增生与异常沉积所致肝结构和(或)功能异常改变的一种病理变化,是多种类型细胞、氧化应激、细胞因子和生长因子等一系列复杂作用的结果。肝纤维化是各种慢性肝病向肝硬变,甚至向肝癌发展所必经的中间环节。虽然肝中多种细胞参与了肝纤维化的形成,但近来国内外取得广泛共识的是,肝星状细胞(hepatic stellate cells,HSC)为产生胶原纤维和其他非胶原纤维基质蛋白的主要来源。当肝受到损伤后,HSC被激活,活化的HSC大量增殖,合成并分泌大量的ECM。同时,HSC高表达组织金属蛋白酶抑制物(tissue inhibi-tors of metalloproteinases),降低胶原酶的活性,造成胶原降解障碍,ECM大量沉积,导致肝纤维化的发生发展[1-3]。近年来的研究表明,肝纤维化,甚至肝硬变早期都可逆转,而逆转的关键在于减少活化HSC的数量[4]。
牛蒡子来源于菊科2年生草本植物牛蒡子属牛蒡(Arctium lappa L.)的干燥成熟果实,为常用中药,有疏风散热、解毒透疹、利咽消肿等功效。有研究表明,牛蒡子水提物对慢性乙醇刺激诱发的大鼠肝损伤[5],以及四氯化碳(carbon tetrachloride,CCl4)或对乙酰氨基酚造成的小鼠急性肝损伤[6]均有良好的保护作用。牛蒡子苷元(arctigenin,ATG)作为牛蒡子中主要成分,是否能逆转继发于肝损伤的纤维化进程及其相关机制尚无报道。本课题组近期研究发现,采用血小板源性生长因子BB(platelet-derived growth factor-BB)体外刺激HSC活化,ATG可通过上调p27kip1蛋白表达,使激活的HSC生长周期阻滞于G0/G1期,从而抑制其恶性增殖的能力[7]。本研究拟在整体动物模型上,观察ATG对CCl4诱导的大鼠肝纤维化的治疗作用,并进一步从细胞周期调控角度探讨ATG影响HSC增殖的机制。
1 材料与方法
1.1药物、试剂和仪器
CCl4,批号20120220,成都市科龙化工试剂厂;苯巴比妥,批号130602,上海信谊药厂有限公司;ATG,南京泽郎医药科技有限公司,纯度>99.5%;秋水仙碱(colchicine,COL),货号C3915,美国Sigma公司;谷丙转氨酶(glutamic pyruvic transaminase,GPT)、谷草转氨酶(glutamic oxaloacetic transami-nase,GOT)、白蛋白(albumin,ALB)、总胆红素(total bilirubin,TBIL)和羟脯氨酸(hydroxypro-line,HYP)测定试剂盒,南京建成生物工程研究所;RIPA组织蛋白裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒、5×SDS-PAGE蛋白上样缓冲液和大鼠α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体(批号AA132),江苏碧云天生物技术研究所;兔细胞周期蛋白D1 (cyclin D1)单克隆抗体,批号YE102505,美国Epitomics公司;兔细胞周期蛋白依赖性蛋白激酶2 (cyclin-dependent kinase 2,CDK2)、CDK4和大鼠p27kip1单克隆抗体,批号分别为D1211,D0711和L2309,美国Santa Cruz公司;兔增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体,批号1,美国CST公司;兔p21cip1多克隆抗体、HRP标记山羊抗兔IgG抗体和HRP标记山羊抗小鼠IgG抗体,批号分别为G22121,AB04141和121107,美国Bioworld公司;FITC-羊抗兔IgG和Cy3-羊抗小鼠IgG抗体,武汉博士德生物工程有限公司。Multiskan GO型多功能酶标仪,美国Thermo Fisher Scientific公司;3K15型4℃低温离心机,德国Sigma-Aldrich公司;041BR88778型蛋白电泳和电转移装置及ChemiDocTMXRS+型化学发光仪,美国Bio-Rad公司;T10B型电动组织匀浆机,德国IKA公司;EclipseE200型正置荧光显微镜,日本Nikon公司。
1.2动物、分组和给药
72只成年Sprague-Dawley大鼠,♂,SPF级,体质量180~200 g,由中国人民解放军第三军医大学第三附属医院实验动物中心提供,合格证号SCXK(渝)2012-0005。饲养条件为温度20~24℃,相对湿度为55%,自由进食及饮水。随机均分为6组,分别为溶剂对照组、ATG 3.0 mg·kg-1组、CCl4模型组、CCl4+ATG 1.0和3.0 mg·kg-1组、CCl4+ COL 0.1 mg·kg-1阳性对照组。大鼠肝纤维化模型的复制参照文献[8]的方法,略有修改。大鼠在造模第1周饮用0.03%苯巴比妥(苯巴比妥30 mg,溶于100 mL水中)以诱导混合功能氧化酶活性,增加CCl4代谢产物的生成,提高造模成功率,并缩短造模周期。除溶剂对照组和单用ATG 3.0 mg·kg-1组(按体质量sc给予等量花生油)外,其他组首次sc给予40%CCl4花生油混合液5 mL·kg-1,以后每次注射2 mL·kg-1,每周2次,连续注射8周诱导出肝纤维化模型。自造模第5周起,按10 mL·kg-1分别ig给予不同剂量的药物,每天1次,连续4周。ATG ig给药剂量参考文献[9],并经过课题组前期预实验验证。溶剂对照组和模型组ig给予等体积的药物溶媒(5%DMSO)。
1.3大鼠体质量、肝指数和脾指数测定
造模之前称量大鼠体质量,并在之后每周测一次体质量,在第8周,末次给药1 h后,大鼠在麻醉下股动脉放血处死,称量大鼠体质量和肝、脾湿重。肝、脾指数=肝、脾质量(g)/体质量(g)×100。
1.4血清肝功能指标测定
股动脉取血,血样不抗凝,取血1 h后以3000×g离心15 min,分离血清,按试剂盒说明测量血清中GPT,GOT,ALB和TBIL肝功能指标水平。
1.5肝组织病理检查
取大鼠肝左外叶,冰生理盐水冲洗,置于4%的多聚甲醛溶液中固定,常规石蜡包埋、切片,进行HE染色和Masson染色,光镜下观察组织形态变化,参照文献[10]标准进行组织病理学评分。
1.6肝组织中羟脯氨酸含量测定
精确称取大鼠肝左外叶组织湿重30~100 mg,置于EP管中,参照试剂盒说明书测定大鼠肝组织中HYP含量。
1.7免疫荧光法检测活化的肝星状细胞增殖
将大鼠肝左外叶冰冻切片用冰丙酮固定,10%山羊血清封闭30 min后,加入含有大鼠α-SMA单抗和兔PCNA单抗的混合液,在4℃下孵育过夜。充分洗涤后滴加含有FITC-羊抗兔IgG和Cy3-羊抗小鼠IgG的混合液,37℃孵育1 h,洗去二抗,用50%的甘油封片,在荧光显微镜下观察并拍照。
1.8Western蛋白印迹法检测细胞周期相关蛋白表达
取大鼠肝左外叶组织,置于EP管中,加入RIPA强裂解液,使用电动组织匀浆机进行匀浆,按照蛋白提取试剂盒说明书操作提取总蛋白,采用BCA比色法测定蛋白浓度。将蛋白样品与5×SDS上样缓冲液混匀,进行SDS-PAGE电泳分离蛋白,电转移至PVDF膜上,5%脱脂牛奶封闭1 h,4℃下与一抗孵育过夜,加入辣根过氧化物酶标记的二抗,37℃孵育1 h,经ECL底物化学发光显影,结果用Quantity One软件定量分析条带的积分吸光度值(integrated absorbance,IA),依目标蛋白与内标蛋白IA表示蛋白的相对表达水平。
1.9统计学分析
全部数据采用SPSS19.0软件进行分析,实验结果数据以±s表示。单因素方差分析比较各组间差异,当差异显著时(P<0.05),组间两两比较采用Tukey法,P<0.05认为差异有统计学意义;等级资料在比较各组间差异时,采用Kruskal-Wallis H检验,当差异显著时(P<0.05),组间两两比较采用Mann-Whitney U检验,P<0.05认为差异有统计学意义。
2 结果
2.1牛蒡子苷元对四氯化碳诱导的慢性肝纤维化大鼠体质量、肝指数和脾指数的影响
与溶剂对照组比较,CCl4模型组大鼠的肝、脾指数均显著升高(P<0.05)。而单用ATG 3.0 mg·kg-1后,与溶剂对照组比较,差异无统计学意义。与CCl4模型组比较,ATG 1.0和3.0 mg·kg-1可显著提高CCl4损伤大鼠降低的体质量,同时明显降低CCl4模型大鼠肝、脾指数(P<0.05),COL 0.1 mg·kg-1阳性对照组大鼠肝、脾指数与CCl4模型组比较,也显著降低(P<0.05),而其体质量与CCl4模型组比较,差异无统计学意义,见表1。
2.2牛蒡子苷元对四氯化碳诱导的慢性肝纤维化大鼠血清肝功能指标的影响
表2结果显示,与溶剂对照组相比,CCl4模型组大鼠血清中GPT,GOT和TBIL水平显著升高,ALB浓度显著降低(P<0.05)。而单用ATG 3.0 mg·kg-1处理后,与溶剂对照组比较,无统计学意义。与CCl4模型组比较,ATG 1.0和3.0 mg·kg-1能显著降低CCl4模型大鼠血清中GPT,GOT和TBIL水平,升高ALB浓度(P<0.05),COL 0.1 mg·kg-1阳性对照组血清中GOT和TBIL含量也明显降低(P<0.05),而血清中GPT水平与CCl4模型组比较,差异无统计学意义。
2.3牛蒡子苷元对四氯化碳诱导的慢性肝纤维化大鼠肝组织病理变化的影响
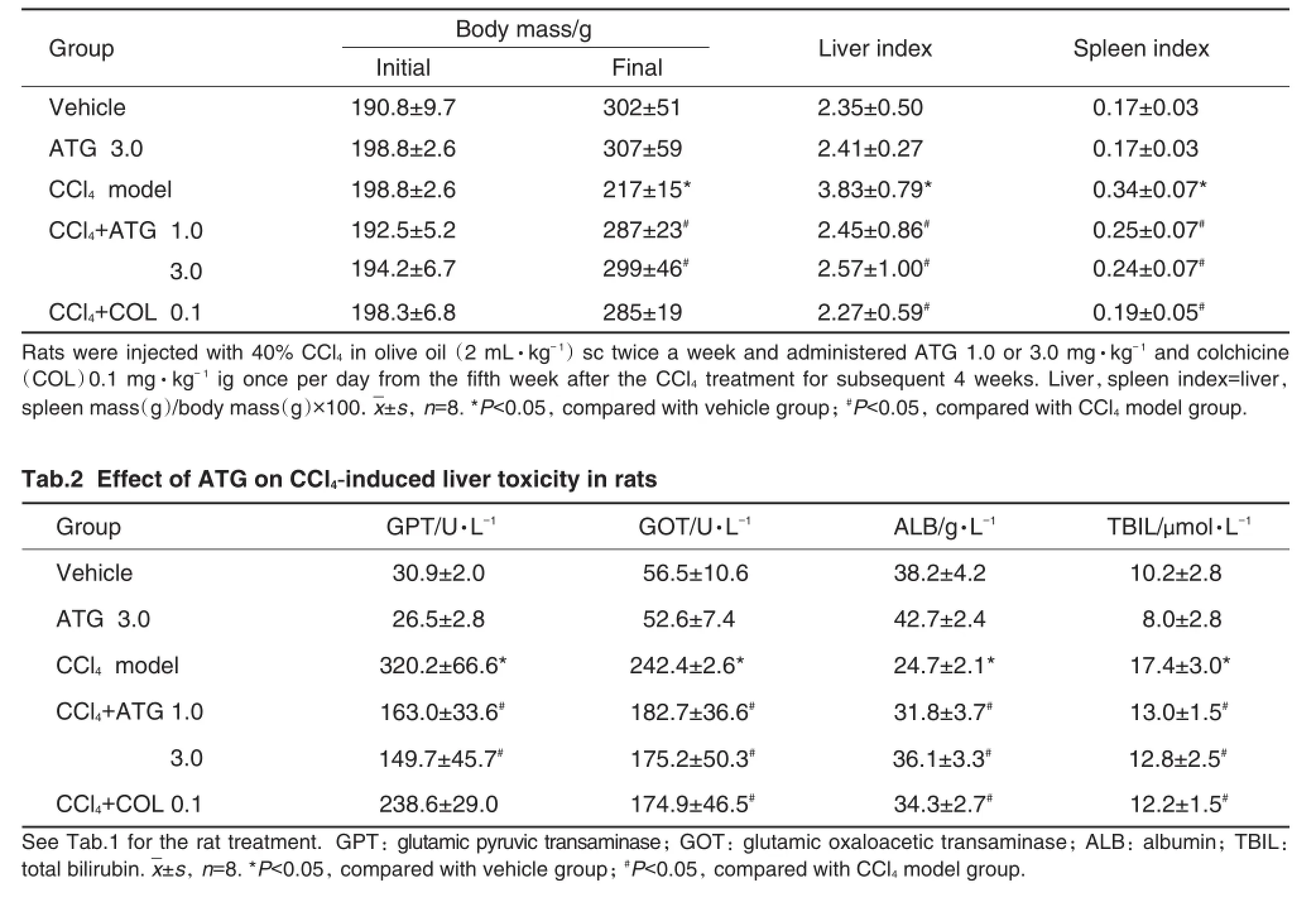
HE染色结果见图1,各组的肝纤维化分级结果见表3,可见溶剂对照组和ATG 3.0 mg·kg-1组大鼠肝小叶结构清晰,肝细胞索由中央静脉向四周整齐排列。CCl4模型组肝细胞脂肪变性、坏死;大量的纤维组织向肝小叶内伸展,并与邻近汇管区及肝静脉相连,纤维间隔较厚,分割包绕肝实质,形成大小不一的假小叶。ATG 1.0和3.0 mg·kg-1和COL 0.1 mg·kg-1能明显减轻CCl4所致的慢性肝纤维化程度,对炎症细胞浸润、胶原纤维的增生、肝小叶的破坏和假小叶的形成均有明显的抑制作用。
Tab.1 Effect of arctigenin(ATG)on body mass,livers and spleen indices of CCl4-injured rats

Fig.1 Effect of ATG on hepatic morphology and archi-tecture by HE staining(HE×200).See Tab.1 for the rat treatment.The arrows indicate the necrotic fibrous septa.
各组Masson染色结果见图2,溶剂对照组和ATG 3.0 mg·kg-1组大鼠肝小叶结构完整,肝细胞索排列整齐,仅在汇管区与中央静脉区血管壁附着蓝色,无明显胶原增生。CCl4模型组大鼠肝小叶结构被破坏,肝组织汇管区和小叶间有大量粗大增生的胶原纤维,有大量假小叶形成,分割包绕肝实质。ATG 1.0 和3.0 mg·kg-1和COL 0.1 mg·kg-1能不同程度地减少炎症细胞的浸润,汇管区、小叶内、小叶间胶原纤维间隔减少、变细,仅纤维间隔内可见脂肪空泡形成,部分较细的蓝色纤维走行于血管周围,无假小叶形成。
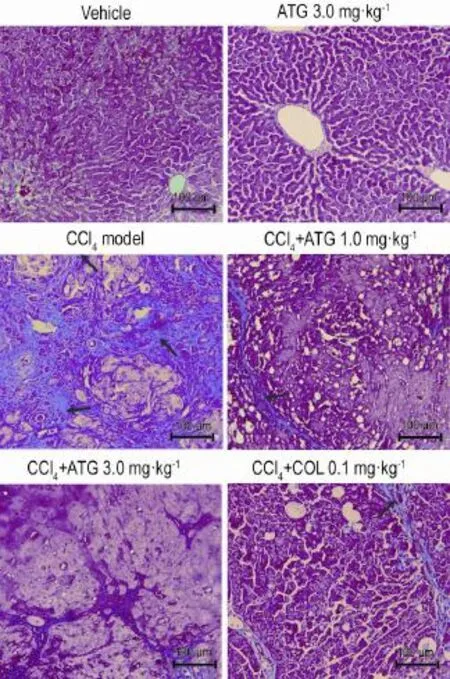
Fig.2 Effect of ATG on collagen deposition by Masson staining(Masson×200).See Tab.1 for the rat treatment. The arrows show the collagen fiber.
2.4牛蒡子苷元对四氯化碳诱导的慢性肝纤维化大鼠肝组织羟脯氨酸含量的影响
表4结果表明,与溶剂对照组比较,CCl4模型组大鼠肝组织中HYP含量升高2.6倍(P<0.05)。ATG 3.0 mg·kg-1组与溶剂对照组相比较,HYP含量无显著差异。与CCl4模型组比较,ATG 1.0和3.0mg·kg-1能显著降低大鼠肝组织中HYP含量(P<0.05),COL 0.1 mg·kg-1阳性对照组大鼠肝组织中HYP含量也明显降低(P<0.05)。

Tab.4 Effect of ATG on hepatic hydroxyproline(HYP)content in CCl4-injured rats
2.5牛蒡子苷元对四氯化碳诱导的慢性肝纤维化大鼠肝星状细胞增殖能力的影响
从图3可以发现,CCl4模型组大鼠肝组织内激活的HSC大量增殖(表现出叠加为黄色荧光的阳性细胞数量明显增加,如箭头指示),而CCl4+ATG 1.0 和3.0 mg·kg-1组和COL 0.1 mg·kg-1阳性对照组中仅表达少量荧光标记双阳性细胞。
2.6牛蒡子苷元对四氯化碳诱导的慢性肝纤维化大鼠细胞周期相关调控蛋白的影响
如图4所示,溶剂对照组和ATG 3 mg·kg-1组仅表达少量cyclin D1,CCl4模型组有明显的cyclin D1表达上调。经过ATG 1.0和3.0 mg·kg-1及COL处理后,cyclin D1表达水平明显低于CCl4模型组(P<0.05)。同时,CCl4模型组出现CDK2和CDK4蛋白高表达,与溶剂对照组和ATG 3.0 mg·kg-1组比较,有显著性差异(P<0.05)。ATG 1.0和3.0 mg·kg-1及COL 0.1 mg·kg-1处理后,大鼠肝组织中CDK2 和CDK4蛋白表达水平也显著降低(P<0.05)。
溶剂对照组和ATG 3.0 mg·kg-1组有较高的细胞周期阻抑物蛋白p21cip1和p27kip1表达,而经过CCl4处理后,模型组大鼠中仅有微弱的p21cip1和p27kip1表达。同时,经ATG 1.0和3.0 mg·kg-1及COL 0.1 mg·kg-1处理后,与CCl4模型组比较,p21cip1蛋白表达水平未见明显改变,而p27kip1蛋白表达水平明显高于CCl4模型组(P<0.05)。溶剂对照组和ATG 3.0 mg·kg-1组中,仅见少量PCNA表达,而CCl4模型组中有较高PCNA的表达,经过ATG 1.0和3.0 mg·kg-1及COL 0.1 mg·kg-1处理后,可明显降低CCl4模型组大鼠肝组织中PCNA的表达水平(P<0.05)。
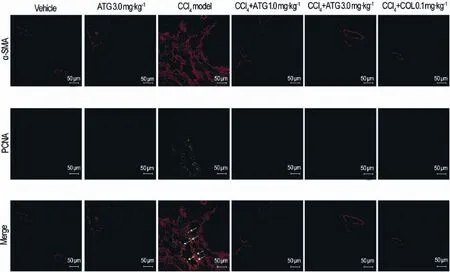
Fig.3 Effect of ATG on proliferation of HSC in fibrotic rats induced by CCl4(Immunofluorescence×200).See Tab.1 for the rat treatment.The arrows show the numbers of activated and proliferative HSC〔α-smooth muscle actin(α-SMA)/proliferating cell nuclear antigen(PCNA)dual-positive cells〕in the CCl4model group are notably higher than those found in the vehicle group.

Fig.4 Effect of ATG on expression of cell cycle-related protein by Western blotting.See Tab.1 for the rat treatment.A:immunoblots are shown for each protein.B-D:quantitation of proteins,band intensities were converted to arbitrary densitometric units,normalized by the value of β-actin.Lane 1-2:vehicle;lane 3-4:ATG 3.0 mg·kg-1;lane 5-6:CCl4model;lane 7-8:CCl4+ATG 3.0 mg·kg-1;lane 9-10:CCl4+ATG 1.0 mg·kg-1;lane 11-12:CCl4+Col 0.1 mg·kg-1.CDK:cyclin-dependent kinase.±s,n=8.*P<0.05,compared with vehicle group;#P<0.05,compared with CCl4model group.
3 讨论
肝纤维化是在各种致病因子的作用下引起的慢性肝损伤,是多种慢性肝疾病的共同病理过程,如得不到有效控制,它很可能导致肝硬变,甚至肝癌[11]。研究表明,ATG具有较强的抗炎、保肝、免疫调节、抗病毒等活性[5-6,12],而ATG的体内抗肝纤维化作用尚未见报道。本研究显示,经ATG治疗后,CCl4诱导的纤维化大鼠中血液生化异常变化及肝病理损害均获得显著改善。同时,给予ATG治疗后,肝内炎症细胞浸润、细胞外基质沉积、肝小叶的破坏和假小叶的形成明显减轻,提示ATG对CCl4所致的大鼠肝纤维化有显著治疗作用。
处于静息状态的HSC被激活并大量增殖,被认为是肝纤维化发生的关键步骤,而α-SMA在HSC中的高表达,被认为是HSC激活的标志。本研究通过组织免疫荧光法发现,在CCl4诱导的模型大鼠肝组织内,出现大量阳性表达α-SMA的细胞,同时组织中PCNA呈阳性表达的细胞数也大量增加,提示此时大鼠肝中的HSC处于激活后的增殖状态。经ATG处理后,大鼠肝组织中α-SMA和PCNA双阳性细胞数量明显降低,提示ATG可能通过抑制HSC激活及其随后的增殖状态,逆转肝纤维化的进程。
细胞增殖是通过细胞周期的运行实现的,在真核细胞的细胞周期调控中,G0/G1-S期之间的限制点(restriction point,又称R点)是细胞内外信号经传递、整合,汇集到细胞核对细胞增殖进行调控的关键点。处于G1期的HSC在生长因子的刺激下表达cyclin D1,进而cyclin D1与CDK4/6结合进入细胞核内进行磷酸化[13]。磷酸化的cyclin D1与CDK4/6复合物可进一步促使“成视网膜细胞瘤”(retinoblastoma,RB)蛋白磷酸化,而相继周期蛋白E-CDK2组成的复合物进一步磷酸化RB蛋白。RB的高度磷酸化解除了其对E2F等基因转录因子的抑制作用,从而启动S期相关蛋白编码基因的转录,使细胞通过G1期进入S期[14]。由上可知,cyclin D1/CDK复合物对于细胞G0/G1-S期转变起到至关重要的作用。p27kip1作为细胞周期的负性调控因子,通过抑制CDK的激活过程,或抑制已激活的cyclin D1/CDK激酶活性,阻止RB蛋白磷酸化,使细胞无法通过G0/G1-S期限制点,从而抑制细胞的增殖[15]。本研究结果显示,在CCl4诱导的肝纤维化模型大鼠肝组织内存在有较高水平的cyclin D1,CDK2,CDK4和PCNA蛋白表达,同时p27kip1蛋白水平相对较低。因此,被激活的HSC处于DNA合成相对活跃的S期。经过ATG治疗后,大鼠肝组织cyclin D1,CDK2,CDK4和PCNA蛋白表达水平明显降低,p27kip1蛋白表达水平上调,使HSC停滞于G0/G1期,从而恢复其相对静息的低增殖状态,这可能是ATG抑制HSC增殖的分子机制。
综上所述,本研究证实了ATG对CCl4诱导的大鼠肝损伤有保护作用,同时,ATG通过抑制cyclin D1与CDK2和CDK4,上调细胞周期阻抑物蛋白p27kip1的表达水平,使得HSC无法进入自主分裂程序,从而抑制活化的HSC增殖,这可能是ATG抗肝纤维化的作用机制。
参考文献:
[1]Svegliati-Baroni G,De Minicis S,Marzioni M.Hepatic fibrogenesis in response to chronic liver injury:novel insights on the role of cell-to-cell interaction and transition[J].Liver Int,2008,28(8):1052-1064.
[2]Tsukada S,Parsons CJ,Rippe RA.Mechanisms of liver fibrosis[J].Clin Chim Acta,2006,364(1-2):33-60.
[3]Wells RG.Mechanisms of liver fibrosis:new insights into an old problem[J].Drug Discov Today Dis Mech,2006,3(4):489-495.
[4]Fang L,Zhan S,Huang C,Cheng X,Lyu X,Si H,et al.TRPM7 Channel regulates PDGF-BB-induced proliferation of hepatic stellate cells via PI3K and ERK pathways[J].Toxicol Appl Pharma-col,2013,272(3):713-725.
[5]Lin SC,Lin CH,Lin CC,Lin YH,Chen CF,Chen IC,et al.Hepatoprotective effects of Arctium lappa Linne on liver injuries induced by chronic ethanol consumption and potentiated by carbon tetrachlo-ride[J].J Biomed Sci,2002,9(5):401-409.
[6]Lin SC,Chung TC,Lin CC,Ueng TH,Lin YH,Lin SY,et al.Hepatoprotective effects of Arctium lappa on carbon tetrachloride-and acetaminopheninduced liver damage[J].Am J Chin Med,2000,28(2):163-173.
[7]Li A,Wang J,Wu M,Zhang X,Zhang H.The inhibitionofactivatedhepaticstellatecells proliferation by arctigenin through G0/G1phase cell cycle arrest:persistent p27(kip1)induction by inter-fering with PI3K/Akt/FOXO3a signaling pathway [J].Eur J Pharmacol,2015,747(11):71-87.
[8]Zhong Y,Tang Z,Xu R,Lin N,Deng M,Fang H,et al.Effect of transplantation route on stem cell migration to fibrotic liver of rats via cellular magnetic resonance imaging[J].Cytotherapy,2013,15 (10):1266-1274.
[9]Awale S,Lu J,Kalauni SK,Kurashima Y,Tezuka Y,Kadota S,et al.Identification of arctigenin as an antitumor agent having the ability to eliminate the tolerance of cancer cells to nutrient starvation[J]. Cancer Res,2006,66(3):1751-1757.
[10]Jiang Y, Wang C, Li YY,Wang XC,An JD,Wang YJ,et al.Mistletoe alkaloid fractions alleviates carbon tetrachloride-induced liver fibrosis through inhibition of hepatic stellate cell activation via TGF-β/ Smad interference[J].J Ethnopharmacol,2014,158(Pt A):230-238.
[11]Li SB,Jia YJ.Interaction betweenextracellular matrix and stellate cells in hepatic fibrosis[J].Prog Physiol Sci(生理科学进展),2014,45(6):462-464.
[12]Wang L,Zhao F,Liu K.Advances in studies on pharmacological effect of arctiin and arctigenin [J].Chin Tradit Herbal Drugs(中草药),2008,39 (3):467-470.
[13]Lu ML,Yan C,Lai D,Xu HH.Cyclin D1 and cell cycle regulation[J].Biot Bull(生物技术通报),2011,(10):55-59.
[14]Sánchez I,Dynlacht BD.New insights into cyclins,CDKs,and cell cycle control[J].Semin Cell Dev Biol,2005,16(3):311-321.
[15]Stanley JA,Lee J,Nithy TK,Arosh JA,Burghardt RC,Banu SK.Chromium-Ⅵ arrestscellcycleand decreases granulosa cell proliferation by downregulating cyclin-dependent kinases(CDK)and cyclins and up-regulating CDK-inhibitors[J].Reprod Toxicol,2011,32(1):112-123.
(本文编辑:贺云霞)
Therapeutic effect of arctigenin on carbon tetrachloride-induced liver fibrosis in rats
ZHANG Xiao-xun,WANG Jun,ZHAO Yu,ZHANG Jing-yao,LI Ao
(College of Pharmacy and Bioengineering,Chongqing University of Technology,Chongqing 400054,China)
Abstract:OBJECTlVETo investigate the effect of arctigenin(ATG)on liver fibrosis in rats induced by carbon tetrachloride(CCl4)and to explore its underlying mechanism.METHODS Sprague-Dawley rats were randomly divided into six groups:vehicle,ATG 3.0 mg·kg-1group,CCl4model group,CCl4+ATG 1.0 and 3.0 mg·kg-1groups,and CCl4+colchicine(COL)0.1 mg·kg-1(toxicity)group. Liver fibrosis was induced by subcutaneous injection of CCl4in rats for 8 weeks.ATG and colchicine were administrated ig once a day starting from the fifth week after the CCl4treatment for 4 weeks subsequent.At the end of the study,glutamic pyruvic transaminase(GPT),glutamic oxaloacetic transaminase(GOT),albumin(ALB),and total bilirubin(TBIL)as well as the contents of hydroxyproline (HYP)in liver tissues were measured.Histopathological changes were observed in the liver tissues using hematoxyline-eosin(HE)and Masson’s trichrome staining.The proliferation of hepatic stellate cells(HSC)and expression of cell cycle-related proteins were assayed by indirect immunofluores-cence staining and Western blotting,respectively.RESULTS Compared with CCl4model group,ATG 1.0 and 3.0 mg·kg-1improved the liver function by decreasing serum contents of GPT,GOT and TBIL (P<0.05),and increasing serum content of albumin(P<0.05).Histological results indicated that ATG 1.0 and 3.0 mg·kg-1alleviated liver damage and reduced the formation of fibrous septa.Moreover,ATG 1.0 and 3.0 mg·kg-1significantly decreased liver HYP when compared with CCl4model group(P<0.05).In addition,CCl4-induced proliferation of activated HSC was inhibited by ATG 1.0 and 3.0 mg·kg-1,and this was accompanied by down-regulation of cyclin D1,cyclin-dependent kinase(CDK)2,CDK4,and proliferating cell nuclear antigen(PCNA)(P<0.05),and up-regulation of p27kip1in activated HSC (P<0.05).CONCLUSlON ATG can alleviate hepatic injury and fibrosis induced by CCl4,which is probably associated with suppression of the proliferation of activated HSC.
Key words:arctigenin;hepatic fibrosis;hepatic stellate cells;cell cycle
中图分类号:R285.5
文献标志码:A
文章编号:1000-3002(2016)01-0053-08
Foundation item:The project supported by National Natural Science Foundation of China(81001675);and Chongqing Natural Science Foundation(cstc2014jcyjA10030) LI Ao,E-mail:ao_livip@sina.com,Tel:(023)62400251,Fax:(023)68906603
收稿日期:(2015-09-21接受日期:2015-12-20)
基金项目:国家自然科学基金(81001675);重庆市科委前沿与应用基础研究(一般)项目(cstc2014jcyjA10030)
作者简介:张晓珣,男,硕士研究生,主要从事慢性纤维化疾病的中医药防治研究。
通讯作者:李 傲,E-mail:ao_livip@sina.com,Tel:(023)62400251,Fax:(023)68906603
