大鼠经胃和皮下暴露毒死蜱的毒物代谢动力学和毒效学模型构建
2016-07-21曹正颖姚欣雅赵敏娴王灿楠东南大学公共卫生学院营养与食品卫生系环境医学工程教育部重点实验室江苏南京210009
曹正颖,姚欣雅,赵敏娴,王灿楠(东南大学公共卫生学院营养与食品卫生系环境医学工程教育部重点实验室,江苏南京 210009)
大鼠经胃和皮下暴露毒死蜱的毒物代谢动力学和毒效学模型构建
曹正颖,姚欣雅,赵敏娴,王灿楠
(东南大学公共卫生学院营养与食品卫生系环境医学工程教育部重点实验室,江苏南京 210009)
摘要:目的 构建毒死蜱(CPF)同时ig和sc暴露的以生理学为基础的毒物代谢动力学和毒效学(PBTK/TD)模型,模拟和验证其预测CPF暴露后体内毒代特征及毒效可靠性。方法 ①构建CPF的PBTK/TD模型,运用所构建的模型模拟大鼠同时ig和sc暴露CPF的毒代和毒效学数据,预测暴露大鼠血液中CPF及其代谢物3,5,6-三氯-2-吡啶酚(TCP)浓度变化,血液和大脑中乙酰胆碱酯酶(AChE)活性变化曲线。②45只成年雄性大鼠一次性ig和sc联合染毒CPF(50+50)mg·kg-1,染毒后0.0,1.0,2.0,4.0,6.0,8.0,12.0,24.0和48.0 h收集生物样本,测定血浆CPF和TCP浓度,及血浆和大脑皮质AChE活性,将实测值与模型模拟值进行比较,以验证模型的准确性。结果 模拟大鼠ig和sc联合暴露CPF 20+20,10+30和(30+ 10)mg·kg-1后,48 h内血液中CPF和TCP浓度均先上升,达到峰值后随之下降;ig暴露剂量越大,血浆AChE活性下降越快,酶活性抑制程度越重,但酶活性恢复速度很快;大脑AChE活性抑制程度受皮下暴露量的影响较大。实测大鼠联合染毒(50+50)mg·kg-1CPF后的血浆CPF和TCP浓度,及血浆和大脑皮质AChE活性,与模型预测值基本一致,差异无统计学意义。结论 本研究所构建的PBTK/TD模型可预测大鼠同时ig和sc暴露CPF后的体内毒代特征及毒效水平。
关键词:毒死蜱;乙酰胆碱酯酶;毒物代谢动力学;毒效学;数学模型
DOl:10.3867/j.issn.1000-3002.2016.01.011
毒死蜱(chlorpyrifos,CPF)是一种高效广谱、中等毒性的有机磷农药,不仅可抑制胆碱酯酶活性,还可阻断植物的光合作用,既是杀虫剂又是除草剂[1],对实验动物具有急性、亚慢性和慢性毒性作用。CPF可经呼吸道、消化道和皮肤暴露,而膳食暴露是普通人群的主要途径[2]。对于职业人群很有可能3种途径同时暴露,其中又以皮肤暴露最为重要[3]。虽然已有大量关于职业人群CPF暴露的研究资料,但绝大部分都以测量外暴露量为主[4-6],无法评估内暴露剂量以及中毒效应之间的关系。本研究所构建CPF同时ig和sc暴露的以生理学为基础的毒代和毒效学(physiologically based toxicokinetics and toxicodynamics,PBTK/TD)模型,可预测体内CPF的内暴露剂量和毒效应水平,为CPF多途径暴露风险评估提供新的更加有效的方法。
1 材料与方法
1.1试剂和仪器
市售玉米油;CPF(纯度97%,成都麦卡希化工有限公司),用玉米油溶解稀释至所需浓度;CPF标准品(99%,美国Aladdin试剂公司);3,5,6-三氯-2-吡啶酚(3,5,6-trichloro-2-pyridinol,TCP)标准品(>99%,美国Sigma公司)。岛津高效液相色谱仪LC-20AD,岛津二极管阵列检测器,TGL-16C离心机,氮吹仪。
1.2动物分组和处理
SPF级成年雄性Spraque-Dawley(SD)大鼠45只,体质量257~289 g,由上海市西普尔-必凯实验动物有限公司提供,许可证号:SCXK(沪)2013-0016。适应性喂养7 d后,同时ig和sc注射一次性染毒,剂量为(50+50)mg·kg-1。在染毒后0.0,1.0,2.0,4.0,6.0,8.0,12.0,24.0和48.0 h 9个时间点随机抽取5只大鼠,乙醚麻醉,取股动脉血,颈椎脱臼处死,分离大脑,生物样本经处理后于-80℃冷冻保存。
1.3检测方法
大脑皮质中蛋白含量按考马斯亮蓝试剂盒说明书测定,血液和大脑皮质乙酰胆碱酯酶(acetylcholineesterase,AChE)活性按乙酰胆碱酯酶试剂盒说明书测定。参照文献[7],采用高效液相色谱法检测血液CPF和TCP含量。
1.4模型结构
根据CPF在机体内的作用特点及生理学和解剖学原理设计模型的框架,CPF多途径PBTK/TD模型可分为皮肤(sk)、脂肪(f)、隔膜(d)、大脑(b)、肝(l)、快速灌注组织(r)和缓慢灌注组织(s)7个房室,具体如图1所示。
1.5模型参数
本研究中的相关参数均参考文献(表1)。大鼠生理参数(体质量、脏器容积、血流灌注速率)参考文献[8],组织器官分配系数(CPF的血脑、血脂、血肝、血液和皮肤等分配系数)参考文献[9],代谢参数〔米氏常数(Km)、最大代谢速率(Vmax)〕来自文献[10-11,13-14],吸收参数参考文献[10-12]。Smith等[15]比较了CPF ig与sc注射两种染毒方式在机体内的PBTK/TD行为特征,发现ig染毒时大脑胆碱酯酶活性几乎不受脑组织代谢的影响,而sc染毒时脑组织代谢对大脑胆碱酯酶活性影响很大。因此,本研究将脑组织代谢引入模型中,其Vmax及Km参考文献[14]。
模型模拟所需的毒效学参数,酶合成速率、降解速率、抑制速率、再生速率以及老化速率均参考文献[10]。
1.6模型的运算
根据质量守恒定律,单位时间内各房室CPF变化量=进入该室的质量-离开该室的质量+通过代谢在该室产生的质量-通过代谢在该室减少的质量。本文所用公式均参考文献[7]和[13]。
大鼠ig染毒后,CPF首先进入胃肠道,最终随血液进入肝,CPF在胃肠道吸收、转运情况为:

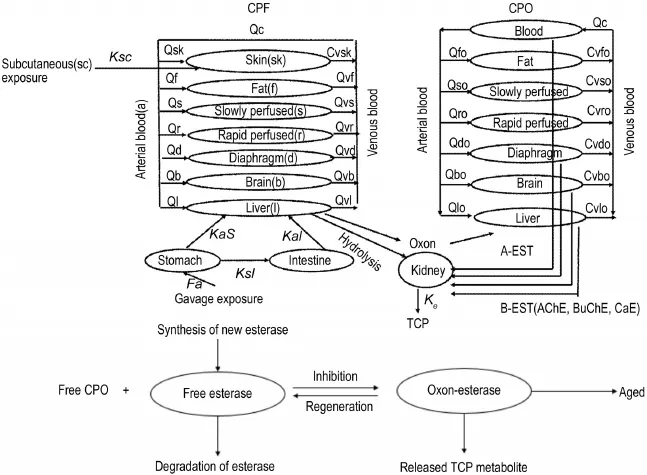
Fig.1 Physiologically based toxicokinetics and toxicodynamics model for disposition of chlorpyrifos(CPF),CPF-oxon(CPO),3,5,6-trichloro-2-pyridinol(TCP)and B-esterase(B-EST)inhibition in rats following simnlta-neously oral and subcutaneous exposure to CPF.Qc:cardiac output;Ca:arterial blood concentration of CPF;Cv:pooled venous blood concentration of CPF;KaS:first-order transfer from the stomach into the liver;KaI:first-order transfer from intestine into the liver;Fa:fractional absorption;KsI:first-order transfer from the stomach into the intestine;Ke:elimination rate constant;A-EST:paraoxonose 1,PON-1.

Tab.1 Parameters of physiologically based toxicokinetics and toxicodynamics(PBPK/PD)model
式中,R1和R2分别表示胃和肠道中CPF剂量,KaS和KaI分别表示胃和肠道吸收进入肝的一级反应速率常数,KsI表示胃肠道之间转换系数。dOral/dt表示CPF经胃肠道吸收进入肝的CPF的变化率。
CPF在皮肤房室的吸收、转运情况为:

式中,Ksc表示CPF在皮下的吸收速率常数。CUTE表示皮下CPF的量,PSC表示皮肤房室中CPF的量。
CPF在大脑房室的代谢、转运方程如下:

式中,AB表示大脑CPF的量,QB表示大脑血流量,CAf为血液中游离CPF浓度,CVBf为离开大脑时静脉血游离CPF浓度,CB表示大脑CPF浓度。AML5表示游离的CPF被细胞色素P450 (CYP)代谢成氧毒死蜱(CPF-oxon,CPO)的含量,Vmax5和Km5分别是大脑中CPF代谢成CPO的最大速率常数和米氏常数。
CPF在脂肪、隔膜、缓慢和快速灌注组织房室转运:
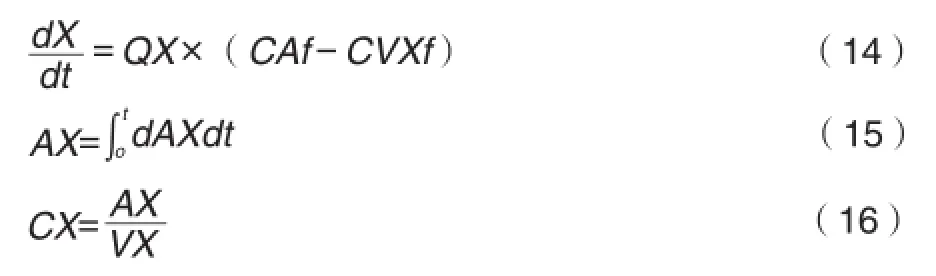
式中,AX表示X室CPF的量,QX表示X室血流量,CAf为血液中游离CPF浓度,CVXf为离开X室时静脉血游离CPF浓度,CX表示X室CPF浓度。
CPF在肝房室的代谢:

式中,QH是肝血流量,CAf是血液中游离CPF浓度,CVHf是离开肝时静脉血游离CPF浓度,dOral/dt表示从胃肠道进入肝房室的吸收速率,AML1和AML2分别表示游离的CPF被CYP代谢成CPO和TCP的含量,Vmax1和Km1是肝中CPF代谢成CPO的最大速率常数和米氏常数,Vmax2和Km2是肝中CPF代谢成TCP的最大速率常数和米氏常数。
两种途径联合暴露后,CPF随血液进入肝脏代谢产生CPO,CPO则进一步可以与B酯酶结合,如乙酰、丁酰胆碱酯酶以及羧酸酯酶,从而抑制胆碱酯酶,引起毒性作用。AChE活性变化:

式中,dAChEdt表示单位时间内某一房室中AChE的变化量,Ka,Ks,Kd,Ki和Kr分别表示AChE老化率、合成率、降解率、抑制率以及复活率。AChE是房室中AChE的初始含量,Co是房室中CPO的浓度,iACHE是房室中AChE受抑制的含量。Hce表示某一房室中AChE的活性。
1.7模型模拟与验证
基于大鼠ig和sc暴露CPF PBTK/TD模型的构建,对大鼠联合暴露CPF的毒代学和毒效学进行模拟,预测暴露大鼠CPF 20+20,10+30和(30+ 10)mg·kg-1后,血液CPF和TCP浓度变化以及血液和大脑AChE活性变化。为验证该模型的准确性,将暴露大鼠CPF(50+50)mg·kg-1作为外暴露剂量代入模型,模拟血液CPF和TCP浓度以及血液和大脑AChE活性,并将模拟结果与动物实验结果进行比较。
2 结果
2.1大鼠经胃和皮下联合暴露毒死蜱的毒物代谢动力学模拟结果
模拟暴露大鼠CPF 20+20,10+30,30+10和(50+50)mg·kg-1后48.0 h内血液中CPF和TCP浓度变化,结果见图2。从图中CPF浓度模拟曲线可见,当联合暴露于CPF后,血CPF浓度均先上升,达到峰值后随之下降。虽然20+20,10+30和(30+ 10)mg·kg-13个剂量组暴露总量一样,但皮下暴露剂量越大,血液CPF浓度越高,血液CPF浓度与皮下染毒剂量呈梯度对应。由图2中TCP浓度模拟曲线可见,20+20,10+30,(30+10)mg·kg-13个剂量组血液TCP浓度均在给药后6.6 h达到峰值,随之下降,3条曲线相交于给药后21.8 h。在21.8 h内血液TCP浓度为30+10>20+20>(10+ 30)mg·kg-1,21.8 h后血液TCP浓度为10+30>20+20>(30+10)mg·kg-1,这种现象可能与CPF ig摄入的首过效应及皮下染毒后CPF在注射部位缓慢吸收释放入血有关。而(50+50)mg·kg-1由于其总剂量大于其他3组,所以血液CPF和TCP浓度均高于其他3组。

Fig.2 Simulation for concentrations of CPF(A)and TCP(B)in blood of SD rats administered CPF by ig and sc injection.
2.2大鼠经胃和皮下联合暴露毒死蜱的毒效学模拟结果
模拟大鼠经ig和sc联合暴露CPF 20+20,10+ 30,30+10和(50+50)mg·kg-1后48.0 h内血液和大脑AChE活性变化,结果见图3。从图3A血液AChE活性模拟曲线可见,联合ig和sc暴露(10+ 30)mg·kg-1剂量组,血液AChE活性在染毒后14.0 h降到最低值31.01%,(20+20)mg·kg-1剂量组在染毒后9.0 h降到最低值21.85%,(30+10)mg·kg-1剂量组在染毒后8.4 h降到最低值17.35%,表明联合暴露时ig暴露剂量越大血液AChE活性下降越快,酶活性抑制程度越重,但酶活性恢复速度很快。图3B大脑AChE活性模拟曲线显示,在染毒后15.0 h内,3组大脑AChE活性下降水平差别不大,随后开始出现较大差距,抑制程度依次为10+30>20+20>(30+10)mg·kg-1剂量组,提示两种途径同时暴露时,大脑AChE活性抑制程度受皮下暴露量的影响较大。在(50+50)mg·kg-1组可见大脑AChE活性明显下降,而血液AChE活性下降不明显,可能是因为血液AChE与CPO的结合已接近饱和,这也说明血液AChE活性可作为CPF急性暴露的生物标志物。

Fig 3.Simulation for inhibition of AChE in blood(A)and brain(B)administered CPF by ig and sc injection. AChE activity:AChE activity of experiment group/control group× 100%.
2.3模型验证
大鼠联合ig和sc暴露(50+50)mg·kg-1CPF后,测量不同时间点大鼠血液中CPF和TCP的浓度及血液和大脑中AChE活性。将模型模拟所得的毒代学和毒效学数据与实测数据进行比较,以验证模型的准确性。
2.3.1大鼠经胃和皮下联合毒死蜱暴露的毒物代谢动力学
图4显示了联合暴露CPF(50+50)mg·kg-1后48.0 h大鼠血液CPF和TCP浓度变化的模拟值与实测值。联合暴露后2.0 h,血液CPF浓度达到峰值0.74 μmol·L-1,模型模拟血液CPF浓度在2.8 h达到峰值0.78 μmol·L-1。联合暴露后6.0 h,血液TCP浓度达到峰值65.62 μmol·L-1,模型模拟血液TCP浓度在6.6 h达到峰值68.07 μmol·L-1。血液CPF和TCP浓度模拟值与实测值经t检验,t值分别为1.40和-0.52,P值为0.20和0.62,差异无统计学意义。由此可见,模型对血液CPF和TCP浓度的模拟结果与实测值相符。
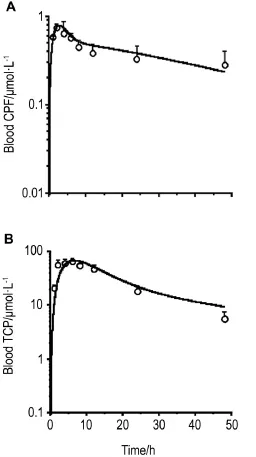
Fig.4 Experimental data(symbol)and simulation (line)for concentrations of CPF(A)and TCP(B)in blood of rats administered CPF by ig and sc injection at dose of(50+50)mg·kg-1.
2.3.2大鼠经胃和皮下联合暴露毒死蜱的毒效学
图5显示了联合暴露CPF(50+50)mg·kg-1后48.0 h大鼠血液和大脑AChE活性模拟值与实测值。实验数据显示,血液AChE活性在12.0 h降到最低值6.67%,模型模拟血液AChE活性在9.5 h降到最低值11.37%,大脑AChE活性在24.0 h降到最低值24.32%,模型模拟大脑AChE活性在18.4 h降到最低值17.84%,模型稍微低估了大脑AChE活性。血液和大脑AChE活性模拟值与实测值经t检验,t值分别为1.25和-0.51,P值为0.25和0.63,差异无统计学意义。由此可见,模型对血液和大脑AChE活性的模拟结果与实测值相符。

Fig.5 Experimental data(symbol)and simulation (line)for inhibition of AChE in blood(A)and brain (B)of rats administered CPF by ig and sc injection at dose of(50+50)mg·kg-1.AChE activity:AChE activity of experiment group/control group×100%.
3 讨论
本研究构建了大鼠ig和sc联合暴露CPF的PBTK/TD模型,模拟了3个剂量组的毒代学和毒效学结果,并对构建的模型用动物实验数据进行验证。结果显示所构建的PBTK/TD模型可较好地模拟现有的实验数据。
模型对暴露大鼠CPF 20+20,10+30和(30+ 10)mg·kg-1模拟结果显示,当总剂量相同时,皮下染毒剂量越大,血液CPF浓度越高,这可能是由于皮下染毒没有首过代谢效应的作用[16],也可能是由于CPF的亲脂特性[17]导致CPF蓄积在皮下脂肪中。CPF ig染毒后,迅速吸收并经肝氧化代谢为CPO 和TCP,CPO对人和动物具有更强的毒性。而皮下注射途径,因为少了首过效应,导致血液中CPF代谢缓慢。对于血液TCP浓度出现3种曲线相交的现象,可能是因为两种途径联合暴露时,ig途径的CPF吸收代谢迅速,ig暴露浓度越大,血液TCP浓度也越大,21.8 h之后,ig暴露的CPF大多已被代谢,此时血液TCP浓度主要受皮下暴露CPF的影响。Timchalk等[18]ig暴露CPF 60 mg·kg-124.0 h后,绝大多数CPF内剂量以TCP代谢物的形式从尿液中排泄。Marty等[19]采用放射性同位素标记法跟踪了sc CPF,发现直到染毒后2.0 h,大量CPF仍存留在注射部位。所以,当ig和sc联合暴露CPF后,ig暴露CPF迅速被吸收代谢,导致早期血液中CPF浓度受ig暴露剂量的影响,而sc暴露CPF则缓慢吸收释放入血,以致后期血液浓度是受sc染毒剂量的影响。该结论在毒效学结果中也得到了证实,血液和大脑AChE活性变化曲线均出现此现象。值得注意的是,这种情况对大脑AChE活性影响不大,3组大脑AChE活性最初相差不多,相交之后活性差距逐渐拉大,这提示皮下染毒对大脑AChE活性的影响较大[15,20]。因此,我们在模型的构建过程中引入了大脑代谢。
本研究选用ig与sc联合暴露途径,其中sc暴露代替经皮暴露途径,这是因为有研究显示sc暴露接近人体的经皮暴露[14]。在目前的CPF暴露研究中,在空气、食物、灰尘等样品中均检测到CPF的残留[21]。因此,多途径暴露不再仅仅是职业暴露人群,非职业人群的CPF多途径暴露也值得关注。本研究构建的多途径大鼠ig和sc暴露毒死蜱PBTK/TD模型有利于大鼠实验数据到人群结果的外推,这将会越来越多地被应用于构建剂量-反应关系和制定参考剂量。
本研究所构建的模型不仅能较好地对CPF ig 和sc联合暴露后的毒代学进行拟合,且能很好地描述血液和大脑AChE活性水平。因此,可用于通过血液生物标志物进行逆向的暴露水平重建[22]。总之,本研究所构建的PBTK/TD模型可预测大鼠ig 和sc联合暴露CPF后的体内PBTK/TD水平。
参考文献:
[1]Zheng G.Research progresses in the toxicology of chlorpyrifos[J].Chin J Public Health(中国公共卫生),2002,18(4):496-498.
[2]Poet TS,Timchalk C,Hotchkiss JA,Bartels MJ. Chlorpyrifos PBPK/PD model for multiple routes of exposure[J].Xenobiotica,2014,44(10):868-881.
[3]Ramos LM,Querejeta GA,Flores AP,Hughes EA,Zalts A,Montserrat JM.Potential dermal exposure in greenhouses for manual sprayers:analysis of the mix/load,application and re-entry stages[J]. Sci Total Environ,2010,408(19):4062-4068.
[4]Cruz Márquez M,Arrebola FJ,Egea González FJ,Castro Cano ML,Martínez Vidal JL.Gas chro-matographic-tandem mass spectrometric analytical methodforthestudyofinhalation,potential dermal and actual exposure of agricultural workers to the pesticide malathion[J].J Chromatogr A,2001,939(1-2):79-89.
[5]Soutar A,Semple S,Aitken RJ,Robertson A. Use of patches and whole body sampling for the assessment of dermal exposure[J].Ann Occup Hyg,2000,44(7):511-518.
[6]MacheraK, GoumenouM, Kapetanakis E,Kalamarakis A,Glass CR.Determination of potential dermalandinhalationoperatorexposureto malathion in greenhouses with the whole body dosimetry method[J].Ann Occup Hyg,2003,47 (1):61-70.
[7]Zhao MX,Yao XY,Cao ZY,Wan CN.Toxicoki-netics and toxicodynamics of chlorpyrifos in rats following one single subcutaneous exposure[J]. Carcinog Teratog Mutag(癌变·畸变·突变),2015,27(2):129-133.
[8]Gearhart JM,Jepson GW,Clewell HJ,Andersen ME,Conolly RB.Physiologically based pharmacokinetic and pharmacodynamic model for the inhibition of acetylcholinesterase by diisopropylfluorophosphate [J].Toxicol Appl Pharmacol,1990,106(2):295-310.
[9]LoweER,PoetTS,RickDL,MartyMS,Mattsson JL,Timchalk C,et al.The effect of plasma lipids on the pharmacokinetics of chlorpyrifos and the impact on interpretation of blood biomonitoring data[J].Toxicol Sci,2009,108(2):258-272.
[10]Timchalk C,Kousba AA,Poet TS.An age-dependent physiologically based pharmacokinetic/pharmaco-dynamic model for the organophosphorus insecticide chlorpyrifos in the preweanling rat[J].Toxicol Sci,2007,98(2):348-365.
[11]Timchalk C,Poet TS.Development of a physiologi-cally based pharmacokinetic and pharmacodynamic model to determine dosimetry and cholinesterase inhibition for a binary mixture of chlorpyrifos and diazinon in the rat[J].Neurotoxicology,2008,29 (3):428-443.
[12]Zhao MX,Yao XY,Cao ZY,Wan CN.Physiologi cally based pharmacokinetic and pharmacodynamic model in rats folllowing acute subcutaneous expo-sure to chlorpyrifos[J].Acta Univ Med Nanjing(南京医科大学学报),2015,35(5):745-750.
[13]Timchalk C,Nolan RJ,Mendrala AL,Dittenber DA,Brzak KA,Mattsson JL.A physiologically based pharmacokinetic and pharmacodynamic(PBPK/PD)model for the organophosphate insecticide chlorpy-rifos in rats and humans[J].Toxicol Sci,2002,66 (1):34-53.
[14]Ellison CA,Smith JN,Lein PJ,Olson JR.Pharma-cokinetics and pharmacodynamics of chlorpyrifos in adult male Long-Evans rats following repeated subcutaneous exposure to chlorpyrifos[J].Toxicology,2011,287(1-3):137-144.
[15]Smith JN,Campbell JA,Busby-Hjerpe AL,Lee S,Poet TS,Barr DB,et al.Comparative chlorpyrifos pharmacokinetics via multiple routes of exposure and vehicles of administration in the adult rat[J]. Toxicology,2009,261(1-2):47-58.
[16]Carr RL,Nail CA.Effect of different administration paradigms on cholinesterase inhibition following repeated chlorpyrifos exposure in late preweanling rats[J].Toxicol Sci,2008,106(1):186-192.
[17]Moser VC,Padilla S.Age-and gender-related differences in the time course of behavioral and biochemical effects produced by oral chlorpyrifos in rats[J].Toxicol Appl Pharmacol,1998,149(1):107-119.
[18]Timchalk C,Poet TS,Hinman MN,Busby AL,Kousba AA.Pharmacokinetic and pharmacody-namic interaction for a binary mixture of chlorpyrifos and diazinon in the rat[J].Toxicol Appl Pharmacol,2005,205(1):31-42.
[19]Marty MS,Domoradzki JY,Hansen SC,Timchalk C,Bartels MJ,Mattsson JL.The effect of route,vehicle,and divided doses on the pharmacokinetics of chlorpyrifos and its metabolite trichloropyridinol in neonatal Sprague-Dawley rats[J].Toxicol Sci,2007,100(2):360-373.
[20]Chambers JE,Chambers HW.Oxidative desulfuration of chlorpyrifos,chlorpyrifos-methyl,and leptophos by rat brain and liver[J].J Biochem Toxicol,1989,4(3):201-203.
[21]Morgan MK,Sheldon LS,Croghan CW,Jones PA,Robertson GL,Chuang JC,et al.Exposures of preschool children to chlorpyrifos and its degradation product 3,5,6-trichloro-2-pyridinol in their everyday environments[J].J Expos Anal Environ Epidemiol,2005,15(4):297-309.
[22]Chao YY,Zhang H,Liu Y,Zhang XF.Construction of a PBPK/PD model for methamidophos in rats using the exposure-related dose estimating model (ERDEM)[J].Pract Pharm Clin Remedies(实用药物与临床),2015,18(2):174-176.
(本文编辑:齐春会)
A physiologically based toxicokinetics and toxicodynamics model in rats following both oral and subcutaneous exposure to chlorpyrifos
CAO Zheng-ying,YAO Xin-ya,ZHAO Min-xian,WANG Can-nan
(Ministry of Education Key Laboratory of Environmental Medical Engineering,Department of Nutrition and Food Hygiene,School of Public Health,Southeast University,Nanjing 210009,China)
Abstract:OBJECTlVE To develop and validate a physiologically based toxicokinetics and toxico-dynamics(PBTK/TD)model for chlorpyrifos(CPF)in rats following both oral and subcutaneous expo-sures to CPF.METHODS①A PBTK/TD model was established with toxicokinetics and toxicodynam-ics data in literature,which was used for predicting contents of CPF and 3,5,6-trichloro-2-pyridinol (TCP)in blood and activities of acetylcholine esterase(AChE)in the plasma and brain of rats exposed to CPF.②Rats were given 50 mg·kg-1CPF oral and 50 mg·kg-1CPF sc simultaneously.Blood and brain samples were collected at 0,1,2,4,6,8,12,24 and 48 h,respectively,after CPF administration (n=5).CPF And TCP contents in plasma,activities of AChE in the plasma and brain were deter-mined,and compared with the simulation values by PBTK/TD model in order to validate the accuracy of the model.RESULTS It was predicted by the PBTK/TD model that after the administration(oral+ sc)of CPF 20+20,10+30 and(30+10)mg·kg-1,the concentrations of CPF and TCP in plasma increased and then decreased with time in each group.The inhibitory level of AChE activity in the plasma was orally dose-dependent,while AChE activity of the brain was more sensitive to CPF subcutaneous exposure.The simulation values obtained by the PBTK/TD model were not significantly different from the experimental values obtained by co-administered CPF at(50+50)mg·kg-1.CONCLUSlON This CPF PBTK/TD model can quantitatively estimate target tissue dosimetry and AChE inhibition.
Key words:chlorpyrifos;acetylcholinesterase;toxicokinetics;toxicodynamics;mathematical model
中图分类号:R338.1,R34
文献标志码:A
文章编号:1000-3002(2016)01-0074-08
Foundation item:The project supported by National Natural Science Foundation of China(81273080);and National Natural Science Foundation of China(81072304) WANG Can-nan,E-mail:wcnseu@126.com,Tel:(025)83272568
收稿日期:(2015-07-03接受日期:2015-11-25)
基金项目:国家自然科学基金(81273080);国家自然科学基金(81072304)
作者简介:曹正颖,女,硕士研究生,从事食品安全风险评估研究。
通讯作者:王灿楠,E-mail:wcnseu@126.com,Tel:(025)83272568
