喹啉酸对PC12细胞自噬发生及相关信号通路蛋白表达的影响
2016-07-21李永金杨开勇阚美佳陈月芳潘海元黄晓佳江苏大学医学院江苏镇江03中国人民解放军第8医院药剂科江苏淮安300
李永金,张 谊,杨开勇,安 珂,张 庄,阚美佳,陈月芳,潘海元,黄晓佳(.江苏大学医学院,江苏镇江 03;.中国人民解放军第8医院药剂科,江苏淮安 300)
·论著·
喹啉酸对PC12细胞自噬发生及相关信号通路蛋白表达的影响
李永金1,张 谊1,杨开勇1,安 珂1,张 庄1,阚美佳1,陈月芳1,潘海元2,黄晓佳1
(1.江苏大学医学院,江苏镇江 212013;2.中国人民解放军第82医院药剂科,江苏淮安 223001)
摘要:目的 探讨喹啉酸(QA)是否引起大鼠肾上腺嗜铬细胞瘤PC12细胞自噬的发生及其与糖原合酶激酶-3β(GSK-3β)/β-联蛋白相关信号通路的关系。方法 用不同浓度QA(2.5,5和10 mmol·L-1)处理PC12细胞24 h,MTT法测定细胞存活,免疫荧光法观察微管相关蛋白1轻链3(LC3)荧光斑点标记的自噬体形成,Western蛋白印迹法检测细胞GSK-3β、β-联蛋白、LC3和Beclin 1的表达。结果QA作用24 h,可浓度依赖性地降低PC12细胞存活率,IC50为8.7 mmol·L-1。QA作用24 h,与正常对照组比较,PC12细胞内LC3荧光斑点标记的自噬体增多,自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ的比值和Beclin 1表达增高(P<0.01);同时PC12细胞内GSK-3β的表达增加(P<0.05,P<0.01),β-联蛋白的表达降低(P<0.05,P<0.01)。结论 QA可诱导PC12细胞自噬的发生,其机制可能与GSK-3β/β-联蛋白相关的信号通路激活有关。
关键词:喹啉酸;PC12细胞;自噬;糖原合酶激酶3;β-联蛋白
DOl:10.3867/j.issn.1000-3002.2016.01.006
神经系统退行性疾病如阿尔茨海默病(Alzheimer disease,AD)、帕金森病和亨廷顿病等的发生发展过程均与谷氨酸受体过度兴奋所介导的神经细胞迟发性损伤有关。喹啉酸(quinolinic acid,QA)是一种内源性谷氨酸受体亚型N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体激动剂,可诱导神经细胞损伤,其在大脑中含量大增是引起神经元损伤的一个重要原因[1],因此被广泛用于制备神经细胞损伤模型。
在神经细胞损伤过程中,Wnt/β-联蛋白(钙黏蛋白相关蛋白β,β-catenin)信号通路扮演重要的角色,糖原合酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)和β-联蛋白均是Wnt信号通路的下游关键调控因子,参与调节细胞能量代谢过程和调控细胞的生长、分化、突变和细胞凋亡等生命活动,是多种信号途径的交汇点,参与多种信号通路的调控,如Wnt通路和磷脂酰肌醇3-激酶/Akt通路等[2]。在AD中,β淀粉样蛋白纤维或寡聚体能激活GSK-3β活性,进而促进Tau蛋白过度磷酸化,诱导神经元凋亡[3]。此外,在模拟AD细胞模型的体外研究中,给予姜黄素后,GSK-3β mRNA和蛋白表达水平均显著减弱;而p-GSK-3β-Ser9蛋白水平却明显增加;β-联蛋白mRNA和蛋白水平也增加,表明GSK-3β/ β-联蛋白信号通路激活可能是AD的发病机制之一[4]。另一项研究也表明,GSK-3β的抑制剂锂具有神经保护和营养功能,其机制是通过抑制GSK-3β激活脑源性神经营养因子介导的细胞存活通路,从而抑制神经元凋亡,促进行为和认知功能的恢复。同时,β-联蛋白也被认为是锂发挥药理作用的关键因子;锂抑制GSK-3β活性后,引起其下游信号β-联蛋白在胞质中积累进入细胞核内参与相关靶基因的转录,进而发挥神经保护作用[5]。此外,氯化锂也是细胞自噬抑制剂,可通过抑制细胞自噬起到神经保护作用[6],提示自噬的发生可促进神经细胞的死亡。然而在乳腺癌耐药的研究中,发现羟氯喹(hydroxychloroquine)可通过抑制自噬的发生增强含雌激素阳性乳腺癌细胞对抗雌激素的敏感性,提示自噬的发生可促进肿瘤细胞的耐受和存活[7]。这一矛盾的结论表明,自噬可能具有双重作用。自噬在兴奋性毒性诱导神经细胞损伤过程中的角色,其形成与GSK-3β和β-联蛋白是否有联系,目前还不明确。
因此,本研究选用大鼠肾上腺嗜铬细胞瘤PC12细胞作为实验对象,以不同浓度QA损伤模拟神经细胞兴奋性毒性,探讨QA是否可引起PC12细胞发生自噬性死亡及其与GSK-3β和β-联蛋白的关系。
1 材料与方法
1.1细胞、试剂和主要仪器
大鼠肾上腺嗜铬细胞瘤PC12细胞来源于中国科学院上海细胞库。DMEM培养基和胰蛋白酶,美国Gibco公司;新生牛血清,杭州四季青生物工程材料有限公司;QA,美国Sigma公司;噻唑蓝(MTT),美国Amresco公司;兔抗GSK-3β多克隆抗体,美国Santa Cruz Biotechnology公司;兔抗β-联蛋白多克隆抗体,美国ImmunoWay公司;兔抗微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)抗体,日本MB公司;兔抗Beclin 1抗体,沈阳万类生物科技有限公司;小鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehy-drogenase,GAPDH)单克隆抗体,上海康城生物有限公司;辣根过氧化物酶或荧光基团标记的二抗,北京康为世纪公司;底物化学发光试剂,美国Millipore公司;其余试剂均为国产分析纯。凝胶成像系统(ChampGel 5000),北京赛智创业科技有限公司。
1.2细胞培养和药物处理
将PC12细胞用含10%新生牛血清、青霉素100 kU·L-1和链霉素100 mg·L-1的高糖DMEM培养基培养,置于含5%CO2和95%空气的37℃培养箱中,每2 d换液1次,4 d传代1次,取对数生长期细胞进行实验。将PC12细胞以3×107L-1密度接种于96孔或24孔板,置于培养箱中培养24 h后,加入QA 1.25~20 mmol·L-1处理24 h,或者加入不同浓度的QA(终浓度分别为2.5,5.0和10.0 mmol·L-1)处理12~72 h。对照组细胞中加入相同体积的PBS。
1.3MTT法检测细胞存活
药物处理结束后,培养板每孔中加入MTT(终浓度为0.5 g·L-1),37℃反应4 h,吸去上清后每孔加入100 μL二甲亚砜,振荡5 min,置酶标仪上于490 nm处测定各孔吸光度(A)值。存活率(%)=实验孔平均A值/对照孔平均A值×100%。50%最大抑制浓度(IC50)=lg-1〔Xm-i(ΣP-0.5)〕,重复4次,取平均值。Xm:最大浓度的对数值;i:浓度倍比的对数值;ΣP:各组生长抑制率之和;0.5:经验常数。
1.4细胞形态学检测
PC12细胞经不同浓度QA处理后,于普通光学倒置显微镜下观察细胞形态并拍照,观察细胞形态变化。
1.5免疫荧光法检测PC12细胞内LC3的表达定位
将PC12细胞接种于玻璃片上,经药物处理后固定细胞,以0.3%Triton X-100透化10 min,羊血清封闭30 min后,滴加抗LC3抗体(1∶300),4℃反应过夜;PBS洗涤后加入FITC标记的二抗(1∶50)室温下避光反应1 h,用50%甘油封片,置荧光显微镜下观察。
1.6细胞GSK-3β 、β -联蛋白、LC3和Beclin 1蛋白的表达检测
细胞经不同浓度QA处理后,收集细胞,提取总蛋白并测定蛋白浓度。将30 mg蛋白进行SDSPAGE电泳、转膜并封闭后,加入抗GSK-3β(1∶1000)、β-联蛋白(1∶1000)、LC3(1∶1000)、Beclin 1 (1∶1000)和GAPDH(1∶7000)抗体于4℃反应过夜。洗涤后,将膜和相应二抗(1∶5000)在室温下反应1 h,以底物化学发光试剂显色后,以凝胶成像系统进行扫描,以ImageJ软件分析各条带积分吸光度值(integrated absorbance,IA)。以GAPDH条带IA作参照,进行半定量分析。
1.7统计学分析
2 结果
2.1喹啉酸对PC12细胞存活的作用
MTT法检测结果(图1A)表明,PC12细胞经QA 1.25~20 mmol·L-1处理24 h,细胞存活率逐渐降低(P<0.05,P<0.01),QA 2.5 mmol·L-1即可降低细胞存活率。QA抑制PC12细胞存活的IC50为8.7mmol·L-1。此外,QA 2.5~10.0 mmol·L-1也可时间(0~72h)依赖性地降低PC12细胞存活率(图1B)。
2.2喹啉酸对PC12细胞形态的影响
如图2所示,正常对照组PC12细胞形态完整,贴壁生长,呈多巴胺神经细胞样形态;胞体可呈三角形、菱形或梭形,胞体饱满,立体感强,周围有光晕,突起明显。经QA 5.0 mmol·L-1处理24 h后,PC12细胞突起回缩淡化,胞体肿胀或变圆,细胞明显减少并出现死亡。QA 10.0 mmol·L-1可引起细胞透光率下降,胞体变圆且突触明显缩短或消失,部分细胞呈现漂浮状态。QA 2.5 mmol·L-1对PC12细胞形态无明显影响。
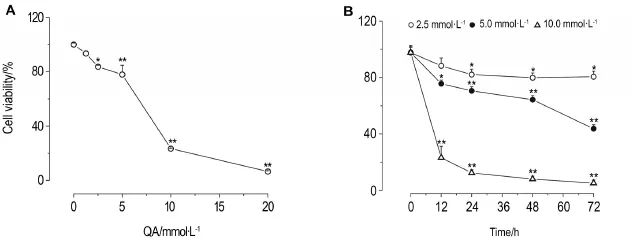
Fig.1 Effect of quinolinic acid(QA)on viability of PC12 cells.After treatment with QA for 24 h(A)or 12-72 h(B),the via-bility of PC12 cells was tested by MTT assay.±s,n=5.*P<0.05,**P<0.01,compared with cell control(0)group.
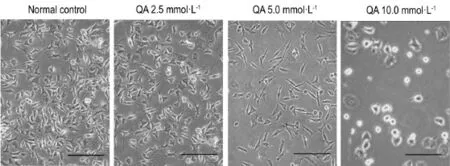
Fig.2 Morphological changes of PC12 cells induced by QA.PC12 cells were treated with QA for 24 h.Scale bar=50 μm.
2.3喹啉酸对PC12细胞LC3表达定位的影响
经绿色荧光FITC标记的自噬特异性蛋白LC3在损伤条件下呈点状聚集,分布于细胞质中。如图3所示,正常对照组只有极弱的荧光弥散分布于细胞质中;QA 5.0 mmol·L-1处理24 h后,PC12细胞荧光强度明显增高,自噬体数量明显增多;QA 10.0 mmol·L-1处理后,胞质中LC3荧光信号进一步增强,可见大量点状簇集融合。
2.4喹啉酸对PC12细胞β -联蛋白、GSK-3β 、LC3 和Beclin 1蛋白表达的作用
Western蛋白印迹法实验结果(图4)所示,QA 2.5~10.0 mmol·L-1处理PC12细胞24 h后,与正常对照组比较,胞内GSK-3β表达明显增加(P<0.05,P<0.01),β-联蛋白表达明显降低(P<0.05,P<0.01),LC3-Ⅱ/LC3-Ⅰ比值明显增加(P<0.01),Beclin 1表达升高(P<0.05)。
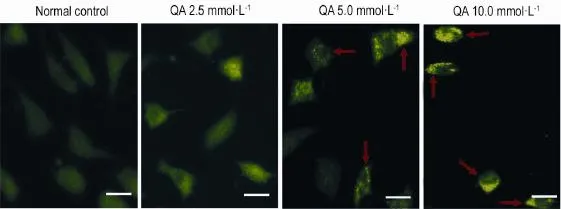
Fig 3.Nucleic accumulation of microtubule-associatedprotein 1 light chain 3(LC3)in PC12 cells induced by QA.SeeFig.2 for the cell treartemnt.The arrows showed nucleic accumulation.Scale bar=25 μm.

Fig.4 Effects ofQA on expression of β -catenin,glycogen synthase kinase-3β(GSK-3β ),LC3 and Beclin 1 in PC12 cells detected by Western blotting. See Fig.2 for the cell treatment.The integrated absorbance(IA)was scanned and the relative expression of target protein was expressed as the ratio of IATarget protein/IAGAPDH.A2 and B2 were the semiquantitative result of A1 and B1,respectively.±s,n=4. *P<0.05,**P<0.01,compared with cell control(0)group.
3 讨论
本研究结果显示,不同浓度QA处理PC12细胞24 h可浓度依赖性地降低PC12细胞存活率,细胞内LC3荧光斑点标记的自噬体增多,自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ的比值和Beclin 1的表达增高。此外,QA也引起了PC12细胞内GSK-3β的表达增高,β-联蛋白的表达降低。这些结果表明,QA可能通过激活自噬相关蛋白LC3和Beclin 1导致PC12细胞发生自噬性死亡,且该过程的发生可能与GSK-3β和β-联蛋白相关信号通路有关。
在自噬的形成过程中,LC3和Beclin1具有重要作用。LC3是细胞自噬相关的特异性基因8的同源物,LC3在刚开始合成时以无活性的形式存在,通过C端与自噬相关的特异性基因4结合,转化为蛋白水解形式LC3-Ⅰ,最终修饰转化为磷脂酰乙醇胺(phosphatidylethanolamine,PE)结合的形式LC3-Ⅱ(LC3-PE),LC3-Ⅱ分子特异地结合在自噬膜泡的内膜和外膜上,LC3-Ⅱ的含量或LC3-Ⅱ/ LC3-Ⅰ的比例与自噬泡数量呈正相关。因此,它常作为研究细胞自噬的标志分子[8]。Beclin 1是酵母自噬相关的特异性基因6的同源体,表达于反面高尔基网状结构,调控自噬前体生成和自噬体的形成。因此,Beclin 1表达增强也可作为评价自噬水平升高的重要指标[8]。通过免疫荧光法和Western蛋白印迹法检测LC-3和Beclin1的表达水平,可确定细胞自噬体的形成。本研究结果表明,QA 2.5~10 mmol·L-1处理PC12细胞24 h后,LC3荧光斑点标记的自噬体增多,自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ的比值和Beclin 1的表达增高,提示QA可诱导PC12细胞自噬的发生。
然而,自噬在神经退行性疾病的发生发展中的作用报道不一。在亨廷顿病研究中发现,依赖细胞自噬途径的降解能减少致病蛋白在神经元中的蓄积,同时诱导细胞自噬的发生可减缓神经的退行性变[9]。而在AD和脑缺血性损伤等疾病中发现,抑制细胞自噬体的形成将有助于减少神经细胞的死亡[10-12]。此外,在人恶性胶质瘤细胞中,线粒体膜完整性破坏,LC3表达上调,发生自噬性死亡[13]。在QA和海藻酸钠诱导大鼠纹状体神经元兴奋性损伤的过程中,自噬的激活可促进神经元死亡,此现象可被自噬抑制剂所阻断[14-16]。以上研究提示,细胞自噬的发生在神经系统疾病中既有损伤作用又有保护作用。本研究表明,在兴奋性毒性损伤PC12细胞过程中,自噬的发生促进了细胞的死亡。
细胞自噬性死亡的发生受多种因子的调控,其中GSK-3β和β-联蛋白具有重要作用。GSK-3β是一种丝氨酸/苏氨酸蛋白激酶,在糖原合成、细胞凋亡和干细胞维持所涉及的信号通路中都发挥重要作用,是多种信号途径的交汇点,参与多种信号通路的调控。β-联蛋白是GSK-3β下游一个很重要的转录激活因子,GSK-3β可使β-联蛋白磷酸化进而促进其降解,阻止其入核与TCF/Lef形成复合物发挥促细胞存活的作用[2,4]。在胰岛素剥夺的海马神经干细胞模型中,胰岛素的缺失可通过激活GSK-3β诱导细胞发生自噬性死亡[17]。在葡萄糖剥夺的人胚肾细胞和人包皮成纤维细胞模型中,发现葡萄糖剥夺可通过降解β-联蛋白的途径诱导自噬的发生[18]。此外,在研究氧糖剥夺的海马神经元和小胶质细胞模型中,也发现氧糖剥夺后神经细胞损伤明显加重;同时引起GSK-3β高表达、β-联蛋白低表达及自噬相关蛋白LC3和Beclin 1高表达,提示GSK-3β的激活可阻断β-联蛋白移位入核进而抑制其发挥促细胞存活的功能,从而诱导细胞发生自噬性死亡[19]。本研究结果也表明,QA可诱导PC12细胞发生自噬性死亡,其分子机制可能与激活GSK-3β和β-联蛋白有关。
但自噬在QA诱导的PC12细胞损伤中的作用及其与GSK-3β和β-联蛋白的关系还不明确,本研究组将在后续实验中使用自噬抑制剂3-甲基腺嘌呤和GSK-3β的抑制剂氯化锂加以干预,以期进一步证实自噬在QA诱导PC12细胞损伤中的作用及其与GSK-3β和β-联蛋白的关系。
综上所述,本研究提示,GSK-3β和β-联蛋白可能参与了兴奋性神经毒性损伤过程,抑制GSK-3β或激活β-联蛋白可能具有抑制自噬发生、进而抑制兴奋性神经细胞损伤的作用。
参考文献:
[1]Pérez-De La Cruz V,Carrillo-Mora P,Santamaría A. Quinolinic acid,an endogenous molecule combining excitotoxicity,oxidative stress and other toxic mecha-nisms[J].Int J Tryptophan Res,2012,5:1.
[2]Hanumanthappa P,Densi A,Krishnamurthy RG. Glycogen synthase kinase-3 beta in ischemic neu-ronal death[J].Curr Neurovasc Res,2014,11 (3):271-278.
[3]Noh MY,Koh SH,Kim Y,Kim HY,Cho GW,KimSH.Neuroprotectiveeffectsofdonepezil through inhibition of GSK-3 activity in amyloid-betainduced neuronal cell death[J].J Neurochem,2009,108(5):1116-1125.
[4]Zhang X,Yin WK,Shi XD,Li Y.Curcumin acti-vates Wnt/beta-catenin signaling pathway through inhibiting the activity of GSK-3 beta in APPswe transfected SY5Y cells[J].Eur J Pharm Sci,2011,42(5):540-546.
[5]Huang HC,Klein PS.Multiple roles for glycogen synthase kinase-3 as a drug target in Alzheimer′s disease[J].Curr Drug Targets,2006,7(11):1389-1397.
[6]Li Q,Li H,Roughton K,Wang X,Kroemer G,Blomgren K,et al.Lithium reduces apoptosis and autophagy after neonatal hypoxia-ischemia[J]. Cell Death Dis,2010,1(7):e56.
[7]Cook KL,Wärri A,Soto-Pantoja DR,Clarke PA,Cruz MI,Zwart A,et al.Hydroxychloroquine inhibits autophagy to potentiate antiestrogen responsive-ness in ER+breast cancer[J].Clin Cancer Res,2014,20(12):3222-3232.
[8]Mizushima N.Autophagy:process andfunction [J].Genes Dev,2007,21(22):2861-2873.
[9]Iwata A,Christianson JC,Bucci M,Ellerby LM,Nukina N,Forno LS,et al.Increased susceptibility of cytoplasmic over nuclear polyglutamine aggre-gates to autophagic degradation[J].Proc Natl Acad Sci USA,2005,102(37):13135-13140.
[10]Cherra 3rd SJ,Chu CT.Autophagy in neuroprotec-tion and neurodegeneration:a question of balance [J].Future Neurol,2008,3(3):309-323.
[11]Lee JA,Gao FB.Inhibition of autophagy induction delays neuronal cell loss caused by dysfunctional ESCRT-Ⅲin frontotemporal dementia[J].J Neurosci,2009,29(26):8506-8511.
[12]Yang Z,Zhong LA,Zhong SC,Xian RH,Yuan BQ. Hypoxia induces microglia autophagy and neural inflammation injury in focal cerebral ischemia model [J].Exp Mol Pathol,2015,98(2):219-224.
[13]Yang CH,Kao YH,Huang KS,Wang CY,Lin LW. Cordycepsmilitarisandmycelialfermentation induced apoptosis and autophagy of human glioblas-toma cells[J].Cell Death Dis,2012,3(11):e431.
[14]Wang Y,Han R,Liang ZQ,Wu JC,Zhang XD,GuZL,etal.Anautophagicmechanismis involved in apoptotic death of rat striatal neurons induced by the non-N-methyl-D-aspartate receptor agonist kainic acid[J].Autophagy,2008,4(2):214-226.
[15]Wang Y,Dong XX,Cao Y,Liang ZQ,Han R,Wu JC,et al.P53 induction contributes to excitotoxic neuronal death in rat striatum through apoptoticand autophagic mechanisms[J].Eur J Neurosci,2009,30(12):2258-2270.
[16]Zhang XD,Wang Y,Wang Y,Zhang X,Han R,Wu JC,et al.P53 mediates mitochondria dysfunc-tion-triggered autophagy activation and cell death in rat striatum[J].Autophagy,2009,5(3):339-350.
[17]Ha S,Ryu HY,Chung KM,Baek SH,Kim EK,Yu SW.Regulation of autophagic cell death by glycogen synthase kinase-3β in adult hippocampal neural stem cells following insulin withdrawal[J]. Mol Brain,2015,8(1):30.
[18]Choi SW,Song JK,Yim YS,Yun HG,Chun KH. Glucosedeprivationtriggersproteinkinase C-dependent β-catenin proteasomal degradation [J].J Biol Chem,2015,290(15):9863-9873.
[19]Wang SH, Chong ZZ,Shang YC,Maiese K. WISP1(CCN4)autoregulates its expression and nuclear trafficking of beta-catenin during oxidant stress with limited effects upon neuronal autophagy [J].Curr Neurovasc Res,2012,9(2):91-101.
(本文编辑:齐春会)
Effects of quinolinic acid on autophagy and protein expressions of related signaling pathway in PC12 cells
LI Yong-jin1,ZHANG Yi1,YANG Kai-yong1,AN Ke1,ZHANG Zhuang1,KAN Mei-jia1,CHEN Yue-fang1,PAN Hai-yuan2,HUANG Xiao-jia1
(1.School of Medicine,Jiangsu University,Zhenjiang 212013,China;2.Department of Pharmacy,The 82nd Hospital of PLA,Huaian 223001,China)
Abstract:OBJECTlVE To investigate whether quinolinic acid(QA)induces autophagy in PC12 cells and its relationship with glycogen synthase kinase-3β(GSK-3β)/β-catenin related signaling path-ways.METHODS PC12 cells were treated with QA 2.5,5.0 and 10.0 mmol·L-1for 24 h.The cell viability was determined by MTT assay.Autophagy fluorescent spots labelled form of microtubule-associated protein 1 light chain 3(LC3)was examined by LC3 immunostaining.The expressions of GSK-3β,β-catenin,LC3 and Beclin 1 were determined by Western blotting.RESULTS QA inhibited PC12 cell survival in a concentration-dependent manner,and IC50was 8.7 mmol·L-1.Compared with normal control group,QA 2.5,5.0 and 10.0 mmol·L-1increased autophagic intracellular LC3 fluorescence spots,elevated the expression ratio of LC3-Ⅱ/LC3-Ⅰ and expression of Beclin 1 in PC12 cells(P<0.05).In addition,QA enhanced GSK-3β expression and decreased β-catenin expression(P<0.05,P<0.01).CONCLUSlON QA induces autophagy in PC12 cells.This mechanism may be associated with the activation of GSK-3β/β-catenin related signaling pathways.
Key words:quinolinic acid;PC12 cells;autophagy;glycogen synthase kinase 3;beta-catenin
中图分类号:R966
文献标志码:A
文章编号:1000-3002(2016)01-0038-06
Foundation item:The project supported by National Natural Science Foundation of China(81300059);Senior Talent Foundation of Jiangsu University(08JDG005);and Senior Talent Foundation of Jiangsu University(11JDG092) LI Yong-jin,E-mail:lyj3600@163.com;HUANG Xiao-jia,E-mail:harold1980@163.com
收稿日期:(2015-07-08接受日期:2015-11-24)
基金项目:国家自然科学基金项目(81300059);江苏大学高级人才基金项目(08JDG005);江苏大学高级人才基金项目(11JDG092)
作者简介:李永金,男,博士,副教授,硕士生导师,主要从事神经药理研究。
通讯作者:李永金,E-mail:lyj3600@163.com;黄晓佳,E-mail:harold1980@163.com
