消癌平注射液联合吉非替尼对耐药非小细胞肺癌H460和H1975裸鼠移植瘤的抑制作用
2016-07-21韩淑燕郑文献何曦冉蒋姗彤庞丽娜李晓红李萍萍北京大学肿瘤医院暨北京市肿瘤防治研究所中西医结合科恶性肿瘤发病机制及转化研究教育部重点实验室北京100142
韩淑燕,郑文献,何曦冉,赵 灿,蒋姗彤,庞丽娜,李晓红,李萍萍(北京大学肿瘤医院暨北京市肿瘤防治研究所中西医结合科恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
消癌平注射液联合吉非替尼对耐药非小细胞肺癌H460和H1975裸鼠移植瘤的抑制作用
韩淑燕,郑文献,何曦冉,赵 灿,蒋姗彤,庞丽娜,李晓红,李萍萍
(北京大学肿瘤医院暨北京市肿瘤防治研究所中西医结合科恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
摘要:目的 研究消癌平注射液(Xap)联合吉非替尼(Gef)对耐药非小细胞肺癌(NSCLC)细胞H460 和H1975裸鼠移植瘤的抑制作用及机制。方法 BALB/c裸鼠皮下接种人NSCLC的H460或H1975细胞,待肿瘤体积达到50~100 mm3,分别ip给予Xap 5 g·kg-1、ig给予Gef 50 mg·kg-1或Xap+Gef(Xap+Gef组),连续给药21 d。每7 d测量肿瘤体积2~3次,绘制肿瘤增殖曲线,计算肿瘤增殖率,并记录体质量。取肿瘤组织,称取瘤重,计算肿瘤抑制率。免疫组化法和Western蛋白印迹法检测肿瘤组织中血管生成标志物血管内皮生长因子(VEGF)和内皮糖蛋白(CD105)及耐药相关蛋白磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(Akt)、哺乳动物西罗莫司(雷帕霉素)靶蛋白(mTOR)和磷酸化胞外信号调节激酶(ERK)的表达。结果 与模型对照组相比,单用Xap或Gef对H460和H1975裸鼠移植瘤的生长无显著影响,而两药联合能显著抑制裸鼠的瘤体积〔H460组:(1103±340)vs(3020±450)mm3,H1975组:(487±153)vs(1269± 161)mm3,P<0.05〕、降低瘤重〔H460组:(1.20±0.52)vs(2.78±0.93)g,H1975组:(0.52±0.32)vs (0.92±0.42)g,P<0.05〕,肿瘤增殖率和抑制率分别为42.1%,43.5%(H460,P<0.01)和43.0%,52.5% (H1975,P<0.01)。与单用Xap或Gef相比,联合用药组能显著性地降低瘤重和肿瘤增殖率,提高肿瘤抑制率(P<0.05)。免疫组化结果表明,单用Xap或Gef对肿瘤血管新生标志物VEGF和CD105及耐药相关蛋白p-PI3K,p-ERK,p-Akt和p-mTOR的表达无影响,而联合用药却能明显降低H460和H1975肿瘤组织中VEGF,CD105,p-ERK,p-Akt和p-mTOR的表达。Western蛋白印迹结果表明,与模型对照组相比,联合用可显著抑制p-PI3K及其下游蛋白p-Akt,p-ERK和p-mTOR蛋白的表达(P<0.01),并且优于单用Xap或Gef(P<0.05)。结论 联合Xap可显著提高Gef在H460和H1975裸鼠移植瘤的疗效,该协同作用部分是通过抑制肿瘤血管新生和PI3K及其下游信号分子等耐药相关蛋白的表达实现的。
关键词:消癌平注射液;吉非替尼;非小细胞肺癌;肿瘤移植
DOl:10.3867/j.issn.1000-3002.2016.01.007
近年来,针对肺腺癌驱动基因的靶向药物已成为晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)治疗的发展方向。吉非替尼(gefitinib,Gef)等小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)能显著延长中位生存期[1],给晚期NSCLC患者的治疗带来曙光,美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐EGFR突变患者可一线使用EGFR-TKI[2]。虽然TKI对表皮生长因子受体(epidermal growth factor receptor,EGFR)突变的晚期NSCLC疗效较好,但经过6~12个月的缓解期后仍会发生耐药出现疾病进展[3]。耐药已成为制约TKI靶向药疗效的主要瓶颈,是治疗过程亟需解决的问题。
有关Gef耐药的机制尚未阐明,目前已明确的主要机制包括EGFR的T790M突变、c-met基因的扩增和k-ras基因突变等[4-5]。对于Gef耐药后的主要临床挽救措施包括厄洛替尼(erlotinib)[6]和化疗[7],c-Met抑制剂和不可逆EGFR抑制剂[8]等分子抑制剂的应用尚在研究中。尽管上述方法可在一定的程度上使Gef耐药患者获益,但不可避免地会发生再次耐药[9]。如二代TKI阿法替尼对T790M突变患者有效,但耐药性仍然是影响其疗效的重要因素[10]。临床上迄今尚缺乏解决Gef等TKI耐药的有效药物。因此,寻找低毒、高效的逆转Gef耐药的途径仍然是临床的迫切需求。若能从当前已在临床应用的抗肿瘤药物中筛选,则更会缩短研究周期,降低研发费用。
Gef耐药后会出现EGFR下游信号通路磷酸化磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,phospho-PI3K)、磷酸化蛋白激酶B(phospho-Akt,p-AKT)、磷酸化哺乳动物西罗莫司(雷帕霉素)靶蛋白〔phospho-mammalian target of sirolimus(Rapamycin),p-mTOR〕和磷酸化胞外信号调节激酶(extracellular signal-regulated kinase,p-ERK)的持续活化[11-13]。通过抑制PI3K/Akt/mTOR通路和(或)ERK的活化,特别是当同时抑制2条通路时,可有效逆转NSCLC对Gef的耐药,提高耐药细胞对Gef的响应[14-16]。
消癌平(Xiaoaiping,Xap)是中药通关藤的水提醇沉制剂,在临床上可用于肺癌、消化道肿瘤和白血病等多种恶性肿瘤,该药联合化疗对NSCLC的疗效优于单纯化疗。我们的前期研究表明,Xap注射液能显著改善NSCLC对Gef的耐药,提高肿瘤对Gef的敏感性,降低Gef的IC50,促进细胞凋亡,抑制耐药细胞株的PI3K/Akt/mTOR通路和ERK的活化[17-18]。但Xap改善Gef耐药的作用及其机制尚有待进一步验证和阐明。前期在耐药NSCLC荷瘤裸鼠上进行了Xap剂量的比较结果[18],选取具有微弱抑瘤作用的Xap 5 g·kg-1与Gef 50 mg·kg-1联合,研究Xap改善Gef耐药的作用。
1.材料与方法
1.1药品和试剂
Gef,购自英国阿斯利康公司,用二甲亚砜(DMSO)配置成20 mmol·L-1的储备液;Xap,南京圣和药业有限公司(201107041)。Matrigel,美国BD公司;RPMI 1640培养基,天津百若克医药生物技术有限责任公司;胎牛血清(fetal bovine serum,FBS),美国Gibco公司;BCA蛋白定量试剂盒,美国Pierce公司。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)(1∶200)抗体,美国Eptomics公司;血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体(1∶100)和内皮糖蛋白(endoglin,CD105)抗体(1∶100),美国Santa Cluz公司;磷酸化PI3K(phospho-PI3K,p-PI3K)(1∶1000),p-Akt抗体(Ser473)(1∶2000),p-ERK抗体(Thr202/Tyr204)(1∶2000),p-mTOR抗体(Ser2448)(1∶2000),β肌动蛋白抗体(1∶5000),甘油醛-3-磷酸脱氢酶(GAPDH)抗体(1∶5000),美国CST公司。辣根过氧化物酶标记的山羊抗兔和山羊抗小鼠IgG二抗购自北京中杉金桥公司,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜和ECL购自美国Millipore公司。
1.2主要仪器
B5060EK-CO2型二氧化碳培养箱,德国Heraeus公司;1285型生物安全柜,美国Thermo Electron公司;Allegra 64R型高速低温台式离心机,美国Beckman Coulter公司;IMJ-213型Olympus倒置显微镜,MDF-U4086S型超低温冰箱(-80℃),日本Sanyo;Western蛋白印迹电泳和转膜系统,美国Bio-Rad公司。
1.3细胞培养
人NSCLC细胞H460(k-ras突变)和H1975 (EGFR-L858R/T790M突变)购自美国ATCC细胞库,以含10%FBS的RPMI 1640培养基于含5% CO2的孵箱中37℃进行培养。
1.4动物、模型制备及分组给药
BALB/c-nu/nu雄性裸小鼠,体质量18~22 g,购自中国医学科学院基础所实验动物中心,合格证编号:SYXK(京)2006-0005,按SPF级动物实验要求分笼饲养与管理。
常规培养H460和H1975细胞,待细胞融合度达到80%~90%时,0.25%胰酶消化细胞,PBS重悬,加入等体积的matrigel混匀,每只裸鼠皮下接种0.2 mL,即3×105个细胞。每周2次测量肿瘤体积,同时记录动物的体质量。肿瘤体积计算公式为:V= 1/2×a×b2,式中a为长径,b为短径。计算相对肿瘤体积(relative tumor volume,RTV)=Vt/V0,式中Vt是每次测量时的肿瘤体积,V0是分组给药前的肿瘤体积;处理组RTV与模型对照组RTV比值的百分比为相对肿瘤增殖率(T/C),T/C>60%为无效,≤60%为有效。待肿瘤体积达到50~100 mm3,将裸鼠随机分为4组,每组8只:模型对照组(不含通关藤提取物的注射液溶剂)、Xap 5 g·kg-1组(ip给予)、Gef 50 mg·kg-1组(ig给予)和Xap 5 g·kg-1+Gef 50 mg·kg-1组,给药21 d。实验结束,取肿瘤组织部分固定于4%多聚甲醛中,部分冻存于液氮中,待做后续检测。
1.5免疫组化检测肿瘤组织中VEGF,CD105,p-Akt,p-mTOR和p-ERK的表达
取多聚甲醛固定的H460和H1975裸鼠肿瘤组织,制成石蜡切片。3%H2O2消除内源性过氧化物酶活性,微波抗原修复,室温封闭20 min,加入一抗4℃过夜,二抗孵育后经DAB显色,显微镜下观察结果。以胞浆或细胞核染成棕黄色或棕褐色为阳性反应,每个标本随机观察5个高倍镜视野(×200),计算每个高倍镜视野100个肿瘤细胞中的阳性细胞数,取其平均值作为阳性细胞数,计算阳性细胞所占百分比。
1.6Western蛋白印迹法检测肿瘤组织的PCNA,p-AKT,p-mTOR和p-ERK蛋白表达
取冻存于液氮中的H460和H1975裸鼠肿瘤组织,预冷PBS洗涤,液氮中研磨后加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液,冰上裂解肿瘤组织20 min,18 800×g离心20 min,收集上清液即为细胞总蛋白。BCA法测定蛋白含量,调整样品蛋白含量为2 g·L-1。取20 μg蛋白进行SDSPAGE电泳,蛋白电转移到PVDF膜上,以5%脱脂牛奶或5%BSA室温封闭1 h,加入一抗4℃孵育过夜。TBST洗膜4~5次,用辣根过氧化物酶标记的二抗孵育1 h,TBST洗膜后以ECL化学发光检测试剂盒检测蛋白印迹。以β肌动蛋白或GAPDH进行上样量校正,以目标蛋白与内标蛋白积分吸光度值的比值表示蛋白的相对表达量。
1.7统计学分析
2 结果
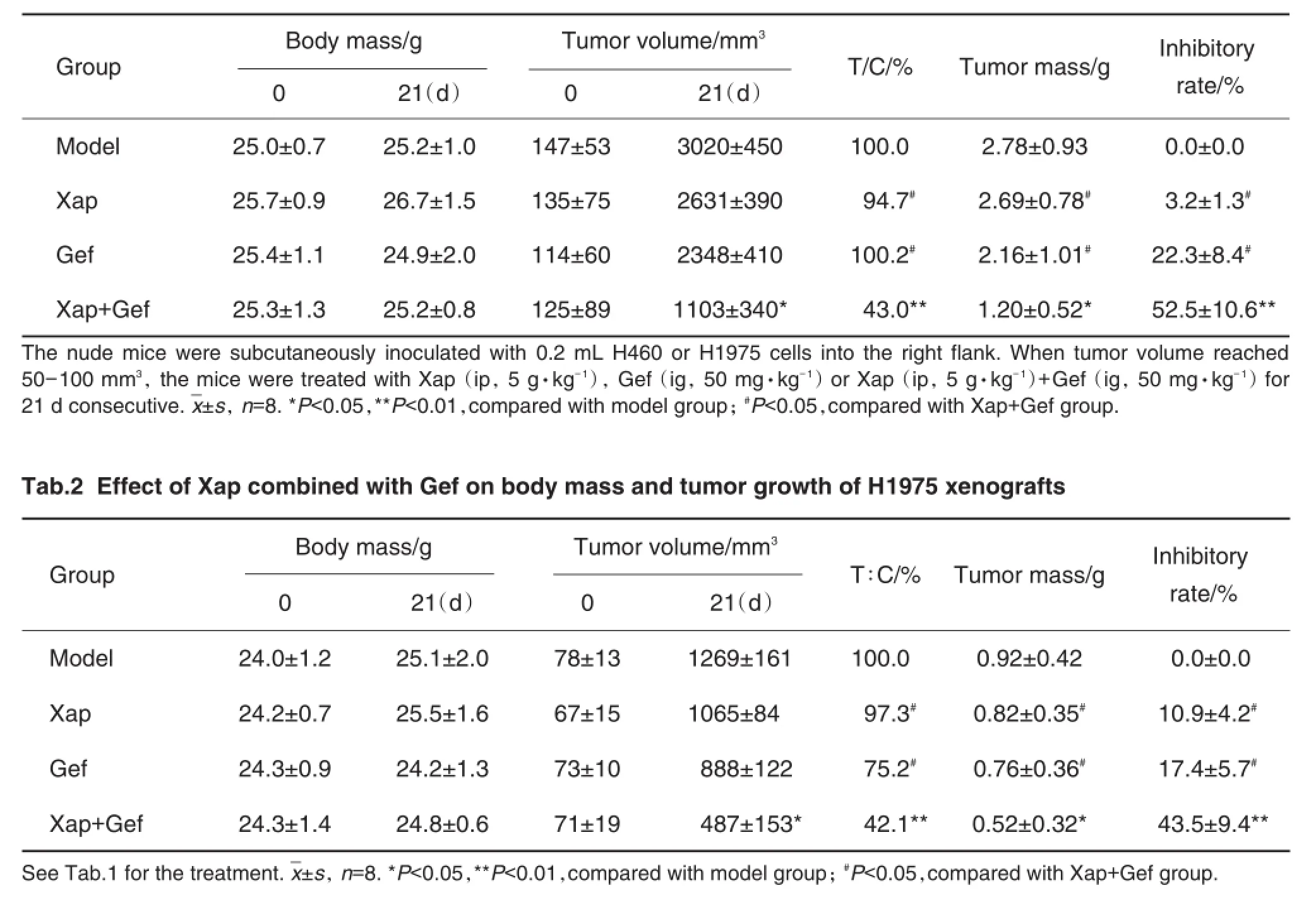
Tab.1 Effect of Xiaoaiping injection(Xap)combined with gefitinib(Gef)on body mass and tumor growth of H460 xenografts
2.1Xap+Gef对耐药非小细胞肺癌H460和H1975移植瘤裸鼠肿瘤生长及体质量的影响
表1结果显示,H460移植瘤裸鼠给药组的肿瘤体积及相对肿瘤增殖率均优于单用Xap和Gef组(P<0.05)。与模型组相比,Xap组和Gef组的瘤重无统计学差异,联合用药组显著降低(P<0.05),肿瘤抑制率为52.5%(P<0.01),瘤重及抑制率均优于单独应用各组(P<0.05)。表2的结果显示,H1975移植瘤裸鼠体质量无显著差异。与模型组相比,Xap和Gef单用组的肿瘤体积无显著变化,联合用药组的肿瘤体积明显缩小(P<0.05),肿瘤增殖率显著低于模型组(P<0.01)。
2.2Xap+Gef对耐药非小细胞肺癌H460和H1975移植瘤裸鼠移植瘤组织VEGF,CD105,p-AKT,p-mTOR和p-ERK表达的影响
图1结果显示,与肿瘤模型对照组相比,单用Xap或Gef对H460移植瘤裸鼠肿瘤组织的VEGF,CD10,耐药相关蛋白p-AKT,p-mTOR和p-ERK的表达无影响,Xap+Gef组能明显抑制肿瘤组织中的VEGF,CD105,p-AKT,p-mTOR和p-ERK的表达(P<0.01),联合用药组的抑制作用显著强于单用组(P<0.05)。

Fig.1 Effect of Xap combined with Gef on expression of vascular endothelial growth factor(VEGF),endoglin (CD105),phospho-Akt(p-AKT),phospho-mammalian target of sirolimus(rapamycin)(p-mTOR)and extracellular signal-regulated kinase(p-ERK)in tumor tissue of H460 non-small cell lung cancer(NSCLC)xenografts deter-nimined by immunohistochemistry(×200).See Tab.1 for the treatment.B was the semiquantitative result of A.±s,n=8.**P<0.01,compared with model group;#P<0.05,compared with Xap+Gef group.
图2结果是显示,与肿瘤模型对照组相比,单用Xap或Gef对H1975移植瘤裸鼠肿瘤组织的VEGF,CD105,耐药相关蛋白p-AKT,p-mTOR和p-ERK的表达无影响,Xap+Gef组能明显抑制肿瘤组织中的VEGF,CD105,p-AKT,p-mTOR和p-ERK的表达的表达(P<0.01),联合用药组的抑制作用显著强于单用组(P<0.05)。表明Xap+Gef具有抑制H460和H1975移植肿瘤血管生成和耐药相关蛋白表达的作用。

Fig.2 Effect of Xap combined with Gef on expression of VEGF,CD105,p-AKT,p-mTOR and p-ERK in tumor tis-sue of H1975 NSCLC xenografts deternimined by immunohistochemistry(×200).See Tab.1 for the treatment.B was the semiquantitative result of A.±s,n=8.**P<0.01,compared with model group;#P<0.05,compared with Xap+Gef group.
2.3Xap+Gef对耐药非小细胞肺癌H460和H1975移植瘤裸鼠肿瘤组织PCNA,p-Pl3K,p-AKT,p-ERK和p-mTOR蛋白表达的影响
Western蛋白印迹结果显示(图3),与模型对照组相比,Xap 5 g·kg-1组和Gef 50 mg·kg-1组对H460裸鼠肿瘤组织中的PCNA,p-PI3K,p-Akt,p-ERK和p-mTOR(图3A)蛋白相对表达无明显影响。而Xap 5 g·kg-1+Gef 50 mg·kg-1组可显著降低H460和H1975肿瘤组织中PCNA,p-PI3K,p-Akt,p-ERK和p-mTOR的表达水平(P<0.01),并且优于单用Xap或Gef(P<0.05)(图3B,C)。
图4的结果表明,与模型对照组相比,Xap 5 g·kg-1组和Gef 50 mg·kg-1组对H1975移植瘤裸鼠肿瘤组织中PCNA,p-PI3K,p-Akt,p-ERK和p-mTOR蛋白相对表达量无明显影响。而Xap 5 g·kg-1+Gef 50 mg·kg-1组可显著降低H1975肿瘤组织中上述蛋白的表达水平(P<0.01),并且优于单用Xap或Gef(P<0.05)(图4B,C)。
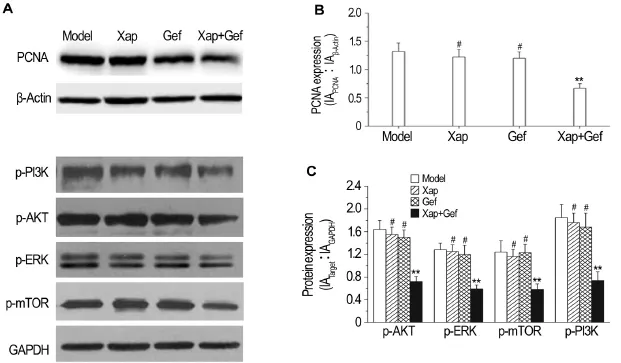
Fig.3 Effect of Xap combined with Gef on expression of p-Pl3K,p-Akt,p-ERK and p-mTOR in tumor tissue of H460 NSCLC xenografts determined by Western blotting.See Tab.1 for the treatment.B and C were the semiquantitative re-sults of A.±s,n=8.**P<0.01,compared with model group;#P<0.05,compared with Xap+Gef group.

Fig.4 Effect of Xap combined with Gef on expression of p-Pl3K,p-Akt,p-ERK and p-mTOR in tumor tissue of H1975 NSCLC xenografts determined by Western blotting.See Tab.1 for the treatment.B and C were the semiquantitative results of A.±s,n=8.**P<0.01,compared with model group;#P<0.05,compared with Xap+Gef group.
3 讨论
本研究发现,Xap+Gef处理能显著抑制耐药NSCLC细胞H460和H1975裸鼠移植瘤的生长,降低肿瘤体积和瘤重,表明Xap+Gef能抑制肿瘤细胞的增殖,提高Gef在耐药NSCLC裸鼠移植瘤中的疗效。
本研究中,免疫组化和Western蛋白印迹结果均显示,Xap+Gef可显著降低H460和H1975裸鼠移植瘤组织中PCNA的表达,表明耐药NSCLC肿瘤细胞的增殖受到抑制。PCNA的表达除了作为评价细胞增殖状态的一个指标外,近来的研究亦提示,PCNA作为细胞生长、死亡和修复等过程的协调者,有可能成为肿瘤治疗的潜在靶点[19]。
肿瘤的增殖受多种因素的调控,其中肿瘤血管的生成发挥了重要作用。肿瘤血管生成不仅提供肿瘤生长所需的营养,而且有利于肿瘤细胞通过血管发生转移。VEGF是重要的血管形成分子,是目前已知作用最强、特异性最高的促血管生长因子。VEGF在大多数恶性肿瘤中均表达增加,是与肿瘤转移和预后密切相关的重要细胞因子[20]。CD105在肿瘤组织的未成熟血管中呈高表达,而在正常血管内皮细胞却无表达,所以CD105是一种特异性表达于新生肿瘤血管的内皮细胞标志物,在标记肿瘤组织微血管密度方面显著优于CD31和CD34等标志物[21]。相关分析显示CD105和VEGF的表达呈正相关[22]。在本试验中,Xap+Gef组能显著降低VEGF和CD105的表达,说明两药联用具有抑制NSCLC肿瘤血管生成的作用。
驱动基因发生突变是NSCLC对TKI靶向药物发生原发性或获得性耐药的重要原因之一。H1975细胞因存在EGFR-T790M突变而耐药,而NCIH460细胞因存在k-ras突变而对Gef原发耐药。Gef耐药后会出现PI3K/AKT和ERK等通路的持续活化,同时抑制相关通路的活化则能有效增强Gef疗效。在本研究中,Xap+Gef能显著降低耐药相关蛋白p-PI3K,p-Akt,p-ERK和p-mTOR的表达,提示两药联用能同时抑制PI3K/Akt/mTOR和MEK/ ERK通路的活化。PI3K可被细胞膜上的各种酪氨酸激酶受体激活,同时也能被Ras蛋白(Raf/MEK/ ERK通路上游的蛋白因子)所激活,PI3K被激活后通过其下游的Akt/mTOR等对细胞生长和蛋白质合成、血管生成、炎症反应等均有促进作用[23-25]。由此可见,PI3K处于PI3K/Akt/mTOR和MEK/ERK两条信号通路的上游,Xap+Gef下调耐药相关蛋白的表达主要是通过抑制PI3K的活化实现的。
综上,本研究表明Xap注射液能增强Gef在H460和H1975细胞荷瘤裸鼠的疗效,提高耐药NSCLC对Gef的敏感性,抑制肿瘤细胞的增殖,减少肿瘤血管生成。抑制EGFR下游信号通路PI3K/ Akt/mTOR和ERK的活化可能为Xap提高Gef疗效的作用机制之一,是今后将继续进行深入研究的机制。本研究在体外细胞实验的基础上,在动物体内研究了Xap注射液改善Gef耐药的作用及机制,为应用Xap注射液改善Gef等抗肿瘤靶向药的耐药提供了实验依据,同时为巩固或提高Gef的疗效进行了新的探索。
参考文献:
[1]Sequist LV,Martins RG,Spigel D,Grunberg SM,Spira A,Jänne PA,et al.First-line gefitinib in patientswithadvancednon-small celllung cancer harboring somatic EGFR mutations[J].J Clin Oncol,2008,26(15):2442-2449.
[2]Ettinger DS, Akerley W,Bepler G,Blum MG,Chang A,Cheney RT,et al.Non-small cell lung cancer[J].J Natl Compr Canc Netw,2010,8 (7):740-801.
[3]Hoshi S,Yamaguchi T,Kono C, Amano H,Yamada Y.Recurrenceof non-small cell lung cancer after successful treatment with gefitinibreport of three cases[J].Gan To Kagaku Ryoho,2004,31(8):1209-1213.
[4]Kosaka T,Yamaki E,Mogi A,Kuwano H.Mecha-nisms of resistance to EGFR TKIs and develop-ment of a new generation of drugs in non-small cell lung cancer[J].J Biomed Biotechnol,2011,2011:165214.doi:10.1155/2011/165214.
[5]Wang S,An T,Wang J,Zhao J,Wang Z,Zhuo M,et al.Potential clinical significance of a plasmabased KRAS mutation analysis in patients with advanced non-smallcelllungcancer[J].Clin Cancer Res,2010,16(4):1324-1330.
[6]Kaira K,Naito T,Takahashi T,Ayabe E,Shimoyama R,Kaira R,et al.Pooled analysis of the reports of erlotinib after failure of gefitinib for non-smallcelllungcancer[J].Lung Cancer,2010,68(1):99-104.
[7]Wu YL,Yang JJ,Huang YJ,Zhou Q,Huang YS,Xu CR.Docetaxel as salvage chemotherapy in patients with advanced non-small cell lung cancer after failure of cytotoxic agents and gefitinib treatment[J].Chin-German J Clin Oncol,2008,7(9):495-499.
[8]Miller VA,Hirsh V,Cadranel J,Chen YM,Park K,Kim SW,et al.Afatinib versus placebo for patients with advanced,metastatic non-small-cell lung cancer after failure of erlotinib,gefitinib,or both,and one or two lines of chemotherapy(LUX-Lung 1):a phase 2b/3 randomised trial[J].Lancet Oncol,2012,13(5):528-538.
[9]Ercan D, Zejnullahu K, Yonesaka K,Xiao Y,Capelletti M,Rogers A,et al.Amplification of EGFR T790M causes resistance to an irreversible EGFR inhibitor[J].Oncogene,2010,29(16):2346-2356.
[10]Azuma K,Kawahara A,Sonoda K,Nakashima K,Tashiro K,Watari K,et al.FGFR1 Activation is an escape mechanism in human lung cancer cells resistant to afatinib,a pan-EGFR family kinase inhibitor[J].Oncotarget,2014,5(15):5908-5919.
[11]Lopiccolo J, Blumenthal GM, Bernstein WB,Dennis PA.Targeting the PI3K/Akt/mTOR pathway:effective combinations and clinical considerations [J].Drug Resist Updat,2008,11(1/2):32-50.
[12]Miller KA,Yeager N,Baker K,Liao XH,Refetoff S,Di Cristofano A.Oncogenic Kras requires simulta-neous PI3K signaling to induce ERK activation and transform thyroid epithelial cells in vivo[J].Cancer Res,2009,69(8):3689-3694.
[13]EngelmanJA,Jaenne PA.Mechanismsof acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small cell lung cancer[J].Clin Cancer Res,2008,14(10):2895-2899.
[14]Janmaat ML,Rodriguez JA,Gallegos-Ruiz M,Kruyt FA,Giaccone G.Enhanced cytotoxicity induced by gefitinib and specific inhibitors of the Ras or phosphatidyl inositol-3 kinase pathways in non-small cell lung cancer cells[J].Int J Cancer,2006,118(1):209-214.
[15]Milton DT, Riely GJ, Azzoli CG,Gomez JE,Heelan RT,Kris MG,et al.Phase 1 trial of everolimus and gefitinib in patients with advanced nonsmallcell lung cancer[J].Cancer,2007,110(3):599-605.
[16]La Monica S,Galetti M,Alfieri RR,Cavazzoni A,Ardizzoni A,Tiseo MA,et al.Everolimus restores gefitinib sensitivity in resistant non-small cell lung cancer cell lines[J].Biochem Pharmacol,2009,78(5):460-468.
[17]Han SY,Zhao MB,Zhuang GB,Li PP.Marsdenia tenacissima extract restored gefitinib sensitivity in resistant non-small cell lung cancer cells[J].Lung Cancer,2012,75(1):30-37.
[18]Han SY,Zhao W,Sun H,Zhou N,Zhou F,An G,et al.Marsdenia tenacissima extract enhances gefitinib efficacy in non-small cell lung cancer xenografts [J].Phytomedicine,2015,22(5):560-567.
[19]Wang SP.A silent housekeeper or a potential ther-apeutic target[J].Trends Pharmacol Sci,2014,35 (4):178-186.
[20]Hoeben A,Landuyt B,Highley MS,Wildiers H,Van Oosterom AT,De Bruijn EA.Vascular endo-thelial growth factor and angiogenesis[J].Pharmacol Rev,2004,56(4):549-580.
[21]Tanaka F,Otake Y,Yanagihara K,Kawano Y,Miyahara R,Li M,et al.Evaluation of angiogenesis in non-small cell lung cancer:comparison between anti-CD34 antibody and anti-CD105 antibody[J]. Clin Cancer Res,2001,7(11):3410-3415.
[22]Mineo TC,Ambrogi V,Baldi A,Rabitti C,Bollero P,Vincenzi B,et al.Prognostic impact of VEGF,CD31,CD34,and CD105 expression and tumour vessel invasionafter radical surgery for IB-ⅡA non-smallcelllung cancer[J].J Clin Pathol,2004,57(6):591-597.
[23]Fruman DA,Rommel C.PI3K And cancer:lessons,challenges and opportunities[J].Nat Rev Drug Discov,2014,13(2):140-156.
[24]Liu P,Cheng H,Roberts TM,Zhao JJ.Targeting the phosphoinositide 3-kinase pathway in cancer [J].Nat Rev Drug Discov,2009,8(8):627-644.
[25]Ebi H,Costa C,Faber AC,Nishtala M,Kotani H,Juric D,et al.PI3K Regulates MEK/ERK signaling in breast cancer via the Rac-GEF,P-Rex1[J]. Proc Natl Acad Sci USA,2013,110(52):21124-21129.
(本文编辑:乔虹)
Xiaoaiping injection combined with gefitinib inhibits resistant non-small cell lung cancer xenografts H460 and H1975
HAN Shu-yan,ZHENG Wen-xian,HE Xi-ran,ZHAO Can,JIANG Shan-tong,PANG Li-Na,LI Xiao-hong,LI Ping-ping
〔Key Laboratory of Carcinogenesis and Translational Research(Ministry of Education),Department of Integration of Chinese and Western Medicine,Peking University Cancer Hospital&Institute,Beijing 100142,China〕
Abstract:OBJECTlVE To study the antitumor activity and underlying mechanisms of Xiaoaiping injection(Xap)combined with gefitinib(Gef)in nude mice bearing resistant non-small cell lung cancer (NSCLC)cells H460 or H975.METHODS BALB/c nude mice were inoculated with human NSLCL cells H460 or H1975 and the drug treatment did not start until the tumor volume reached 50-100 mm3. The tumor bearing mice were divided into four groups:control group,Xap group(5 g·kg-1,ip),Gef group(50 mg·kg-1,ig),and Xap plus Gef group.All the administration lasted for 21 d continuous. Tumor volumes were measured two or three times per week,and the body weight of animals was recorded.At the end of the test,tumors were weighed after the sacrifice of mice.Tumor inhibition rate and relative tumor proliferation rate were calculated based on tumor weight and tumor volume.The related biomarkers and proteins in tumor tissues were detected by immunohistochemistry and Western blot assay,respectively.RESULTS Compared with the control group,no significant effect was observed on the growth of H460 and H1975 xenografts in groups of Xap or Gef alone in nude mice.However,the twodrug combination significantly suppressed tumor volume,with(1103±340)versus(3020±450)mm3for H460 and(487±153)versus(1269±161)mm3for H1975,respectively(P<0.05).The combined Xap and Gef application also significantly reduced the tumor weight,with(1.20±0.52)versus(2.78±0.93)g for H460 and(0.52±0.32)versus(0.92±0.42)g for H1975,respectively(P<0.05).The relative tumor proliferation rate and inhibition rate in the combination group was 42.1%and 43.5%for H460(P<0.01),43.0% and 52.5%for H1975(P<0.01).Compared with Xap and Gef drug alone,their combination showed significant difference in reducing tumor weight,suppressing tumor proliferation rate and increasing tumor inhibition rate(P<0.05).Immunohistochemistry results showed that each drug alone had no effect on tumor angiogenesis markers of vascular endothelial growth factor(VEGF)and CD105 expression,or on drug resistance related proteins of p-ERK,p-Akt and p-mTOR,whereas the combination of Xap and Gef obviously reduced the expression of these biomarkers in H460 and H1975 tumor tissues.The decreased drug resistance related proteins of p-PI3K and its downstream molecules p-Akt,p-ERK and p-mTOR by the two-drug combination were also confirmed by Western blot results(P<0.01,compared with control),and showed significant difference compared with each single treatment(P<0.05). CONCLUSlON The addition of Xap significantly improves the antitumor activity of Gef in H460 and H1975 xenografts,and this synergistic effect may be ascribed to the inhibition of tumor angiogenesis,the downregulation of PI3K and its downstream signaling molecules which are associated with drug resistance.
Key words:Xiaoaiping injection;geftinib;non-small cell lung cancer;neoplasm transplantation
中图分类号:R979.1,R734.2
文献标志码:A
文章编号:1000-3002(2016)01-0044-09
Foundation item:The project supported by National Natural Science Foundation of China(81274148);and Specialized Research Fund for Doctoral Program of Higher Education(20110001120100) LI Ping-ping,Tel:(010)88196069,E-mail:lppma123@sina.com
收稿日期:(2015-08-03接受日期:2015-12-31)
基金项目:国家自然科学基金(81274148);高等学校博士学科点专项科研基金资助课题(20110001120100)
作者简介:韩淑燕,女,副教授,主要从事中药抗肿瘤的活性物质基础及作用机制研究;李萍萍,女,教授,博士生导师,主要从事中西医结合临床研究。
通讯作者:李萍萍,E-mail:lppma123@sina.com,Tel:(010)88196706
