1 786例静脉用药致药品不良反应/事件的帕累托图分析
2016-07-21邱召娟戎有和
付 虹,邱召娟,戎有和
(1.南京中医药大学附属医院药学部,江苏 南京 210029; 2.南京中医药大学护理学院,江苏 南京 210029)
1 786例静脉用药致药品不良反应/事件的帕累托图分析
付虹1*,邱召娟1,戎有和2#
(1.南京中医药大学附属医院药学部,江苏 南京210029; 2.南京中医药大学护理学院,江苏 南京210029)
摘要目的:了解南京中医药大学附属医院(以下简称“我院”)药品不良反应/事件的发生特点,促进临床合理用药。方法:对我院2014年1 786例静脉用药导致的药品不良反应/事件报告进行帕累托图分析。结果:1 786例发生药品不良反应/事件的患者中,男性826例(占46.25%),女性960例(占53.75%);年龄1~97岁。新发生的药品不良反应/事件有570例,占31.91%;严重的药品不良反应/事件有79例,占4.42%。帕累托图分析结果显示,药品不良反应/事件主要涉及营养药、抗微生物药、中药注射剂、神经系统用药和抗肿瘤药,临床表现以皮肤及其附件损害、局部损害和全身性损害为主。结论:临床用药应全面考虑药品不良反应/事件,合理使用各类药物,以尽量减少药品不良反应/事件的发生。
关键词药品不良反应; 药品不良事件; 帕累托图分析; 合理用药
药品不良反应(adverse drug reaction,ADR)是指合格药品在正常用法用量下出现的与用药目的无关的有害反应;药品不良事件(adverse drug event,ADE)是指在药品治疗过程中发生的任何不幸的医疗卫生事件,是指与药品相联系的机体损害[1]。ADR是治疗中必须伴随的风险,其发生并不完全取决于药品本身,可因患者种族、性别、年龄、个体差异、病理状况、生活环境、生活习性、饮食习惯、给药途径、联合用药及给药时间等的不同而产生[2]。ADE一般包括ADR、药品标准缺陷、药品质量问题、用药失误和药品滥用等方面。ADE不仅给患者带来身心痛苦,同时也增加了患者的经济负担,甚至带来严重的不良社会影响。为进一步了解ADE的发生规律和特点,降低其危害,现对南京中医药大学附属医院(以下简称“我院”)2014年收集的1 786份ADR/ADE进行回顾性分析,为临床合理用药提供参考。
1资料与方法
收集我院2014年上报的ADR/ADE报告1 786例。报告内容包括:患者姓名、年龄、就诊科室、原患疾病、既往情况及家族ADR史、发生ADR/ADE的时间、ADR/ADE过程描述、怀疑引发ADR/ADE的药品(名称、剂量、生产厂家、生产批号、用法与用量、用药起止时间、用药原因)、联合用药、ADR/ADE的处理措施及疾病转归等。按照药品种类、临床表现等方面进行统计分析。为了更直观、简洁和系统地量化引发ADR/ADE的药物种类及其累及器官和(或)系统,特进行帕累托图分析:将影响因素分为3类,A类为关键的少数,为主要因素,其影响程度的累计构成比为0~80%;B类为次要因素,其影响程度的累计构成比为80%~90%;C类为一般因素,其影响程度的累计构成比为90%~100%。B和C类构成了次要因素的大多数[3]。
发生ADR/ADE的1 786例患者中,男性826例(占46.25%),女性960例(占53.75%);年龄1~97岁。新发生的ADR/ADE有570例,占31.91%;严重的ADR/ADE有79例,占4.42%。发生ADR/ADE患者的年龄分布见表1。

表1 发生ADR/ADE患者的年龄分布
2.2引发ADR/ADE的药物种类分布
1 786例ADR/ADE报告涉及14大类药物,其中营养药最多,其次为抗微生物药和中药注射剂,见表2。
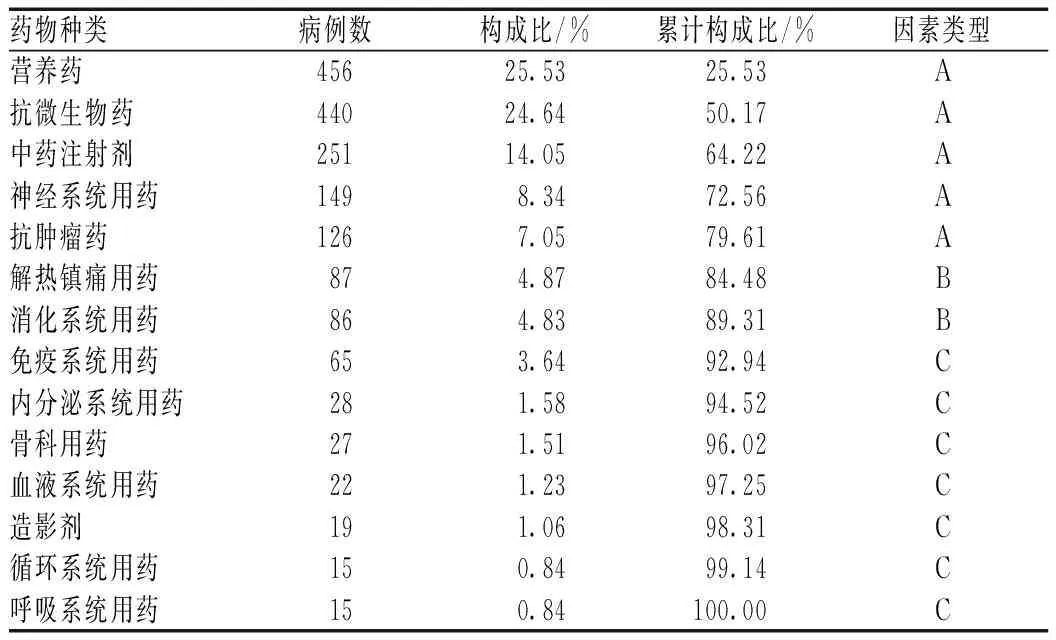
表2 引发ADR/ADE的药物种类分布
2.3ADR/ADE病例数排序居前10位的药品
ADR/ADE病例数排序居前10位的药品,主要为营养药和抗菌药物,其中营养药占据了前3位,分别为转化糖电解质注射液、丙氨酰谷氨酰胺注射液、注射用12种复合维生素,见表3。
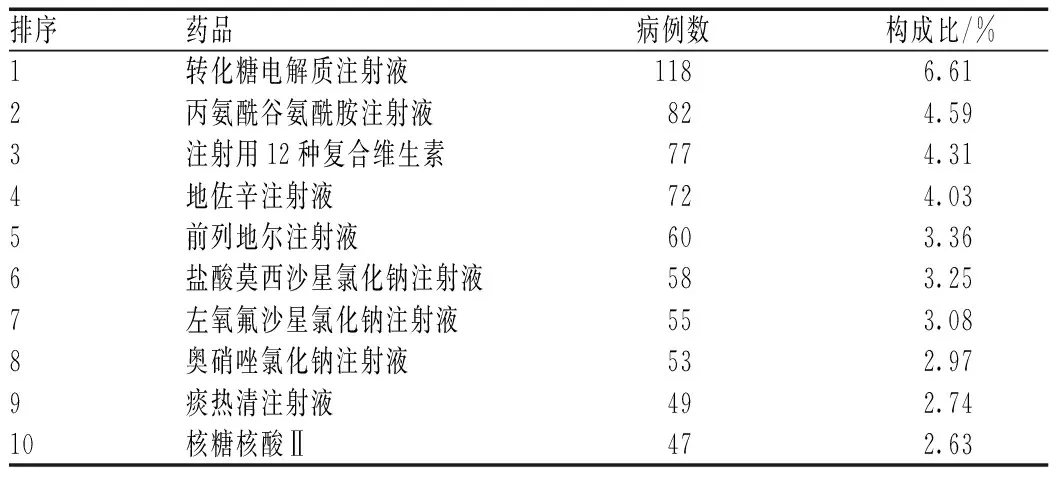
表3 ADR/ADE病例数排序居前10位的药品
2.4ADR/ADE累及器官和(或)系统及临床表现
ADR/ADE累及器官和(或)系统较多,以皮肤及其附件损害为主,主要表现为皮疹、皮肤瘙痒、皮肤红肿、结膜充血等,提示皮疹是临床最常见的不良反应,见表4。
2.5帕累托图分析
2.5.1ADR/ADE涉及药品种类的帕累托图分析:1 786例ADR/ADE主要涉及营养药、抗微生物药、中药注射剂、神经系统用药和抗肿瘤药,提示临床应对这几类药引起重视,见图1。
2.5.2ADR/ADE累及器官和(或)系统的帕累托图分析:1 786例ADR/ADE主要表现为皮肤及其附件损害、局部损害和全身性损害,约占70%,见图2。究其原因可能包括:(1)皮肤瘙痒、皮疹、皮肤红肿、静脉炎等ADR/ADE在临床上发生率高;(2)上述表现在临床容易发现和上报。
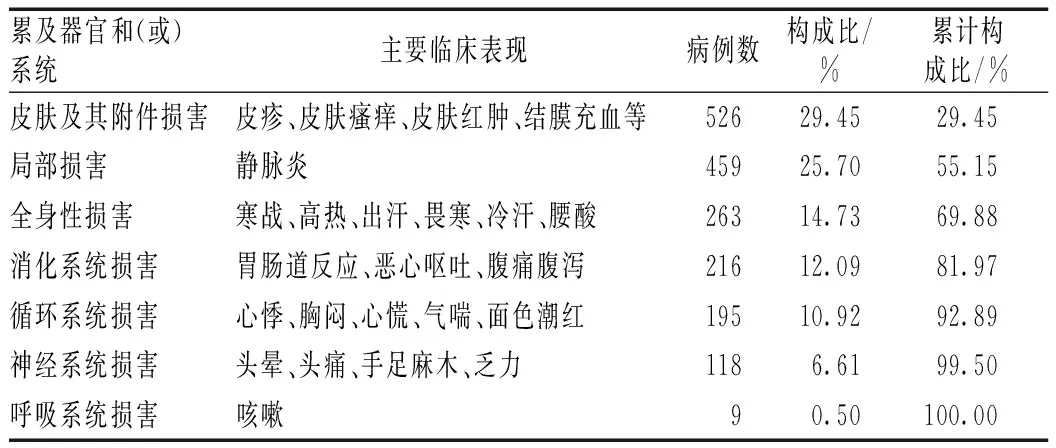
表4 ADR/ADE累及器官和(或)系统及主要临床表现
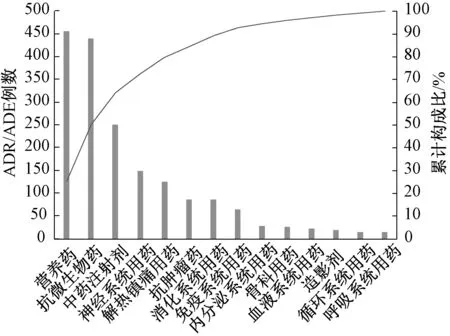
图1 ADR/ADE涉及药品种类的帕累托图分析Fig 1 Pareto diagram analysis on the categories of ADR/ADE-inducing drugs
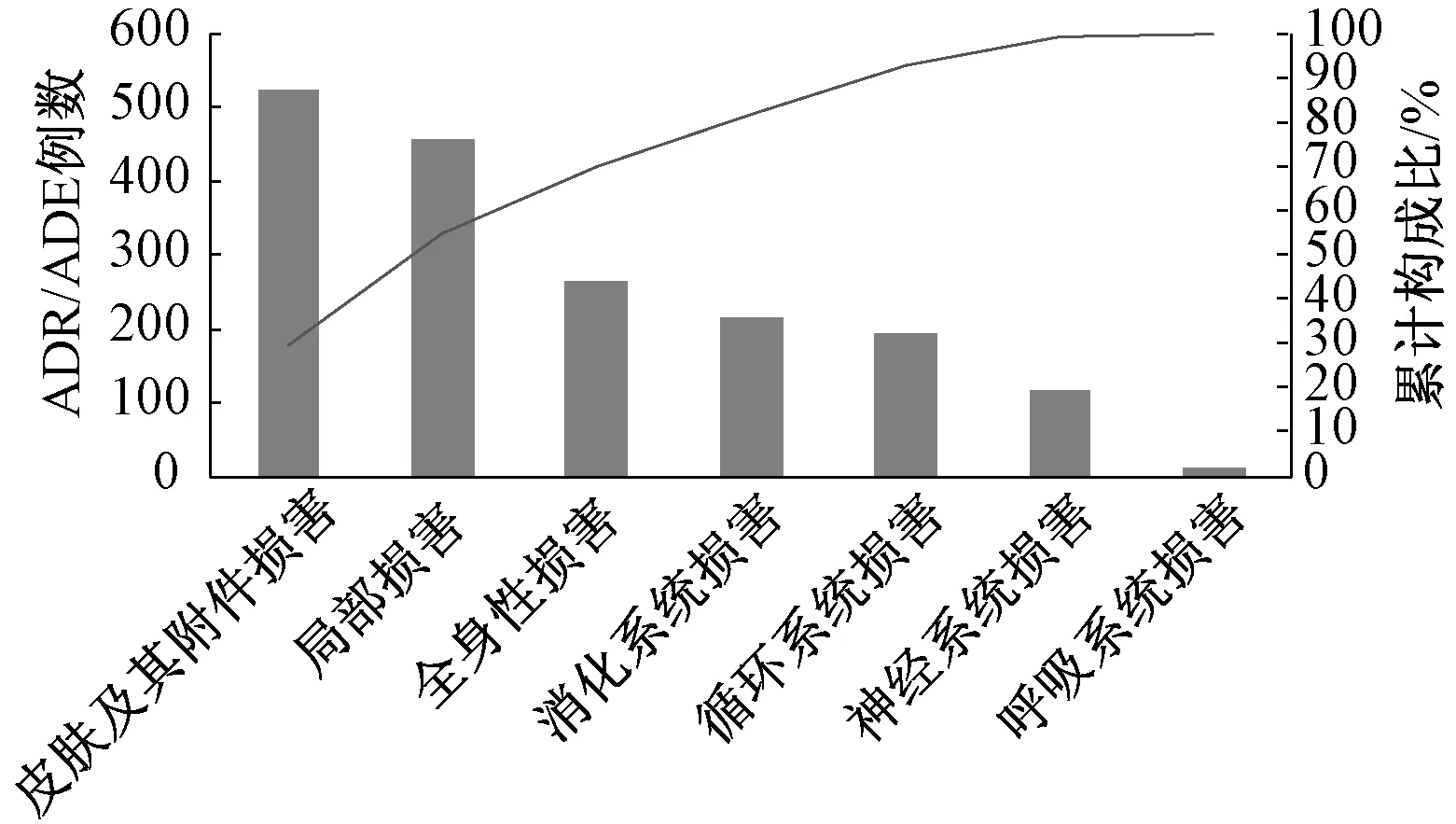
图2 ADR/ADE累及器官和(或)系统的帕累托图分析Fig 2 Pareto diagram analysis on ADR/ADE involved organs and(or) systems
3讨论
3.1老年患者是发生ADR/ADE的高危人群
本次统计结果显示,1 786例发生ADR/ADE的患者中,老年患者所占比例较大。老年患者属于特殊人群,各组织、器官功能逐渐衰退,对药物的代谢能力相对中、青年患者较差,靶器官对药物的敏感性也会发生变化,因此增加了ADR的发生概率。其次,老年患者常会同时服用几种药物,药物间的相互作用也会增加ADR的发生。因此,在给老年患者用药时,要密切注意观察,一旦发现ADR,应立即给予对症处理,以减轻对患者的损害。
3.2引发ADR/ADE的主要药品种类
各类药物致ADR/ADE的帕累托图分析结果显示,在1 786例报告中,营养药、抗菌药物、中药注射剂、神经系统药和抗肿瘤药的累计构成比落在了0%~80%的区间,为主要因素;消化系统药和解热镇痛药累计构成比落在了80%~90%的区间,为次要因素;其余药物均为一般因素。
3.2.1营养药:营养药引发的ADR/ADE病例数占25.53%,是引发ADR/ADE的最主要因素。主要原因可能是临床上营养药的使用比较广泛,如转化糖电解质注射液常作为溶剂与其他药物配伍使用,增加了ADR的发生概率。转化糖电解质注射液制剂成分复杂,含有多种金属离子,其对化学反应有催化作用。在静脉滴注过程中,可能催化药物中的某些成分而导致失效,也可能使药物沉淀析出,产生混浊现象,发生ADR。又如,丙氨酰谷氨酰胺注射液主要适用于需要补充谷氨酰胺患者肠外营养地补充,包括处于分解代谢和高代谢的患者。该药说明书中明确指出不可直接滴注,需要与可配伍的氨基酸溶液或含有氨基酸的溶液相结合,与载体溶液一起滴注。在此次调查中发现,临床上有使用10%葡萄糖注射液、转化糖电解质注射液和转化糖注射液等作为溶剂来静脉滴注;此外,在丙氨酰谷氨酰胺中还加入复合辅酶或注射用脂溶性维生素等药物进行混合静脉滴注,没有按照药品说明书规定的用法进行使用,故发生ADR/ADE的机会也明显增加。可见,规范营养药的使用势在必行。
3.2.2抗菌药物:目前,抗菌药物在临床上使用品种较多,用药起点低,使用频率高。虽然历次抗菌药物整治活动起到了一定效果,但是还有不尽如人意的地方。因此,临床医师应根据患者的具体情况,合理使用抗菌药物。在使用青霉素及头孢菌素类抗菌药物之前,要详细询问患者是否有药物过敏史,并做皮肤敏感试验,用药后认真观察,以减少ADR的发生。本次调查中,抗菌药物中,左氧氟沙星氯化钠注射液(可乐必妥)、盐酸左氧氟沙星注射液(左克)、盐酸莫西沙星氯化钠注射液(拜复乐)引发的ADR/ADE病例数最多,共占24.64%。这3种药品都属于氟喹诺酮类抗菌药物,容易引起皮疹、静脉炎、心悸等不良反应。因此,临床上使用氟喹诺酮类抗菌药物时,要密切关注患者情况,尤其是老年患者,一旦发现不适,应立即停药,并采取对症处理措施。
3.2.3中药注射剂:在临床上,中药注射剂的应用越来越广泛,因此其引起的ADR/ADE也较多[4-5]。中药注射剂容易引起过敏样反应,与变态反应机制有关。导致药物过敏的原因可能是药物本身的蛋白质、多肽、多糖等大分子物质。这些大分子物质可能具有免疫原性,从而使机体产生免疫应答,产生抗体或致敏的淋巴细胞,导致变态反应发生。中药注射剂除了药物本身的原因外,制剂工艺过程中加入的稀释剂、添加剂和着色剂等,以及药物本身经过氧化、还原、分解、聚合等反应形成的杂质均有可能成为过敏原,引起变态反应,从而发生ADR/ADE[6,12-13]。因此,中药注射剂一般应单独配置给药,最好使用单独输液装置。若与其他药物共用同一输液通道,更换药物时应先用合适的溶剂冲管。其次,若患者使用多种静脉药物时,可将中药注射剂放在首位使用,从而最大程度地明确引起ADR的药物。本次统计结果显示,中药注射剂引发的ADR/ADE有251例(占14.05%),仅次于营养药和抗微生物药。可能的原因:一是中药注射剂品种越来越多,临床医师与患者可能认为中药“作用缓和、ADR轻”而常作为辅助药物,使用越来越广泛,也增加了ADR/ADE的发生概率。二是中药注射剂多为复方制剂,所含成分复杂,原药材质量及制备工艺对成药质量影响较大,因此出现ADR/ADE的可能性较高[7]。三是溶剂选择及用量问题。首先,常见的溶剂主要是0.9%氯化钠注射液和5%葡萄糖注射液等。0.9%氯化钠注射液的pH为4.5~7.0,而5%葡糖糖注射液的pH为3.2~5.5。pH不同,适合选用的药物也有所不同。其次,溶剂的用量关系到药物的溶解度和浓度。溶剂量过多会使药物浓度降低致药效降低,或使输注时间延长增加不稳定性。溶剂用量过少,使药物不能完全溶解而发生混浊和药物浓度过大产生刺激或引起ADR/ADE[8]。如灯盏细辛注射液,其说明书推荐溶剂是0.9%氯化钠注射液,而临床上常用5%葡萄糖注射液作溶剂这样会使药物的pH降低,引起药物性状的改变,导致ADR/ADE。其次,灯盏细辛说明书常用剂量为1次20~40 ml,临床上最大用到了1次60 ml。溶剂使用不合理和药物剂量偏大均可导致发生ADR/ADE的可能性增加。因此,临床应加强对中药注射液的合理应用,辨证施治,严格掌握临床适应证,按照药品说明书推荐溶剂稀释以及规定的给药方法、用法与用量使用[9,14]。中药注射剂的说明书中很少提及ADR/ADE,临床医师应予以重视。
3.2.4神经系统用药:神经系统用药也是引发ADR/ADE的主要药物之一,占8.34。可能的原因是,目前在我院神经内科的主要病种是脑卒中,而相关脑保护治疗药物在我国的研究和使用比较广泛。如长春西汀注射液,说明书中明确规定该药应溶于0.9%氯化钠注射液500 ml,质量浓度≤0.06 mg/ml,质量浓度高于此值可能会引起溶血,但在本次调查中发现,我院长春西汀注射液均使用0.9%氯化钠注射液250 ml作为溶剂,不符合其说明书的要求。因此,规范长春西汀注射液可能会明显减少ADE的发生。
3.3ADR/ADE累及器官和(或)系统
ADR/ADE累及器官和(或)系统的帕累托图分析结果表明,在1 786例ADR/ADE报告中,皮肤及其附件损害、局部损害和全身性损害的累计构成比落在了40%~80%的区间,为主要类型;消化系统损害的累计构成比落在了80%~90%的区间,为次要类型;神经系统损害、循环系统损害和呼吸系统累计构成比落在了90%~100%的区间,为一般类型。皮肤及其附件损害比例较大,病情一般较轻,可能与临床上易发现有关。
3.4ADR/ADE的防范措施
针对发生ADR/ADE的不同原因,应采取不同的措施来预防其发生。ADR是药物在使用过程中不可避免,因此临床用药前应详细询问患者的过敏史,用药后密切监测患者的反应,对于老年患者应采取用药从简、对症治疗、适当减少药物剂量措施[15]。对于肝、肾功能不全者,要选择对肝、肾功能没有不良影响的药物,并增强此类人群的血药浓度监测。为了避免ADE,临床应更加规范药物的使用,通过加强对医护药人员药物知识的培训、引入电子计算机系统和软件拦截不合理的处方和加强医疗机构对易致ADE药品的监控等[10-11,16]。此外,随着临床药学的蓬勃开展,临床药师应发挥自身优势,促进临床合理用药,减少或避免ADE的发生。
总之,将本调查收集的数据经过系统的帕累托图分析,可反映出主要的少数和次要的多数的关系,从而找出引发ADR/ADE的主要药品,提醒我院在临床治疗过程中需对以上药品重点监控并进行干预,促进临床合理用药。ADR/ADE的监测虽然能及时发现一些药物的不安全信息,但是并不能预测其发生。因此,在宣传和完善ADR监测制度的同时应加强临床用药知识培训,促进医师、药师和护士相互配合,共同提高安全用药意识,规范用药,才能保障患者用药安全[17]。
参考文献
[1]卫生部.药品不良反应报告和监测管理办法[S].卫生部令第81号.2011-05-04.
[2]钱之玉.药理学进展[M].南京:东南大学出版社,2005:433-443.
[3]马红,石杰,苏家茹.药品不良反应1140例帕累托图分析[J].中国药物与临床,2013,13(6):810-811.
[4]张惠霞,陈建玉,宋成.3414例中药注射剂不良反应分析[J].中国药物警戒,2006,3(4):232-235.
[5]余佳,李应霞,黎莉华.我院402例药品不良反应报告分析[J].中国药业,2010,19(7):48-50.
[6]施志红,樊洪中,岳德永.中药注射剂致药品不良反应类别的构成比分析[J].药学服务与研究,2013,13(1):54-55.
[7]陈秀兰.山西医科大学门急诊药品不良反应分析[J].临床医药实践杂志,2007,16(4):288-290.
[8]陆红柳,饶金华.注射药物的溶剂配伍及给药注意事项[J].首都医药,2012(3):43-44.
[9]刘立民,蔡学菊.中药注射液在临床应用中存在的问题[J].现代中西医结合杂志,2007,16(12):1687-1688.
[10]王明薇,王大南,菅凌燕.防范住院患者药物不良事件的研究进展[J].中国药房,2012,23(34):3236-3238.
[11]刘惠民,周东升.医院药物不良事件与管理措施探讨[J].中医药管理杂志,2014,22(5):751-752.
[12]昝军民.216 例药品不良反应报告分析[J].中国药事,2015,29(7):759-765.
[13]胡毅坚,朱素燕,徐萍.住院患者可防范药物不良事件发生的原因及防范对策探讨[J].中国药物滥用防治杂志,2010,16(1):48-50.
[14]朱立勤,徐彦贵,王屏.中药注射剂不良反应发生的原因分析[J].中国药房,2007,18(3):215-218.
[15]侯卫巍.我院2012—2013年药品不良反应/事件报告分析[J].实用医技杂志,2014,21(6):689-690.
[16]杨玉玲.评价戴明环在药品不良反应监测中的应用[J].中国现代药物应用,2012,6(6):55-57.
[17]刘雁,朱锦秀,余美玲.蚌埠医学院第一附属医院1728例药品不良反应报告分析[J].中国药事,2013,27(12):1333-1336.
Pareto Diagram Analysis on 1 786 Cases of Adverse Drug Reactions/ Adverse Drug Events Induced by Intravenous Medication
FU Hong1, QIU Zhaojuan1, RONG Youhe2
(1.Dept.of Pharmacy, Affiliated Hospital of Nanjing University of Traditional Chinese Medicine, Jiangsu Nanjing 210029, China; 2.School of Nursing, Nanjing University of Traditional Chinese Medicine, Jiangsu Nanjing 210029, China)
ABSTRACTOBJECTIVE:To investigate the characteristics of adverse drug reactions/ adverse drug events(ADR/ADE) in Affiliated Hospital of Nanjing University of Traditional Chinese Medicine(hereinafter referred to as “our hospital”), so as to promote the rational drug use in clinic. METHODS: 1 786 cases of ADR/ADE induced by intravenous medication in ward were analyzed by pareto diagram. RESULTS: There were 1 786 cases, including 826 males (46.25%) and 960 females (53.75%). Patient of the oldest was 97 years old, and the youngest was 1 year old. 570 cases of ADR/ADE were new, accounting for 31.91%. 79 cases of ADR/ADE were severe, accounting for 4.42%.According to pareto diagram, ADR/ADE involved nutraceuticals,antimicrobial drugs,traditional Chinese medicine injection,nervous system drugs and anticancer drugs.The main clinical manifestations were the damage of skin and its appendages, local damage and systemic damage. CONCLUSIONS: Great attention should be paid to the development of ADR/ADE in clinic. Rational use of drugs should be emphasized to decrease the occurrence o f ADR/ADE.
KEYWORDSAdverse drug reactions; Adverse drug events; Pareto diagram analysis; Rational drug use
2结果
2.1患者基本情况及ADR/ADE的发生率
中图分类号R969.3
文献标志码A
文章编号1672-2124(2016)06-0832-04
DOI10.14009/j.issn.1672-2124.2016.06.041
(收稿日期:2015-12-15)
