假禾谷镰孢细胞凋亡基因FpTatD的鉴定与表达分析
2016-07-18陈琳琳丁胜利李洪连
陈琳琳,侯 莹,丁胜利,施 艳,李洪连
(河南农业大学植物保护学院/小麦玉米作物学国家重点实验室/河南省粮食作物协同创新中心,郑州 450002)
假禾谷镰孢细胞凋亡基因FpTatD的鉴定与表达分析
陈琳琳,侯莹,丁胜利,施艳,李洪连
(河南农业大学植物保护学院/小麦玉米作物学国家重点实验室/河南省粮食作物协同创新中心,郑州 450002)
摘要:【目的】鉴定和克隆假禾谷镰孢(Fusarium pseudograminearum)细胞凋亡相关基因FpTatD,分析FpTatD在假禾谷镰孢菌丝、分生孢子和侵染不同时期的表达,为探索细胞凋亡在假禾谷镰孢侵染过程中的功能提供理论依据。【方法】从GenBank获得模式物种已知的TatD氨基酸序列,利用BLASTP的方法在镰孢中鉴定TatD同源蛋白,并构建进化树;分别以假禾谷镰孢的基因组DNA和cDNA为模板,通过PCR方法克隆假禾谷镰孢FpTatD的基因序列和开放阅读框(ORF)序列;利用实时荧光定量PCR方法分析FpTatD在假禾谷镰孢生长、产孢及侵染不同时期的表达;利用转录组测序方法分析FpTatD在假禾谷镰孢与感病小麦和抗病小麦互作中的表达差异。【结果】镰刀菌中有4个保守的TatD同源蛋白,与其他物种的TatD蛋白构建系统进化树,发现TatD在进化上分成两个大的分支,第一个分支的TatD在所有物种中都非常保守,包括镰刀菌的TatD1和TatD2,第二个分支的TatD蛋白属于植物和真菌特有的,包括镰刀菌的TatD3和TatD4;克隆假禾谷镰孢的FpTatD1、FpTatD2、FpTatD3、FpTatD4基因长度分别为993、1 331、1 227、1 176 bp,ORF区长度为993、1 182、1 227、1 176 bp。FpTatD2 5′端包含两段长度为94和55 bp的非编码序列,FpTatD1、FpTatD3和FpTatD4均不含非编码序列。4个FpTatD编码蛋白质的分子量大小分别为36.37、43.13、45.59、44.25 kD。蛋白结构和序列分析显示FpTatD蛋白均具有明显的DNase结构域以及大部分保守的氨基酸位点;实时荧光定量PCR分析显示,FpTatD1和FpTatD2在假禾谷镰孢中的表达量高,且在侵染初期阶段明显诱导表达,尤其是FpTatD1在侵染36 h和3 d时分别上调表达8.8倍和7.6倍;而FpTatD3和FpTatD4表达量非常低,且在不同阶段的表达量无明显变化,说明FpTatD1和FpTatD2在假禾谷镰孢中起主要作用;通过分析假禾谷镰孢与感病小麦国麦301和抗病小麦周麦24互作的转录组数据,与实时荧光定量PCR结果一致,FpTatD1和FpTatD2表达量高,并在侵染阶段上调表达,而且相对于假禾谷镰孢与感病小麦的亲和互作中,其与抗病小麦的非亲和互作中,FpTatD诱导表达倍数更高。【结论】假禾谷镰孢细胞凋亡相关基因FpTatD可能参与病原菌与寄主的互作过程。
关键词:假禾谷镰孢;细胞凋亡;TatD核酸酶;基因克隆;表达分析
联系方式:陈琳琳,E-mail:llchensky@163.com。通信作者李洪连,Tel:0371-63558791;E-mail:honglianli@sina.com
0 引言
【研究意义】假禾谷镰孢(Fusarium pseudograminearum)于1951年在澳大利亚首次被报道,其引起的小麦茎基腐病每年造成直接经济损失超过10亿美元。目前,世界上已有10多个国家先后报道该病害的发生和危害[1]。2011年,LI等在河南省小麦产区首次报道假禾谷镰孢的危害,罹病植物茎基部腐烂、呈蜜褐色病斑,染病地块的田间发病率达70%以上,由于常年实施秸秆还田,造成菌源积累,品种抗性差等原因,病害的发生呈现不断加重和蔓延趋势,假禾谷镰孢已成为中国黄淮麦区危害小麦生产的重要病原菌[2-3],而目前对其致病分子机理的研究还非常少。因此,克隆假禾谷镰孢细胞凋亡相关基因FpTatD,并分析其在生长、产孢和侵染不同时期、侵染不同抗性小麦的表达情况,可为探讨细胞凋亡在假禾谷镰孢致病过程中的作用提供依据,对于病害防治具有重要意义。【前人研究进展】核酸酶 TatD是在物种中非常保守的一种细胞质蛋白,在细胞凋亡过程中转移到细胞核中降解DNA,从而调控多种生物的细胞凋亡过程[4-7]。细胞凋亡指生物体中自然发生的或生理性的细胞死亡,是程序性细胞死亡的一种,在真核生物的生长、发育以及分化过程中具有非常广泛和重要的作用,例如维持细胞动态平衡、清除受损细胞以及对病原体和胁迫的响应等[8]。近年来研究发现,丝状真菌发生的类细胞凋亡过程调控机体细胞衰老、孢子形成、菌丝融合及致病性等多个生理过程[9-12]。尤其是在病原菌与植物互作过程中,植物通过产生抗毒素等次级代谢产物诱导病原菌细胞凋亡的发生来阻止病原菌的侵入[13-14],所以通过调控病原菌的细胞凋亡可以实现有效的病害控制。在大肠杆菌(Escherichia coli)中,TatD由 Tat操纵子编码,调控大肠杆菌 Tat(Twin-Arginine Translocation)蛋白转运途径[15]。但已有研究表明,与膜蛋白TatA/B/C/E的作用不同,TatD定位在细胞质内,对折叠蛋白的转运无明显影响,而具有依赖于Mg2+的内切核酸酶活性和3′到5′端外切核酸酶活性,参与多种生物细胞凋亡过程[4,16]。在秀丽隐杆线虫(Caenorhabditis elegans)、布氏锥虫(Trypanosoma brucei)、酿酒酵母(Saccharomyces cerevisiae)和大肠杆菌(Escherichia coli)中分别缺失TatD基因后,细胞对低浓度过氧化氢的耐受性增强,凋亡细胞减少;而过表达 TatD,细胞对过氧化氢的耐受性降低,TUNEL(terminal deoxynucleotidyltransferase-mediated dUTP-nick end labeling)阳性细胞增多,说明TatD参与细胞凋亡过程中DNA的降解[4-7]。CHEN等克隆并分析了植物丝状病原菌大豆疫霉(Phytophthora sojae)的TatD,发现PsTatD4通过调控病原菌细胞凋亡的发生正调控大豆疫霉无性孢子的产生、负调控其致病性[17]。【本研究切入点】目前,关于细胞凋亡在假禾谷镰孢侵染过程中的功能研究尚未见报道,前期笔者通过TUNEL染色法检测到低浓度过氧化氢能够诱导假禾谷镰孢分生孢子细胞凋亡的发生。【拟解决的关键问题】通过鉴定和克隆假禾谷镰孢细胞凋亡相关基因FpTatD,并利用qRT-PCR及转录组测序方法分析FpTatD在假禾谷镰孢菌丝、分生孢子和侵染不同时期、与不同抗性小麦互作的表达,阐释 FpTatD可能的生物学功能,以期为进一步探究细胞凋亡在假禾谷镰孢侵染过程中的功能提供理论基础。
1 材料与方法
试验于2015年4月至2016年2月在河南农业大学小麦病害研究实验室完成。
1.1 材料
1.1.1 供试菌株 假禾谷镰孢菌株Wz2-8A,禾谷镰孢(Fusarium graminearum)菌株Cz072-7A均由河南农业大学小麦病害研究实验室分离并保存。
1.1.2 供试植物 对假禾谷镰孢菌株 Wz2-8A高感小麦品种矮抗58、国麦301以及抗病小麦品种周麦24,由国家小麦工程技术研究中心提供。
1.1.3 酶与试剂 Taq DNA聚合酶、PrimerSTAR HS高保真酶、反转录PrimeScript™ RT reagent Kit(Perfect Real Time)、实时荧光定量 PCR SYBR Premix Ex Taq™(Tli RNaseH Plus)、T载体pMD™19-T Vector Cloning Kit、DNA Marker购自大连TaKaRa公司;Trizol Reagent购自美国Invitrogen公司;DNA胶回收试剂盒、质粒小量抽提试剂盒购自上海生工生物公司;其他试剂为国产分析纯。
1.2 方法
1.2.1 假禾谷镰孢基因组DNA、RNA及cDNA的制备假禾谷镰孢菌丝基因组DNA的提取采用CTAB法[18]。假禾谷镰孢菌丝、分生孢子及侵染不同阶段的样品,参照 Trizol说明书提取总 RNA,最终溶解于 30 µL RNase-free H2O,琼脂糖凝胶电泳鉴定RNA的质量,用超微量分光光度计测量 RNA样品的纯度和浓度。取 1 µg RNA 按照 PrimeScript™ RT reagent Kit (TaKaRa RR037A)提供的Protocal进行DNA消解和逆转录反应获得cDNA。
1.2.2 FpTatD克隆 根据预测的基因序列设计引物分别从假禾谷镰孢基因组 DNA和 cDNA中扩增FpTatD的基因序列和 ORF序列。所用引物分别为FpTatD1:F-5′ ATGGCTTCATCTGCAGCAG 3′和R-5′CTACTTCTCCTCGAGTCCA 3′;FpTatD2:F-5′ ATGT CGTCTACTGTTGATC 3′和R-5′ CTAGCGTCGTCCA AGTCCAA 3′;FpTatD3:F-5′ ATGTGCCAATACACC CACA 3′和R-5′ CTACTCTCGTCGTCCAAAG 3′;FpTatD4:F-5′ ATGTGTATGCATGATCATC 3′和R-5′CTAGCCAAATATAAACTCAG 3′。扩增获得目的条带,利用DNA胶回收试剂盒纯化DNA,连接T载体转化大肠杆菌DH5α,利用菌落PCR方法筛选阳性克隆并送上海生工生物公司测序。
1.2.3 TatD蛋白系统进化分析 利用MEGA_4.1软件构建人(Homo sapiens)(NP_114415.1,NP_055575.3 和 NP_001036017.1)、大肠杆菌(YP_026271.1,NP_287234.1和YP_026291.2)[19]、拟南芥(Arabidopsis thaliana)(NP_190807.3,NP_974418.1,NP_187000.1 和 NP_568352.1)、酿酒酵母(NP_009498.1和NP_013989.2)、布氏锥虫[7]、大豆疫霉[17]和稻瘟菌(Magnaporthe grisea)及4种镰刀菌TatD蛋白的系统发育进化树。利用ClustalX[19]软件,分析4个FpTatD候选蛋白与大肠杆菌、酿酒酵母、布氏锥虫、人和拟南芥的TatD蛋白的氨基酸序列。
1.2.4 假禾谷镰孢菌丝体和分生孢子样品获得 检测假禾谷镰孢在羧甲基纤维素钠培养基(CMC)、绿豆汤培养基(Mung)和康乃馨叶片培养基(Car)中分生孢子的产生,假禾谷镰孢转接到100 mL液体培养基中,25℃、黑暗条件下150 r/min振荡培养1、2、4、6、8、10 d后统计产孢量。结果显示,假禾谷镰孢在绿豆汤培养基和康乃馨叶片培养基中培养2 d时即可产生分生孢子,但是孢子量偏低;而在CMC培养基中,从第4 天开始产生大量分生孢子,到第10天孢子量逐渐增多,所以CMC可用作诱导假禾谷镰孢产孢的培养基。与其亲缘关系非常相近的禾谷镰孢在绿豆汤培养中更适合诱导分生孢子的产生(图 1-A)。将假禾谷镰孢分生孢子在 YEPD培养基中、25℃、150 r/min过夜摇培获得假禾谷镰孢菌丝体样品。
1.2.5 假禾谷镰孢接种 为获得假禾谷镰孢侵染小麦不同时期的样品,选择感病品种小麦矮抗58,用3%的次氯酸钠处理3 min后放在1%的琼脂中保湿催芽3 d后移苗至营养液中继续生长至第7天,采用浸根法接种假禾谷镰孢,孢子浓度为 1.0×106个/mL(图1-B)。分别在接种18 h、36 h、3 d、6 d、9 d、12 d取小麦根和茎基部0.5 cm提取RNA,用于FpTatD的表达分析(图1-C)。图1-B显示,与对照相比,接种假禾谷镰孢6 d后的小麦表现出植株矮小、根茎部变褐腐烂等明显的发病症状。
利用杨云等[20]介绍的温室盆栽苗期抗性鉴定方法接种,假禾谷镰孢分别接种感病小麦国麦301和抗病小麦周麦24后5 d(侵染初期)和15 d(侵染中后期)取样,进行转录组测序。

A:假禾谷镰孢和禾谷镰孢在不同培养基中分生孢子的产生Conidia of F. pseudograminearum and F. graminearum were produced in different culture media;B:小麦育苗及接种Culturation and inoculation of wheat seedlings;C:假禾谷镰孢菌丝、分生孢子及侵染不同时期的RNA RNA extracts at F. pseudograminearum mycelia, conidia and infection stages图1 假禾谷镰孢分生孢子产生、侵染及RNA提取Fig. 1 Conidia production and host infection of F. pseudograminearum, and RNA extraction
1.2.6 实时荧光定量PCR 以TEF1a(FPSE_11980)作为内参基因。所用引物为TEF1a:RTF-5′ TCACCA CTGAAGTCAAGTCC 3′和RTR-5′ ACCAGCGACGT TACCACGTC 3′;FpTatD1:RTF-5′ TGATCGAGACT GATGGACC 3′和RTR-5′ CAGGTTCGGCAGCAGCA GT 3′;FpTatD2:RTF-5′ CTTTGTTGGAAGCGCATC AC 3′和RTR-5′ ACTGCTGCTGCCGAACCTG 3′;FpTatD3:RTF-5′GCTGAGGACTTTTCGGATGAG 3′和RTR-5′ ACACTTCAACACTGGCGCTG 3′;FpTatD4:RTF-5′ ACTTTTGTACGACGCCTTG 3′和 RTR-5′CCGTTTGAGTATTTTCTTTC 3′。将不同样品反转录后的cDNA,进行实时荧光定量PCR。反应体系为:SYBR Premix Ex Taq™ 10 µL,Primer F(10 µmol·L-1)0.4 µL,Primer R(10 µmol·L-1)0.4 µL,ROX Reference Dye II 0.4 µL,cDNA 2 µL,ddH2O 6.8 µL。反应程序:95℃ 30 s预变性,40个循环(95℃ 5 s,60℃ 30 s),引物的特异性可以通过熔解曲线和电泳来判断。以稳定表达的TEF1a为参照进行标准化,将假禾谷镰孢分生孢子待分析基因表达量定为 1,分析比较相应基因在假禾谷镰孢与植物互作过程中的相对转录量。
2 结果
2.1 FpTatD克隆及序列分析
通过GenBank获得已知TatD蛋白的氨基酸序列,包括人、布氏锥虫、拟南芥、大豆疫霉、酿酒酵母和大肠杆菌。通过BLASTP方法对镰刀菌数据库进行检索,查找TatD的同源蛋白,然后通过pFAM(E-value <1e-5)的方法检查TatD蛋白已知的DNase结构域,具有明显的DNase结构域的蛋白列为TatD的候选蛋白,并根据与酵母 TatD的同源关系进行重新命名。其中假禾谷镰孢 TatD蛋白分别命名为:FpTatD1:FPSE_08319;FpTatD2:FPSE_06574;FpTatD3:FPSE_07179;FpTatD4:FPSE_05373。
为获得假禾谷镰孢FpTatD的基因序列和ORF序列,根据预测的基因序列设计引物,在以假禾谷镰孢禾谷镰孢菌丝体基因组DNA和cDNA为模板的情况下,FpTatD1、FpTatD2、FpTatD3和FpTatD4均获得目的片段(图2),并将扩增得到的DNA分别连接载体PUC19并测序。测序结果显示FpTatD1、FpTatD2、 FpTatD3、FpTatD4长度分别为993、1 331、1 227、1 176 bp;ORF序列长度分别为993、1 182、1 227、1 176 bp。FpTatD2 5′端第64位和336位分别包含长度为94和55 bp的非编码序列,FpTatD1、FpTatD3 和FpTatD4均不含非编码序列,编码蛋白质的分子量大小为36.37、43.13、45.59、44.25 kD。通过pFAM (E-value<1e-5)方法分析FpTatD蛋白结构域,均具有明显的DNase结构域。根据QIU等的报道TatD蛋白含有 21个保守的氨基酸[6],将假禾谷镰孢 4个FpTatD蛋白与已知模式物种的TatD蛋白进行氨基酸序列比对,结果显示假禾谷镰孢的 TatD均包含大部分保守氨基酸(附图1)。

图2 假禾谷镰孢FpTatD全长序列及完整开放阅读框序列的扩增Fig. 2 PCR amplification of FpTatD DNA sequences and entire open reading frame (ORF) sequences in F. pseudograminearum
2.2 TatD蛋白的系统进化分析
根据人、布氏锥虫、拟南芥、大豆疫霉、酿酒酵母、稻瘟菌、大肠杆菌和4个镰刀菌小种的TatD蛋白数据构建了系统进化树(图3)。进化树显示TatD蛋白有两个明显的分支,第一个分支包含人、布氏锥虫、大肠杆菌的全部 TatD蛋白,拟南芥和酿酒酵母的TatD1,大豆疫霉的3个TatD蛋白以及稻瘟菌和4种镰刀菌的TatD1和TatD2。分析不同物种TatD的相似度可以发现,镰刀菌和稻瘟菌的 TatD蛋白同源性最高,其次分别为酿酒酵母、大豆疫霉、拟南芥、布氏锥虫、人和大肠杆菌,TatD的进化符合物种进化的方向,说明物种的 TatD蛋白可能来自共同的祖先;第二个分支只包含植物、大豆疫霉、酿酒酵母、稻瘟菌的和镰刀菌的 TatD蛋白,且同一物种中第一个分支的TatD蛋白与第二个分支的TatD蛋白亲缘关系较远,说明在进化过程中,植物和真菌中进化出一类新的TatD蛋白。不同物种中TatD的数量存在差异,可能在进化过程中发生了基因的复制或丢失。
2.3 FpTatD在假禾谷镰孢菌丝、分生孢子及侵染阶段的表达
FpTatD1和FpTatD2表达量较高(FpTatD1在分生孢子阶段 Ct值=23.77;FpTatD2在分生孢子阶段Ct值=26.32),且在侵染阶段上调表达,尤其是FpTatD1在侵染36 h和3d时分别上调8.8倍和7.6倍。而FpTatD3和FpTatD4表达量比较低(FpTatD3在分生孢子阶段 Ct=30.79;FpTatD4在分生孢子阶段Ct=33.68),其在不同阶段表达差异较小,说明假禾谷镰孢的 FpTatD虽然在数量上发生扩增,但起主要作用的仍是物种中非常保守的FpTatD1和FpTatD2,且这两个基因在侵染阶段明显诱导表达,假禾谷镰孢的TatD可能参与调控其侵染过程(图4)。
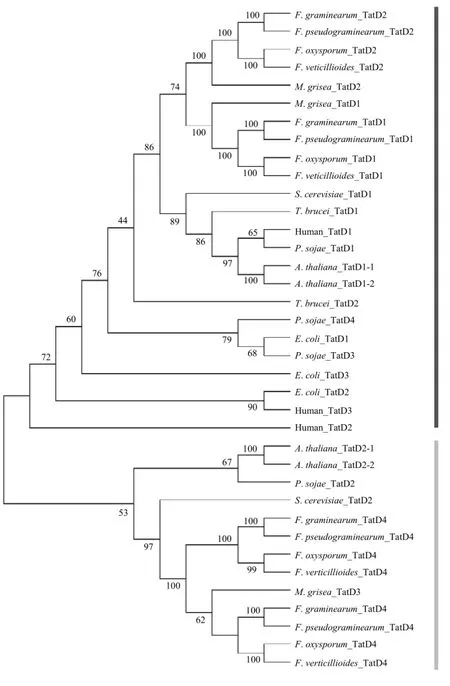
图3 TatD蛋白的系统进化树Fig. 3 The phylogenetic relationship of TatD proteins
2.4 FpTatD在假禾谷镰孢与不同抗性植物互作中的表达
为了进一步明确 FpTatD在假禾谷镰孢侵染过程中的作用,分析了假禾谷镰孢分别与感病品种国麦301和抗病品种周麦24互作的转录组数据。结果显示,与qRT-PCR结果类似,FpTatD1和FpTatD2表达量较高,且在侵染阶段上调表达;比较假禾谷镰孢与不同抗性小麦的互作,其与抗病品种互作的过程中,FpTatD表达量更高(图5)。在真核生物中TatD正调控细胞凋亡的发生,即假禾谷镰孢在与抗病品种小麦互作中诱发更强的细胞凋亡[6-7,17]。之前已有研究发现,植物与病原菌互作过程中,植物通过自身产生的次级代谢物质诱发病原菌细胞凋亡的发生杀死病原菌以实现有效的抗病[9]。
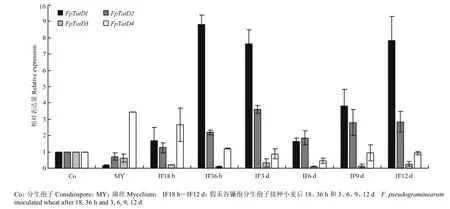
图4 FpTatD在假禾谷镰孢菌丝、分生孢子及侵染不同时期的表达Fig. 4 Transcriptional profiles of FpTatD in F. pseudograminearum conidia, mycelia and infection
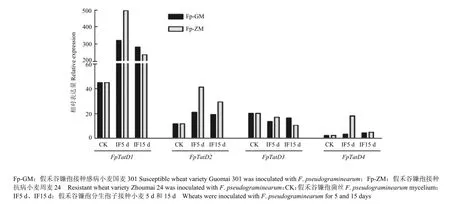
图5 FpTatD在假禾谷镰孢与感病小麦和抗病小麦互作中的表达Fig. 5 Expression profiles of FpTatD in affinity interaction and non affinity interaction
3 讨论
植物与病原菌互作过程中,双方都通过复杂的网络试图去操纵对方的细胞死亡以最大限度的提高自身的生存概率。该过程在互作中最大的特点就是寄主或者病原菌都可能获益,这取决于谁先获得平衡[9,21]。众所周知,植物可以通过局部细胞死亡来抵抗病原菌的侵入,而这种抗性主要取决于寄主的分子信号,同时也受病原菌影响[22-23]。而最近的研究发现多种病原真菌也在经历着细胞凋亡的发生,且在病原菌生长、产孢和侵染过程中起至关重要的作用[13,17,24]。但是细胞凋亡过程在镰刀菌中的作用目前还不清楚。本研究通过分析细胞凋亡相关基因 FpTatD在假禾谷镰孢生长、产孢及侵染阶段的表达,阐述细胞凋亡可能的生物学功能。
TatD是在物种中非常保守的一类核酸酶,参与细胞凋亡最后阶段 DNA的降解过程[6]。T. brucei和Leishmania诱导细胞凋亡过程中,TatD从细胞质转移到细胞核中,与内切核酸酶 G(EndoG)形成复合体称为 DNA“降解体”,调控细胞凋亡过程[25];在 T. brucei中过表达TatD能增强其细胞凋亡的发生[7];在大豆疫霉中,TatD通过调控其细胞凋亡正调控无性孢子的产生,负调控其致病性[17]。本研究中4种镰刀菌的蛋白组中鉴定到4个TatD蛋白,在进化上分属两个分支,TatD1和TatD2在所有物种中都非常保守,而TatD3和TatD4是植物和真菌特有的。
本研究克隆了假禾谷镰孢 FpTatD的基因序列及ORF序列,其编码的具有明显的DNase结构域及大部分TatD保守的氨基酸位点。利用qRT-PCR方法分析假禾谷镰孢FpTatD在菌丝体、分生孢子和侵染不同时期的表达,FpTatD1和FpTatD2的表达量较高,且在侵染初期阶段明显的诱导表达。进一步分析假禾谷镰孢与感病小麦和抗病小麦互作的转录组数据,发现在与抗病小麦互作过程中,FpTatD的表达量更高。由此可以推测,假禾谷镰孢与寄主的互作初期阶段,病原菌经历细胞凋亡的诱导发生,如果发生水平低,使更多的病原菌存活下来以实现有效的侵染;如果细胞凋亡发生水平高,将抑制病原菌进一步的侵染和定殖。最近已有研究证实,植物产生的次级代谢物种能够诱导病原真菌细胞凋亡的发生,以实现有效的抗病[26-28]。所以也许可以通过合成化学药剂或者基因工程的方法使植物高表达诱导微生物细胞凋亡的因子来形成植物保护的新策略。
4 结论
鉴定和克隆了假禾谷镰孢的FpTatD,其在侵染过程中诱导表达,推测 FpTatD可能参与调控假禾谷镰孢与植物的互作过程。
References
[1] MOOLHUIJZEN P M, MANNERS J M, WILCOX S A, BELLGARD M I, GARDINER D M. Genome sequences of six wheat-infecting Fusarium species isolates. Genome Announcements, 2013, 1(5):e00670-13.
[2] LI H L, YUAN H X, FU B, XING X P, SUN B J, TANG W H. First report of Fusarium pseudograminearum causing crown rot of wheat in Henan, China. Plant Disease, 2012, 96(7): 1065.
[3] 周海峰, 杨云, 牛亚娟, 袁虹霞, 李洪连. 小麦茎基腐病的发生动态与防治技术. 河南农业科学, 2014, 43(5): 114-117. ZHOU H F, YANG Y, NIU Y J, YUAN H X, LI H L. Occurrence and control methods of crown rot of wheat. Journal of Henan Agricultural Sciences, 2014, 43(5): 114-117. (in Chinese)
[4] WEXLER M, SARGENT F, JACK R L, STANLEY N R, BOGSCH E G, ROBINSON C, BERKS B C, PALMER T. TatD is a cytoplasmic protein with DNase activity. No requirement for TatD family proteins in sec-independent protein export. The Journal of Biological Chemistry, 2000, 275(22): 16717-16722.
[5] PARRISH J Z, XUE D. Functional genomic analysis of apoptotic DNA degradation in C. elegans. Molecular Cell, 2003, 11(4):987-996.
[6] QIU J, YOON J H, SHEN B. Search for apoptotic nucleases in yeast:role of Tat-D nuclease in apoptotic DNA degradation. The Journal of Biological Chemistry, 2005, 280(15): 15370-15379.
[7] GANNAVARAM S, DEBRABANT A. Involvement of TatD nuclease during programmed cell death in the protozoan parasite Trypanosoma brucei. Molecular Microbiology, 2012, 83(5): 926-935.
[8] TAYLOR R C, CULLEN S P, MARTIN S J. Apoptosis: controlled demolition at the cellular level. Nature Reviews Molecular Cell Biology, 2008, 9(3): 231-241.
[9] SHLEZINGER N, GOLDFINGER N, SHARON A. Apoptotic-like programed cell death in fungi: the benefits in filamentous species. Frontiers in Oncology, 2012, 2: Article 97.
[10] BRUST D, HAMANN A, OSIEWACZ H D. Deletion of PaAif2 and PaAmid2, two genes encoding mitochondrial AIF-like oxidoreductases of Podospora anserina, leads to increased stress tolerance and lifespan extension. Current Genetics, 2010, 56: 225-235.
[11] GEORGIOU C D, PATSOUKIS N, PAPAPOSTOLOU I, ZERVOUDAKIS G. Sclerotial metamorphosis in filamentous fungi is induced by oxidative stress. Integrative and Comparative Biology, 2006, 46(6):691-712.
[12] HAMANN A, BRUST D, OSIEWACZ H D. Deletion of putative apoptosis factors leads to lifespan extension in the fungal ageing model Podospora anserina. Molecular Microbiology, 2007, 65(4):948-958.
[13] SHLEZINGER N, MINZ A, GUR Y, HATAM I, DAGDAS Y F,TALBOT N J, SHARON A. Anti-apoptotic machinery protects the necrotrophic fungus Botrytis cinerea from host-induced apoptotic-like cell death during plant infection. PLoS Pathogen, 2011, 7(8): e1002185.
[14] GALLUZZI L, AARONSON S A, ABRAMS J, ALNEMRI E S,ANDREWS D W, BAEHRECKE E H, BAZAN N G, BLAGOSKLONNY M V, BLOMGREN K, BORNER C. Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes. Cell Death and Differentiation, 2009, 16(8): 1093-1107.
[15] SARGENT F, BOGSCH E G, STANLEY N R, WEXLER M,ROBINSON C, BERKS B C, PALMER T. Overlapping functions of components of a bacterial Sec-independent protein export pathway. The EMBO Journal, 1998, 17(13): 3640-3650.
[16] BERKS B C, SARGENT F, PALMER T. The Tat protein export pathway. Molecular Microbiology, 2000, 35(2): 260-274.
[17] CHEN L, SHEN D, SUN N, XU J, WANG W, DOU D. Phytophthora sojae TatD nuclease positively regulates sporulation and negatively regulates pathogenesis. Molecular Plant-Microbe Interaction, 2014,27(10): 1070-1080.
[18] 陈清清, 孙炳剑, 袁虹霞, 施艳, 李洪连. 小麦根腐病菌索氏平脐蠕孢SYBR Green I实时荧光定量PCR检测技术研究. 菌物学报,2014, 33(3): 690-696. CHEN Q Q, SUN B J, YUAN H X, SHI Y, LI H L. Quantitative detection of Bipolaris sorokiniana in winter wheat based on SYBR Green I real-time PCR. Mycosystema, 2014, 33(3): 690-696. (in Chinese)
[19] THOMPSON J D, GIBSON T J, PLEWNIAK F, JEANMOUGIN F,HIGGINS D G. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research, 1997, 25(24): 4876-4882.
[20] 杨云, 贺小伦, 胡艳峰, 侯莹, 牛亚娟, 代君丽, 袁虹霞, 李洪连.黄淮麦区主推小麦品种对假禾谷镰刀菌所致茎基腐病的抗性. 麦类作物学报, 2015, 35(3): 339-345. YANG Y, HE X L, HU Y F, HOU Y, NIU Y J, DAI J L, YUAN H X,LI H L. Resistance of wheat cultivars in Huang-Huai Region of China to crown rot caused by Fusarium pseudograminearum. Journal of Triticeae Crops, 2015, 35(3): 339-345. (in Chinese)
[21] NARASIMHAN M L, DAMSZ B, COCA M A, IBEAS J I, YUN D J,PARDO J M, HASEGAWA P M, BRESSAN R A. A plant defense response effector induces microbial apoptosis. Molecular Cell, 2001,8(4): 921-930.
[22] DEL POZO O, LAM E. Caspases and programmed cell death in the hypersensitive response of plants to pathogens. Current Biology, 1998,8(24): R896.
[23] LAM E. Controlled cell death, plant survival and development. Nature Reviews Molecular Cell Biology, 2004, 5(4): 305-315.
[24] BARHOOM S, SHARON A. Bcl-2 proteins link programmed cell death with growth and morphogenetic adaptations in the fungal plant pathogen Colletotrichum gloeosporioides. Fungal Genetics and Biology, 2007, 44(1): 32-43.
[25] BOSEDASGUPTA S, DAS B B, SENGUPTA S, GANGULY A, ROY A, DEY S, TRIPATHI G, DINDA B, MAJUMDER H K. The caspaseindependent algorithm of programmed cell death in Leishmania induced by baicalein: the role of LdEndoG, LdFEN-1 and LdTatD as a DNA ‘degradesome'. Cell Death and Differentiation, 2008, 15(10):1629-1640.
[26] RAMSDALE M. Programmed cell death in pathogenic fungi. Biochimica et Biophysica Acta, 2008, 1783(7): 1369-1380.
[27] SHARON A, FINKELSTEIN A, SHLEZINGER N, HATAM I. Fungal apoptosis: function, genes and gene function. FEMS Microbiology Review, 2009, 33(5): 833-854.
[28] SHARON A, SHLEZINGER N. Fungi infecting plants and animals:killers, non-killers, and cell death. PLoS Pathogen, 2013, 9(8):e1003517.
(责任编辑 岳梅)
Cloning and Expression Analysis of Apoptosis-Related Gene FpTatD in Fusarium pseudograminearum
CHEN Lin-lin, HOU Ying, DING Sheng-li, SHI Yan, LI Hong-lian
(College of Plant Protection, Henan Agricultural University/National Key Laboratory of Wheat and Maize Crop Science/ Collaborative Innovation Center of Henan Grain Crops, Zhengzhou 450002)
Abstract:【Objective】The objective of this study is to investigate the potential biological functions of apoptosis-related genes FpTatD in Fusarium pseudograminearum, for this purpose, FpTatD genes were identified and cloned in F. pseudograminearum, and the expression of these genes were examined at mycelia, conidia and infection stages.【Method】 The known TatD proteins were obtained from GenBank, and four TatD candidates in fusariums were identified by BlastP. FpTatD genes and open reading frames(ORF) were amplified from genome DNA and cDNA by PCR, and the transcription levels in mycelia, conidia and infection were examined by qRT-PCR. The expression levels of FpTatD genes in the affinity interaction and non affinity interaction were assayed by RNA-seq.【Result】Four TatD candidates were identified in Fusariums, which divided into two significant branches by the phylogenetic tree. TatD1 and TatD2 belong to an ancient family that is conversed in almost all eukaryotic, while TatD3 and TatD4 seem to come from a unique TatD family that only exists in plants and fungi. Four FpTatD candidates, which identified in F. pseudograminearum were cloned, and the full-length sequences of FpTatD1, FpTatD2, FpTatD3 and FpTatD4 were 993, 1 331,1 227 and 1 176 bp. FpTatD2 contains an intact open reading frame with 94 and 55 bp non-coding sequences in 5′ terminal, while FpTatD1, FpTatD3 and FpTatD4 consist continuous open reading frames. The four clones encode 36.37, 43.13, 45.59 and 44.25 kD proteins. All FpTatD contained the conserved DNase domain and most conserved amino acid residues. qRT-PCR analysis revealed that FpTatD1 and FpTatD2 were highly expressed in F. pseudograminearum, and both were highly up-regulated at early stages of infection. Especially, the expression level of FpTatD1 escalated to 8.8 and 7.6 times in 36 h and 3 d. However, FpTatD3 and FpTatD4 were poorly expressed at all stages. Thus, FpTatD1 and FpTatD2 might play important roles in F. pseudograminearum. RNA-seq analysis was consistent with qRT-PCR results that FpTatD1 and FpTatD2 were highly expressed and up-regulated at early stages of infection. In addition, Compared to the affinity interaction between F. pseudograminearum and GM301, FpTatD genes showed higher expression levels in the non affinity interaction between F. pseudograminearum and ZM24. 【Conclusion】Apoptosis-related gene FpTatD might play an important role in the interaction between F. pseudograminearum and its host.
Key words:Fusarium pseudograminearum; apoptosis; TatD nuclease; gene cloning; expression analysis
收稿日期:2016-03-15;接受日期:2016-04-18
基金项目:国家自然科学基金(30601221)、国家公益性行业(农业)科研专项(201503112)
