从麦胚清蛋白分离制备高活性抗氧化肽
2016-07-18陈思远刘永祥曹小舟张逸婧陈海娟沈新春
陈思远,刘永祥,曹小舟,张逸婧,陈海娟,沈新春
(南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)
从麦胚清蛋白分离制备高活性抗氧化肽
陈思远,刘永祥,曹小舟,张逸婧,陈海娟,沈新春
(南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,南京 210023)
摘要:【目的】探究能有效地从小麦胚芽清蛋白二步双酶酶解物中分离得到高活性抗氧化肽的工艺。【方法】以小麦胚芽清蛋白为原料,DPPH自由基清除率和Fe2+螯合能力为抗氧化活性的评价指标,通过胰蛋白酶进行酶解,依次采用超滤膜和凝胶过滤色谱(Sephadex G-75)对酶解产物进行分离纯化,筛选出活性较高的组分;采用碱性蛋白酶对获得的活性较高组分进行酶解,通过凝胶过滤色谱(Sephadex G-15)和反相高效液相色谱(RP-HPLC)分离纯化其酶解产物;采用质谱技术(ESI-TOF MS/MS)对抗氧化活性最高的组分进行结构鉴定。【结果】分离得到3个活性组分(峰)Pa、Pb、Pc,采用DPPH法和Fe2+螯合能力测定法测定其抗氧化活性的结果都显示,在3个组分中,提取率为23.1%的组分Pb抗氧化活性最强(P<0.05),因此选取组分Pb进行下一步碱性蛋白酶酶解。该酶解物经Sephadex G-15分离后得到Pd和Pe两个组分(峰),经抗氧化活性测定,选取提取率为52.1%的高抗氧化活性组分Pd(P<0.05)进一步通过RP-HPLC进行疏水性分离,得到P1、P2、P3、P4、P5五个活性组分(峰),其中提取率为7.3%的组分P3的抗氧化活性最强(P<0.05),其DPPH自由基清除率和Fe2+螯合能力的EC50值分别为1 mg·mL-1、0.6 mg·mL-1。最后通过质谱技术(ESI-TOF MS/MS)鉴定组分 P3的结构,得到其氨基酸序列为 AREGETVVPG,分子量为1 013.51 Da,纯度约为85%,与用化学方法合成的多肽AREGETVVPG(纯度95%以上)的抗氧化活性相比,结果没有显著差异(P>0.05)。【结论】二步双酶酶解结合超滤膜、凝胶过滤色谱和RP-HPLC等蛋白分离纯化技术为直接得到单一的高活性抗氧化肽提供了技术参考。
关键词:小麦胚芽;清蛋白;二步双酶酶解;分离纯化;抗氧化肽
联系方式:陈思远,E-mail:824170843@qq.com。通信作者沈新春,Tel:13675121836;E-mail:shenxinchun@njue.edu.cn
0 引言
【研究意义】抗氧化肽是一种由氨基酸组成的小分子多肽(大多数少于20个氨基酸),属于一种生物活性肽。与大分子的肽链蛋白质相比,显示出更高的活性,具有清除自由基和抑制脂质过氧化的功能,能够维持人体自由基的平衡,进而提高机体抗衰老、抗疾病的能力。来源于动、植物蛋白的天然抗氧化活性多肽由于低毒、高效等特点,作为食品添加剂(人工抗氧化剂的最优替代品)和保健食品因子应用于食品、医药、饲料等领域,具有广阔的开发前景。【前人研究进展】研究表明,小麦胚芽蛋白[1]及其酶解产物[2]都具有很强的抗氧化活性,且水解能够提高麦胚蛋白的抗氧化活性[3-4]。贾俊强等[5]利用碱性蛋白酶对小麦胚芽中4种蛋白进行酶解比较研究后,发现清蛋白酶解物的抗氧化活性最强,球蛋白最弱。因此,推断麦胚清蛋白中可能蕴藏着一些具有高抗氧化活性的天然多肽序列,以其作为原料制备天然抗氧化肽具有很强的可操作性。目前,制备抗氧化肽的方法主要有化学水解法、酶解法和发酵法[6],其中具有降解位点特异、重复性高的酶解法是最常用的方法,其不足之处是酶解后的组分多,难以分离得到单一的组分。程云辉[7]、DIAO[8]等分别对单酶酶解麦胚蛋白制备抗氧化肽的工艺条件进行了探究和优化,得到了具有清除DPPH自由基和超氧阴离子自由基较强的混合多肽组分。ZHU等[9]利用碱性蛋白酶酶解麦胚蛋白获得抗氧化肽,并采用多种体外方法测定其抗氧化活性,结果表明混合多肽组分具有很强的自由基清除和Fe2+螯合能力。程云辉等[10]对制备麦胚蛋白抗氧化肽的水解用酶进行了系统的筛选后发现,碱性蛋白酶制备的麦胚混合多肽的抗氧化活性最强。这是由于碱性蛋白酶的特异性酶切位点多,水解效率高,更有利于将大分子蛋白水解成小分子的肽。此外,张丽霞等[11]选用碱性蛋白酶和胰蛋白酶对麦胚蛋白进行双酶酶解制备抗氧化肽,结果表明双酶组合的水解度高于单一酶解法,有利于提高肽的转化率。然而,由于水解组分更多,更难以分离纯化筛选出单一的抗氧化肽。胰蛋白酶作为一种限制性消化酶,酶解位点仅为赖氨酸和精氨酸,而且它只作用于暴露在蛋白表面的赖氨酸和精氨酸,而不能水解包裹在蛋白内部的这两种氨基酸,得到的产物是具有不同功能和活性的抗胰蛋白酶结构域或片段[12],由于酶解组分较少,有利于进行初步分离和筛选。因此,本研究选用麦胚清蛋白为原料,有望通过二步双酶酶解法(对麦胚清蛋白的胰蛋白酶酶解物进行初步分离后,筛选出较高抗氧化活性组分再进行碱性蛋白酶酶解)来制备出单一的高抗氧化活性的肽。【本研究切入点】目前的研究多集中在对麦胚蛋白酶解物粗产品的活性测定上[13-14],缺乏对于其构效关系和活性机制等方面的深入阐述,而纯化出单一的组分是解决上述问题的关键和前提。由于酶解后的产物组成十分复杂,可能含有多肽、寡肽、氨基酸甚至小分子蛋白,给肽的分离纯化造成了很大的难度,难以一次性从复杂的酶解物中筛选出具有高抗氧化活性的单一肽段,因此,合理选择水解用酶,并建立可行且有效的、重复性高的蛋白质酶解和纯化体系是十分必要的。【拟解决的关键问题】依据胰蛋白酶和碱性蛋白酶水解特性的不同,通过二步双酶酶解法水解麦胚清蛋白,并结合多种多肽的分离纯化技术,从麦胚清蛋白中筛选出高活性的天然抗氧化肽,以期为抗氧化肽的分离和筛选建立一种行之有效的方法,并为动植物源多肽的抗氧化作用机制的研究奠定基础。
1 材料与方法
试验于 2014年在南京财经大学食品科学与工程学院及江苏省粮油品质控制及深加工技术重点实验室完成。
1.1 材料与试剂
小麦胚芽由江苏省淮安新丰面粉厂提供。
胰蛋白酶,生工生物工程(上海)股份有限公司;碱性蛋白酶Alcalase 2.4 L,丹麦诺维信生物技术有限公司;DPPH,美国Sigama公司;Sephadex G-75、Sephadex G-15,美国GE公司;乙腈、三氟乙酸(TFA),美国BD公司;其他试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
高速万能粉碎机,天津市泰斯特仪器有限公司;电子分析天平,德国赛多利斯公司;SL-N系列电子天平,上海民桥精密科学仪器有限公司;台式恒温振荡器,太仓市强乐实验设备有限公司;生化培养箱,上海一恒科学仪器有限公司;标准型旋转混匀仪,美国赛洛捷克公司;Milli-Q纯水机、Labscale小型切向流超滤系统,默克密理博公司;蛋白纯化系统,上海沪西分析仪器厂有限公司;酶标仪,美国Bio Tek公司;半制备液相仪,美国 Waters公司;Triple TOF 5600+,ABSCIEX公司。
1.3 小麦胚芽清蛋白的制备
1.3.1 脱脂麦胚粉的制备 称取一定质量的小麦胚芽置于具塞锥形瓶中,加入5倍体积的正己烷,在30℃恒温振荡器中振荡脱脂12 h后,换用3倍体积的正己烷继续脱脂12 h。脱脂后的小麦胚芽平铺在托盘中,通风橱中晾干,用高速万能粉碎机粉碎并过100目筛。将脱脂麦胚粉分装,并在4℃下真空密封保存。
1.3.2 麦胚清蛋白的提取 麦胚清蛋白的提取依据OSBOREN[15]分级法,并稍作修改。取一定量的的脱脂麦胚粉,用去离子水按 1∶10(W/V)的料液比混合,并在40℃水浴中搅拌提取1 h,提取液在4℃条件下8 000 r/min离心30 min,取上清液;在上清液中缓慢加入硫酸铵配成饱和度为75%的溶液,在4℃下搅拌2 h使清蛋白盐析沉淀;将上述溶液在4℃条件下13 000 r/min离心30 min,取沉淀;将沉淀透析除盐并冷冻干燥即得到麦胚清蛋白粉。
1.4 麦胚抗氧化肽的制备和分离纯化
1.4.1 胰蛋白酶酶解清蛋白制备抗氧化肽 麦胚清蛋白溶于 0.1 mol·L-1、pH 7.6的磷酸盐缓冲液(KH2PO4-K2HPO4),配制成浓度为1%(W/V)的蛋白溶液,并盛放在50 mL离心管中;加入胰蛋白,加酶量为7 000 U·g-1蛋白;将50 mL离心管固定在旋转混匀仪上,生化培养箱中于37℃反应6 h。反应结束后,在90℃水浴中加热3 min灭酶,冰上冷却,随后在4℃、13 000 r/min离心20 min,弃去沉淀,将上清液在-20℃保存。
1.4.2 超滤膜分离 选用截流分子量为10 KDa的超滤膜对酶解物进行分离。首先,用0.1 mol·L-1的磷酸盐缓冲液将上一步反应制备得到的胰酶酶解物稀释为0.1%(W/V)的溶液,并用0.45 μm的滤膜过滤除去不溶物。将蛋白溶液倒入超滤杯中,调节泵的压力使进口端压力不超过 20 psi,出口端的压力不超过 30 psi,超滤过程在4℃下进行。收集分子量小于10 KDa的滤过液,透析除盐,冷冻干燥,冻干粉在-20℃密封保存。
1.4.3 凝胶过滤色谱分离(Sephadex G-75) 采用交联葡聚糖Sephadex G-75对超滤后的组分进行进一步的分离和纯化。Sephadex G-75干粉用去离子水充分溶胀,利用重力沉降原理装填入25 mm×750 mm层析柱中,去离子水平衡;将1.4.2得到冻干粉溶于去离子水配成浓度为2%(W/V)的溶液,经0.22 μm的滤膜过滤除去颗粒物,上样量为柱体积的 5%;去离子水洗脱,流速为30 mL·h-1,检测波长220 nm,每10 min收集一管洗脱液,依据分离色谱图将洗脱液合并,冷冻干燥,测抗氧化活性。
1.4.4 碱性蛋白酶酶解制备抗氧化肽 胰蛋白酶的酶解物经过两步分离后,取抗氧化活性最高的部分用碱性蛋白酶(Alcalase 2.4 L,酶活力:2.4 AU·mL-1)进行酶解。样品溶于0.1 mol·L-1磷酸盐缓冲液(pH 8.0)配成浓度为3%(W/V)的蛋白溶液,加酶量0.15 AU/g蛋白,在50℃下酶解90 min。酶解过程在生化培养箱中进行,利用旋转混匀仪使酶解物混合均匀。反应结束后,在90℃水浴中加热3 min灭酶,冰上冷却,冷冻干燥,冻干粉在-20℃密封保存。
1.4.5 凝胶过滤色谱分离(Sephadex G-15) 碱性蛋白酶酶解后的产物分子量较小(一般小于1.5 KDa),因此选用排阻体积为1.5 KDa的交联葡聚糖SephadexG-15对其进行分离和纯化。Sephadex G-15干粉用去离子水充分溶胀,利用重力沉降原理装填入15 mm ×600 mm层析柱中,去离子水平衡;碱性蛋白酶水解产物冻干粉溶于去离子水配成质量百分浓度为2%的溶液,经0.22 μm的滤膜过滤除去颗粒物,上样量为柱体积的3%;去离子水洗脱,流速为24 mL·h-1,检测波长220 nm,每10 min收集一管洗脱液,依据分离色谱图将洗脱液合并,冷冻干燥,测其抗氧化活性。
1.4.6 制备型 RP-HPLC分离 取上述纯化步骤中抗氧化活性最高的组分,通过制备型 RP-HPLC,选用Waters XBridgeTMprep C18制备柱(300 Å,5 µm,10 mm×150 mm)进行疏水性分离,分离条件如表 1,检测波长214 nm,柱温25℃。根据分离图谱,对洗脱液进行手动收集,收集后冷冻干燥,并测抗氧化活性。流动相A为含有0.1%(V/V)TFA和5%(V/V)乙腈的去离子水溶液,流动相B为含有0.085%(V/V)TFA和20%(V/V)去离子水的乙腈溶液。
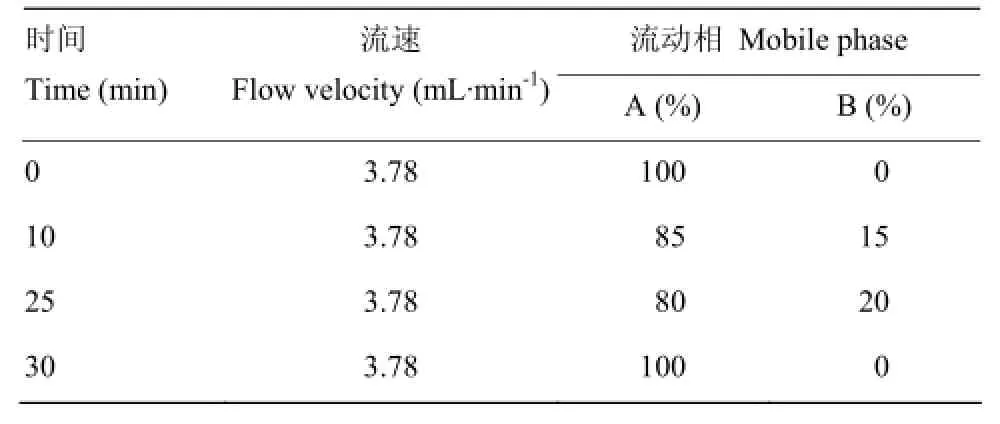
表1 RP-HPLC分离条件Table 1 Separation parameters for RP-HPLC
1.5 体外抗氧化活性测定
DPPH是一种自由基,在溶液中呈现紫色,517 nm下有吸收峰,加入自由基清除剂会使紫色变淡,褪色程度越高表明自由基清除能力越强[16-17]。抗氧化剂具有螯合金属离子的作用,通过测定抗氧化剂对Fe2+螯合能力来表征其活性的高低[18-19]。
1.5.1 DPPH法 准确称量4.6 mg DPPH,用无水乙醇定容到100 mL,配成0.12 mmol·L-1的DPPH溶液,该溶液需避光保存、现用现配。将待测蛋白稀释成不同浓度的溶液,取1 mL蛋白溶液和1 mL DPPH溶液混合均匀,25℃下避光反应30 min,在517 nm波长下测定吸光值。试验需设置空白组(用不含样品的溶液替代样品)、对照组(用无水乙醇替代DPPH溶液)和试验组,每组设置3个平行。DPPH清除率计算公式如下:
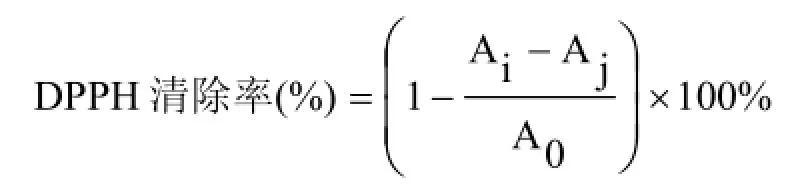
Ai:样品组吸光值,Aj:对照组吸光值,A0:空白组吸光值。
以样品浓度为横坐标,DPPH清除率为纵坐标绘制曲线,求得清除50% DPPH自由基所需样品的浓度,即半数有效浓度,用EC50表示。EC50的数值越小则表示肽的抗氧化活性越强。
1.5.2 Fe2+螯合能力测定法 待测样品溶于去离子水配制成不同浓度的蛋白溶液,FeCl2溶于去离子水配制成2 mmol·L-1的溶液,菲洛嗪溶于30%的乙酸钠配制成5 mmol·L-1的溶液。1.5 mL样品加入25 μL FeCl2溶液室温振荡5 min。加入50 μL菲洛嗪溶液,充分混匀后,室温下反应5 min,在562 nm下测吸光值。试验需设置样品组、样品空白组、对照组和对照空白组,每组3个平行。Fe2+螯合率计算公式如下:

S:样品组,SB:样品空白组,C:对照组,CB:对照空白组。
以样品浓度为横坐标,Fe2+螯合率为纵坐标绘制曲线,求出螯合Fe2+的EC50值。
1.6 抗氧化肽的结构鉴定
采用质谱技术(ESI-TOF MS/MS)对制备型RP-HPLC分离得到的抗氧化活性最高的组分进行结构鉴定。
1.7 数据处理
试验结果采用数据处理软件 SPSS17.0进行Student-t检验和LSD多重比较。
2 结果
2.1 胰蛋白酶酶解产物的分离和抗氧化活性测定
将胰蛋白酶酶解物依次经过超滤膜和 Sephadex G-75分离,得到3个活性组分Pa、Pb、Pc,提取率分别为42.3%、23.1%和12.1%,分离色谱图如图1。分别采用DPPH法(图2)和Fe2+螯合能力测定法(图3)测3个组分的抗氧化活性。由图2和图3可知,两个测定方法的结果一致,Pb的抗氧化活性最强,其次为Pc,Pa的抗氧化活性最弱,3个组分的抗氧化活性差异显著(P<0.05)。因此,选取组分 Pb进行下一步碱性蛋白酶酶解。
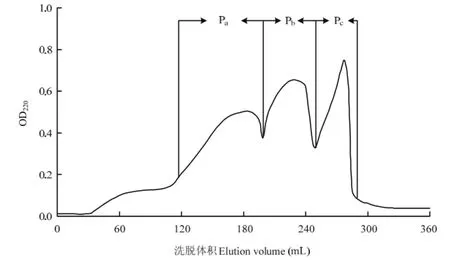
图1 胰蛋白酶酶解物的Sephadex G-75分离色谱图Fig. 1 Chromatogram of tryptic hydrolysates separated by Sephadex G-75
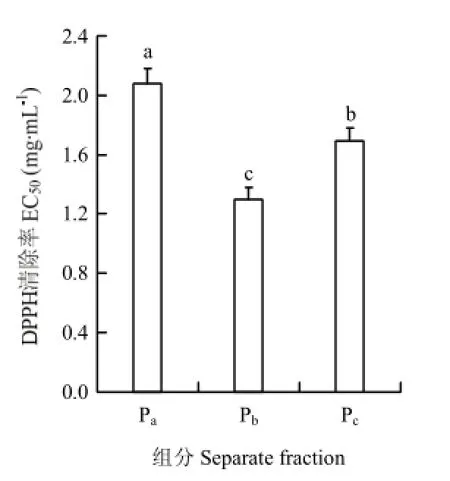
不同字母表示差异显著(P<0.05)。下同Different letters refer to the significant differences (P<0.05). The same as below图2 不同组分的DPPH清除能力Fig. 2 DPPH scavenging activity of different separate fractions

图3 不同组分的Fe2+螯合能力Fig. 3 Fe2+chelating activity of different separate fractions
2.2 碱性蛋白酶酶解产物的分离和抗氧化活性测定
2.2.1 凝胶过滤色谱分离和抗氧化活性测定 Pb经碱性蛋白酶酶解后,其酶解物通过凝胶过滤色谱(Sephadex G-15)分离,得到两个活性组分Pd和Pe,提取率分别为52.1%和27.6%,分离色谱图如图4。通过DPPH法和Fe2+螯合能力测定法测两个组分的抗氧化活性,结果如图5和图6。由测定结果可知Pd的抗氧化活性高于Pe,两者的差异显著(P<0.05)。因此,选取组分Pd进行下一步的RP-HPLC疏水性分离。
2.2.2 制备型RP-HPLC分离和抗氧化活性测定 Pd经过 RP-HPLC疏水性分离,被分成了 P1、P2、P3、P4、P55个峰,如图7所示。5个峰的保留时间分别为P1:11.90—12.17 min,P2:12.28—12.55 min,P3:12.61 —12.88 min,P4:15.04—15.64 min,P5:16.99—17.38 min,其提取率分别为10.2%、6.1%、7.3%、11.3%和5.2%。采用DPPH法和Fe2+螯合能力测定法测5个组分的抗氧化活性,结果如图8和图9。由测定结果可知P3的抗氧化活性最高,P3与其他4个组分的活性差异显著(P<0.05),其 DPPH自由基清除率和 Fe2+螯合能力的EC50值分别为1 mg·mL-1和0.6 mg·mL-1。
综上所述,经过多步分离纯化筛选得到抗氧化活性最高的组分P3,选择其进行结构鉴定以确定其氨基酸序列。
2.3 抗氧化肽的结构鉴定
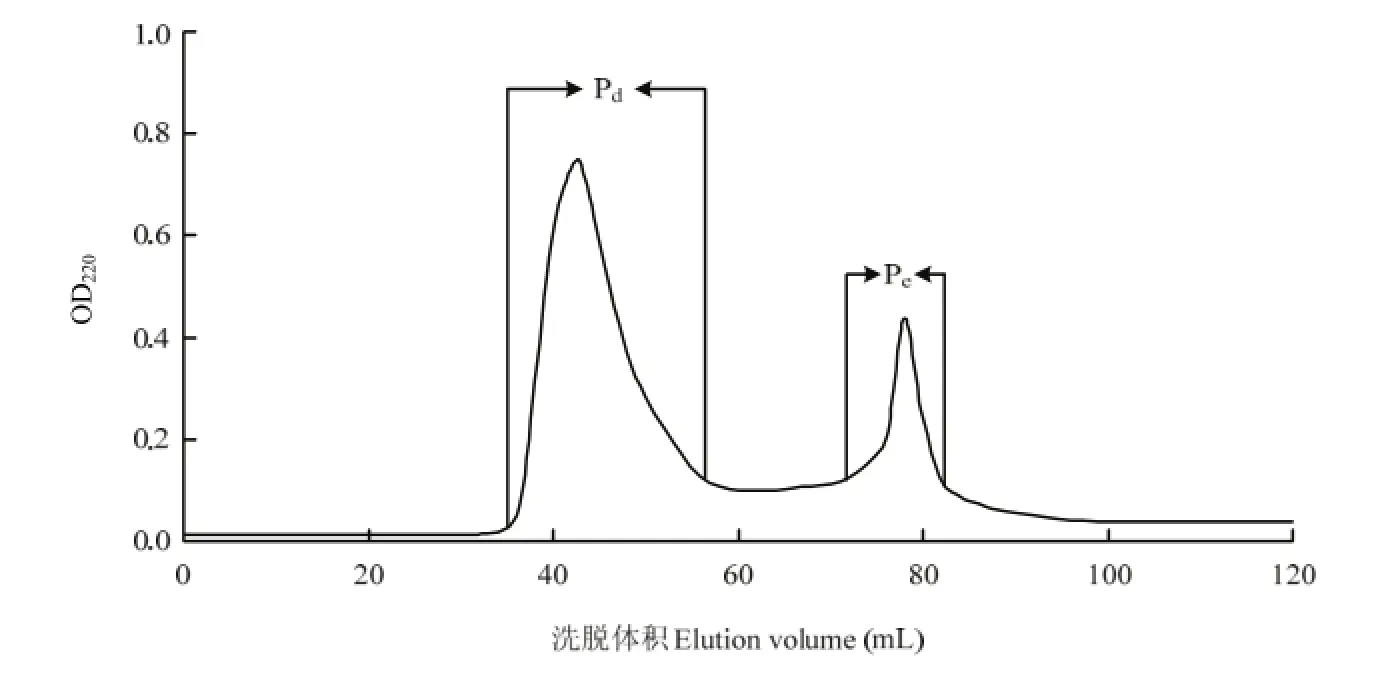
图4 碱性蛋白酶酶解产物的Sephadex G-15分离色谱图Fig. 4 Chromatogram of alcalase hydrolysates separated by Sephadex G-15
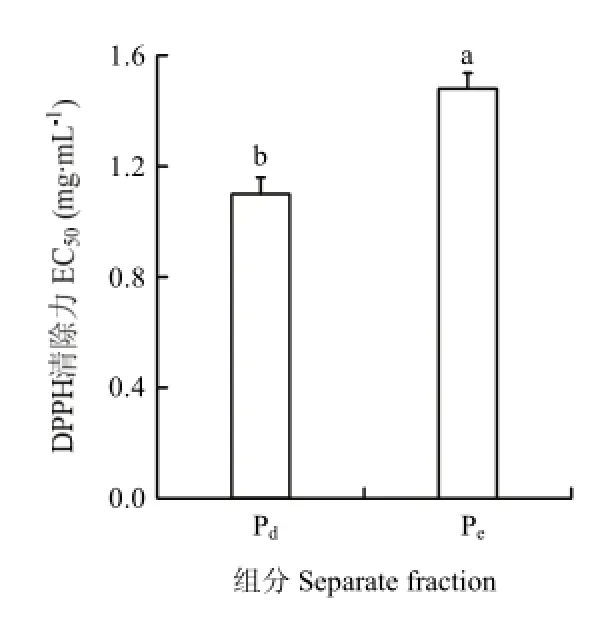
图5 不同组分的DPPH清除能力Fig. 5 DPPH scavenging activity of different separate fractions
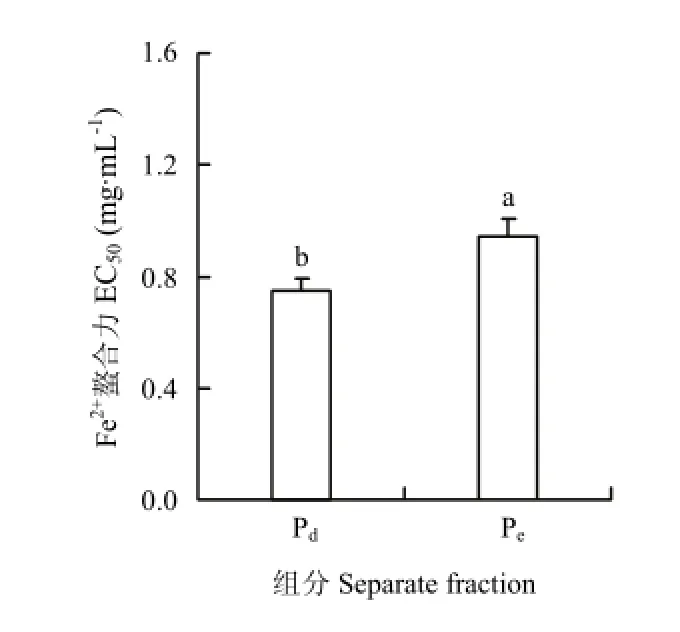
图6 不同组分的Fe2+螯合能力Fig. 6 Fe2+chelating activity of different separate fractions
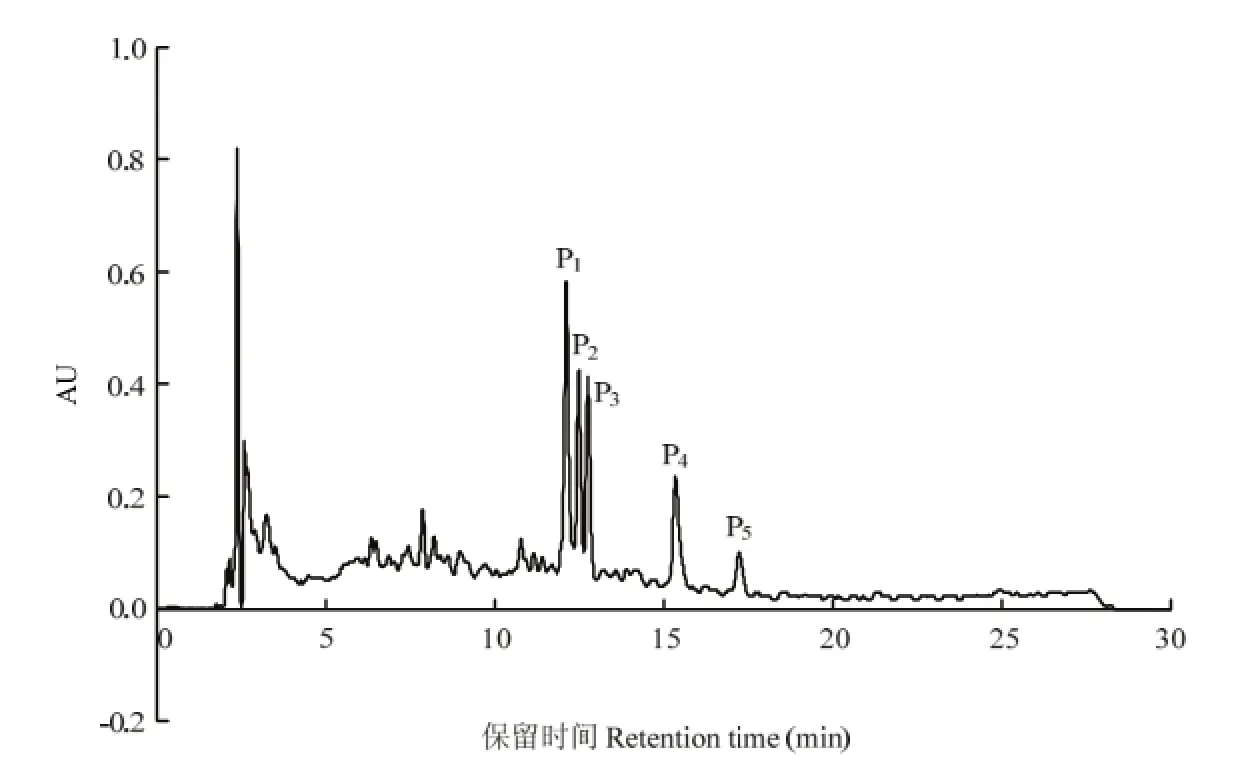
图7 Pd分离液相图Fig. 7 Reversed-phase HPLC profiles of the fraction Pdseparated by Sephadex G-15
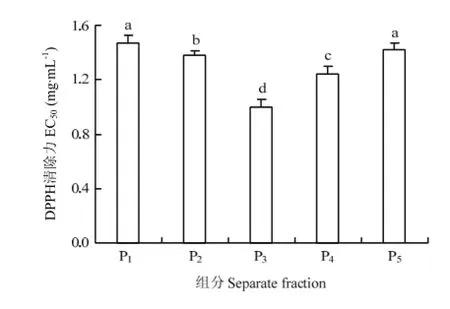
图8 不同组分的DPPH清除能力Fig. 8 DPPH scavenging activity of different separate fractions
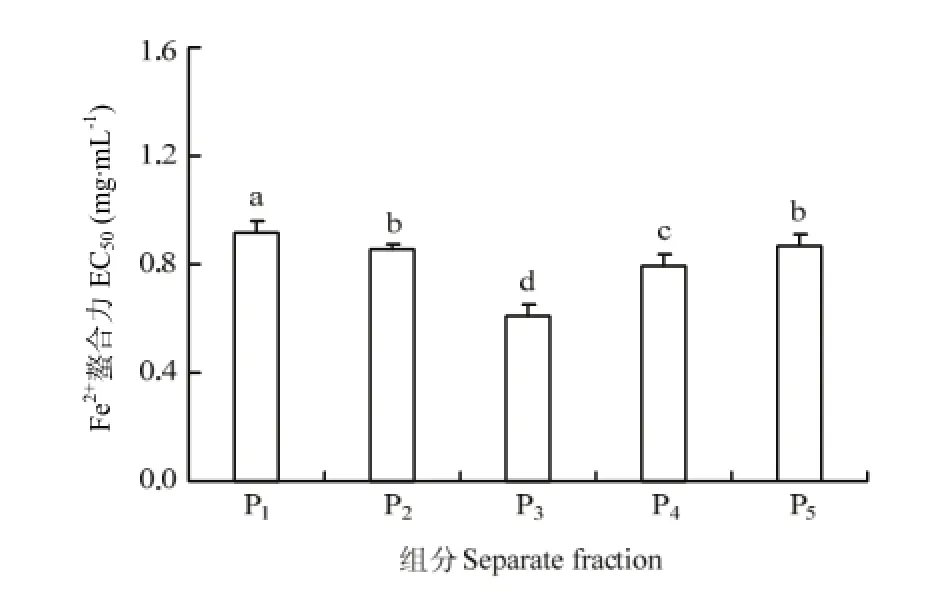
图9 不同组分的Fe2+螯合能力Fig. 9 Fe2+chelating activity of different separate fractions
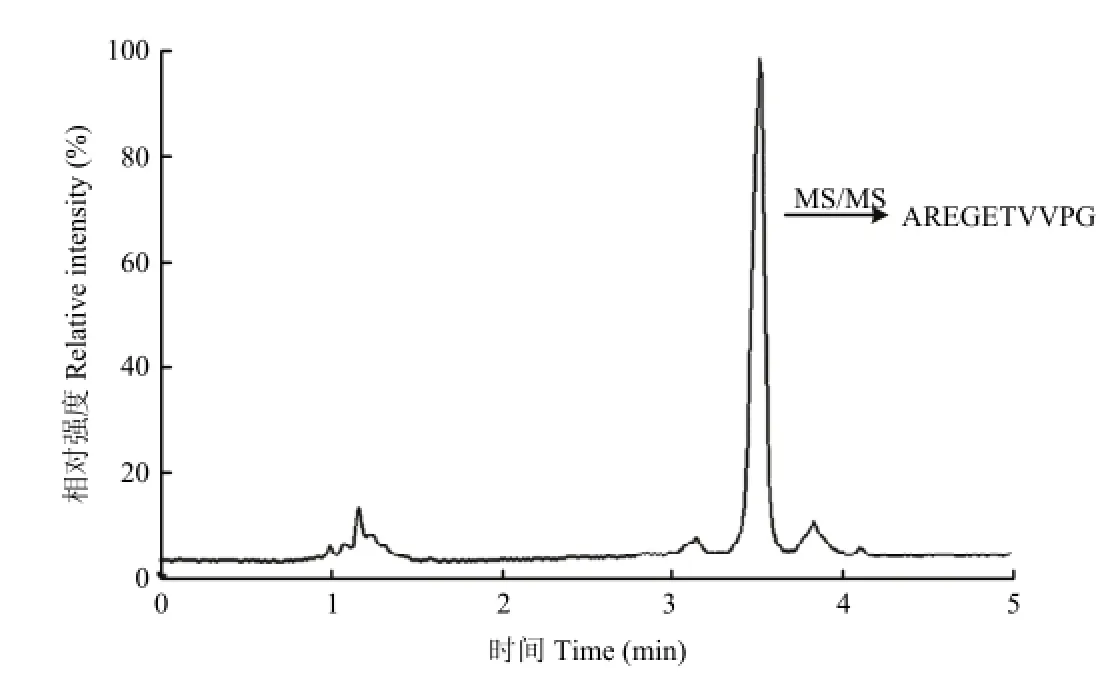
图10 P3样品总离子流图Fig. 10 MS TIC of P3
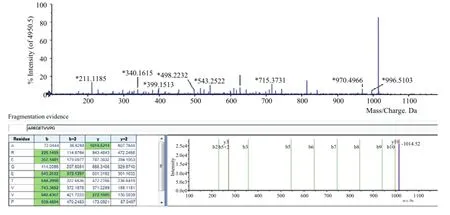
图11 P3样品的二级质谱图Fig. 11 MS/MS spectrum of P3
采用ESI-TOF MS/MS对P3的氨基酸序列进行鉴定。样品首先经由RP-HPLC分离(图10),再利用二级质谱(MS/MS)使多肽碎片化(图11),最后通过软件对分子碎片进行分析。由图10可知经过多步分离纯化后,P3已达到了较高的纯度(约为85%),组成相对单一。经测定,其氨基酸序列可能为RAEGETVVPG或者AREGETVVPG,通过与蛋白质数据库中的信息进行比对,确定其氨基酸序列为AREGETVVPG。此外,通过化学方法合成纯度在95%以上的多肽序列AREGETVVPG,对其体外抗氧化活性进行了测定。P3的抗氧化活性与用化学方法合成的多肽AREGETVVPG(纯度95%以上)相比,没有显著差异(P>0.05)。
3 讨论
酶解法制备抗氧化肽具有水解位点特异、重复性高的特点,然而传统的双酶酶解工艺仍然由于酶解后的组分多,难以从麦胚蛋白中分离纯化制备单一的抗氧化肽。本研究首先采用酶解位点少且具有限制性消化特性的胰蛋白酶酶解麦胚清蛋白,其水解物组分相对较少,然后经过超滤膜初步分级筛选,去除低抗氧化活性的大分子蛋白多肽,将较高抗氧化活性的小分子蛋白多肽经Sephadex G-75分离得到3个组分(峰)。选取抗氧化活性高的组分进行第二步碱性蛋白酶(酶解位点多、水解效率高)酶解得到小分子多肽,其酶解产物经Sephadex G-15和RP-HPLC分离筛选出纯度较高、相对单一的抗氧化活性肽。因此,本研究采用的二步双酶酶解结合超滤膜、凝胶过滤色谱和RP-HPLC等蛋白分离纯化技术为直接得到单一的高活性抗氧化肽提供了一种有效的工艺流程。
在前期研究中,根据蛋白质的分子量、离子特性、亲和性和疏水性等不同的性质,采用多种分离纯化手段对酶解物进行逐级分离筛选,在制备出较高活性、相对较少的多肽混合组分基础上,通过质谱鉴定出具有不同抗氧化活性肽[20-21]。SUETSUNA等[20]就利用凝胶过滤色谱 Sephadex G-25、阳离子交换色谱SP-Sephadex C-25和RP-HPLC从酪蛋白中分离得到了具有不同自由基清除活性的混合多肽组分,并进行质谱鉴定出强自由基清除活性的多肽序列YFYPEL;PARK等[21]分别采用超滤膜、SP-Sephadex C-25、Sephadex G-25和HPLC从狭鳕的酶解物中分离得到了相对较少的混合多肽组分,通过质谱鉴定出分子量为672 Da的抗氧化肽LPHSGY。但是,传统的酶解分离纯化工艺流程最终只能获得相对较少的混合多肽组分,而本研究的工艺流程则能直接制备出纯度较高、相对单一的抗氧化活性肽组分。
肽的抗氧化活性与肽的氨基酸种类、数量和排序有关。许多已分离出的抗氧化肽中含有疏水性氨基酸,例如CHEN等[22]从大豆蛋白中分离得到的6种抗氧化肽,其N-端都为疏水性氨基酸,AREGETVVPG中有疏水性氨基酸Ala(A)、Val(V)和Pro(P),这3种氨基酸对于抗氧化肽的活性可能发挥着重要的作用,尚需进一步验证。此外,肽的抗氧化作用也与肽的构象、序列有关,与抗氧化肽含有同等氨基酸量的混合物与肽的活性进行比较后发现,肽的抗氧化活性更强,这就说明构象和氨基酸的排序对肽的活性有影响[23]。从猪肌原纤维蛋白中分离得到的肽IEAEGE具有很强的自由基清除活性和金属离子螯合能力[24],与麦胚抗氧化肽AREGETVVPG具有相同的氨基酸序列EGE;从海洋轮虫(Brachionus rotundiformis)中分离出的抗氧化肽LLGPGLTNHA和DLGLGLPGAH[25]均含有与麦胚抗氧化肽AREGETVVPG相同的序列PG。因此,推断EGE和PG可能是具有抗氧化活性的特征序列,而AREGETVVPG的抗氧化活性高于上述肽,本研究的序列中有可能还含其他特征片段或是由于这些特征片段的综合作用,但尚需进一步的研究和验证。另外,采用细胞实验和动物实验还需进一步的验证AREGETVVPG的体内抗氧化活性,并对其抗氧化作用机制进行阐释。
4 结论
建立了从小麦胚芽清蛋白中有效地分离纯化抗氧化肽的工艺流程。用胰蛋白酶限制性消化小麦胚芽清蛋白,获得的组分相对较少,易于用超滤膜和凝胶过滤色谱Sephadex G-75进行初步的筛选分离。继而采用碱性蛋白酶Alcalase 2.4 L酶解上一步的抗氧化活性较高的分离产物可获得活性更高的小分子肽,并通过凝胶过滤色谱Sephadex G-15和RP-HPLC分离纯化得到纯度较高、相对单一的 5个组分,对其中抗氧化活性最强的组分进行结构鉴定,确定其氨基酸序列为 AREGETVVPG,分子量为 1 013.51 Da。该抗氧化肽的DPPH自由基清除率和Fe2+螯合能力的EC50值分别为1 mg·mL-1和0.6 mg·mL-1,表明该抗氧化肽具有很强的抗氧化活性。综上所述,本研究的二步双酶酶解结合 3种蛋白分离纯化技术的方法为直接得到单一的高活性抗氧化肽提供了一种有效的工艺参考。
致谢:本论文在撰写过程中承蒙周建新教授的帮助,谨致谢意!
References
[1] 孙婕, 尹国友, 刘文霞, 王利枝, 王巧, 郑高攀. 小麦麦胚蛋白提取工艺及抗氧化活性初探. 粮食与饲料工业, 2014 (3): 26-29. SUN J, YIN G L, LIU W X, WANG L Z, WANG Q, ZHENG G P. Extraction process and antioxidant activity of wheat germ protein. Cereal & Feed Industry, 2014 (3): 26-29. (in Chinese)
[2] 殷微微. 麦胚蛋白提取及其酶解产物抗氧化活性研究[D]. 大庆:黑龙江八一农垦大学, 2008. YIN W W. Study on the extraction of wheat germ protein and their antioxidant activity of enzymolysis product [D]. Daqing: Heilongjiang Bayi Agricultural University, 2008. (in Chinese)
[3] 朱志方. 麦胚蛋白的酶法制备及功能特性研究[D]. 郑州: 河南工业大学, 2011. ZHU Z F. The study on extraction and properties of hulless barley protein [D]. Zhengzhou: Henan University of Technology, 2011. (in Chinese)
[4] 张丽萍, 毛晶晶, 刁静静, 王雪. 麦胚蛋白水解物抗氧化活性及其作用模式. 中国粮油学报, 2012, 27(6): 14-19. ZHANG L P, MAO J J, DIAO J J, WANG X. Study on antioxidant and mechanism of wheat germ hydrolysates. Journal of the Chinese Cereals and Oils Association, 2012, 27(6): 14-19. (in Chinese)
[5] 贾俊强, 马海乐, 赵伟睿, 王振斌, 何荣海, 骆琳. 小麦胚芽蛋白组分酶解物降血压和抗氧化作用. 营养学报, 2010, 32(1): 55-59. JIA J Q, MA H L, ZHAO W R, WANG Z B, HE R H, LUO L. Study on the antihypertensive and antioxidant properties of wheat germ protein fractions hydrolysates. Acta Nutrimenta Sinica, 2010, 32(1):55-59. (in Chinese)
[6] NIU L Y, JIANG S T, PAN L J. Preparation and evaluation of antioxidant activities of peptides obtained from defatted wheat germ by fermentation. Journal of Food Science and Technology, 2013,50(1): 53-61.
[7] 程云辉, 王璋, 许时婴. 酶解麦胚蛋白制备抗氧化肽的研究. 食品科学, 2006, 27(6): 147-151. CHENG Y H, Wang Z, Xu S Y. Preparation of antioxidant peptide from wheat germ protein by enzymatic hydrolysis. Food Science,2006, 27(6): 147-151. (in Chinese)
[8] DIAO D P, HUANG J H, FENG J W, HOU Y C, HUI M, YOU Q Q,SU X F, WANG W, YANG M Q. The technology research of anti-oxidation peptide preparation by alkaline protease hydrolyzing wheat germ meal. Agricultural Science & Technology, 2014, 15(2):182-186.
[9] ZHU K X, ZHOU H M, QIAN H F. Antioxidant and free radical-scavenging activities of wheat germ protein hydrolysates(WGPH) prepared with alcalase. Process Biochemistry, 2006, 41:1296-1302.
[10] 程云辉, 文新华, 王璋. 麦胚抗氧化肽水解用酶的筛选研究. 中国粮油学报, 2007, 22(3): 29-33. CHENG Y H, WEN X H, WANG Z. Selection of protease for preparing antioxidant peptides from wheat germ protein. Journal of the Chinese Cereals and Oils Association. 2007, 22(3): 29-33. (in Chinese)
[11] 张丽霞, 顾振新, 周剑忠, 刘红锦, 黄开红, 龚小峰. 双酶水解麦胚制备抗氧化肽的工艺优化. 江苏农业学报, 2010, 26(3): 601-606. ZHANG L X, GU Z X, ZHOU J Z, LIU H J, HUANG K H, GONG X F. Optimization of preparation of wheat germ antioxidant peptides with two enzymes. Jiangsu Journal of Agricultural Sciences, 2010,26(3): 601-606. (in Chinese)
[12] SHEN X C, CHEN S Y, GE H. Combinatory use of cell-free protein expression, limited proteolysis and mass spectrometry for the high-throughput domain boundary identification. Biochemical and Biophysical Research Communications, 2014, 444(4): 480-484.
[13] 郭旭, 朱科学, 郭晓娜, 周惠明. 麦胚蛋白酶解产物对过氧化氢诱导PC12细胞损伤的抗氧化作用. 油料蛋白, 2013, 38(11): 18-22. GUO X, ZHU K X, GUO X N, ZHOU H M. Antioxidant effects of wheat germ protein isolate hydrolysates against H2O2-induced oxidative stress in PC12 cells. China Oils and Fats, 2013, 38(11):18-22. (in Chinese)
[14] 王丹丹, 胡蓉. 脱脂小麦胚芽酶解及其水解物抗氧化性研究. 现代面粉工业, 2009, 23(5): 44-47. WANG D D, HU R. Study on enzymatic hydrolysis of wheat germ and antioxidant activity of hydrolysate. Modern Flour Milling Industry, 2009, 23(5): 44-47. (in Chinese)
[15] OSBORNE T B. The Vegetable Proteins. 2nd ed. London: Longmans Green and Co., 1924: 154.
[16] SHIMADA K, FUJIKAWA K, YAHARA K, NAKAMURA T. Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion. Journal of Agricultural and Food Chemistry,1992, 40(6): 945-948.
[17] DUAN X J, ZHANG W W, LI X M, WANG B G. Evaluation of antioxidant property of extract and fractions obtained from a red alga,Polysiphonia urceolata. Food Chemistry, 2006, 95(1): 37-43.
[18] HATAMI T, EMAMI S A, MIRAGHAEE S S, MOJARRABA M. Total phenolic contents and antioxidant activities of different extracts and fractions from the aerial parts of Artemisia biennis willd. Iranian Journal of Pharmaceutical Research, 2014, 13(2): 551-558.
[19] He R, Ju X, Yuan J, Wang L F, Girgih A T, Aluko R E. Antioxidantactivities of rapeseed peptides produced by solid state fermentation. Food Research International, 2012, 49(1): 432-438.
[20] SUETSUNA K, UKEDA H, OCHI H. Isolation and characterization of free radical scavenging activities peptides derived from casein. Journal of Nutritional Biochemistry, 2000, 11(3): 128-131.
[21] PARK P J, JE J Y, KIM S K. Antioxidant activity of a peptide isolated from Alaska pollack (Theragra chalcogramma) frame protein hydrolysate. Food Research International, 2005, 38(1): 45-50.
[22] CHEN H, MURAMOTO K, YAMAUCHI F. Structural analysis of antioxidative peptides from soybean β-conglycinin. Journal of Agricultural and Food Chemistry, 1995, 43(3): 574-578.
[23] TONG L M, SASAKI S, MCCLEMENTS D J, DECKER E A. Mechanisms of the antioxidant activity of a high molecular weight fraction of whey. Journal of Agricultural and Food Chemistry, 2000,48(5): 1473-1478.
[24] SAIGA A, TANABE S, NISHIMURA T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment. Journal of Agricultural and Food Chemistry, 2003, 51(12):3661-3667.
[25] BYUN H, LEE J K, PARK H G, JEON J K, KIM S K. Antioxidant peptides isolated from the marine rotifer (Brachionus rotundiformis). Process Biochemistry, 2009, 44(8): 842-846.
(责任编辑 赵伶俐)
The Preparation Process for Isolation of a Highly Active Antioxidant Peptide Derived from Wheat Germ Albumin
CHEN Si-yuan, LIU Yong-xiang, CAO Xiao-zhou, ZHANG Yi-jing, CHEN Hai-juan, SHEN Xin-chun
(College of Food Science and Engineering, Nanjing University of Finance and Economics/Collaborative Innovation Center for Modern Grain Circulation and Safety/Key Laboratory of Grains and Oils Quality Control and Processing, Nanjing 210023)
Abstract:【Objective】 The aim of this study is to develop an effective preparation process for obtaining highly active antioxidant peptide derived from wheat germ albumin using two-step dual-enzymatic hydrolysis. 【Method】 A two-step dual-enzymatic hydrolysis and separation were employed to screen the antioxidant peptide (AOP) from wheat germ albumin. The in vitro AOP's antioxidant activity was evaluated by DPPH radical scavenging activity and Fe2+chelating ability assays. The hydrolysate derived from tryptic hydrolysis of wheat germ albumin was fractionated by ultrafiltration according to molecular weight;then the fractions with high antioxidant capacity were further isolated by gel filtration chromatography (Sephadex G-75). After that,the fraction with higher antioxidant activity was further hydrolyzed by an alcalase, and the hydrolysate was subjected to purification by Sephadex G-15 gel filtration chromatography and reversed-phase HPLC (RP-HPLC), respectively. The highest antioxidant fraction was achieved and the structure was identified by ESI-TOF MS/MS. 【Result】 Hydrolysate derived from tryptic hydrolysisof wheat germ albumin was fractionated by ultrafiltration according to molecular weight. Three fractions, Pa, Pband Pcwere obtained from the fraction with high antioxidant capacity. The fraction Pbshowed the strongest antioxidant activity evaluated by DPPH radical scavenging activity and Fe2+chelating ability assays and its extraction yield was 23.1%. The fraction Pbwhich had the highest antioxidant activity was further hydrolyzed by an alcalase, and the hydrolysate was subjected to gel filtration chromatography (Sephadex G-15) and two more groups, Pdand Pewere obtained. The extraction yield of fraction Pdwhich had higher antioxidant capacity was 52.1%. After further purification by RP-HPLC, five fractions, P1, P2, P3, P4and P5were separated from the fraction Pd,and the fraction P3exhibited the highest antioxidant activity with the in vitro EC50values of DPPH radical scavenging activity at 1 mg/ml and Fe2+chelating ability at 0.6 mg/ml, respectively. The extraction yield of the fraction P3was 7.3% in RP-HPLC step. Finally, employing the electrospray ionization-time-of-flight mass spectrometer (ESI-TOF MS/MS), the structure of the fraction P3was identified. Its amino acids sequence, molecular weight and purity were AREGETVVPG, 1013.51Da and 85%, respectively. Consistently, the antioxidant capacity of the synthetic peptide with the same sequences ( purity ≥95%) showed the similar activity to the fraction P3(P>0.05). 【Conclusion】 The preparation process of a two-step dual-enzymatic hydrolysis in combination with ultrafiltration, gel filtration chromatography, and RP-HPLC was effective in separation, screen and purification of a highly active antioxidant peptide.
Key words:wheat germ; albumin; a two-step dual-enzymatic hydrolysis; separation and purification; antioxidant peptide (AOP)
收稿日期:2015-11-03;接受日期:2016-03-02
基金项目:国家自然科学基金(31271983)、江苏省高校自然科学研究重大项目(14KJA550002)、2014年度江苏省高校第四期“333工程”资助科研项目、2015年度江苏省高校优秀科技创新团队项目、江苏高校优势学科建设工程资助项目
