酱香大曲中产香细菌HMZ-D的分离鉴定及GC-MS产物分析
2016-07-15杨国华刘洪波周剑丽邱树毅贵州省轻工业科学研究所贵州贵阳550007贵州理工学院贵州贵阳550005贵州医科大学附属医院贵州贵阳550005贵州大学酿酒与食品工程学院贵州贵阳55005
杨国华,刘洪波,周剑丽,邹 雪,邱树毅,黄 平,姜 螢(.贵州省轻工业科学研究所,贵州贵阳550007;.贵州理工学院,贵州贵阳550005;.贵州医科大学附属医院,贵州贵阳550005;.贵州大学酿酒与食品工程学院,贵州贵阳55005)
酱香大曲中产香细菌HMZ-D的分离鉴定及GC-MS产物分析
杨国华1,刘洪波1,周剑丽2,邹雪3,邱树毅4,黄平1,姜螢1
(1.贵州省轻工业科学研究所,贵州贵阳550007;2.贵州理工学院,贵州贵阳550005;3.贵州医科大学附属医院,贵州贵阳550005;4.贵州大学酿酒与食品工程学院,贵州贵阳550025)
摘要:从茅台镇当地酱香酒厂中筛选出2种酱香高温大曲,通过细菌培养基平板划线分离菌株,再以闻香记录、蛋白酶测定、发酵液酸酯分析为依据,筛选出1株放香好、蛋白酶活力高、酸酯含量较优的菌株HMZ-D,对该菌株进行相关实验分析。结果表明,菌株HMZ-D最适生长温度为30℃,最适生长pH值为7;菌株HMZ-D的固态、液态发酵粗酶液蛋白酶酶活具有不同的最适温度及pH值,金属离子对其的促进及抑制作用也各异;HMZ-D菌株在两种发酵方式下所得产物种类较为相似,但液态发酵所产各化合物含量及各类物质总量要低于固态发酵,从含量上看具有一系列主要特征性产物;通过鉴定,菌株HMZ-D归属为巨大芽孢杆菌。
关键词:微生物;酱香大曲;产香细菌;分离筛选;鉴定;GC-MS分析
优先数字出版时间:2016-04-25;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160425.1448.016.html。
酱香型白酒素以“微黄透明、酱香突出、幽雅细腻、酒体醇厚、回味悠长、空杯留香持久”的特点而驰名中外。20世纪60年代起,我国的科研工作者们就开始对酱香型白酒的典型代表——茅台酒的各个生产环节进行研究,以期找到其经验式的传统生产工艺与生物、化学、物理等多门科学之间的深层联系。这一方面可为我国传统白酒打下坚实的科学基础,另一方面也可利用科技指导生产,为行业内的创新技术能够成功实践铺平道路。
本课题组从酱香大曲中分离筛选产酱香菌株,并进行相关研究,已取得一定研究成果[1-2]。现从菌株的分离筛选、鉴定、GC-MS产物含量分析的角度来详细介绍整个实验过程,以期为相关研究的开展提供参考与借鉴。
1材料与方法
1.1材料、试剂及仪器
1.1.1菌种分离材料
本研究实验所用菌株分离材料——酱香高温大曲是在仁怀茅台镇2家酱香酒生产企业的种曲车间选取的,选择标准见表1。

表1实验大曲选择标准
按上述标准根据对应厂家日常理化指标鉴定结果,得到代号分别为HMZ、GZL的2种高温大曲。将曲样用封口胶袋密封,保存于4℃的冰箱中备用,另外,为使在室内得到的实验结果尽可能与实际生产相符合,所用高粱、小麦、麸皮皆为厂家提供。
培养基:平板分离培养基、斜面培养基、液体培养基、固体发酵培养基、液体发酵培养基,按参考文献[1]、[2]中的方法进行配制[1-2]。
1.1.2试剂
实验试剂按表2所示进行准备。
1.1.3仪器设备
本实验所需仪器设备见表3。
1.2实验方法
1.2.1产酱香细菌的分离筛选
初筛:将挑选的HMZ、GZL 2种大曲分别粉碎成粉末状,于无菌水中混匀,30℃水浴中活化30min,取出;按梯度稀释涂布划线法进行菌株的筛选,挑取形态有差异的单菌落于斜面试管上以37℃培养24h,编号,4℃保藏;将各所得试管菌株接入液态培养基中37℃培养24h得到各菌的液态培养液;将其各自按10%接种量接入固态发酵培养基中进行培养发酵,培养方式为37℃恒温培养,每天取出,闻香,记录每天的香味变化情况,综合选出感官评价较高的菌株。

表2主要实验试剂及药品
复筛:根据闻香、蛋白酶活力,结合固态发酵酸酯含量测定结果,筛选出1株香味佳、酶活高、酸酯含量较高的菌株。
1.2.2发酵粗酶液的制备[3]
固态发酵粗酶液制取(5%酶液):称取发酵醅1 g于20mL醋酸钠溶液中。40℃水浴浸出30min,4000r/min离心,滤纸过滤,即为所得酶液(每株菌做3个重复实验,取平均值)。

表3主要实验仪器设备

表4 37℃下闻香结果
液态发酵粗酶液制取(5%酶液):将10%接种量的液体发酵培养基以200r/min培养,各取2d、4d、6d发酵液,4000r/min离心10min后,取上清液即是所需的粗酶液,于4℃冰箱中保存待用(每株菌做3个重复实验,取平均值)。
1.2.3测定方法
根据参考文献[2]及《酿酒分析与检测》[3]的实验方法,对发酵粗酶液的蛋白酶、总酸、总酯等进行测定。1.2.4目标菌株的鉴定
1.2.4.1不同温度、pH值下生长曲线绘制
温度:将HMZ-D菌株接入液体培养基中,选取培养温度分别为20℃、30℃、40℃、50℃、60℃,使用分光光度计(波长520nm)测定培养液的OD值,每隔2h测1次直至60h为止;以培养时间为横坐标、吸光度为纵坐标,绘制生长曲线。
pH值:将所HMZ-D菌株接入液体培养基中,调节pH值分别为5、6、7、8、9,使用分光光度计(波长520nm)测定培养液的OD值,每隔2h测1次直至60h为止;以培养时间为横坐标、吸光度为纵坐标,绘制生长曲线。
1.2.4.2显微形态观察
采用稀释涂布平板法对目标菌株进行菌落形态观察,再依据《微生物学实验教程》[9]作革兰氏染色及芽孢染色,以便在显微镜下观察其形态。
1.2.4.3生理生化实验
按《伯杰细菌鉴定手册》[4]及《常见细菌系统鉴定手册》[5]对目标菌作生理生化鉴定,分别考察了其革兰氏染色、触酶、VP反应等14个实验。
1.2.4.4分子生物学水平鉴定
由生工生物工程(上海)股份有限公司完成。
1.2.5粗酶液酶活变化研究
对目标菌株在1.2.2方法下所制得纯种发酵粗酶液,在不同温度、pH值、乙醇浓度、金属离子下的变化进行了研究,并且对其稳定性进行了分析测定。
1.2.6 GC-MS产物分析
参考文献按[2]、[6]中方法进行。
2结果与分析
2.1菌株分离筛选
2.1.1发酵闻香结果
从HMZ与GZL两个大曲中共分离出21株菌株,转于斜面培养基中4℃下保存。通过模拟固态发酵感官闻香比较,选出8株产酱香较明显菌株,对其进行编号,闻香结果见表4。
从表4结果来看,在37℃的较高温度下,8株菌种中大多数都能产生较易辨别的酱香味,而且随着发酵时间的延长,酱香味更浓,其他的邪杂、异味也逐渐消退。结合实际生产来看,在“高温堆积”的过程中发酵时间往往不是固定的,短则只要3~4d,多则7~8d。这和四季变更及当地气候变化有很大的关系。一般情况下,蒸好的粮食经摊晾、拌曲,再掀盖成堆子,随着时间的延长,拌入曲子和周围环境中所富集的微生物会大量进行繁殖代谢生长,在生成很多香味前体物质的同时也释放出热量,这样就会使得堆子内部温度升高。一般车间实际生产会根据相关的指标来判断是否到了该下窖的时候,如手感、气味、温度等,只要达到标准即可下窖。在以上闻香结果中,多数菌株都有酱香味,但味道有明显的区别,有些酱香风味淡寡,且还有异味;有些较为醇厚、纯正,且风味上佳,使人愉悦。
2.1.2菌株发酵测定分析
2.1.2.1蛋白酶测定
按1.2.4方法对初筛所选的8株产酱香菌株的蛋白酶进行测定,结果见图1。

图1蛋白酶活力测定结果
由图1可知,HMZ-D的蛋白酶活力明显高于其余菌株。因酱香酒在贮存的过程中其酸酯含量较多,且酯含量大于酸,下一步根据以上各菌株产香情况和蛋白酶活力的高低,选出3株菌:HMZ-D、GZL-Y、GZL-Z,作发酵清液的酸酯含量测定。
2.1.2.2总酸、总酯测定
根据1.2.4的方法取与蛋白酶测定时一样的发酵时间,测定发酵清液的酸酯含量,结果见表5。
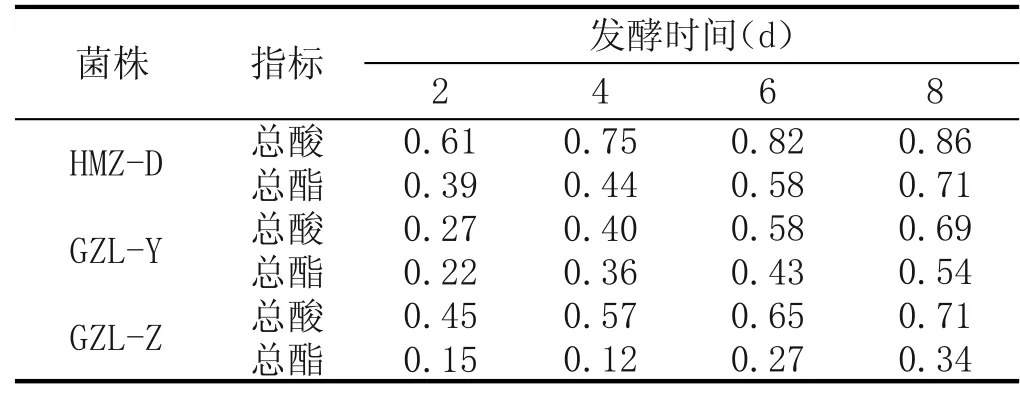
表5 3株菌发酵清液酸酯含量测定 (g/L)
从表5结果来看,HMZ-D的蛋白酶活力最高,对应的总酸、总酯含量也明显高于GZL-Y、GZL-Z;3株菌的酸酯含量皆随时间的延长而逐渐升高,这表明所接菌种对发酵醅起到明显的分解代谢作用;GZL-Y、GZL-Z 2株菌的蛋白酶活力稍低,而对应的酸酯含量也较低。结合此3株菌的感官闻香、酶活力测定、酸酯含量推断:所分离筛选出的细菌蛋白酶活力较高,对应的酸酯含量也较高,而后者又是白酒中主要香味成分,所以从菌株产蛋白酶作用原料方面入手来研究酱香的主体风味物质具有一定的可行性。
综合以上实验数据,选定HMZ-D为后续实验的研究目标菌株。
2.2HMZ-D发酵粗酶液酶活变化研究
2.2.1温度
在按1.2.2方法得到粗酶液后,选取25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃水浴温度对酶液活化5min,而后测定其酶活(图2)。

图2酶活随温度变化
由图2可知,2种方式发酵下的酶活在35~40℃之间有最大值,其最适酶活温度也在此范围。另外,高温所导致的酶失活程度明显高于低温下,这实际上是一个物理化学现象:高温意味着剧烈的热运动,低温反之;热运动过强就会破坏分子结构,对于蛋白质来说,也就是失去了活性的基础。低温不破坏蛋白质分子结构并不能让蛋白质失活,而是通过降低热运动来减缓反应速率,不仅是对于酶,有些物化、生化反应也是如此。
2.2.2 pH值
取pH值为2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0的乳酸-乳酸钠缓冲液配制的20 g/L酪蛋白作为底物,以此测定液态发酵蛋白酶;对于固态发酵醅,则用以上缓冲液进行提取测定(图3)。
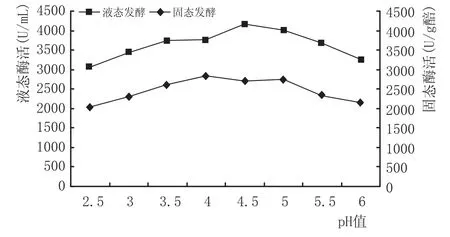
图3酶活随pH值变化
由图3可知,在酸性条件下,固液酶活都较高,初步说明此蛋白酶是酸性酶。其中固、液酶活最适pH值分别为4、4.5;并不是酸度越高就越适于酶活升高,相反当体系的pH值开始降低至2.5时,酶活力有明显的下降,同时在pH值靠近中性时,酶活力也会下降。pH值过高或过低一方面会改变酶的构象致使其失活,一方面也会影响底物分解及其与酶的结合能力,从而导致活力降低[10]。
2.2.3乙醇浓度
选用无水乙醇(分析纯),用蒸馏水配制3%vol、3.5%vol、4.0%vol、4.5%vol、5.0%vol、5.5%vol、6.0%vol的乙醇-水溶液替代缓冲液对发酵醅进行酶液提取;对于液态发酵酶液则直接按体积比向酶液中添加乙醇,以此测定(图4)。

图4酶活随乙醇浓度变化
由图4可看出,2种发酵状态的酶活皆随着乙醇浓度的提升而呈现下降趋势,在达到一定值(4.5%vol)时趋于平稳。总体来说,乙醇的加入对酶活起到抑制作用。
2.2.4热稳定性
将所得酶液置于80℃高温下,对于固态(发酵醅先经保温处理再提粗酶液)、液态分别选取不同的保温时间(固态:1min、2min、3min、4min、5min、6min、7min、8min、9min、10min;液态:10s、20s、30s、40s、50s、60s、70s、80、90s)对酶活进行测定,其中对液态发酵的测定是以80℃水浴保温处理。以不经保温的为对照,考察其在高温下随时间的酶稳定性,结果以与未热处理的对照相比所得的酶活降低百分数表示,见图5。

图5 80℃下粗酶液发酵酶活热稳定变化曲线
由图5看出,在80℃下,酶迅速失活,最低可达到初始酶活的25%左右。其中,液态酶活下降速率明显远高于固态,可能是由于水浴加热导致体系更容易接收热量,使酶受到高热的作用而迅速失活。
2.2.5金属离子
配制1.5 mmol/L的KCl、CaCl2、FeCl3、MgSO4、Zn-SO4、CuSO4溶液对发酵醅进行提取粗酶液,测定;对于液态发酵酶液,则直接按此浓度添加药品,再测定。以未添加药品的为对照,以与其相比所得的升降百分数表示(图6)。
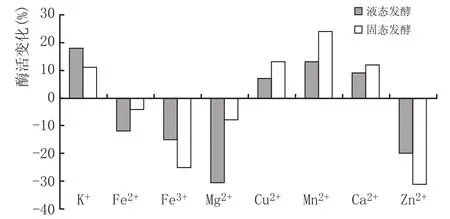
图6金属离子对酶活的影响
由图6可知,不同金属离子对酶活有不同的明显作用:Fe2+、Fe3+、Mg2+、Zn2+对2种发酵酶活皆有明显的抑制作用,其中Zn2 +的作用最为明显(固态-32%、液态-20%);K+、Cu2+、Mn2+、Ca2+同时都能促进固液酶活,其中Mn2+效果最为明显(固+23%、液+12%)。
2.3菌株HMZ-D的鉴定
2.3.1不同温度、pH值下生长曲线绘制
2.3.1.1温度
将HMZ-D菌株接入液体培养基中,选取培养温度分别为20℃、30℃、40℃、50℃、60℃,使用分光光度计(波长520nm)测定培养液的OD值,每隔2h测1次直至60h为止;以培养时间为横坐标、吸光度为纵坐标,绘制生长曲线,结果见图7。

图7 HMZ-D不同温度生长曲线
由图7可知,60℃下菌株几乎不生长,表明此温度过高,对菌株具有抑制甚至是杀灭作用;在30℃下,菌株生长最好;而在40℃及50℃下,菌株的生长较好。并且从图7中可以看出,30℃及50℃下菌株处在稳定期的时间较长。
2.3.1.2 pH值生长曲线
将HMZ-D菌株接入液体培养基中,选取培养pH值分别为5、6、7、8、9,使用分光光度计(波长520nm)测定培养液的OD值,每隔2h测1次直至60h为止;以培养时间为横坐标、吸光度为纵坐标,绘制生长曲线。结果见图8。

图8 HMZ-D菌株的不同pH值生长曲线
由图8可知,HMZ-D在中性条件(pH7)条件下生长态势最佳;而在偏酸或偏碱的环境中,其生长会受到抑制。
2.3.2显微形态观察
按1.2.4.2方法,在显微镜下对HMZ-D形态进行观察,结果见图9。

图9 HMZ-D显微形态察结果
由图9可知,HMZ-D在细菌培养基上生长良好,其单菌落呈类圆状,较黏稠平滑、易挑起;革兰氏染色为阳性,呈杆状,长度约为2.0μm;取37℃下培养12h的斜面菌体进行芽孢染色,显微观察可看到许多绿色芽孢,菌体则为红色。
2.3.3生理生化指标测定
按1.2.4.3方法,HMZ-D生理生化指标测定结果见表6。

表6生理生化鉴定结果
2.3.4分子生物学水平鉴定
得到的基因组电泳图及PCR扩增产物电泳图谱见图10。
所用到的引物序列:
8f(5'- AGAGTTTGATCCTGGCTCAG- 3');1492r (5'-GGTTACCTTGTTACGACTT-3')。
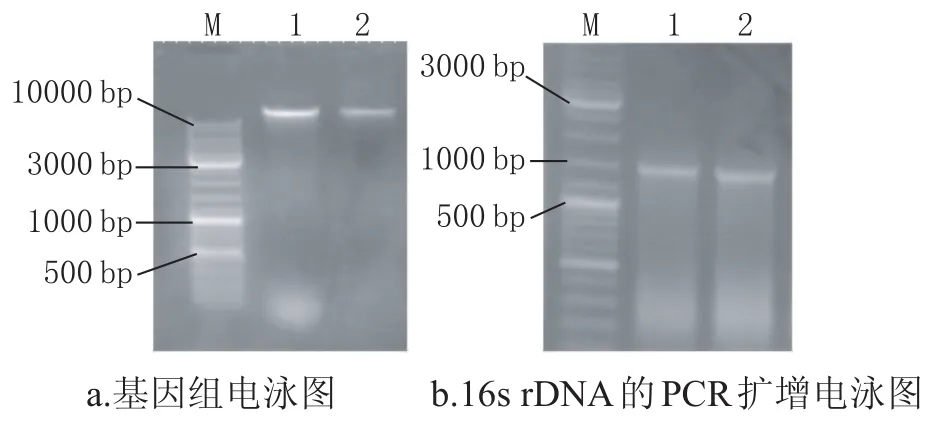
图10 HMZ-D基因组电泳图及PCR扩增电泳图
由图10可知,所提取的总基因组大小为10000 bp左右;PCR扩增产物的大小为1000 bp左右。通过胶回收试验对目的DNA进行纯化,上机测序;将得到的16s rDNA序列输入NCBI(http://www.ncbi.nlm.nih.gov/blast)进行比对分析,构建系统发育树,见图11。

图11系统发育树
综合以上显微形态观察、生理生化实验、分子生物学鉴定的结果,将HMZ-D鉴定为巨大芽孢杆菌。查阅相关资料,目前在酱香功能细菌的研究中鲜有关于巨大芽孢杆菌的报道。因此,继续对此菌的发酵产物进行GCMS分析,以期找到与其他相关报道具有共性的地方,以及对此“新种”对酱香风味的形成所起作用进行探讨分析。
2.4GC-MS产物分析
2.4.1产物列表
对各个化合物含量情况进行统计,见表7、表8。
由表7、表8结果可知,30℃及37℃2种温度条件下对其2种培养方式的发酵产物作GC-MS分析。结果表明,HMZ-D菌株2种发酵方式下所得种类较为相似,但液态发酵所产各化合物含量及各类物质总量要低于固态发酵,且在37℃下,固液发酵所得产物的含量均比低温(30℃)明显提高,其中以正辛酸、丁酸乙酯、己酸乙酯、丙酸辛酯、癸醛的含量升高明显;少数物质含量在30℃时反而较高,如2,5-二甲基吡嗪、四甲基吡嗪。正辛醇、β-苯乙醇、乙酸乙酯、丁酸乙酯、丁酸丁酯、己酸乙酯、庚酸乙酯、乳酸乙酯、己酸丁酯、油酸乙酯、亚油酸乙酯、乙酸、癸酸、2,5-二甲基吡嗪及四甲基吡嗪为HMZ-D发酵主要特征产物,初步推断巨大芽孢杆菌对酱香风味的形成也起着重要的作用。具体分析见参考文献[2]。
2.4.2图谱分析
按1.2.6方法进行产物分析,对30℃、37℃下HMZD固态、液态发酵所得产物进行GC-MS分析,本节内容已在参考文献[2]中进行了大类上的分析,现将各检测物含量进行列表分析,以便更准确地分析各单体物质的变化。GC-MS图谱见图12。
由图12可知,以菌株HMZ-D进行固、液发酵可明显产生多种物质,从图谱所体现的直观信息看,37℃下发酵所得峰型较多。以所测结果为基础,进一步对发酵产物作定性及定量分析。

表7 HMZ-D固态发酵产物含量分析
3 结论
3.1以酱香大曲为菌株筛选源,利用蛋白胨细菌培养基通过稀释涂布及划线涂布筛选得到21株不同菌落形态菌株。从此21株菌中,以感官闻香为初筛指标,得到3株产酱香明显的菌株,再以蛋白酶活力及酸酯测定结果为指标,最终筛选出1株产香好、酶活高的菌株(HMZ-D)。
3.2绘制菌株HMZ-D生长温度及pH值曲线,得到其最适生长温度为30℃,最适生长pH值为7;然后对其进行鉴定,通过形态、生理生化、分子水平鉴定最终将HMZD归属为巨大芽孢杆菌。
3.3对HMZ-D固、液发酵粗酶液酶活变化进行研究,结果表明:(1)两种条件下所得粗酶液酶活随温度均呈先升高后降低的趋势;(2)随pH值变化均呈先升后降趋势,但幅度不大;(3)两种发酵状态的酶活皆随着乙醇浓度的提升而呈现下降趋势,在达到一定值(4.5%)时趋于平稳;(4)在80℃下两种条件下发酵粗酶液酶活均随时间的延长而降低,最低可降至25%,且液态发酵酶活降低速率较快;(5)金属离子Fe2+、Fe3+、Mg2+、Zn2+对两种发酵酶活皆有明显的抑制作用,其中Zn2+的作用最为明显;K+、Cu2+、Mn2+、Ca2+同时都能促进固液酶活,其中以Mn2+的促进作用最为明显。

表8 HMZ-D液态发酵产物含量分析
3.4在化合物含量上,固态发酵明显多于液态发酵,且2种发酵方式在高温下很多醇、酯、醛、其他芳香及杂环化合物含量增幅明显,这表明本研究的目标菌株HMZ-D发酵可产生较多的发酵风味产物;正辛醇、β-苯乙醇、乙酸乙酯、丁酸乙酯、丁酸丁酯、己酸乙酯、庚酸乙酯、乳酸乙酯、己酸丁酯、油酸乙酯、亚油酸乙酯、乙酸、癸酸、2,5-二甲基吡嗪及四甲基吡嗪为HMZ-D发酵的主要特征产物。
[1]杨国华,邱树毅,黄永光.酱香大曲中产香细菌发酵产蛋白酶的条件优化[J].中国酿造,2011(12):50-53.

图12 GC-MS分析图谱
[2]杨国华,黄永光,邱树毅,等.酱香白酒酿造过程HMZ-D发酵风味产物研究[J].酿酒科技,2013(2):38-41.
[3]王福荣.酿酒分析与检测[M].北京:化学工业出版社,2005:260-292.
[4]布坎南,吉本斯.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984.
[5]东秀珠.常见细菌学系统鉴定手册[M].北京:科学出版社,2001.
[6]张荣.产香功能细菌的筛选及其特征风味化合物的研究[D].无锡:江南大学,2008.
[7]Martins S I F S,Jongen W M F,van Boekel MAJ S.Areview of Maillard reaction in food and implications to kinetic modelling[J].Trends in Food Science & Technology,2000,11(9-10):364-373.
[8]Marchand S,de Revel G,Vercauteren J,et al.Possible mechanism for involvement of cysteine in aroma production in wine[J].JAgric Food Chem,2002,50(21):6160-6164.
[9]周德庆.微生物学教程[M].北京:高等教育出版社,2002:29-30.
[10]Zoetendal E G,Mackie R I.Molecular methods in microbial ecology[M]// Tannock G W.Probiotics and Prebiotics: Scientific Aspects.Norfolk: Caister Academic Press,2005.
Isolation & Identification of Aroma-Producing Bacteria Strain HMZ-D from Jiangxiang Daqu and GC-MS Analysis of Its Metabolites
YANG Guohua1,LIU Hongbo1,ZHOU Jianli2,ZOU Xue3,QIU Shuyi4,HUANG Ping1and JIANG Ying1
(1.Guizhou Institute of Light Industry,Guiyang,Guizhou 550007;2.Guizhou Institute of Technology,Guiyang,Guizhou 550005;3.Affiliated Hospital of Guizhou Medcial University,Guiyang,Guizhou 550005;4.School of Liquor and Food Engineering,Guizhou University,Guiyang,Guizhou 550025,China)
Abstract:Two kinds of Jiangxiang high-temperature Daqu were screened form local distilleries in Maotai town.Then bacteria strains were isolated from Daqu through bacteria culture medium flat line isolation.With aroma records,protease detection,and acid & ester analysis of fermenting liquid,a bacteria strain HMZ-D with good aroma-producing capacity,high protease activity,and good ester & acid content was finally obtained.The relative experimental analysis suggested that,the optimum growth temperature of HMZ-D was 30℃and its optimum growth pH value was 7;crude enzyme liquid protease activity by solid fermentation/liquid fermentation of HMZ-D had different optimum temperature and pH value,and the promoting effects/inhibiting effects of metal ions were different;HMZ-D strain had almost the same metabolites under two different fermentation patterns,however,the content of each compound produced in liquid fermentation and the total amount of the produced compounds were lower than that in solid fermentation;strain HMZ-D was identified as Bacillus megaterium.
Key words:microbe;Jiangxiang Daqu;aroma-producing bacteria;isolation & screening;identification;GC - MS analysis
中图分类号:TS261.1;Q93-3;TS262.3
文献标识码:A
文章编号:1001-9286(2016)06-0029-09
DOI:10.13746/j.njkj.2016139
基金项目:贵州科学院青年基金,编号:黔科院J合字[2014]09号。
收稿日期:2016-04-20
作者简介:杨国华(1987-),男,硕士研究生,工程师,国家二级品酒师,主要从事科技期刊编辑、酿酒微生物等方面科研工作。
通讯作者:邱树毅,博士,教授,博士生导师。
