优良非酿酒酵母的分离与发酵性能研究
2016-07-15王晓昌李京宁张惠玲付丽霞宁夏大学农学院食品系宁夏银川750000宁夏食品检测中心宁夏银川750000
王晓昌,李京宁,张惠玲,刘 亚,付丽霞(.宁夏大学农学院食品系,宁夏银川750000;.宁夏食品检测中心,宁夏银川750000)
优良非酿酒酵母的分离与发酵性能研究
王晓昌1,李京宁2,张惠玲1,刘亚1,付丽霞1
(1.宁夏大学农学院食品系,宁夏银川750000;2.宁夏食品检测中心,宁夏银川750000)
摘要:非酿酒酵母对葡萄酒的风味有重要影响。本实验利用WL培养基对宁夏贺兰山东麓采集的葡萄种植园土样和葡萄果实表面上附着的非酿酒酵母进行了初步的分离鉴定,为酿造出具有宁夏地区独具风格和特色的地域性酒种提供基础性探索依据。本实验鉴定出:戴尔有孢圆酵母、葡萄汁有孢汉生酵母、异常汉生酵母和东方伊萨酵母。并且初步对4种非酿酒酵母进行发酵性能研究。结果表明,戴尔有孢圆酵母在耐SO2、耐酒精度和产酒度实验中均有良好表现。
关键词:非酿酒酵母;同质化;分离;发酵性能;葡萄酒
优先数字出版时间:2016-04-25;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160425.1443.015.html。
葡萄酒酿造最初采用的是自然发酵技术,自然发酵前期会有大量非酿酒酵母参与。与酿酒酵母相比,非酿酒酵母能产生和分泌甘油、高级醇、各种挥发性化合物以及多种胞外酶,这些物质与葡萄汁相互作用,对提升葡萄酒的香气、风味等感官特征有很大的作用。
但是非酿酒酵母对葡萄酒风味的影响一般是难以预测的,非酿酒酵母可能会产生不良的气味和口感。近几十年,许多葡萄酒生产国放弃了传统的自然发酵法,开始利用商用酵母进行纯种发酵。相比较而言,商用酿酒酵母耐高酒精度、耐高温,具有较强的竞争有限营养物的能力,使葡萄酒的风味更有保障,提高生产效率并且使酒的酿造便于控制,保证安全高效生产[1]。但由于商用酿酒酵母的使用,不能很好地体现葡萄酒的复杂性和典型性。因此,分离出优良的非酿酒酵母,了解其发酵性能,使之发挥酵母优势,应用于酿造葡萄酒中的研究成为行业热点。
2007年,杨莹等[2]用WL培养基对分离的34株酵母菌进行分类鉴定,并用26S rDNAD1/D2区序列分析方法对这些酵母菌进行分子鉴定,依次验证WL培养基鉴定结果的可靠性。结果表明,大多数菌株经2种方法的分类鉴定的结果一致。本实验采用WL培养基对酵母菌进行初步鉴定。
1材料与方法
1.1材料
采样:宁夏贺兰山东麓葡萄种植园土样、赤霞珠葡萄。
1.2培养基及试剂
YPD培养基:酵母浸粉1.0%,蛋白胨2.0%,葡萄糖2.0%,琼脂2.0%,氯霉素100 mg/L(在筛选过程中排除细菌的干扰)。
WL营养培养基:酵母浸粉4.0 g,胰蛋白酶5.0 g,葡萄糖50.0 g,磷酸二氢钾0.55 g,氯化钾0.425 g,氯化钙0.125 g,硫酸镁0.125 g,氯化铁0.0025 g,硫酸锰0.0025 g,琼脂20.0 g,溴甲酚绿0.022 g,pH6.5,定容至1 L[3]。
发酵性能所需试剂:无水乙醇、亚硫酸、柠檬酸。
1.3实验方法
1.3.1菌种的分离纯化
(1)将采集的不同品种的葡萄浆果在实验室中除梗,每种葡萄浆果取等量浆液5mL分别放入5个无菌烧杯中破碎,每个烧杯中分别加入200mL、400mL、600mL、800mL和1000mL无菌蒸馏水进行梯度稀释。
(2)将采集的葡萄种植园土样取等量土样5 g分别放入5个无菌烧杯中,每个烧杯中加入200mL、400mL、600mL、800mL和1000mL无菌蒸馏水进行梯度稀释。
(3)在超净工作台中将稀释液分别涂布于YPD平板培养基上,28℃培养3d。待培养基表面长出单个菌落,选取菌落疏密分布适当的培养基,随机挑选40个菌落,编号1~40,并在YPD平板培养基上以划线方式分离纯化。将纯化后的酵母菌在28℃恒温下培养2d,放入4℃冰箱保藏,待测。
1.3.2酵母菌的分类鉴定
将已保藏的菌株接种于YPD液体培养基中,活化24h,让各菌株尽量处于同一个生长状态。然后划线接种于WL培养基中,28℃培养5d,观察记录菌落的形态和颜色,然后根据菌落的形态和颜色将所采集的菌株进行初步分类[4]。
1.3.3发酵特性实验
将采集的葡萄浆果除梗、破碎,得到的葡萄汁灭菌待用。
(1)耐SO2实验:取10mL灭菌葡萄汁分装于灭菌试管(内装有杜氏管),加入亚硫酸使SO2浓度分别为50 mg/L、100 mg/L、150 mg/L、200 mg/L,用移液枪吸100μL活化菌液接入上述灭菌葡萄汁中,25℃培养,记录起始发酵时间[5],发酵时间为从接种菌株到累计产气0.1mL(约为杜氏管的1/4)所需时间。
(2)耐酒精度实验:取10mL灭菌葡萄汁分装于灭菌试管(内装有杜氏管),用移液器加入无水乙醇使葡萄汁中乙醇体积分数分别为8.0%vol、10.0%vol、12.0%vol、14.0%vol,用移液枪吸100μL活化菌液接入上述灭菌葡萄汁中,25℃培养,记录起始发酵时间[6]。
(3)最佳发酵温度测定:取10mL灭菌葡萄汁分装于灭菌试管(内装有杜氏管),分别将温度控制在10℃、15℃、20℃、25℃,用移液枪吸100μL活化菌液接入上述灭菌葡萄汁中,记录起始发酵时间。
(4)最佳发酵pH值:取10mL灭菌葡萄汁分装于灭菌试管(内装有杜氏管),调pH值分别为5、6、7、8,用移液枪吸100μL活化菌液接入上述灭菌葡萄汁中,25℃培养,记录起始发酵时间[6]。
(5)产酒精度测定:取400mL灭菌葡萄汁,用移液枪吸4mL活化菌液接入上述灭菌葡萄汁中,设定25℃培养4d。然后将发酵醪液等量分装入4个蒸馏烧瓶中,加100mL蒸馏水,置1000 W电炉上蒸馏出100mL液体,摇匀后用酒精计和温度计分别测定其酒精度和温度,然后查表校正为20℃酒精浓度[7]。
2结果与分析
2.1利用WL培养基分离出的非酿酒酵母菌落形态
分离的菌株在WL培养基中培养5d,通过观察其菌落形态和颜色,可分为5类。以上5类酵母菌在WL培养基上培养结果见图1。
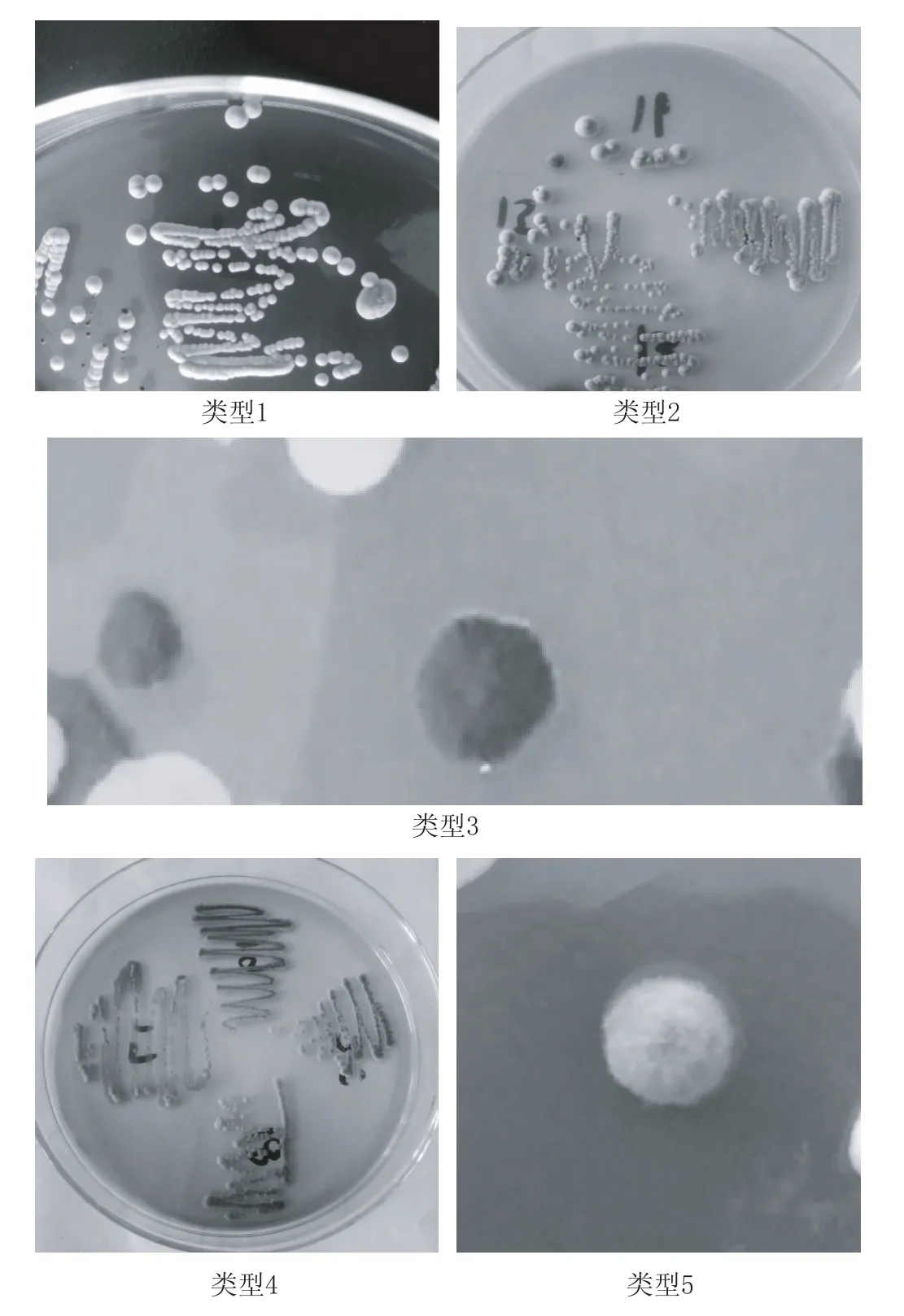
图1 5类酵母菌在WL培养基上的培养结果

表1 5类酵母菌在WL培养基上的分类结果
2.2利用WL培养基鉴定分离纯化后的酵母菌
WL培养基是被设计用来监测饮料发酵过程中的微生物类群的[8]。Cavazza等[3]研究表明,在葡萄酒自然发酵过程中出现的大多数典型的酵母菌种都可以用WL培养基进行区分,主要基于菌落颜色及菌落形态。本实验筛选到的5类酵母在WL培养基上形成的菌落颜色和形态见表1[9]。
如表1所示,初步鉴定,从葡萄汁中分离出的20株酵母菌株中:1—3号、5—10号、13—15号、19号、20号为戴尔有孢圆酵母;4号、16号为酿酒酵母;12号为葡萄汁有孢汉生酵母;11号、18号为异常汉生酵母;17号为东方伊萨酵母。
2.3发酵特性实验
由于本实验重点筛选非酿酒酵母,4号、16号为酿酒酵母,故排除。
2.3.1耐SO2实验
分离出的4种非酿酒酵母(戴尔有孢圆酵母、葡萄汁有孢汉生酵母、异常汉生酵母和东方伊萨酵母)在不同浓度SO2的灭菌葡萄汁中的起始发酵时间见表2。实验结果表明,葡萄汁有孢汉生酵母和异常汉生酵母耐SO2能力较弱,仅可在SO2浓度为100 mg/L以下的葡萄汁中生长,在浓度为200 mg/L时便无法生长。戴尔有孢圆酵母和东方伊萨酵母耐SO2能力较强,可以在SO2浓度为150 mg/L的葡萄汁中生长,但在浓度为200 mg/L时,4种非酿酒酵母均无法生长。
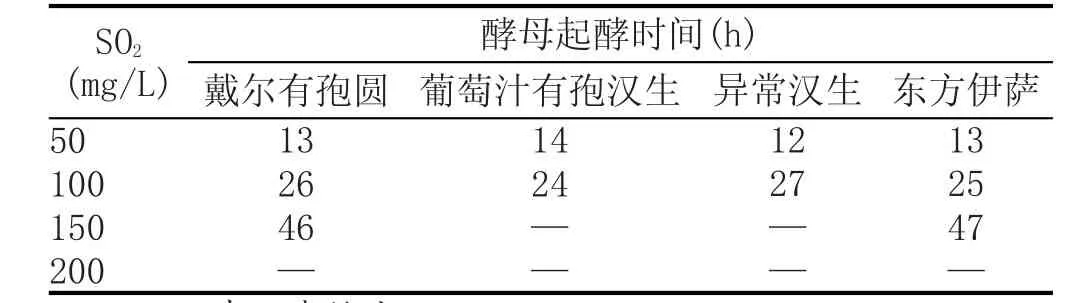
表2不同SO2浓度对起酵时间的影响
2.3.2耐酒精度实验
分离出的4种非酿酒酵母(戴尔有孢圆酵母、葡萄汁有孢汉生酵母、异常汉生酵母和东方伊萨酵母)在不同浓度酒精度的灭菌葡萄汁中的起始发酵时间见表3。实验结果表明,戴尔有孢圆酵母耐酒精能力最强,在14.0%vol的酒精度下可以生长;其次是东方伊萨酵母,可耐受12.0%vol的酒精度;耐酒精能力最弱的是葡萄汁有孢汉生酵母和异常汉生酵母。

表3不同酒精浓度对起酵时间的影响
2.3.3最佳发酵温度
分离出的4种非酿酒酵母(戴尔有孢圆酵母、葡萄汁有孢汉生酵母、异常汉生酵母和东方伊萨酵母)在不同温度的灭菌葡萄汁中的起始发酵时间见表4。实验结果表明,温度越低,起酵时间越慢。在同等温度下各菌株表现较接近。戴尔有孢圆酵母、葡萄汁有孢汉生酵母和异常汉生酵母在20℃左右,发酵能力最强。东方伊萨酵母随着温度的升高,发酵能力不断上升(本实验温度最高为25℃)。

表4温度对起酵时间的影响
2.3.4最佳发酵pH值
分离出的4种非酿酒酵母(戴尔有孢圆酵母、葡萄汁有孢汉生酵母、异常汉生酵母和东方伊萨酵母)在不同pH值的灭菌葡萄汁中的起始发酵时间见表5。实验结果表明,4种非酿酒酵母在各个pH值环境下,起始发酵时间较为接近,最佳发酵pH值均在6~7。
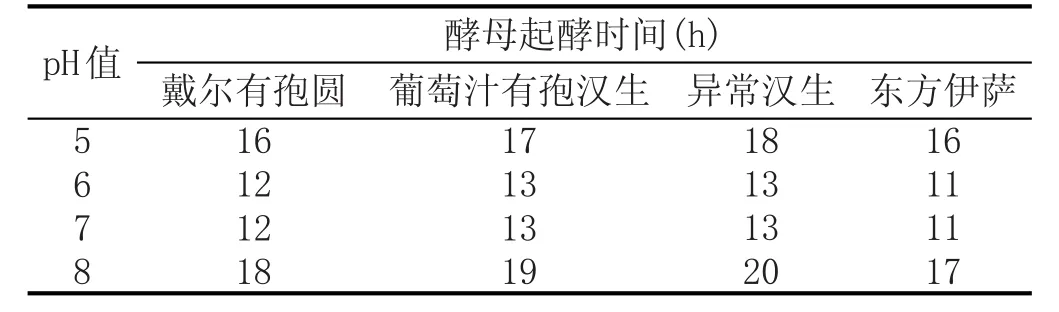
表5不同pH值对起酵时间的影响
2.3.5产酒能力测定
分离出的4种非酿酒酵母在灭菌葡萄汁中产酒精情况见表6。实验结果表明,戴尔有孢圆酵母产酒能力最强,其次是东方伊萨酵母,葡萄汁有孢汉生酵母和异常汉生酵母产酒能力最弱。
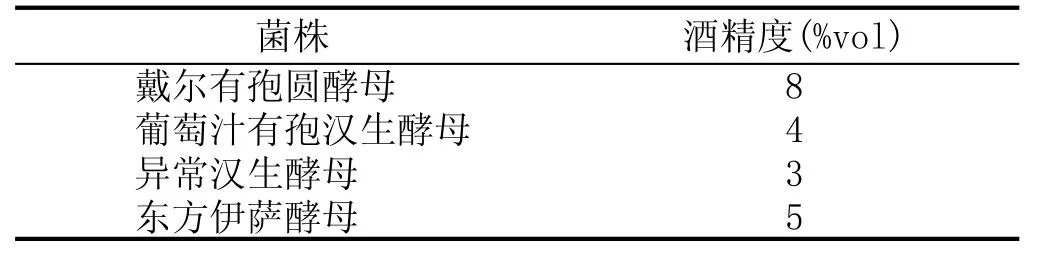
表6菌株产酒精情况
3 结论
本实验采集宁夏贺兰山东麓葡萄种植园土样和葡萄,利用WL培养基从中分离出5种酵母:酿酒酵母、戴尔有孢圆酵母、葡萄汁有孢汉生酵母、异常汉生酵母和东方伊萨酵母。其中戴尔有孢圆酵母数量最多,说明采集的样品中戴尔有孢圆酵母占的比重较大。葡萄酒生产中最主要的酵母菌——酿酒酵母在浆果表面及自然发酵前期并不普遍存在,只在发酵中后期少量存在,一般其数量小于10~100 cfu/g[10],在本实验中分离出了酿酒酵母,原因可能是采摘的葡萄放置时间稍久,葡萄表面有破裂,导致葡萄汁溢出,提前开始自然发酵。
本实验主要对4株非酿酒酵母进行发酵性能研究。通过采用灭菌的葡萄汁做小瓶发酵实验,发现戴尔有孢圆酵母在耐SO2、耐酒精度和产酒度实验中均有良好表现,在最佳发酵温度和最佳发酵pH值实验中与其他菌株差异不大。东方伊萨酵母在最佳发酵温度实验中,随着温度上升,发酵速率也随着上升,本实验中未测到其最佳发酵温度,其余3种菌株最佳发酵温度均在20℃左右。葡萄汁有孢汉生酵母和异常汉生酵母各方面发酵性能较弱。本研究后续将对选出的优良菌株进行发酵产香的研究。
参考文献:
[1]冯作山.优良葡萄酒酵母的选育及发酵性能研究[D].乌鲁木齐:新疆农业大学,2000:27-29.
[2]杨莹,徐艳文,薛军侠,等.WL营养琼脂对葡萄酒相关酵母的鉴定效果验证[J].微生物学杂志,2007,5(27):75-79.
[3]Cavazza A,Grando M S,Zini C.Rilevazione della flora mierobica di mosti e vini[J].Vignevini,1992,9:17-20.
[4]杨雪峰,苏龙,刘树文.利用WL营养培养基鉴定葡萄酒中的相关酵母菌[J].中外葡萄与葡萄酒,2006(4):4-7.
[5]李筝,韩北忠,陈晶瑜,等.优良酿酒酵母菌的发酵性能研究[J].中国酿造,2008(9):11.
[6]王会会.烟台干红葡萄酒发酵过程酵母菌群研究[D].济南:山东轻工业学院,2011:31.
[7]诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994:57-61.
[8]Green S R.,Gray P P.Adifferential procedure applicable to bacteriological investigation in brewing[J].Wallerstein Comm,1950,13:357-366.
[9]程雷.葡萄自然发酵过程中酵母的分离鉴定及优良葡萄酒酵母筛选[D].哈尔滨:东北林业大学,2010.
[10]Mannazzu I,Clementi F,Ciani M.Strategies and criteria for the isolationand selection of autochthonous starters [M]//Ciani M.Biodiversity and Biotechnology of Wine Yeasts.Kerala: Research Signpost,2002:19-33.
Isolation of Quality Non-Saccharomyces Yeasts and Study on Their Fermentation Performance
WANG Xiaochang1,LI Jingning2,ZHANG Huiling1,LIU Ya1and FU Lixia1
(1.Department of Food Science,School of Agriculture,Ningxia University,Yinchuan,Ningxia 750021;2.Ningxia Food Testing Center,Yinchuan,Ningxia 750000,China)
Abstract:Non-Saccharomyces yeasts have important influence on grape wine flavor.In the experiments,non-Saccharomyces yeasts were isolated from soil samples and grapes in vineyards in Ningxia Helan Mountain by WL culture mediums and then identified,which could provide basic research evidence for Ningxia local wine yeast.Four kinds of non-Saccharomyces yeasts including Torulaspora delbrueckii,Hanseniaspora uvarum,Hansenula anomala and Issatchenkia orientalis were identified and their fermentation performance was explored.The results suggested that Torulaspora delbrueckii had good performance in SO2resistance,alcohol resistance and the production of alcohol.
Key words:non-Saccharomyces yeasts;homogenization;separation;fermentation performance;grape wine
中图分类号:TS261.1;TS262.6;TS261.4
文献标识码:A
文章编号:1001-9286(2016)06-0057-04
DOI:10.13746/j.njkj.2015474
基金项目:宁夏回族自治区科技支撑项目(413-0393)。
收稿日期:2015-12-21;修回日期:2016-03-01
作者简介:王晓昌(1990-),男,硕士,研究方向为微生物发酵,E-mail:408420456@qq.com。
通讯作者:张惠玲(1963-),女,教授,学士,研究方向为食品生物技术,E-mail:zhl5792@163.com。
