siRNA抑制HMGA1基因表达对LX-2细胞生物学功能的影响*
2016-07-15杜芳腾张吉翔
胡 蕾,刘 莉,张 霜,杜芳腾,张吉翔
(南昌大学第二附属医院消化内科/江西省分子医学重点实验室,南昌 330006)
siRNA抑制HMGA1基因表达对LX-2细胞生物学功能的影响*
胡蕾,刘莉,张霜,杜芳腾△,张吉翔
(南昌大学第二附属医院消化内科/江西省分子医学重点实验室,南昌 330006)
[摘要]目的探讨高迁移率蛋白A1(HMGA1)siRNA对人肝星状细胞HMGA1、α-SMA、E-钙黏素(E-cadherin)基因的表达调控作用及增殖活性的影响,并探讨其可能的机制。方法将有效的人工合成的HMGA1 siRNA转染人肝星状细胞LX-2(LX-2)后沉默HMGA1基因的表达。通过实时荧光定量PCR(RT-PCR)及蛋白免疫印迹法(Western blot)检测LX-2细胞中HMGA1、α-SMA和E-cadherin的mRNA及蛋白表达水平。采用四甲基偶氮唑盐(MTT)法检测LX-2细胞增殖水平。结果以HMGA1-siRNA序列1组沉默效果最好。TGF-β1刺激组与TGF-β1+NC-siRNA组之间细胞增殖水平、HMGA1、α-SMA、E-cadherin的基因及蛋白表达水平差异无统计学意义(P>0.05),细胞增殖水平、HMGA1、α-SMA表达均明显高于正常对照组(P<0.05),E-cadherin表达显著低于正常对照组(P<0.05);TGF-β1+HMGA1 siRNA组细胞增殖水平及HMGA1、α-SMA的mRNA及蛋白表达水平较另外3组均显著下降(P<0.05),E-cadherin表达水平显著增高(P<0.05)。结论靶向HMGA1的siRNA能够沉默LX-2中HMGA1的表达;抑制TGF-β1诱导的LX-2增殖水平,提示HMGA1参与了TGF-β1诱导的肝星状细胞活化。
[关键词]高迁移率蛋白A1;RNA干扰;肝星状细胞;肝纤维化
肝纤维化是在各种致病因素作用下肝脏内纤维结缔组织异常增生的代偿反应,其本质是肝脏组织内细胞外基质合成大于降解[1]。研究表明某些干预措施如促进细胞外基质降解可促使肝纤维化进程逆转[2]。肝损伤过程中,肝星状细胞被激活发生表型转化后能够获得肌成纤维细胞特性,进而增加细胞收缩性和胶原合成,这种过程受多种细胞因子调控。Shimada等[3]用纤维化过程中的重要转化刺激因子(transforming growth factor-β1,TGF-β1)诱导24 h来激活人肝星状细胞LX-2(hepatic stellate cell LX-2,LX-2)来构建体外肝纤维化实验模型。高迁移率族蛋白A1(high mobility group AT-hook 1,HMGA1)是高迁移率族蛋白中一员,作为转录因子的辅助因子参与真核生物的转录过程[4]。文献报道HMGA1基因在不同胚胎起源的肿瘤相关基因的转录调控过程中发挥着重要的作用[5]。但HMGAl在肝纤维化中的表达研究报道尚罕见。本研究旨在通过干扰人LX-2细胞中HMGA1基因的表达,研究其对LX-2生物学功能的影响,初步探讨HMGA1在肝纤维化形成过程中的作用。
1材料与方法
1.1材料人肝星状细胞LX-2购自湘雅中心实验室细胞库。试剂:重组人TGF-β1(美国PeproTech公司);胎牛血清(FBS,美国Hyclone公司);DMEM培养基、0.25%胰酶、溴化乙锭(EB,上海索来宝生物科技有限公司);FuGENE6(美国罗氏公司)。实时荧光室量PCR(RT-PCR)所需的Trizol(美国Invitrogen公司);Taq PCR Super Mix、DNA MarkrⅠ(北京天根生化科技有限公司);逆转录试剂盒(加拿大Fermenters公司)。总蛋白提取试剂盒(北京普利莱基因技术有限公司)。各目的基因引物由上海捷瑞公司合成。兔抗人HMGA1、α-SMA及E-钙黏素(E-cadherin)单克隆抗体均购自英国Abcam公司,山羊抗鼠IgG、鼠抗人β-actin单克隆抗体和山羊抗兔IgG购自北京中杉金桥生物技术有限公司。四甲基偶氮唑蓝(MTT,上海普飞生物科技有限公司)。DEPC(Diethyl pyrocarbonate)、二甲亚砜(DMSO,美国Ameresco公司)。
1.2方法
1.2.1siRNA的设计与合成Negative siRNA control(NC-siRNA)作为阴性对照由广州市锐博生物科技有限公司设计并合成,另设计与合成含3对HMGA1-siRNA序列(BC004924)的siRNA,分别是HMGA1-siRNA-1,HMGA1-siRNA-2和HMGA1-siRNA-3,见表1、2。
表1各引物序列

表2 3组特异性HMGA1 siRNA序列

1.2.2人肝星状细胞株LX-2的培养及传代用混合培养基DMEM[含10%胎牛血清(Hyclone )、100 U/mL青霉素及100 U/mL链霉素]于37 ℃、含5% CO2的孵箱中培养,细胞贴壁生长,用0.25%胰蛋白酶消化,2~3 d传代1次。
1.2.3细胞转染及有效HMGA1 siRNA筛查将细胞分为以下6组:空白对照组(只转染脂质体,无特异性siRNA)、正常对照组(正常培养的LX-2细胞)、阴性对照组(HMGA1 NC-siRNA)、HMGA1-siRNA-1组、HMGA1-siRNA-2组及HMGA1-siRNA-3组。将处于对数生长期的LX-2以2×105个/孔的密度铺于6 孔板中,常规培养,待细胞贴壁达30%~50%融合率时进行转染。转染前,换用不含血清和抗生素的DMEM培养基2 mL培养。按FuGENE6试剂盒说明书操作。转染后6 h,换成常规含5% FBS的DMEM培养液继续培养48 h。分别提取RNA及总蛋白,采用半定量实时荧光定量PCR(RT-PCR)及蛋白免疫印迹法(Western blot)检测HMGA1基因和蛋白的表达,重复3次。筛选出对HMGA1干扰效果最佳的一组序列用于实验。
1.2.4HMGA1-siRNA对经过TGF-β1刺激后的LX-2细胞中HMGA1、α-SMA、E-cadherin表达的影响将细胞分为4组:TGF-β1刺激组(经TGF-β1处理,未转染)、TGF-β1+NC-siRNA组(经TGF-β1处理,转染加入NC siRNA)、TGF-β1+HMGA1-siRNA组(经TGF-β1处理,转染加入HMGA1-siRNA)、对照组(无TGF-β1刺激,未转染),其中培养液中TGF-β1终浓度为10 ng/mL。转染步骤同前,转染24 h后,再加入TGF-β1孵育24 h,提取各组总RNA及总蛋白,采用Western blot和半定量RT-PCR检测HMGA1、α-SMA、E-cadherin蛋白和基因的表达。
1.2.5半定量RT-PCR检测按Trizol试剂盒操作说明提取细胞总RNA,取光密度(OD)260/280比值接近2.0的RNA进行试验。应用Fermentas逆转录试剂盒,取6 μL RNA反转录成cDNA,以此为模板进行PCR扩增。参照Two-Step RT-PCR试剂盒操作说明书进行RT-PCR,取2 μL cDNA,总反应体积为25 μL,进行PCR反应。扩增条件,HMGA1:94 ℃ 5 min;94 ℃ 45 s;57 ℃ 45 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。α-SMA:94 ℃ 5 min;94 ℃ 45 s;52 ℃ 45 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。E-cadherin:94 ℃ 5 min;94 ℃ 45 s;54 ℃ 45 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。β-actin:94 ℃ 5 min;94 ℃ 45 s;56 ℃ 45 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。PCR 产物经1.5%琼脂糖凝胶电泳(含5 mg/L溴化乙锭)后,紫外灯下观察结果。通过Quantity One图像分析软件(Bio-Rad公司),获得相应组的HMGA1、α-SMA、E-cadherin mRNA的相对表达量(均以β-actin来标化)。
1.2.6Western blot检测按蛋白提取试剂盒说明进行Western blot检测,提取各组细胞的总蛋白,BCA法测定蛋白浓度。取30 μg的蛋白调至等体积上样,经不同浓度(HMGA1、α-SMA、E-cadherin分别用15%、12%及6%)的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),继而把蛋白转移至PVDF膜上,将膜用含5%脱脂奶粉的TBST液室温封闭2 h,分别加封闭液稀释的Ⅰ抗:HMGA1(1∶1 000)、α-SMA(1∶800)、E-cadherin(1∶1 000)和β-actin(1∶1 000)置于4 ℃孵育过夜,洗涤后加入用封闭液稀释辣根过氧化物酶(HRP)标记的Ⅱ抗室温孵育2 h,洗涤后经显色、曝光、显影、定影后拍照并观察结果,用β-actin标化,经Quantity One图像分析软件获得各组蛋白相对表达量。
1.2.7MTT比色法检测细胞增殖转染前1 d收集对数生长期的LX-2细胞并接种于96孔板中。依1.2.3的分组及转染方式操作。分别在每孔加入含有10%MTT溶液20 μL,常规培养4 h后加入DMSO。酶标仪测定4组细胞各孔吸光度(A)值(492 nm),计算各组均值。
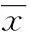
2结果
2.1HMGA1基因沉默对LX-2细胞中HMGA1 mRNA、蛋白表达的影响 用脂质体转染法将siRNA转染LX-2细胞后,3个干扰组的细胞内HMGA1 mRNA表达水平均较其他对照组降低(P<0.05)。其中HMGA1-siRNA-1组干扰效果最好,mRNA表达最少(P<0.05)。Western blot检测结果与半定量RT-PCR检测一致,HMGA1的蛋白表达量显著下降(P<0.05),见图1、2。
2.2HMGA1-siRNA对经过TGF-β1刺激后的LX-2细胞中HMGA1、α-SMA、E-cadherin mRNA和蛋白表达的影响半定量RT-PCR结果显示,TGF-β1+NC-siRNA组与TGF-β1刺激组之间E-cadherin、HMGA1、α-SMA的mRNA及蛋白表达水平差异无统计学意义(P>0.05),HMGA1、α-SMA表达均显著高于对照组(P<0.05),E-cadherin表达显著低于对照组(P<0.05)。与TGF-β1刺激组及TGF-β1+NC-siRNA组相比较,TGF-β1+HMGA1 siRNA组中HMGA1、α-SMA的mRNA及蛋白表达水平均显著下降(P<0.05),E-cadherin表达水平显著增高(P<0.05)。Western blot检测结果与半定量RT-PCR检测一致,见图3、4。

M:Marker;1:正常对照组;2:空白对照组;3:阴性对照组;4:HMGA1-siRNA-1组;5:HMGA1-siRNA-2组;6:HMGA1-siRNA-3组;*:P<0.05;**:P<0.01,与正常对照组、空白对照组、阴性对照组比较。
图1半定量RT-PCR检测HMGA1 siRNA转染LX-2
细胞48 h后HMGA1的mRNA表达

1:正常对照组;2:空白对照组;3:阴性对照组;4:HMGA1-siRNA-1组;5:HMGA1-siRNA-2组;6:HMGA1-siRNA-3组;*:P<0.05;**:P<0.01,与正常对照组、空白对照组、阴性对照组比较。
图2Western blot检测HMGA1 siRNA转染LX-2细胞
48 h后HMGA1的蛋白表达情况
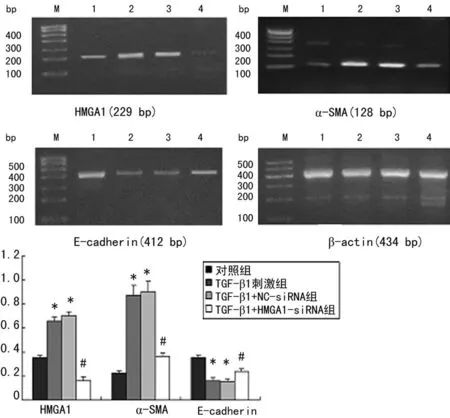
M:MarkerⅠ;1:对照组;2:TGF-β1刺激组;3:TGF-β1+NC-siRNA组;4:TGF-β1+HMGA1-siRNA组;*:P<0.05,与对照组比较;#:P<0.05,与TGF-β1刺激组和TGF-β1+NC-siRNA组比较。

图3 HMGA1 siRNA对经过TGF-β1刺激后的LX-2细胞
*:P<0.05,与对照组比较;#:P<0.05,与TGF-β1刺激组和TGF-β1+NCsiRNA组比较。
2.3转染HMGA1-siRNA后LX-2细胞增殖活力的变化TGF-β1刺激组和TGF-β1+NC-siRNA组所测得A值与对照组相比显著升高,差异有统计学意义(P<0.05);TGF-β1刺激组和TGF-β1+NC-siRNA组间差异无统计学意义(P>0.05);TGF-β1+HMGA1-siRNA组的A值与TGF-β1刺激组和TGF-β1+NC-siRNA组相比显著下降,差异有统计学意义(P<0.05),见表3。

1:对照组;2:TGF-β1刺激组;3:TGF-β1+NC-siRNA组;4:TGF-β1+HMGA1-siRNA组;*:P<0.05,与对照组比较;#:P<0.05,与TGF-β1刺激组和TGF-β1+NC-siRNA组比较。
图4HMGA1-siRNA对经过TGF-β1刺激后的LX-2细胞
中HMGA1、α-SMA、E-cadherin mRNA和蛋白表达
3讨论
上皮间质转化(epithelial-mesenchymal transitions,EMT)是指成熟的上皮细胞经历了短暂结构改变,同时细胞表型发生改变,失去部分上皮细胞用以维持细胞极性及形态,同时表达间充质细胞标记蛋白如波形蛋白、α-SMA、成纤维细胞特异性蛋-1等,细胞迁移与侵袭能力增强,而细胞间黏附力减弱,同时可获得抗凋亡和降解细胞外基质的潜能[6-7]。EMT在促进癌细胞转移、创伤愈合及器官纤维化[8-9]的过程中担当重要角色。上皮组织来源的肿瘤细胞可经EMT过程实现其在体内的侵袭和转移行为,使细胞获得更加适合于在细胞外环境中运动和迁移的表型。早期阻断某些诱导2型EMT的配体可以逆转上皮细胞表型转化。研究发现静息性HSC、肝细胞和胆管上皮细胞都能经EMT转化为肌成纤维细胞,这表明肝实质上皮细胞也参与了肝纤维化进程[10-11]。因此,EMT过程在肝纤维化的发生、发展中可能起一定作用。
资料表明,染色质的核骨架结合序列(MARs/SARs)处,HMGA1可取代组蛋白H1,进而活化染色质的转录[12]。HMGA1并不直接参与转录,而是促使其他转录因子结合、聚集,调节转录起始过程[13]。正常情况下,HMGA1在分化成熟的组织中几乎不表达,而主要存在于胚胎发育期及快速增殖的细胞内[14]。HMGA1基因生物学行为类似癌基因,位于许多肿瘤细胞染色体断裂点簇集区,在转录水平抑制许多基因的表达。许永华等[15]研究发现,HMGA1基因和肿瘤的肝内转移相关,其在肝细胞癌中的表达显著高于正常肝组织。笔者探讨HMGA1通过EMT参与了肝纤维化发展。
本课题实验结果表明,TGF-β1作用于LX-2对HMGA1基因表达有上调作用,且靶向HMGA1的siRNA能沉默LX-2细胞中HMGA1的表达,且以HMGA1-siRNA-1组的沉默效果最佳。干扰HMGA1基因可显著抑制TGF-β1对HMGA1、α-SMA 基因和蛋白表达的诱导作用;同时也可抑制TGF-β1诱导LX-2增殖水平的升高,减轻对E-cadherin表达的抑制作用,提示其参与了TGF-β1诱导的肝星状细胞活化。
综上所述,HMGA1基因在以星状细胞活化为中心的肝纤维化进程中发挥了重要作用。本课题为HMGA1在肝纤维化中的重要作用提供了直接的理论依据。未来研究重点将转向动物实验,如何将其导入体内并确保其有效性、安全性等诸多方面的问题有待进一步的探索。抑制HMGA1的表达有望成为临床防治肝纤维化的一个新靶点。
参考文献
[1]Hernandez-Gea V,Friedman SL.Pathogenesis of liver fibrosis[J].Annu Rev Pathol,2011(6):425-456.
[2]Friedman SL.Liver fibrosis:from mechanisms to treatment[J].Gastroenterol Clin Biol,2007,31(10):812-814.
[3]Shimada H,Staten NR,Rajagopalan LE.TGF-β1 mediated activation of Rho kinase induces TGF-β2 and endothelin-1 expression in human hepatic stellate cells[J].Hepatol,2011,54(3):521-528.
[4]Reeves R.Molecular biology of HMGA proteins:hubs of nuclear function[J].Gene,2001,277(1/2):63-81.
[5]Liau SS,Rocha F,Matros E,et al.High mobility group AT-hook 1 (HMGA1) is an independent prognostic factor and novel therapeutic target in pancreatic adenocarcinoma[J].Cancer,2008,113(2):302-314.
[6]Firrincieli D,Boissan M,Chignard N.Epithelial-mesenchymal transition in the liver[J].Gastroenterol Clin Biol,2010(34):523-528.
[7]Kalluri R,Weinberg RA.The basics of epithelial-mesenchymal transition[J].J Clin Invest,2009(119):1420-1428.
[8]Zeisberg EM,Tarnavski O,Zeisberg M,et al.Endothelial-to-mesenchymal transition contributes to cardiac fibrosis[J].Nat Med,2007(13):952-961.
[9]Ward C,Forrest IA,Murphy DM,et al.Phenotype of airway epithelial cells suggests epithelial to mesenchymal cell transition in clinically stable lung transplant recipients[J].Thorax,2005,60(1):865-871.
[10]Zeisberg M,Yang C,Martino M,et al.Fibroblasts derive from hepatocytes in liver fibrosis via epithelial to mesenchymal transition[J].Biol Chem,2007,282(32):23337-233347.
[11]Choi SS,Omenetii A,Witek RP,et al.Hedgehog pathway activation and epithelial-to-mesenchymal transitions during myofibroblastic transformation of rat hepatic cells in culture and cirrhosis[J].Am J Physiol Gastrointest Liver Physiol,2009,297(6):G1093-1106.
[12]Cleynen I,Van de Ven WJ.The HMGA proteins:a myriad of functions(Review)[J].Int J Oncol,2008,32(2):289-305.
[13]Bustin M.Revised nomenclature for high mobility group(HMG) chromosomal proteins[J].Trends Biochem Sci,2001(26):152-153.
[14]Wang EL,Qian ZR,Rahman MM,et al.Increased expression of HMGA1 correlates with tumour invasiveness and proliferation inhuman pituitary adenomas[J].Histopathology,2010(56):501-509.
[15]许永华,李长贤,陈杰,等.高迁移率族蛋白A1(HMGA1)在肝细胞癌中的表达及临床意义[J].南京医科大学学报(自然科学版),2010(3):304-308,365.
Effects of siRNA inhibit HMGA1 gene expression on LX-2 cell biological functions*
Hu Lei,Liu Li,Zhang Shuang,Du Fangteng△,Zhang Jixiang
(DepartmentofGastroenterology,theSecondAffiliatedHospitalofNanchangUniversity/KeyLaboratoryofMolecularMedicineofJiangxiProvincial,Nanchang,Jiangxi330006,China)
[Abstract]ObjectiveTo investigate the effects of siRNA mediated HMGA1 silence on proliferation and the gene expression of HMGA1,α-SMA and E-cadherin in activated hepatic stellate cells and its mechanisms.MethodsSynthetic HMGA1 siRNA was transfected into LX-2 cells to silence the HMGA1 gene.The expression level of HMGA1,α-SMA and E-cadherin was determined by RT-PCR and Western blot experiments.LX-2 cell proliferation was assessed by MTT assay.ResultsThe best inhibited effect was HMGA1-siRNA-1.Compared with control group,the cell proliferation and the mRNA and protein expression of HMGA1,α-SMA in TGF-β1 group and TGF-β1+NC-siRNA group were significantly increased (P<0.05),without significant differences between the two groups (P>0.05),while the expression of E-cadherin in TGF-β1 group and TGF-β1+NC-siRNA group were significantly decreased compared with control group (P<0.05).Meanwhile,the cells in TGF-β1+HMGA1 siRNA group showed significantly decreased proliferation level,down-regulated mRNA and protein expression of HMGA1,α-SMA but up-regulated expression of E-cadherin compared with TGF-β1 group and TGF-β1+NC-siRNA group(P<0.05).ConclusionHMGA1 interference could significantly down-regulate the expression of HMGA1 in LX-2 cells cultured with TGF-β1,thus inhibiting the proliferation and activation of the cells.
[Key words]high mobility group AT-hook 1;RNAi;hepatic stellate cell LX-2;liver fibrosis
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.17.006
*基金项目:国家自然科学基金资助项目(81360074)。
作者简介:胡蕾(1987-),硕士,主要从事消化系统疾病的研究。△通讯作者,Tel:1360708280;E-mail:jixiangz@tom.com。
[中图分类号]R575.2
[文献标识码]A
[文章编号]1671-8348(2016)17-2323-04
(收稿日期:2015-11-18修回日期:2016-02-22)
