Skp2基因沉默对SPC-A-1肺癌细胞增殖和凋亡的影响
2016-07-15梅同华
李 胜,梅同华
(1.重庆市沙坪坝区人民医院内科 400030;2.重庆医科大学附属第一医院呼吸危重病科 400016)
Skp2基因沉默对SPC-A-1肺癌细胞增殖和凋亡的影响
李胜1,梅同华2△
(1.重庆市沙坪坝区人民医院内科400030;2.重庆医科大学附属第一医院呼吸危重病科400016)
[摘要]目的探讨S期激酶相关蛋白2(Skp2)基因沉默对肺癌细胞增殖和凋亡的影响。方法将Skp2 RNA干扰表达载体转染至SPC-A-1肺癌细胞中,G418筛选获得阳性克隆细胞。通过实时荧光定量(RT-PCR)、蛋白免疫印迹法(Western blot)检测肺癌细胞中Skp2的表达。采用流式细胞术、四甲基偶氮唑盐(MTT)法检测各组肺癌细胞生长、凋亡情况。结果转染Skp2 shRNA表达载体的肺癌细胞中Skp2蛋白表达量明显减少,抑制效率分别可达75.3±5.1,70.4±3.2;转染Skp2 shRNA表达载体的肺癌细胞生长减慢,阻滞于G1期的增多,S期细胞减少。Skp2 shRNA转染质粒组凋亡率较阴性对照组明显增加,细胞凋亡率分别为(17.5±2.8)%、(15.6±3.1)%。结论通过特异性沉默Skp2基因的表达,可有效降低肺癌细胞中Skp2蛋白表达水平,抑制肺癌细胞生长及增加细胞凋亡。
[关键词]肺肿瘤;凋亡;RNA干扰;S期激酶相关蛋白
S期激酶相关蛋白2(S phase kinase associated protein 2,Skp2)是泛素蛋白酶降解过程中一种重要蛋白组成部分,参与周期蛋白的泛素化降解,与细胞周期调节障碍密切相关的可疑癌蛋白,在细胞增殖生长中发挥重要作用[1]。越来越多的研究发现Skp2具有癌基因的潜能,其表达水平及活性与肿瘤发生、发展及生物学性状有关[2-4]。为了研究Skp2在肺癌生长、增殖中的作用,本实验通过构建Skp2 shRNA表达质粒,抑制Skp2基因表达,观察其对人肺癌细胞生物学活性的影响,为肺癌治疗找到新的分子靶点。
1材料与方法
1.1材料Skp2 RNA干扰重组质粒表达载体购于武汉晶赛生物技术公司; SPC-A-1肺癌细胞由上海细胞库提供;兔抗人Skp2抗体、鼠抗人P27抗体购于Santa Cruz公司,羊抗兔抗体、羊抗鼠抗体购于北京中山公司;Annexin V-FITC试剂盒购于晶美生物工程有限公司。
1.2方法
1.2.1细胞培养、转染、细胞筛选SPC-A-1肺癌细胞培养于RPMI培养基。转染前1 d,接种于24孔培养板,用无血清、无抗生素培养基稀释Skp2 RNA干扰表达载体质粒及脂质体。将3种重组质粒Skp2 shRNA-1、Skp2 shRNA-2、Skp2 shRNA-HK(空质粒对照)分别转染至肺癌细胞内,每周换液2次,取阳性克隆肺癌细胞进行扩增培养。
1.2.2实验分组将4组肺癌细胞分为转染质粒组Skp2 shRNA-1组,Skp2 shRNA-2组,Skp2 shRNA-HK组及无质粒的阴性对照组进行研究。
1.2.3肺癌细胞生长曲线检测将4组实验组细胞分别接种于96孔培养板中,移至细胞培养箱中培养,按四甲基偶氮唑盐(MTT)法加入噻唑蓝溶液后继续孵育4 h后,再加入二甲基亚砜,酶联免疫检测仪读取各孔光吸收数值。分别绘制各组细胞生长曲线。每组实验重复3次。每日取1块板检测,连续检测7 d。绘制各组细胞生长曲线。实验重复3次。
1.2.4实时荧光定量PCR(RT-PCR)检测4组肺癌细胞内Skp2 mRNA水平分别收集4组(5×106个/组)肺癌细胞,按照RT-PCR试剂盒说明书操作,检测各组Skp2 mRNA水平。细胞内Skp2 mRNA的相对表达水平以Skp2与β-actin条带灰度值的比值计算。各组实验重复3次。
1.2.5蛋白免疫印迹法(Western blot)检测各组肺癌细胞Skp2、P27蛋白表达提取4组肺癌细胞总蛋白,经凝胶电泳、转膜、封闭,分别加入特异性针对Skp2、P27、β-actin的一抗抗体,再加入稀释后的二抗,最后通过化学发光底物显色。对显色结果进行图像分析,Skp2、P27蛋白的相对表达水平以Skp2、P27与β-actin灰度值的比值表示。实验重复3次。
1.2.6流式细胞术检测细胞周期分别收集4组细胞,每组细胞数为1×107个,用70%乙醇固定24 h,加入RNA酶,37 ℃反应1 h。加入碘化丙啶溶液染色30 min后,在流式细胞仪上进行检测。实验重复3次。
1.2.7流式细胞术检测细胞凋亡情况分别收集实验4组细胞,每组设6孔,收集转染24 h后的细胞,按照凋亡试剂盒说明进行操作。流式细胞术检测记录各组凋亡比例,实验重复3次。
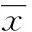
2结果
2.1肺癌细胞生长曲线MTT法结果显示,Skp2 shRNA-1组、Skp2 shRNA-2组细胞生长、增殖速度慢于Skp2 shRNA-HK组及阴性对照组,细胞生长曲线见图1。
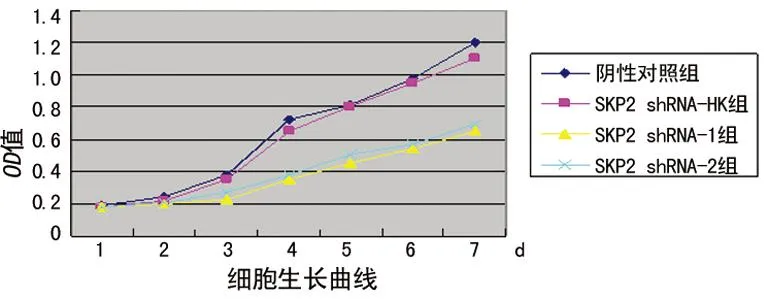
图1 4组肺癌细胞的生长曲线
2.2肺癌细胞内Skp2、P27 mRNA表达情况RT-PCR检测4组肺癌细胞转染前后Skp2、P27 mRNA的表达:Skp2 shRNA-1组、Skp2 shRNA-2组的Skp2 mRNA的表达产物明显弱于Skp2 shRNA-HK组、阴性对照组。Skp2 shRNA-1组、Skp2 shRNA-2组肺癌细胞mRNA与阴性对照组比较,抑制率分别达到(74.2±5.3)%、(61.5±3.4)%,见图2。
M:标准参考物;1:阴性对照组;2:Skp2 shRNA-HK组;3:Skp2 shRNA-1组;4:Skp2 shRNA-2组。
图2Skp2 shRNA对肺癌细胞内Skp2 mRNA
表达水平的影响
2.3各组肺癌细胞内Skp2、P27蛋白表达情况与阴性对照组比较,Skp2 shRNA-1组、Skp2 shRNA-2组细胞内Skp2蛋白表达明显受到抑制,其抑制率分别达到75.3±5.1、70.4±3.2,而转染重组质粒组shRNA-1、shRNA-2 细胞内P27蛋白表达水平明显增加,上升幅度为73.6±4.6、67.2±2.6,而各组间的β-actin表达无明显差异,见图3。

A:Skp2蛋白表达;B:P27蛋白表达;C:内参蛋白表达;1:阴性对照组;2:Skp2 shRNA-HK组;3:Skp2 shRNA-1组;4:Skp2 shRNA-2组。
图3shRNA对肺癌细胞内Skp2、P27蛋白
表达水平的影响
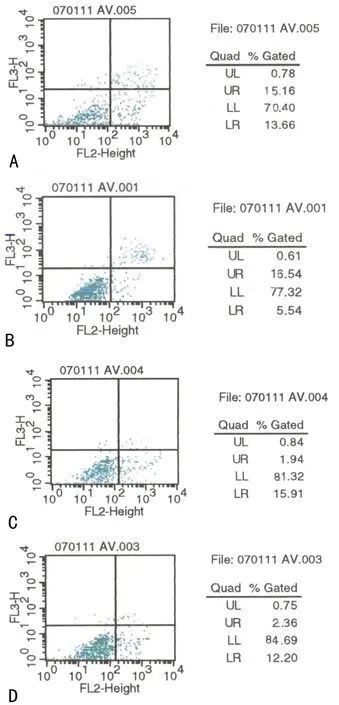
A:Skp2 shRNA-1组;B:Skp2 shRNA-2组;C:Skp2 shRNA-HK组;D:阴性对照组。
图4Annexin V-FITC法对各组细胞凋亡率检测
2.4各组细胞周期的检测流式细胞术检测结果表明,Skp2 shRNA-1组、Skp2 shRNA-2组进入S期细胞比例平均为(22.42±1.52)%、(20.34±1.87)%,低于阴性对照组和Skp2 shRNA-HK组进入S期的细胞比例(30.53%±2.31)%,(29.43±2.24)%,差异有统计学意义(P<0.05);而Skp2 shRNA-1组、Skp2 shRNA-2组停滞于G0/G1期细胞百分数分别为(67.35±2.55)%、(69.43±2.23)%,较阴性对照组及Skp2 shRNA-HK组(56.52±2.33)%、(55.34±2.16)%明显增高,差异有统计学意义(P<0.05);而阴性对照组和Skp2 shRNA-HK组进入S期的细胞比例无明显差别(P>0.05),见表1。
2.5各组细胞凋亡率检测Annexin V-FITC法检测结果表明,Skp2 shRNA-1组、Skp2 shRNA-2组细胞凋亡率与阴性对照组及Skp2 shRNA-HK组相比,两组细胞的凋亡指数出现不同程度的增加,细胞凋亡率分别高达(17.5±2.8)%、(15.6±3.1)%,而阴性对照组的细胞凋亡率为(2.1±0.4)%,Skp2 shRNA-HK组仅为(2.3±0.3)%,差异有统计学意义(P<0.05),见图4。
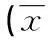
表1 流式细胞技术检测各组细胞周期改变±s,%)
a:P>0.05,与阴性对照组比较;b:P<0.05,与对照组相比;c:P<0.05,与Skp2-shRNA-HK组比较。
3讨论
细胞周期障碍在肿瘤发生、发展中的作用日益受到重视,而泛素蛋白酶体系统功能的异常将导致细胞周期发生障碍,与肿瘤的发生密切相关[5]。Skp2是细胞周期的关键调节因子,属于泛素蛋白连接酶F-box底物识别亚基,能够特异性地识别各种磷酸化蛋白底物,并介导其泛素化降解[6]。Skp2在细胞周期进程、细胞增殖调控方面发挥重要作用,是细胞进入S期所必需因子,Skp2在S期时水平较高,对细胞周期的转换发挥重要作用[7]。在细胞周期蛋白的泛素蛋白降解过程中,Skp2主要通过特异性识别底物,促进底物蛋白泛素化降解而发挥作用。目前发现,E2F、myc、cyclinE、cyclinA、CDC25B,以及细胞周期负性调控因子P27、P21及P57等都是通过Skp2参与的的途径进行降解。Skp2通过调节细胞周期蛋白因子的泛素化降解,促进细胞周期发生转换,从而参与细胞增殖与凋亡的调控,在癌症的发生、发展中发挥重要作用。研究发现,正常细胞中Skp2是低水平表达的,而在绝大多数恶性肿瘤如乳腺癌、前列腺癌、结肠癌、肺癌、胃癌,以及淋巴瘤等肿瘤中均发现有异常高的表达,与肿瘤的恶性程度、侵袭性、转移、预后密切相关,具有癌基因的特性。研究表明Skp2促癌机制与其诱导细胞增殖、抑制凋亡、增强肿瘤的侵袭性及转移活性等多方面的特性有关[2-4]。由于Skp2基因在肿瘤细胞中的特异性表达,并与肿瘤的发生、发展和转移密切相关,因此可能成为肿瘤基因治疗新的靶点。
本实验通过Skp2 shRNA质粒转染肺癌细胞,研究Skp2在肺癌发生、发展中的作用,检测各组肺癌细胞周期的变化,观察其对细胞增殖、凋亡的影响。实验结果表明,转染Skp2 shRNA重组质粒的细胞组与对照组比较,进入S期的细胞比例减少,而停滞在G0/G1期细胞比例增加,沉默Skp2表达阻滞了细胞生长、增殖。本实验观察到转染Skp2 shRNA重组质粒肺癌细胞内Skp2蛋白表达下调同时,P27蛋白表达水平反而上升,也间接证实Skp2可能通过下调P27蛋白表达而在促进细胞增殖中发挥重要作用。关于Skp2对细胞周期影响的具体机制仍不清楚,可能通过抑制Skp2表达,Skp2对负性周期调控因子P27、P21、P57泛素化蛋白降解作用减弱,使上述周期调控因子在细胞内水平的增加,从而抑制了细胞增殖[8-9]。
许多资料表明,肿瘤细胞之所以能在机体内迅速增殖与细胞凋亡机制受到了抑制有关。为进一步探讨Skp2在肿瘤细胞中的抗凋亡作用,笔者检测了转染重组质粒肺癌细胞的凋亡情况。Annexin V-FITC检测结果表明转染质粒组的凋亡指数出现不同程度的增加。结果表明抑制Skp2蛋白的表达能促进SPC-A-1肺癌细胞的凋亡的发生,提示Skp2在肿瘤细胞抗凋亡方面发挥作用。目前Skp2对抗凋亡方面的作用机制,有学者也进行了相关研究和探讨[10-13]。抑制癌细胞Skp2表达后,发现肿瘤细胞凋亡增加,细胞碎片增多,认为细胞凋亡增加与下调Skp2表达后,从而减少了对P27、P53、P21等细胞周期调节蛋白泛素化蛋白降解,上调了上述周期调节蛋白表达水平,激活了细胞内凋亡途径中的重要的凋亡因子caspase-3、 caspase-8、caspase-9活性及增加其水平有关。
本实验通过采用RNAi技术沉默肺癌细胞内Skp2基因表达,进而下调Skp2蛋白表达,增加细胞内周期蛋白P27水平,抑制肺癌细胞的生长,增加了细胞凋亡发生。以Skp2基因为靶点的基因治疗有望在不久的将来应用于肿瘤的治疗,为肺癌的治疗提供新的切入点。
参考文献
[1]Chan CH,Lee SW,Wang J,et al.Regulation of Skp2 expression and activity and its role in cancer progression[J].ScientificWorldJournal,2010(10):1001-1015.
[2]Wang Z,Gao D,Fukushima H,et al.Skp2:a novel potential therapeutic target for prostate cancer[J].Biochim Biophys Acta,2012,1825(1):11-17.
[3]Zhang B,Ji LH,Liu W,et al.Skp2-RNAi suppresses proliferation and migration of gallbladder carcinoma cells by enhancing p27 expression[J].World J Gastroenterol,2013,19(30):4917-4924.
[4]Chan CH,Morrow JK,Zhang S,et al.Skp2:a dream target in the coming age of cancer therapy[J].Cell Cycle,2014,13(5):679-680.
[5]Hershko DD.Oncogenic properties and prognostic implications of the ubiquitin ligase Skp2 in cancer[J].Cancer,2008,112(7):1415-1424.
[6]Bochis OV,Irimie A,Pichler M,et al.The role of Skp2 and its substrate CDKN1B (p27) in colorectal cancer[J].J Gastrointestin Liver Dis,2015,24(2):225-234.
[7]Luo J,Zhou Y,Wang B,et al.Immunohistochemically detected expression of Skp2,p27(kip1),and p-p27 (Thr187) in patients with cholangiocarcinoma[J].Tumour Biol,2015,36(7):5119-5125.
[8]Fagan-SolisKD,PentecostBT,GozgitJM,etal.SKP2overexpressionisassociatedwithincreasedserine10phosphorylationofp27(pSer10p27)
in triple-negative breast cancer[J].J Cell Physiol,2014,229(9):1160-1169.
[9]Sorbye SW,Kilvaer TK,Valkov A,et al.Prognostic impact of Skp2,ER and PGR in male and female patients with soft tissue sarcomas[J].BMC Clin Pathol,2013,13(1):9.
[10]Caraballo JM,Acosta JC,Cortés MA,et al.High p27 protein levels in chronic lymphocytic leukemia are associated to low Myc and Skp2 expression,confer resistance to apoptosis and antagonize Myc effects on cell cycle[J].Oncotarget,2014,5(13):4694-4708.
[11]Chen XM,Bai Y,Zhong YJ,et al.Wogonin has multiple anti-cancer effects by regulating c-Myc/SKP2/Fbw7α and HDAC1/HDAC2 pathways and inducing apoptosis in human lung adenocarcinoma cell line A549[J].PLoS One,2013,8(11):e79201.
[12]Barré B,Perkins ND.The Skp2 promoter integrates signaling through the NF-kappaB,p53,and Akt/GSK3beta pathways to regulate autophagy and apoptosis[J].Mol Cell,2010,38(4):524-538.
[13]Wang J,Huang Y,Guan Z,et al.E3-ligase Skp2 predicts poor prognosis and maintains cancer stem cell pool in nasopharyngeal carcinoma[J].Oncotarget,2014,5(14):5591-5601.
The effect of Skp2 gene silencing on the proliferation and apoptosis of SPC-A-1 lung cancer cells
Li Sheng1,Mei Tonghua2△
(1.DepartmentofInternalMedicine,thePeople′sHospitalofShapingbaDistrict,Chongqing400030,China;2.DepartmentofRespiratoryDiseases,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China)
[Abstract]ObjectiveTo investigate the effect of Skp2 gene silencing on the proliferation and apoptosis of SPC-A-1 lung cancer cells.MethodsSpecific small hairpin RNA (shRNA) targeting Skp2 gene was introduced into lung cancer cells by Lipofectamine 2000 and the positive clones were screened by G418.The Skp2 mRNA and protein expression level of lung cancer cells were detected by RT-PCR and Western blot.MTT method and flow cytometry (FCM) analysis were used to observe the effect of RNAi on proliferation of lung cancer cells.Cell apoptosis was analyzed by FCM.ResultsTransfected with Skp2 shRNA expression vector significantly reduced the expression of Skp2 protein in lung cancer cells.Inhibition efficiency was respectively (75.3±5.1),(70.4±3.2).P27 protein expression was increased significantly in lung cancer cells.The growth of lung cancer cells transfected with Skp2 shRNA was blocked,with Glphase cells increased and S phase cells decreased.The apoptosis rate of cancer cells was higher in Skp2 shRNA groups than in control groups.Apoptosis rates were (17.5±2.8)%,(15.6±3.1)% in Skp2 shRNA groups.ConclusionSpecific inhibition of the expression of Skp2 can slow down the growth of lung cancer cells,increase cell apoptosis.
[Key words]lung neoplasms;apoptosis;RNA interference;S-phase kinase associated protein
作者简介:李胜(1971-),副主任医师,博士,主要从事肿瘤生物学研究。△通讯作者,Tel:(023)89012016;E-mail:mtonghua@163.com。
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.17.009
[中图分类号]R734.2
[文献标识码]A
[文章编号]1671-8348(2016)17-2334-03
(收稿日期:2015-12-18修回日期:2016-03-02)
