黄芩苷对宫颈癌HeLa细胞侵袭转移的抑制作用及其机制
2016-07-14符乔珊
张 悦,符乔珊,刘 韡,高 庆
(1. 西安市第四人民医院妇产科,陕西西安 710004;2. 西安交通大学第二附属医院妇产科,陕西西安 710004)
◇中医药研究◇
黄芩苷对宫颈癌HeLa细胞侵袭转移的抑制作用及其机制
张悦1,符乔珊1,刘韡2,高庆2
(1. 西安市第四人民医院妇产科,陕西西安710004;2. 西安交通大学第二附属医院妇产科,陕西西安710004)
摘要:目的观察黄芩苷对宫颈癌HeLa细胞侵袭转移的作用及其相应机制。方法利用MTT法检测黄芩苷对HeLa细胞增殖的影响;Transwell小室法检测黄芩苷对HeLa细胞侵袭能力的影响;Real-time PCR法检测黄芩苷对MMP-2、MMP-9 RNA表达水平的影响;Western blot法检测黄芩苷对MMP-2、MMP-9蛋白表达的影响;Western blot法检测黄芩苷对P38和p-P38蛋白表达的影响;Real-time PCR法检测黄芩苷和sb203580联合应用对MMP-2和MMP-9 RNA表达水平的影响。结果黄芩苷能够有效抑制HeLa细胞的增值,当质量浓度超过60 μg/mL时,与对照组相比(0 μg/mL)差异出现统计学意义。在低于细胞增殖抑制浓度时,黄芩苷也能够有效抑制HeLa细胞的侵袭,10、20、40 μg/mL组穿过基质胶到达小室底端的细胞数目分别为对照组的(97.58±17.78)%、(67.95±49.75)%和(32.35±20.41)%。黄芩苷能够有效抑制HeLa细胞中MMP-2和MMP-9的表达及有效抑制HeLa细胞中P38的磷酸化水平;P38信号通路抑制剂预处理,能够增强黄芩苷对MMP-2和MMP-9表达的抑制作用。结论黄芩苷能够有效抑制HeLa细胞的侵袭转移,这种作用可能与其通过调节P38信号通路的活性进一步调节MMP-2和MMP-9的表达有关。
关键词:黄芩苷;HeLa细胞;侵袭;P38信号通路;基质金属蛋白酶
宫颈癌是最为常见的妇科恶性肿瘤之一,发病率位于妇科恶性肿瘤的第2位。近年来35岁以下年轻女性中宫颈癌的发病率逐年上升,这与HPV感染率的增高相关。宫颈癌的常规治疗包括手术治疗、放疗、化疗和综合治疗,这些治疗在取得一定疗效的同时会带来较多的副作用和并发症。黄芩苷是从中药黄芩中提取的一种单体化合物,具有抗氧化、抗炎、抗菌、免疫活化和抗病毒等多种功能[1-2]。新近的研究发现,黄芩苷在体内外均有广泛的抗肿瘤作用,且在发挥这种抗肿瘤作用时对正常细胞没有明显毒性[2]。研究发现,黄芩苷对包括结肠癌、乳腺癌、肺癌和淋巴瘤在内的多种肿瘤中具有明确的抗肿瘤作用[3-6]。但关于黄芩素对宫颈癌细胞侵袭转移作用的报道较少。基于以上,本研究拟探讨黄芩素对宫颈癌细胞侵袭转移的作用及其可能机制。
1材料与方法
1.1主要试剂黄芩苷购于美国Sigma公司;Transwell小室购于美国Corning公司;MTT细胞增殖及活性检测试剂、BCA蛋白浓度检测试剂盒、DMSO、Trypsin-EDTA溶液、蛋白分子量标记、细胞裂解液、HRP标记的羊抗兔IgG(H+L)抗体和PVDF膜购于碧云天公司;兔抗人MMP-2、MMP-9,P38和p-P38购于Cellsignal公司;GAPDH购于Santa Crus公司。
1.2细胞培养HeLa细胞为本实验室保有。细胞培养液为含有100 mL/L血清的DMEM培养基,培养基中含有100 U/mL青霉素和100 U/mL链霉素。细胞在37 ℃、50 mL/L CO2的细胞培养箱中培养,每2~3 d换液1次,细胞融合率达到70%~80%时进行传代培养。
1.3黄芩苷溶液的配制利用100% DMSO配制黄芩苷母液,原液质量浓度为60 mg/mL,储存温度为4 ℃。所有实验中用药均采用DMEM培养基现用现配的方法,所有培养液中DMSO的终质量浓度均小于1 g/L。
1.4MTT法检测黄芩苷对HeLa细胞增殖的影响取对数生长期的HeLa细胞,配成密度为5×104/mL悬液接种于96孔板中,每孔接种量为100 μL。细胞贴壁培养6 h后,利用含有黄芩苷药物的溶液培养细胞24 h,药物质量浓度为0、10、20、40、60、80、100 μg/mL,其中0 μg/mL组为对照组。其后96孔板中每孔加入5 mg/mL MTT 10 μL,置于37 ℃环境中培养4 h。在加入DMSO后于酶标仪中选取570 nm进行吸光度(A)读数。每组实验均独立重复3次。
抑制率(IR)(%)=(1-治疗组A/对照组A)×100%。
1.5细胞侵袭实验取对数生长期HeLa细胞,胰酶常规消化后利用含20 mL/L血清的培养基制成5×105/mL细胞悬液,在Tranwell小室上室中加入含有不同浓度黄芩素的细胞悬液0.4 mL,下室中加入血清浓度为100 mL/L的常规培养基。24 h后取出小室对细胞进行固定,用棉签去除上室中残留细胞并对小室底部的细胞进行固定、染色和拍照,并在显微镜下进行计数(每个浓度组随机选择5个视野)。
1.6Real-time PCR检测黄芩苷对MMP-2和MMP-9转录水平的影响Trizol法提取各组细胞总RNA,根据TaKaRa公司PrimeScript RT-PCR Kit试剂说明书进行反转录cDNA。以cDNA为模板进行Real-time PCR反应并对结果进行分析,引物设计见表1。每组实验均独立重复3次。
表1Real-time PCR 引物序列
Tab.1Gene-specific primer pairs used for Real-time PCR
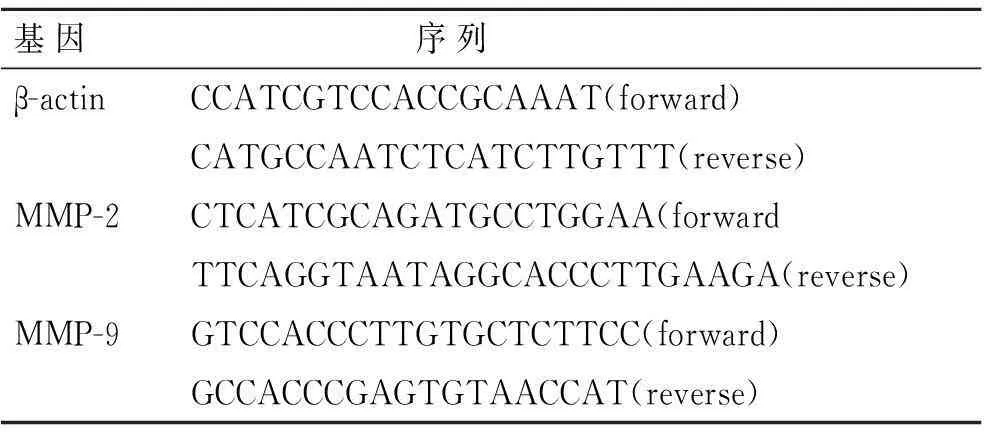
基因序列β-actinCCATCGTCCACCGCAAAT(forward)CATGCCAATCTCATCTTGTTT(reverse)MMP-2CTCATCGCAGATGCCTGGAA(forwardTTCAGGTAATAGGCACCCTTGAAGA(reverse)MMP-9GTCCACCCTTGTGCTCTTCC(forward)GCCACCCGAGTGTAACCAT(reverse)
1.7Western blot检测黄芩苷对侵袭转移相关蛋白的影响黄芩苷处理HeLa细胞24 h后,细胞常规消化,冰PBS洗涤2次,然后加入裂解液进行裂解。利用BCA蛋白定量试剂盒检测蛋白浓度,并根据蛋白提取物浓度确定上样量。SDS凝胶中每孔加入等量蛋白,根据不同分子量的目的蛋白调整电泳时间和电压,其后转膜。转膜结束后,在50 g/L脱脂牛奶中封闭1 h。然后将膜封闭于含有各种抗体的溶液中,4 ℃ 摇床过夜。第2天PBST洗涤3次,每次15 min。然后常温封闭相应二抗1 h。再次用PBST洗涤3次,最后一次用PBS洗涤,时间均为15 min。每组实验均重复3次,最后利用成像系统对结果图像进行采集,并对数据进行分析。
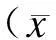
2结果
2.1黄芩苷对HeLa细胞增殖的影响本研究发现黄芩苷能够明显抑制HeLa细胞的增殖,随着黄芩苷浓度的升高,其对HeLa细胞增殖的抑制作用逐渐增强,与对照组相比,当浓度达到60 μg/mL时出现统计学差异(P<0.01,图1)。
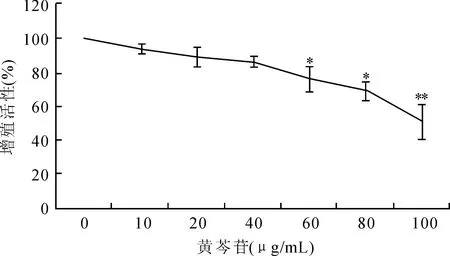
图1黄芩苷对HeLa细胞增殖的抑制作用Fig.1 The inhibition of baicalin on the proliferation of HeLa cells
与0 μg/mL组比较,*P<0.05,**P<0.01。
2.2黄芩苷对HeLa细胞侵袭能力的影响本研究前期实验结果显示,黄芩苷在浓度高于60 μg/mL时,能够明显抑制HeLa细胞的增殖。为此我们选择低于60 μg/mL浓度的黄芩苷作为检测其抗侵袭能力的实验浓度,以消除其抗增殖能力对实验结果的影响。结果显示,在低于细胞毒性浓度的情况下,黄芩苷能够明显抑制HeLa细胞的侵袭,10、20、40 μg/mL浓度组细胞穿过基质胶到达小室底端的细胞数目,分别为对照组的(97.58±17.78)%、(67.95±49.75)%和(32.35±20.41)%,这种抑制作用随着药物浓度的升高而增强,差异具有统计学意义(图2)。
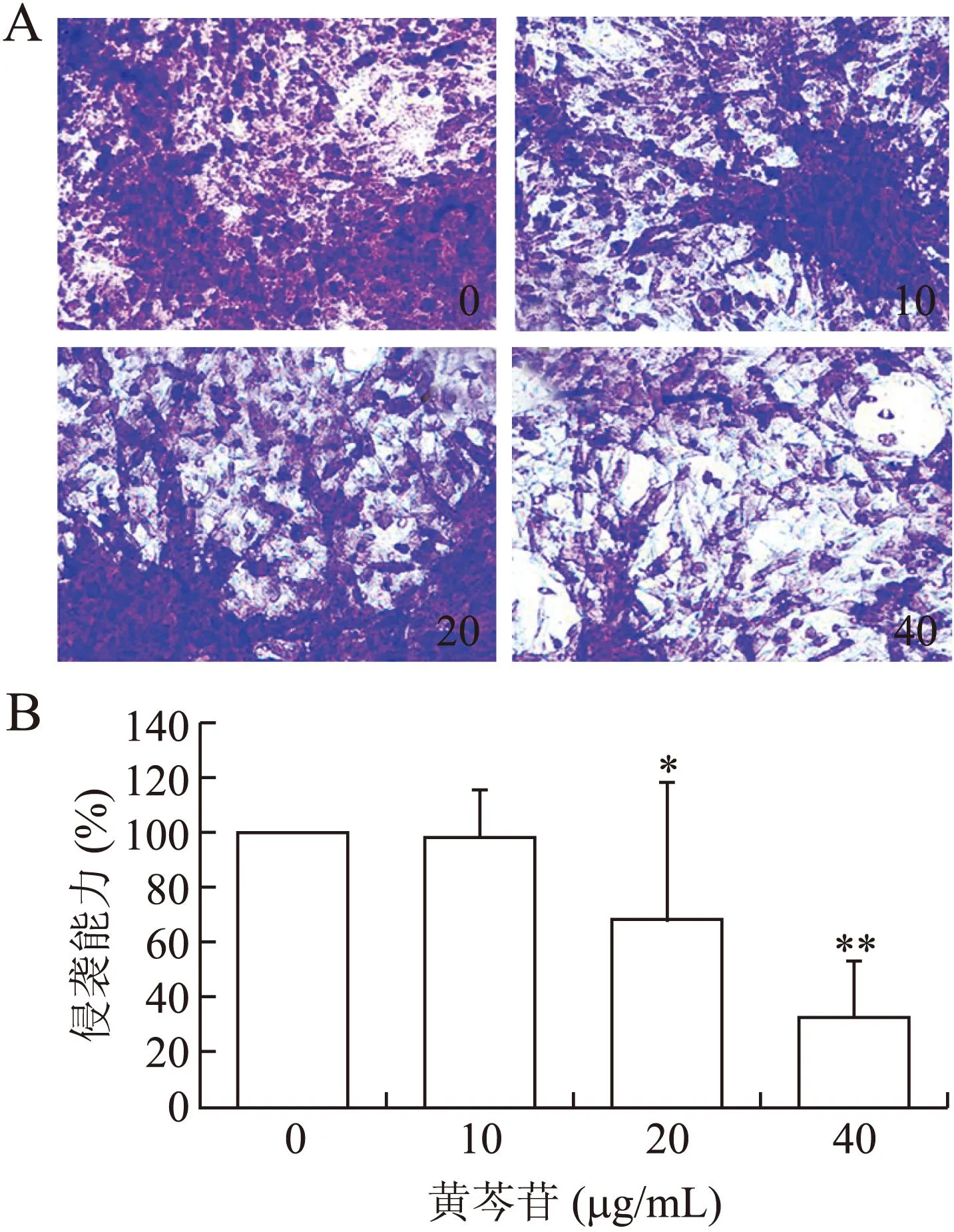
图2黄芩苷对HeLa细胞侵袭转移能力的影响
Fig.2 The inhibitory effect of baicalin on the invasion of HeLa cells
A:不同浓度组穿过基质胶到达小室低端的细胞(紫色);B:对小室底端细胞进行计数后的统计结果。与0 μg/mL组比较,*P<0.05,**P<0.01。
2.3黄芩苷对MMP-2和MMP-9 RNA转录水平的影响为了进一步检测黄芩苷抑制HeLa细胞侵袭转移的机制,我们利用Real-time PCR技术检测了黄芩苷对MMP-2和MMP-9 RNA转录水平的影响。结果发现,黄芩苷能够在RNA水平明显抑制MMP-2和MMP-9的转录,10、20、40 μg/mL浓度组MMP-2为对照组的(72.32±0.49)%、(58.70±11.42)%和(48.12±4.24)%,MMP-9为对照组的(74.37±10.18)%、(62.50±15.89)%和(39.54±6.18)%,差异具有统计学意义(P<0.05,图3)。
2.4黄芩苷对MMP-2和MMP-9蛋白表达的影响同2.3项,我们检测了黄芩苷对HeLa细胞MMP-2和MMP-9蛋白表达的影响。结果发现,黄芩苷能够明显抑制MMP-2和MMP-9的蛋白表达,对照组和黄芩苷治疗组MMP-2和MMP-9的相对表达量分别为0.73±0.1和0.52±0.06,0.95±0.1和0.64±0.07,差异具有统计学意义(图4)。

图3黄芩苷对HeLa细胞中MMP-2和MMP-9转录水平的影响
Fig.3 The effect of baicalin on the transcription of MMP-2 and MMP-9 in HeLa cells at the mRNA level
与0 μg/mL组比较,*P<0.05,**P<0.01。
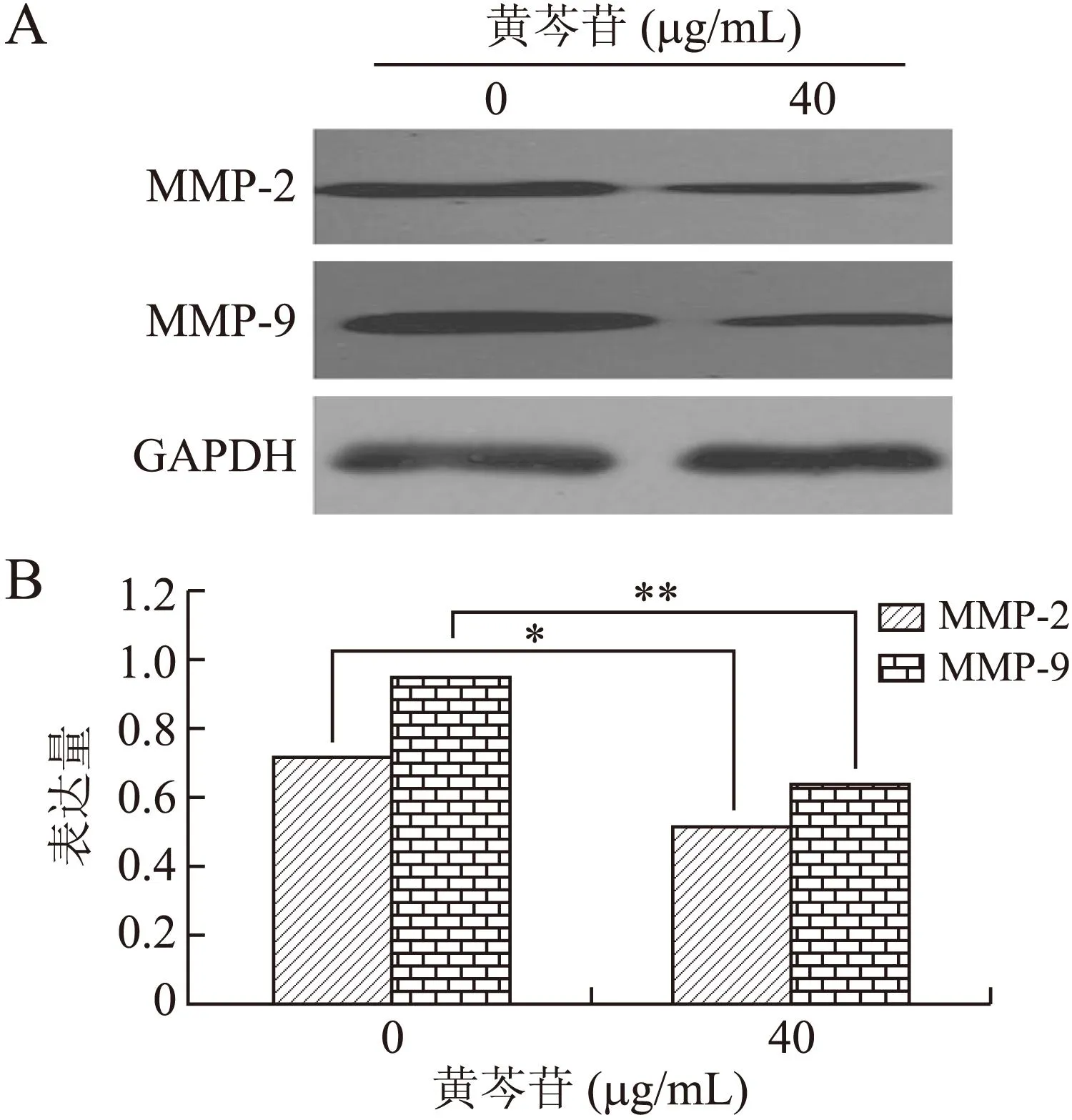
图4黄芩苷对MMP-2和MMP-9蛋白表达的影响
Fig.4 The effect of baicalin on the expressions of MMP-2 and MMP-9 in HeLa cells at the protein level
A:各组细胞MMP-2、MMP-9和GADPH的蛋白表达情况;B:对各蛋白表达的灰度值进行统计后的结果。与0 μg/mL组比较,*P<0.05,**P<0.01。
2.5黄芩苷对P38磷酸化水平的影响为了进一步探讨黄芩苷抑制HeLa细胞侵袭转移的可能调控机制,检测了黄芩苷对P38信号通路活性的影响。结果发现,黄芩苷能够明显抑制P38信号通路的活性。随着黄芩苷浓度的升高P38的磷酸化水平明显降低,差异具有统计学意义(图5)。而黄芩苷与P38信号通路抑制剂联合应用后,sb203580组、sb203580+黄芩素和黄芩苷组MMP-2为对照组的(88.08±5.39)%、(51.85±11.36)%和(67.03±7.23)%,MMP-9为对照组的(84.09±21.58)%、(44.90±3.25)%和(55.47±12.07)%(图6)。

图5黄芩苷对P38信号通路活性的影响
Fig.5 The effect of baicalin on the activity of P38 signal pathway
A:各组细胞中P38和p-P38蛋白的表达情况;B:对各个蛋白的灰度值进行统计后的结果。与0 μg/mL组比较,**P<0.01。
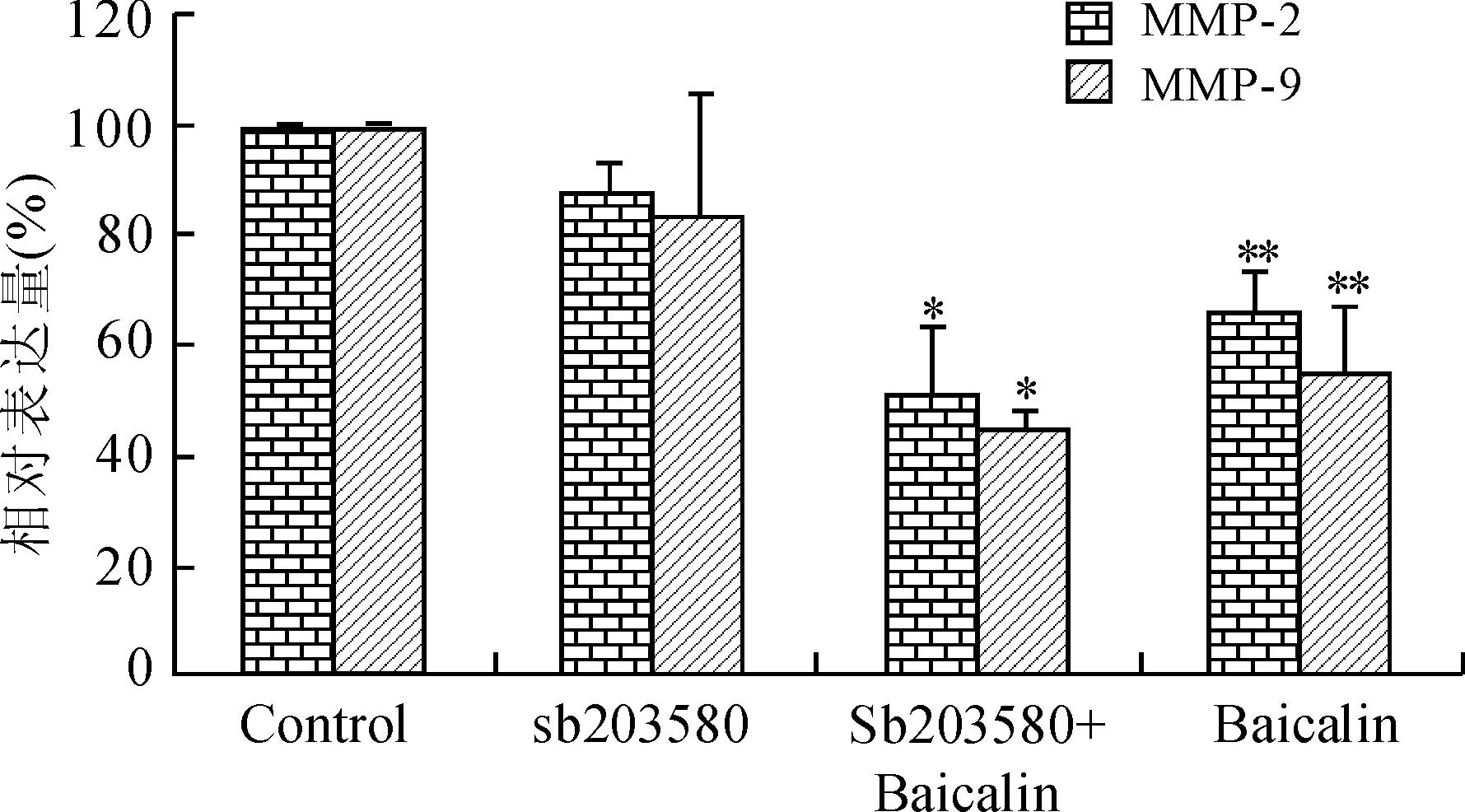
图6黄芩苷与sb203580联合应用对MMP-2和MMP-9表达的影响
Fig.6 The effect of baicalin and sb203580 on the expressions of MMP-2 and MMP-9
与0 μg/mL组比较,*P<0.05,**P<0.01。
3讨论
宫颈癌是最为常见的妇科恶性肿瘤之一,发病率位于妇科恶性肿瘤的第2位。随着HPV的感染率增高宫颈癌呈现出年轻化的趋势,表现为35岁以下年轻女性中宫颈癌的发病率逐年上升[7]。宫颈癌的常规治疗包括手术治疗、放疗治疗、化学治疗和综合治疗。但对于晚期宫颈癌患者,这些治疗在取得一定疗效的同时会带来较多的副作用和并发症。黄芩苷是从中药黄芩中提取的一种单体化合物,具有抗氧化、抗炎、抗菌、免疫活化和抗病毒等多种功能[1]。新近的研究发现,黄芩苷能在对正常细胞无明显毒性的情况下,发挥明显的抗肿瘤细胞作用,提示黄芩苷是一种高效低毒的抗肿瘤中药[2]。但是至今为止还未见关于黄芩苷在宫颈癌侵袭转移过程中作用的报道。本研究发现,黄芩苷能够有效抑制宫颈癌细胞的增殖,同时在低于细胞毒性浓度时也能够有效抑制宫颈癌细胞的侵袭转移。
肿瘤细胞的侵袭转移过程极为复杂,许多分子参与其中。在这个过程中肿瘤细胞需要从原发部位脱离,经过很多环节最终到达转移位点。肿瘤细胞完成这一过程,需要获得新的特性,这些新的特性的获得能够帮助它们从原发肿瘤脱离、迁移进入周围组织,渗入循环系统,到达远处并最终在到达部位形成新的肿瘤病灶。基质金属蛋白酶(Matrix metalloproteinases, MMPs)被认为是促使肿瘤细胞完成侵袭转移过程的关键性分子,其中最具有代表性的是MMP-2和MMP-9。研究发现MMP-2和MMP-9与宫颈癌的发生发展及预后密切相关[1,8]。在MMP-2和MMP-9的表达升高后,宫颈癌细胞的侵袭能力明显增强[9]。而在MMP-2和MMP-9的表达受到抑制之后,宫颈癌的侵袭受到明显抑制[10]。本研究发现黄芩苷能够有效降低MMP-2和MMP-9的转录与表达,提示其对宫颈癌细胞侵袭转移的抑制作用,可能与其对MMP-2和MMP-9表达的抑制作用相关。
P38信号通路对宫颈癌细胞增殖、凋亡等发挥重要的调节作用。既往研究发现,激活P38信号通路能够有效增强下游多种靶点的表达与活化,其中就包括MMP-2和MMP-9[11-12]。此外研究发现,P38信号通路能够通过调节MMP-9启动子位点的活性调节MMP-9的表达,从而进一步调节细胞的侵袭转移[13]。在本研究中发现,黄芩苷能够降低HeLa细胞P38的磷酸化水平,在与P38信号通路抑制剂联合应用后,其对HeLa中MMP-2、MMP-9表达的抑制作用明显增强,提示其对HeLa细胞侵袭转移的抑制作用可能是通过对P38信号通路的活性的调节实现的。
综上所述,本研究发现黄芩苷能够有效抑制宫颈癌细胞的侵袭转移,这种抑制作用与通过下调P38信号通路的活性进一步抑制MMP-2、MMP-9的表达相关。本研究为黄芩苷在宫颈癌临床治疗中的应用奠定了一定的实验基础。
参考文献:
[1] CHEN KL, ZHANG S, JI Y, et al. Baicalein inhibits the invasion and metastatic capabilities of hepatocellular carcinoma cells via down-regulation of the ERK pathway[J]. PLoS One, 2013, 8(9):e72927.
[2] LIANG RR, ZHANG S, QI JA, et al. Preferential inhibition of hepatocellular carcinoma by the flavonoid Baicalein through blocking MEK-ERK signaling[J]. Int J Oncol, 2012, 41(3):969-978.
[3] LI HJ, XIE WL, ZHU J.Antitumor effects of bacailin and its effect on telomerase in tumor celIs[J]. Jiangsu Med J, 2008, 34(4):931-933.
[4] ZHOU QM, WANG S, ZHANG H, et al. The combination of baicalin and baicalein enhances apoptosis via the ERK/p38 MAPK pathway in human breast cancer cells[J]. Acta Pharmacol Sin, 2009, 30(12):1648-1658.
[5] DU GJ, HAN G, ZHANG S, et al. Baicalin suppresses lung carcinoma and lung metastasis by SOD mimic and HIF-1α inhibition[J]. Eur J Pharmacol, 2010, 630(1-3):121-130.
[6] HUANG Y, HU JD, ZHENG J, LI J, et al. Down-regulation of the PI3K/Akt signalling pathway and induction of apoptosis in CA46 Burkitt lymphoma cells by baicalin[J]. J Ex Clin Cancer Res, 2009, 31:48-56.
[7] XU XM. Human papillomaviruses and cervical cancer vaccines: to decode 2008 nobel prize in physiology or medicine. Prog?[J]. Biochem. Biophys, 2008, 35:1095-1103.
[8] ZHOU CY, YAO JF, CHEN XD. Expression of matrix metalloproteinase2,9 and their inhibitorTIMP 1,2 in human squamous cell carcinoma of uterine cervix[J]. Ai Zheng, 2002, 21(7):735739.
[9] ZHU D, YE M, ZHANG W. E6/E7 oncoproteins of high risk HPV-16 upregulate MT1-MMP, MMP-2 and MMP-9 and promote the migration of cervical cancer cells[J]. Int J Clin Exp Pathol, 2015, 8(5):4981-4989.
[10] SONG C, ZHU S, WU C, et al. Histone deacetylase (HDAC) 10 suppresses cervical cancer metastasis through inhibition of matrix metalloproteinase (MMP) 2 and 9 expression[J]. J Biol Chem, 2013, 288(39):28021-28033.
[11] KUMAR KS, PETERSEN BJ, KHANDRIKA L, et al. p38 mitogen-activated protein kinase-driven MAPKAPK2 regulates invasion of bladder cancer by modulation of MMP-2 and MMP-9 activity[J]. Cancer Res, 2010, 70(2):832-841.
[12] WAGNER EF, NEBREDA AR. Signal integration by JNK and p38 MAPK pathways in cancer development[J]. Nat Rev Cancer, 2009, 9(8):537-549.
[13] LOESCH M, ZHI HY, HOU SW, et al. P38 gamma MAPK cooperates with c-Jun in trans-activating matrix metalloproteinase 9[J]. J Biol Chem, 2010, 285(20):15149-15158.
(编辑卓选鹏)
收稿日期:2015-06-25修回日期:2015-10-20
通讯作者:高庆. E-mail: dqinggao@163.com
中图分类号:R737.33
文献标志码:A
DOI:10.7652/jdyxb201604027
Inhibitory effect of baicalin on invasion of cervical cancer HeLa cells and its mechanism
ZHANG Yue1, FU Qiao-shan1, LIU Wei2, GAO Qing2
(1. Department of Obstetrics and Gynecology, Xi’an No. 4 Hospital, Xi’an 710004;2. Department of Obstetrics and Gynecology, the Second Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710004, China)
ABSTRACT:ObjectiveTo observe the anti-metastatic effect and mechanism of baicalin on the growth of HeLa cells was measured by MTT assay, and cell migration baicalin on human cervical cancer HeLa cells. MethodsThe effects of baicalin on the proliferation and invasion of HeLa cells were analyzed by MTT method and Transwell assay. Moreover, Real-time PCR was used for investigating the expressions of MMP-2 and MMP-9 at the RNA level. Western blot was used for investigating the expressions of MMP-2, MMP-9, P38 and p-P38 at the protein level. ResultsBaicalin could significantly inhibit the proliferation of HeLa cells in the dose-dependent manner at the concentration above 60 μg/mL. Anti-metastatic signaling induced by baicalin was characterized by down-regulating the RNA and protein expressions of MMP-2 and MMP-9, and down-regulating the phosphorylation level of P38. Pre-treatment of P38 signal pathway inhibitor could enhance the inhibitory effect of baicalin on the expressions of MMP-2 and MMP-9. ConclusionThese results indicate that baicalin-induced anti-metastatic effect involves the inhibition of MMP-2 and MMP-9 in HeLa cells through P38 signal pathway.
KEY WORDS:baicalin; HeLa cell; invasion; P38 signal pathway; matrix metalloproteinases (MMP)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160620.0837.002.html(2016-06-20)
