瑞舒伐他汀抑制同型半胱氨酸诱导的大鼠主动脉血管平滑肌细胞表型转化及信号通路
2016-07-14孟立平郭航远
杨 博,李 平,孟立平,郭航远
(1. 山东能源新汶矿业集团莱芜中心医院,山东莱芜 271103;2. 绍兴市人民医院心血管内科,浙江绍兴 312000)
◇基础研究◇
瑞舒伐他汀抑制同型半胱氨酸诱导的大鼠主动脉血管平滑肌细胞表型转化及信号通路
杨博1,李平1,孟立平2,郭航远2
(1. 山东能源新汶矿业集团莱芜中心医院,山东莱芜271103;2. 绍兴市人民医院心血管内科,浙江绍兴312000)
摘要:目的验证瑞舒伐他汀是否具有抑制同型半胱氨酸(Hcy)诱导的大鼠血管平滑肌细胞(VSMCs)表型转化的作用及其可能的信号通路。方法SD大鼠主动脉VSMCs原代细胞培养鉴定,取4~7代细胞用于实验。VSMCs分为空白组、100 μmol/L Hcy干预组、Hcy+瑞舒伐他汀干预组、Hcy+雷帕霉素干预组共4组。MTT法测各组VSMCs的增殖;划痕法和Transwell法测各组VSMCs的迁移;ICC法观察各组VSMCs的细胞形态;Western blot 检测各组VSMCs中SM-actin、SM-MHC、calponin、OPN、p-P70S6K1的表达。结果相比于空白组,Hcy组VSMCs增殖和迁移增加;细胞形态变圆;SM-MCH和calponin表达减少(P<0.01);OPN和p-P70S6K1表达增加(P<0.01)。相比于Hcy组,瑞舒伐他汀组和雷帕霉素组VSMCs增殖和迁移减少,细胞形态变的细长,SM-MHC和calponin表达增加(P<0.01);OPN和p-P70S6K1表达减少(P<0.01)。结论Hcy可以促进VSMCs表型转化,瑞舒伐他汀可以抑制Hcy的这一作用,其机制可能是通过抑制mTOR/P70S6K1信号通路实现的。
关键词:瑞舒伐他汀;雷帕霉素;同型半胱氨酸;平滑肌细胞表型转换
血管平滑肌细胞(vascular smooth muscle cells, VSMCs)的增殖和迁移是动脉粥样硬化发展过程中重要的病理基础[1],也是造成支架植入术或冠脉搭桥术后冠脉再狭窄的重要原因[2]。最近有研究显示血管平滑肌细胞在不同的分化阶段具有不同的细胞表型,不同表型之间的平滑肌细胞生理特性相差巨大,并且在外界因素发生变化时,VSMCs不同表型之间可以相互转化[3]。正常血管中的VSMCs一般是已分化的“收缩型”平滑肌细胞,在血管受到损伤时,一些已分化的“收缩型”VSMCs可以去分化成为“合成型”细胞。“收缩型”VSMCs低增殖、低分泌,特异性表达SMA、calponin、SM-MHC等具有标志意义的特征性蛋白,“合成型”VSMCs增殖加快,细胞外基质分泌增加[4],表达“收缩型”细胞所没有的OPN蛋白[5]。现在大量的研究结果显示在粥样斑块中,“收缩型”的VSMCs减少,“合成型”的VSMCs增多[6]。
同型半胱氨酸(homocysteine, Hcy)是目前公认的冠脉粥样硬化的独立危险因素[7-8],我们前期的实验已经证实Hcy可以增强VSMCs的增殖和迁移,诱导VSMCs大量分泌MMPs等影响细胞外基质动态平衡的蛋白酶[9]。王生兰等[10]也通过试验证实Hcy可以促进大鼠血管平滑肌细胞的增殖和表型转化。
瑞舒伐他汀可以显著减少LDLR-/-小鼠主动脉内粥样硬化斑块的面积[11],抑制Hcy诱导的VSMCs表达MMPs等破坏细胞外基质平衡的蛋白[9],但是瑞舒伐他汀是否抑制Hcy诱导的VSMCs表型转化的作用及其机制尚未探明。本实验通过使用mTOR/P70S6K1通路抑制剂雷帕霉素,观察他汀对p-P70S6K1表达的影响,以阐明瑞舒伐他汀是否具有抑制Hcy诱导的VSMCs表型转化的作用及其可能的信号通路。
1材料与方法
1.1材料①实验动物:SPF级SD大鼠,雌雄不限,50 d左右,体质量150~180 g(购自浙江省医学科学院实验动物中心);②实验试剂:瑞舒伐他汀(英国阿斯利康公司),乙醚、甲醇、750 mL/L乙醇、950 mL/L乙醇、无水乙醇、甲醇(杭州化学试剂有限公司),DMEM高糖培养基、PBS、2.5 g/L胰蛋白酶-EDTA、青霉素和链霉素(杭州吉诺公司);同型半胱氨酸(Sigma公司),胎牛血清(GIBCO公司),MTT(Emresco公司);DAPI(Rcohe公司);兔抗大鼠SM-actin单克隆抗体、兔抗calponin、SM-MHC、OPN多克隆抗体(ABCOM公司);辣根过氧化酶标记的山羊抗兔或者抗鼠二抗、FITC、FRITC标记的山羊抗兔IGg(jackson公司);蛋白免疫印迹以及明胶酶谱相关试剂(江苏碧云天生物技术研究所)。
1.2VSMC原代细胞培养以及鉴定采用组织贴块法培育大鼠胸主动脉VSMCs,采用形态学观察和细胞免疫荧光检测平滑肌肌动蛋白(smooth muscle actin, SMA)鉴定VSMCs,通过SMA与DAPI核染之间的关系鉴定VSMCs的纯度。取第4~7代细胞用于后续实验,实验中细胞加干预因素时用含25 mL/L胎牛血清的培养基。
1.3分组及干预细胞实验分为4组:对照组(不加任何干预因素),同型半胱氨酸组(Hcy,浓度为100 μmol/L,以0.1 mL/L DMSO为溶剂),瑞舒伐他汀组(100 μmol/L Hcy+5 μmol/L瑞舒伐他汀,以0.1 mL/L DMSO为溶剂)和雷帕霉素组(100 μmol/L Hcy+20 nmol/L雷帕霉素,以0.1 mL/L DMSO为溶剂)。文献报道DMSO终浓度≤1 mL/L时,可排除DMSO对细胞的毒性作用,所以本实验中没有设0.1 mL/L DMSO溶剂对照组。
1.4MTT法检测VSMCs增殖取4~7代培养细胞,2.5 g/L胰蛋白酶消化单层VSMCs,用含100 mL/L胎牛血清的DMEM高糖培养基配成细胞悬液并计数,以每孔6×103个细胞接种于96孔培养板中。待细胞贴壁后,无血清培养基培养24 h使细胞同步化。各组细胞按上述分组加入对应浓度的干预因子,每组设3个复孔,另设2个空白对照孔(不加细胞)。细胞于37 ℃、50 mL/L CO2孵箱培养24、48、72 h。培养结束,每孔加入MTT液20 μL,37 ℃继续孵育4~6 h,终止培养,小心弃去培养上清,每孔加入150 μL DMSO,震荡10 min,酶联免疫检测仪于490 nm波长测定各孔吸光度值。以时间为横轴,吸光度值为纵轴绘制VSMCs生长曲线。
1.5细胞划痕实验(Wound Healing)检测VSMCs迁移取4~7代培养细胞,2.5 g/L胰蛋白酶消化单层VSMCs,用含100 mL/L胎牛血清的DMEM高糖培养基配成细胞悬液并计数,以每孔105个细胞接种于6孔培养板中,每孔体积2 mL。细胞铺满板底后,无血清培养基培养24 h使细胞同步化,加入1.8 mmol/L羟基脲作用12 h抑制细胞增殖,用100 μL黄色枪头垂直于孔板制造细胞划痕,吸去细胞培养液,用PBS冲洗孔板3次,洗去划痕产生的细胞碎片。加入各组相应的干预因子,于0、12、24、48、72、96 h光学显微镜下观察细胞迁移并拍照,用Image pro plus 6.0分析计算出细胞迁移的面积(划痕面积减去迁移后细胞之间剩余面积),以细胞迁移的面积与最开始的划痕面积的比值表示细胞迁移率。
1.6Transwell法检测VSMCs迁移取4~7代VSMCs,血清饥饿法使细胞同步化,加入1.8 mmol/L羟基脲作用12 h抑制细胞增殖,2.5 g/L胰蛋白酶消化单层VSMCs,用含有各组干预因子的DMEM高糖培养基(无血清)配成细胞悬液并计数(3×104个/mL)。各组24孔板配套的Transwell小室(0.8 μm)的上室加入200 μL细胞悬液,下室加入含有100 mL/L胎牛血清的DMEM高糖培养基500 μL,分别培养4、8、12、24、48 h。干预结束后以棉签轻轻擦去上层未穿透膜的VSMCs,取下Transwell半透膜,TBS洗涤3次,37 g/L多聚甲醛室温固定5 min,流水冲洗后,用2 μg/mL的DAPI染核,PBS冲洗后,荧光显微镜下随机每组取5个视野计数穿膜细胞数计算均值。
1.7细胞免疫荧光法检测SM-actin在细胞中的分布及表达将第4~7代VSMCs接种于96孔板,每孔3 000~5 000个细胞,待细胞贴壁后加入各组干预因子,在细胞融合之前进行检测。先PBS洗3遍,用40 g/L多聚甲醛固定,2.5 mL/L Triton X 100穿破细胞膜,山羊血清室温封闭1 h,加入anti-SMA抗体(1∶250),4 ℃过夜,PBS洗涤3遍之后加入结合有FICT或者FRICT的山羊抗兔二抗,室温孵育1 h后PBS洗涤3遍,荧光显微镜下观察并拍照,用Image Pro Plus 6.0分析。
1.8Western blot检测SM-actin、calponin、OPN、p-P70S6K1的表达各组干预因子干预48 h之后,裂解VSMCs提取蛋白,BCA法蛋白定量。SDS-PAGE胶每孔加入20 μL样品,80 V 30 min进行蛋白浓聚,120 V 2 h进行凝胶电泳,并用孔径0.45 μm硝酸纤维素膜250 mA 90 min进行转膜。转膜完毕经常温下TBST洗膜×3、脱脂奶粉封闭2 h后,以1∶1 000浓度加入兔抗鼠SM-actin一抗(或抗calponin、SM-MHC、OPN、p-P70S6K1β-actin一抗),4 ℃孵育过夜,常温下TBST洗膜×3,辣根过氧化物酶标记的羊抗兔二抗孵育后ECL化学发光法检测目标蛋白和内参。暗室柯达胶片显影,Quantity one软件定量分析。
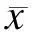
2结果
2.1VSMCs原代培养及鉴定用组织贴块法培养大鼠胸主动脉VSMCs,8 d左右组织块周围有细胞爬出,2周左右细胞融合可以传代。传代后细胞呈典型“峰谷”状排列生长,SM-actin细胞免疫荧光鉴定VSMCs,DAPI核染之后确定细胞纯度在99%以上(图1)。
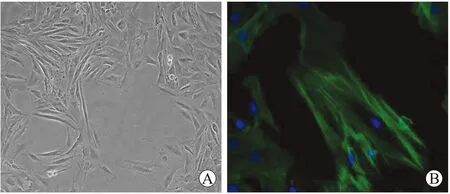
图1大鼠主动脉VSMCs形态学变化(×100)以及细胞免疫荧光鉴定
Fig.1 Identification of the VSMCs’ morphology (×100) and immunocytochemistry (×400)
A:倒置光学纤维镜下见VSMCs呈“峰谷”样生长(×100);B:免疫荧光染色SM-actin鉴定VSMCs纯度。
2.2瑞舒伐他汀抑制Hcy诱导的VSMCs增殖在加入各组干预因素后,12 h和24 h时各组A值没有明显差别。相比于空白对照组,48 h之后Hcy组A值明显升高(P<0.05),说明Hcy可促进VSMCs的增殖;相比于Hcy组,瑞舒伐他汀组和雷帕霉素组A值明显降低(P<0.05),说明瑞舒伐他汀和雷帕霉素具有抑制Hcy诱导的VSMCs增殖的作用(图2)。
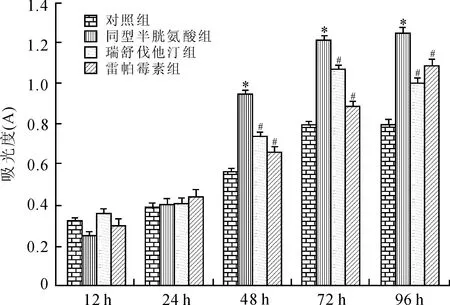
图2各组不同时间点VSMCs增殖情况
Fig.2 Proliferation of VSMCs among different groups at different time points
对照组相比,*P<0.01;与同型半胱氨酸组相比,#P<0.01。
2.3瑞舒伐他汀和雷帕霉素抑制Hcy诱导的VSMCs迁移在划痕之后,各组干预4、8、12、24、48 h,光学纤维镜下观察VSMCs迁移。从8 h开始,相比于对照组,Hcy组VSMCs迁移率明显增加(P<0.01);相比于Hcy组,瑞舒伐他汀组和雷帕霉素组VSMCs迁移率明显减少(P<0.01),说明瑞舒伐他汀和雷帕霉素具有抑制Hcy引起的VSMCs迁移的作用(表1、图3)。各个时间点VSMCs穿透Transwell小室进入下室的细胞数见表2。相比于对照组,Hcy组穿透细胞数明显增多(P<0.01);相比于Hcy组,瑞舒伐他汀和雷帕霉素组穿透细胞数量明显减少(P<0.01,图4)。
表1各组不同时间点VSMCs的迁移率与划痕面积之间的百分比
Tab.1Distance of VSMCs migration area/scratch area at different time points

(%)
与对照组组相比,*P<0.01;与同型半胱氨酸组相比,#P<0.01。
表2VSMCs穿透Transwell小室的细胞数
Tab.2Counts of the VSMCs which penetrated the Transwell chambers (×200)

±s)
与对照组相比,*P<0.01;与同型半胱氨酸组相比,#P<0.01。

图3光镜下观察干预24 h后各组VSMCs的迁移情况
Fig.3 Migration of the VSMCs after each treatment for 24 h (×100)
A:对照组;B:同型半胱氨酸组;C:瑞舒伐他汀组;D:雷帕霉素组。
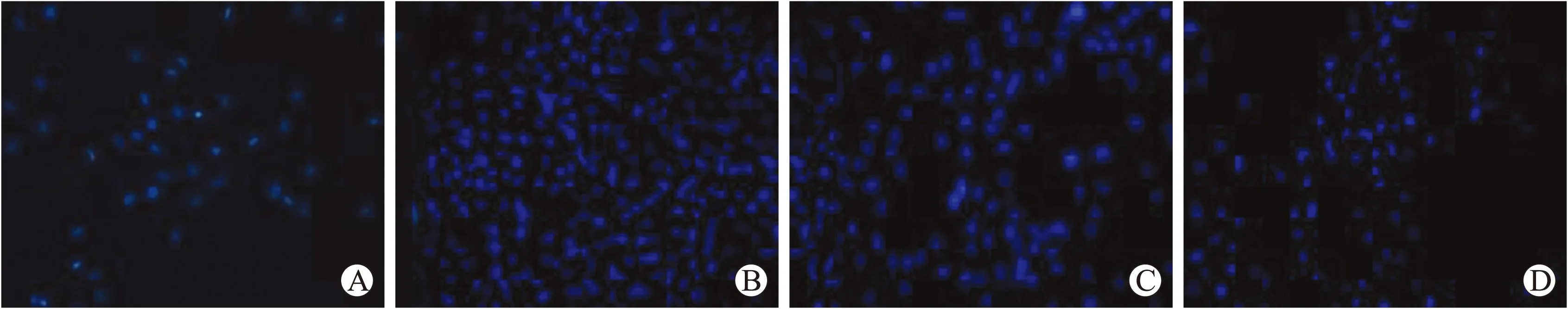
图4VSMCs在Transwell小室培养48 h后各组迁移到下室的细胞DAPI染色图
Fig.4 The migration ability of the VSMCs among groups at 48 h in Transwell chambers (×200)
A:对照组;B:同型半胱氨酸组;C:瑞舒伐他汀组;D:雷帕霉素组。
2.4瑞舒伐他汀和雷帕霉素抑制Hcy诱导的VSMCs形态的变化用SM-actin免疫荧光染色观察各组VSMCs形态变化,结果显示对照组中细胞细长,呈典型的血管平滑肌细胞形态;在100 μmol/L Hcy干预下,平滑肌细胞变圆变小,失去原有的细胞形态;瑞舒伐他汀和雷帕霉素组VSMCs形态恢复正常,表明瑞舒伐他汀和雷帕霉素可以抑制Hcy诱导的VSMCs形态变化(图5)。
2.5SM-actin、calponin、SM-MHC、OPN和p-P70S6K1的表达各组VSMCs中SM-actin的表达量没有显著差异(图6);相比于对照组,Hcy组VSMCs中OPN表达增加(P<0.01),calponin和SM-MCH的表达减少(P<0.05);相比于Hcy组,瑞舒伐他汀和雷帕霉素组VSMCs中OPN表达减少,calponin和SM-MHC表达增多。对照组与Hcy组之间p-P70S6K1的表达没有明显区别;相比于Hcy组,瑞舒伐他汀组和雷帕霉素组VSMCs中p-P70S6K1表达明显减少(P<0.01,图6)。
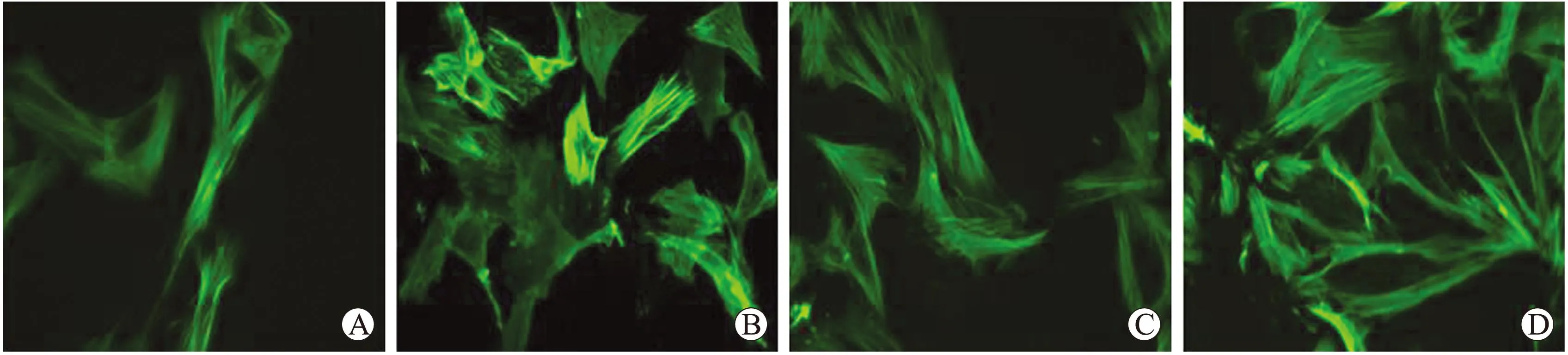
图5细胞免疫荧光法观察各组的细胞形态
Fig.5 Detection of the VSMCs’ morphology by immunocytochemistry (×400)
A:对照组;B:同型半胱氨酸组;C:瑞舒伐他汀组;D:雷帕霉素组。相比于对照组,同型半胱氨酸组VSMCs变圆,失去梭形形态;相比于同型半胱氨酸组,瑞舒伐他汀组和雷帕霉素组VSMCs形态恢复正常。
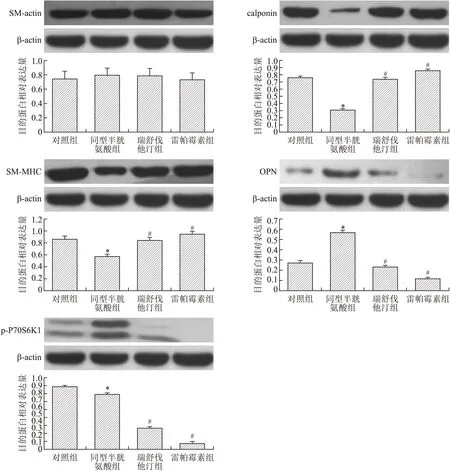

图6 Westernblot检测各组VSMCs中SM-actin,calpo-nin,SM-MHC,OPN和p-P70S6K1的表达Fig.6ExpressionsofSM-actin,calponin,SM-MHC,OPNandp-P70S6K1intheVSMCsdetectedbyWesternblot与对照组相比,*P<0.01;与同型光胱氨酸组相比,#P<0.01。
3讨论
在不同的外界因素影响下,VSMC具有不同的细胞表型,具有很强的可塑性。在正常血管中VSMCs是一种高分化的细胞,细胞形态呈梭形,主要起维持血管形状和收缩血管的作用,具有低增殖、低迁移、低蛋白分泌等特征;当发生动脉粥样硬化等血管疾病时,VSMCs可以去分化为未分化的细胞,形态变圆,细胞收缩性能下降,表现出高增殖、高迁移、高蛋白分泌等特征[12]。过去的观点把VSMCs细胞表型单纯的分为“收缩型”和“分泌型”两种表型[13],现在大量的研究已经证实,在不同强度的外界因素作用下,VSMCs去分化的程度不同,可表现出各种介于“收缩型”与“分泌型”之间的细胞表型特征,从而在很多血管疾病的发生发展中发挥重要的作用[3]。
自从1979年CHAMLEY等第一次发现平滑肌细胞具有不同的细胞表型以来,目前已经发现了一大批特异性比较高的可以当作已分化成熟VSMCs标志的蛋白,比如与细胞收缩密切相关的SM-actin、calponin、SM-MHC、SM22α、smoothelin等蛋白以及参与细胞骨架构成的h-caldesmon、β-vinculin、telokin、metavinculin、desmin等蛋白[4]。这些蛋白在分化成熟的VSMCs中表达,其表达量随着平滑肌细胞的去分化而逐渐减少。相反,最近的研究发现骨桥蛋白(osteopontin, OPN)和糖基质蛋白在去分化的VSMCs中开始表达,并且表达量与细胞的去分化程度正相关[5]。通过检测SM-actin、SM-MHC、calponin、OPN等蛋白的表达情况是近几年来鉴别VSMCs不同细胞表型的常用方法[14-15]。
我们的实验结果显示Hcy可以促进VSMCs的增殖和迁移,使VSMCs细胞形态变圆变小,增加OPN在VSMCs中的表达,减少SM-MHC、calponin蛋白的表达,从而证实了Hcy可以促进VSMCs去分化为“分泌型”的平滑肌细胞。瑞舒伐他汀是一种选择性羟甲基戊二酸甲酰辅酶A还原酶抑制剂,通过减少甲羟戊酸的生成,从而抑制胆固醇的合成,进而降低血清中LDL的水平[16-17]。最近的许多研究表明他汀类药物还具有保护血管内皮细胞、抗氧化、抗炎、抗心肌重构等作用[18-21]。我们的实验结果显示瑞舒伐他汀具有抑制Hcy诱导的VSMCs表型转化的作用,这可能也是其抗动脉粥样硬化的机制之一。
多项研究证实mTOR/P70S6K1通路在调节VSMCs增殖和迁移以及表型转化中发挥着重要的作用。MARTIN等[13]通过实验已经证实mTOR/P70S6K1信号通路在血管平滑肌细胞的表型转化过程中起到关键的调节作用。本实验结果显示,Hcy可以促进p-P70S6K1的表达,我们推测Hcy可能是通过mTOR/P-P70S6K1通路发挥其促进VSMCs表型转化的作用。雷帕霉素是由链球菌属产生的一种大环内酯类抗生素,特异性抑制mTOR信号通路,对多种类型细胞有免疫抑制作用和抗增殖作用。本实验结果显示雷帕霉素可以抑制Hcy诱导的VSMCs表型转化,而且雷帕霉素组p-P70S6K1的表达显著减少。同样,瑞舒伐他汀组VSMCs中p-P70S6K1的表达也明显减少。我们推测瑞舒伐他汀抑制Hcy诱导的VSMCs表型转化的作用可能是通过抑制mTOR/P70S6K1信号通路实现的。
参考文献:
[1] CAGLAYAN E, VANTLER M, LEPPANEN O, et al. Disruption of platelet-derived growth factor-dependent phosphatidylinositol 3-kinase and phospholipase Cγ1 activity abolishes vascular smooth muscle cell proliferation and migration and attenuates neointima formationinvivo[J]. J Am Coll Cardiol, 2011, 57(25):2527-2538.
[2] DEUSE T, KOYANAGI T, ERBEN RG, et al. Sustained inhibition of epsilon protein kinase C inhibits vascular restenosis after balloon injury and stenting[J]. Circulation, 2010, 122(11 Suppl):S170-178.
[3] OWENS GK, KUMAR MS, WAMHOFF BR. Molecular regulation of vascular smooth muscle cell differentiation in development and disease[J]. Physiol Rev, 2004, 84(3):767-801.
[4] ALEXANDER MR, OWENS GK. Epigenetic control of smooth muscle cell differentiation and phenotypic switching in vascular development and disease[J]. Annu Rev Physiol, 2012, 74:13-40.
[5] JIANG H, LUN Y, WU X, et al. Association between the hypomethylation of osteopontin and integrin beta3 promoters and vascular smooth muscle cell differentiation in great saphenous varicose veins[J]. Int J Mol Sci, 2014, 15(10):18747-18761.
[6] GOMEZ D, OWENS GK. Smooth muscle cell phenotypic switching in atherosclerosis[J]. Cardiovasc Res, 2012, 95(2):156-164.
[7] ZHANG D, CHEN Y, XIE X, et al. Homocysteine activates vascular smooth muscle cells by DNA demethylation of platelet-derived growth factor in endothelial cells[J]. J Mol Cell Cardiol, 2012, 53(4):487-496.
[8] HAN XB, ZHANG HP, CAO CJ, et al. Aberrant DNA methylation of the PDGF gene in homocysteine mediated VSMC proliferation and its underlying mechanism[J]. Mol Med Rep, 2014, 10(2):947-954.
[9] SHI YF, CHI JF, TANG WL, et al. Effects of rosuvastatin on the production and activation of matrix metalloproteinase-2 and migration of cultured rat vascular smooth muscle cells induced by homocysteine[J]. J Zhejiang Univ-Sci B, 2013, 14(8):696-704.
[10] 王生兰,刘辉琦,曹学峰,等. 同型半胱氨酸促进大鼠血管平滑肌细胞增殖和表型转化[J]. 中国病理生理杂志, 2010, 26(7):1321-1324.
[11] GUO HY, LV HT, TANG WL, et al. Rosuvastatin may modulate insulin signaling and inhibit atherogenesis beyond its plasma cholesterol-lowering effect in insulin-resistant mice[J]. Cardiovasc Drugs Thera, 2012, 26(5):375-382.
[12] LIU R, LESLIE KL, MARTIN KA. Epigenetic regulation of smooth muscle cell plasticity[J]. Biochim Biophys Acta, 2014. 53(4):487-496.
[13] MARTIN KA, RZUCIDLO EM, MERENICK BL, et al. The mTOR/p70 S6K1 pathway regulates vascular smooth muscle cell differentiation[J]. Am J Physiol Cell Physiol, 2004, 286(3):C507-517.
[14] WAGNER RJ, MARTIN KA, POWELL RJ, et al. Lovastatin induces VSMC differentiation through inhibition of Rheb and mTOR[J]. Am J Physiol Cell Physiol, 2010, 299(1):C119-127.
[15] 方立,陈美芳,余国龙,等. 内皮祖细胞对血管紧张素2诱导的血管平滑肌细胞表型转化的影响[J]. 中国动脉硬化杂志, 2009, 17(6):459-464.
[16] 刘敏,闫杰,张苏川,等. 强化瑞舒伐他汀对冠状动脉造影检查时造影剂肾病的预防作用[J]. 川北医学院学报, 2015, 30(3):377-380.
[17] 蒋小晶,闫亚非,陈新云,等. 瑞舒伐他汀对急性冠脉综合征患者炎症和细胞因子以及心血管事件的影响[J]. 川北医学院学报, 2015, 30(3):366-369.
[18] 樊清波,简立国. 不同剂量阿托伐他汀对急性心肌梗死急诊行PCI患者血清骨桥蛋白的影响[J]. 郑州大学学报(医学版), 2012, 47(6):869-870.
[19] KILIC U, GOK O, ELIBOL-CAN B, et al. Efficacy of statins on sirtuin 1 and endothelial nitric oxide synthase expression: the role of sirtuin 1 gene variants in human coronary atherosclerosis[J]. Clin Exp Pharmacol Physiol, 2015, 42(4):321-330.
[20] FEIG JE, FEIG JL, KINI AS. Statins, atherosclerosis regression and HDL: Insights from within the plaque[J]. Int J Cardiol, 2015, 189:168-171.
[21] TOUSOULIS D, PSARROS C, DEMOSTHENOUS M, et al. Innate and adaptive inflammation as a therapeutic target in vascular disease: the emerging role of statins[J]. J Am Coll Cardiol, 2014, 63(23):2491-2502.
(编辑韩维栋)
收稿日期:2015-12-08修回日期:2016-03-02
基金项目:浙江省自然科学基金项目(No.LY14H020002),
通讯作者:郭航远. E-mail: ghangyuan@hotmail.com
中图分类号:R543.3
文献标志码:A
DOI:10.7652/jdyxb201604008
Rosuvastatin inhibits homocysteine-induced smooth muscle cell phenotype transformation and its signal pathway
YANG Bo1, LI Ping1, MENG Li-ping2, GUO Hang-yuan2△
(1.Laiwu Center Hospital of Shandong Energy Xinwen Mining Group, Laiwu 271103;2. Department of Cardiology, Shaoxing People’s Hospital, Shaoxing 312000, China)
ABSTRACT:Objective To verify whether rosuvastatin can inhibit homocysteine (Hcy)-induced rat aortic vascular smooth muscle cell (VSMC) phenotype transformation and its potential mechanism. Methods The primary culture and identification of rat VSMCs were conducted, using VSMCs in passage4-7 for the following experiments. The VSMCs were divided into 4 groups: control group, Hcy (100 μmol/L) group, Hcy+rosuvastatin group, and Hcy+rapamycin group. MTT was used to investigate the proliferation of VSMCs. Transwell chambers and wound healing were employed to test the migration ability of VSMCs. ICC was used to detect the VSMCs’ morphology. Western blotting was used to investigate the expressions of SM-actin, SM-MHC, calponin, OPN, and p-P70S6K1 in VSMCs of each group. Results Compared with those in control group, the proliferation and migration ability of VSMCs were significantly increased in Hcy modulation group (P<0.01). The expressions of SM-MCH and calponin increased but those of OPN and p-P70S6K1 decreased in Hcy group compared with control group (P<0.01). The expression of SM-actin did not significantly differ between the groups. Compared with those in Hcy modulation group, the proliferation and migration ability of VSMCs were significantly decreased in rosuvastatin and rapamycin groups (P<0.01). The expressions of SM-MCH and calponin increased while OPN and p-P70S6K1 expressions decreased in rosuvastatin and rapamycin groups compared with Hcy group (P<0.01). Conclusion Hcy can induce the dedifferentiation of VSMCs, and rosuvastatin can inhibit this effect of Hcy. Its
KEY WORDS:rosuvastatin; rapamycin; homocysteine (Hcy); vascular smooth muscle cells (VSMCs) phenotype transformation
Supported by the Natural Science Foundation of Zhejiang Province (No.LY14H020002)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160618.1759.002.html(2016-06-18)
potential mechanism may be realized via the mTOR/P70S6K1 signal pathway.
