沉默IFITM1基因对卵巢癌CP70细胞增殖和侵袭能力的影响
2016-07-14高婷婷姚念玲陈必良
杨 蓉,高婷婷,姚念玲,王 建,陈必良
(1. 陕西省第二人民医院妇产科,陕西西安 710004 ;2. 第四军医大学唐都医院妇产科,陕西西安 710038;3. 第四军医大学西京医院妇产科,陕西西安 710033)
◇基础研究◇
沉默IFITM1基因对卵巢癌CP70细胞增殖和侵袭能力的影响
杨蓉1,高婷婷2,姚念玲3,王建3,陈必良3
(1. 陕西省第二人民医院妇产科,陕西西安710004 ;2. 第四军医大学唐都医院妇产科,陕西西安710038;3. 第四军医大学西京医院妇产科,陕西西安710033)
摘要:目的探讨siRNA沉默IFITM1基因表达对卵巢癌CP70细胞增殖和侵袭的影响。方法利用脂质体转染法将靶向IFITM1的小干扰RNA(siRNA)转染卵巢癌细胞株CP70;qRT-PCR和Western blot观察转染后CP70细胞IFITM1 mRNA和蛋白表达的变化;平板克隆形成实验和Transwell小室分别检测各组细胞增殖和侵袭能力的变化。结果转染组CP70细胞的IFITM1 mRNA和蛋白表达明显受抑制;转染组、阴性对照组及转染试剂对照组形成克隆数分别为84、181、178,克隆形成率分别为42%、90.5%、89%,迁移出的细胞分别约为59个、121个、126个,转染组结果与其他两组之间有统计学差异,说明转染IFITM1siRNA抑制了卵巢癌CP70细胞增殖和侵袭能力。结论沉默IFITM1可以降低卵巢癌细胞的增殖和侵袭能力,IFITM1可能成为卵巢癌治疗的潜在新靶点。
关键词:IFITM1;小干扰RNA;卵巢癌;细胞增殖;细胞侵袭
干扰素诱导的跨膜蛋白1(interferon-induced transmembrane protein 1, IFITM1),也称Leu-13或9-27,位于人类11p15.5染色体区,其蛋白相对分子质量为14ku[1]。近年研究报道,IFITM1在结肠癌、肺癌、直肠癌、胃癌及头颈部鳞癌高表达,其在恶性肿瘤中的作用正日益受到广泛关注[2]。在卵巢癌基因表达分析的研究中,国外基因筛查发现IFITM1呈现高表达。本研究前期实验发现IFITM1在卵巢癌组织中表达明显上调,提示IFITM1表达增强可能是卵巢癌的一个初始事件[3]。为了进一步探讨IFITM1基因蛋白表达和功能调控的机制,我们通过脂质体转染技术沉默IFITM1,观察人卵巢癌细胞增殖和侵袭能力的变化,为阐明卵巢癌发生发展的机制及预防治疗提供理论依据。
1材料与方法
1.1细胞株及试剂人卵巢癌顺铂耐药细胞株CP70由西京医院妇产科实验室提供。IFITM1siRNA片段、阴性对照、阳性对照及荧光标记阴性对照由上海吉玛制药技术有限公司设计合成。siRNA序列:siRNA-1,F:UAUAAACUGCUGUA-UCUAGGG,R:CUAGAUACAGCAGUUUAUACC;siRNA-2,F:UCUCUUAAGUUUCUAUUUCCU,R:GAAAUAGAAACUUAAGAGAAA;siRNA-3,F:ACUAGUAACCCCGUUUUUCCU,R:GAAAA-ACGGGGUUACUAGUAG;Negative control,F:UUCUCCGAACGUGUCACGUdTdT,R:DTDTAAGAGGCUUGCACAGUGCA。兔抗人IFITM1单克隆抗体(货号:ab70477)及兔抗人β-actin单克隆抗体购自美国Abcam公司;LipofectamineTM2000购自Invitrogen公司;PCR引物由上海生工生物有限公司合成;Transwell小室购自北京康宁公司。
1.2方法
1.2.1细胞瞬时转染转染前1 d取一6孔板,将对数生长期的卵巢癌CP70细胞制成细胞悬液接种其中,用无双抗的DMEM培养基培养。实验分为3组:转染组(IFITM1siRNA)、阴性对照组(negative control)、转染试剂对照组(mock transfection)。无血清无抗生素的DMEM 100 μL与2 μg siRNA轻柔混匀,将6 μL LipofectamineTM 2000加入无血清无抗生素的DMEM培养液中稀释,轻柔混匀,室温静置5 min。将上述稀释好的siRNA和LipofectamineTM2000柔和混匀,室温静置20 min。取100 μL复合物加入6孔板,轻轻摇晃,常规培养4~6 h后更换新鲜的DMEM培养基,培养48 h。
1.2.2qRT-PCR检测筛选siRNA最优片段收集3组卵巢癌CP70细胞,加入Trizol Reagent试剂提取细胞总RNA,紫外分光光度计测量RNA纯度,反转录成cDNA。IFITM1上游引物:5′-TGAAGTCT-AGGGACAGGAAGATG-3′;下游引物:5′-ACCCCGTTTTTCCTGTATTATC-3′;扩增片段长度:191 bp;退火温度:58 ℃。β-actin上游引物:5′-GTCCACCGCAAATGCTT;CTA-3′下游引物:5′-TGC-TGTCACCTTCACCGTTC-3′;扩增片段长度:190 bp;退火温度:58 ℃。实验重复3次。PCR扩增产物应用ΔΔCT法进行数据分析,筛选出干扰效率最高的siRNA最优片段进行后续实验。
1.2.3Western blot检测siRNA转染后细胞中IFITM1的表达细胞转染48 h后,加入细胞裂解液冰上裂解20 min并离心,提取所需蛋白样品,配胶上样进行SDS-PAGE电泳;将电泳后的凝胶转至NC膜,用TBST配制一抗封闭缓冲液(IFITM1抗体,1∶100,β-actin抗体,1∶100),和上述膜一起装入干净的塑料袋中,旋转过夜。将洗过的膜加入辣根过氧化酶标记的二抗封闭缓冲液(羊抗兔,1∶5 000),摇床封闭1.5 h。在避光下配制发光工作液进行显影定影和发光检测。
1.2.4平板克隆形成实验20 μmol/L顺铂作用48 h后常规消化离心收集细胞沉淀,重悬细胞沉淀,调整细胞密度为1×105个/mL,倍比稀释至1×103个/mL,取200 μL细胞悬液接红纸平皿(每个平皿200个细胞),十字形上下左右晃动至细胞均匀分散,孵箱常规培养2周。当出现肉眼可见克隆时停止培养,甲醇5 mL固定15 min,加入姬姆萨染液染色20 min,自来水冲洗,空气干燥,用带网格的透明胶片计数肉眼可见的克隆数,计算克隆形成率,拍照。
1.2.5Transwell小室提前将Matrigel放入4 ℃保存,用Matrigel包被底部膜的上室面,风干,水化基底膜,每孔加入50 μL无血清培养液(含10 g/L BSA),撤血清饥饿12 h,PBS洗涤细胞沉淀2遍,无血清培养液(含10 g/L BSA)重悬细胞,调整细胞密度至1×105个/mL。取200 μL细胞悬液加入Transwell小室,加入全培养基,孵箱培养24 h,取出Transwell小室,PBS洗涤,950 mL/L乙醇固定10 min,将小室适当风干,1 g/L结晶紫溶液染色,显微镜下随机取5个视野计数,取平均值。
1.2.6统计学方法应用SPSS 17.0统计分析软件对数据进行分析。数据以均数±标准差表示,等级资料比较用秩和检验,计数资料采用χ2检验,各组均数间采用t检验,P<0.05为差异有统计学意义。
2结果
2.1qRT-PCR检测筛选siRNA最优片段采用qRT-PCR检测转染IFITM1 siRNA 48 h后3个片段对靶基因的干扰效果,结果显示,小干扰片段IFITM1 siRNA-3抑制效率最高,以下实验直接选取干扰效率最高的片段IFITM1 siRNA-3进行实验(图1)。
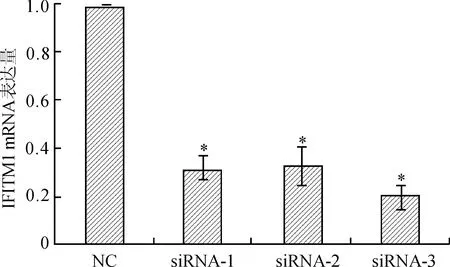
图1qRT-PCR筛选最优IFITM1siRNA小干扰片段
Fig.1 IFITM1mRNA expression detected by real-time qRT-PCR
与阴性对照组(NC)比较,*P<0.05。
2.2siRNA转染CP70细胞后IFITM1的表达变化Western blot结果显示,转染组较转染试剂对照组、阴性对照组中IFITM1蛋白表达水平明显降低(图2)。
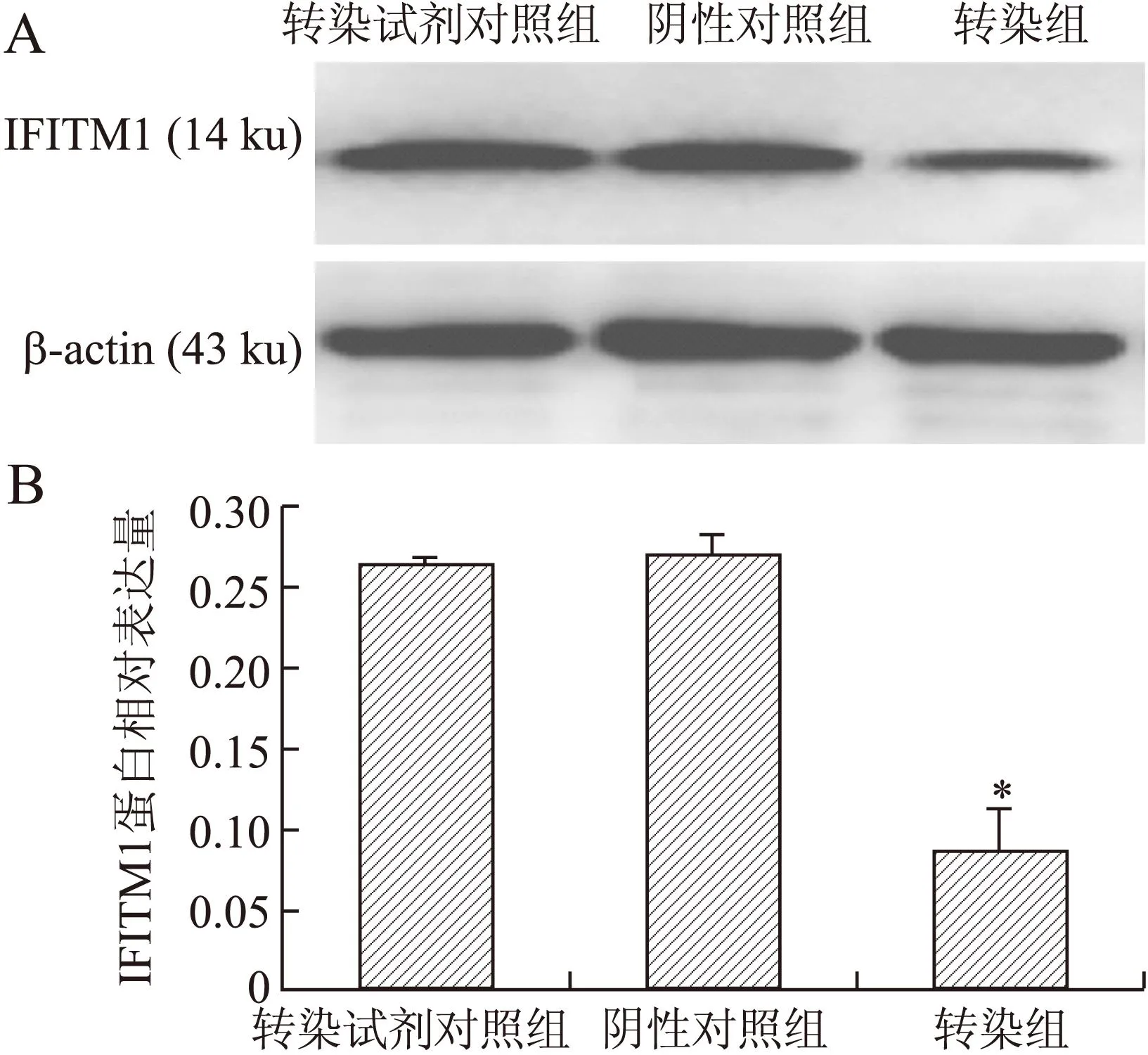
图2Western blot检测转染后IFITM1的表达变化
Fig.2 IFITM1 protein expression detected by Western blot
A:Western blot结果;B:IFITM1蛋白相对表达量。与阴性对照组和转染试剂对照组相比,*P<0.05。
2.3IFITM1 siRNA对CP70细胞增殖能力的影响平板克隆形成实验显示,初始接种细胞200个,转染试剂对照组中形成克隆数为178,其克隆形成率89%;阴性对照组中形成克隆数为181,其克隆形成率90.5%;转染组中形成克隆数为84,其克隆形成率42%。IFITM1 siRNA转染组的克隆形成能力明显小于其他两组,说明IFITM1 siRNA转染增强了CP70对顺铂的敏感性(图3)。
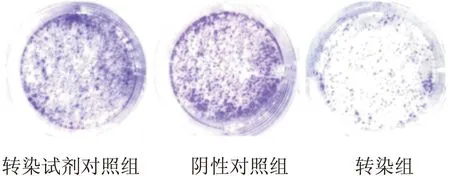
图3平板克隆实验检测CP70细胞增殖的变化
Fig.3 The effect of transfected siRNA on the proliferation of CP70 cells tested by plate clone assay
2.4IFITM1 siRNA对CP70细胞侵袭能力的影响Transwell小室结果显示,转染试剂组和阴性对照组中细胞穿膜数量无明显差异(P>0.05),IFITM1 siRNA转染组穿膜数量明显少于其他两组,差异具有统计学意义(P<0.05),结果表明一直IFITM1表达,CP70细胞的侵袭能力显著降低(图4)。
3讨论
IFITM1通过调控转录水平的众多因子,在不同肿瘤中通过不同的作用机制介导多种生物学功能[4]。刘灏等[5]以结肠癌患者的癌组织提取总RNA,通过RT-PCR扩增、酶切、克隆后免疫小鼠,制备了单克隆抗体并用ELISA、Western blot检测结肠癌组织中IFITM1浓度及含量,提示其远远高于正常的结肠组织,且可能用于结肠癌的早期诊断。另有研究报道,上调结肠癌SW480细胞株的IFITM1表达,其侵袭能力明显增强,推测IFITM1可能促进大肠癌的侵袭和转移[6]。在胃癌组织及细胞中IFITM1的特异性过表达受启动子甲基化作用的影响,通过P38MARK通路发挥其生物学作用[7]。HARRIS等[2]采用人类基因表达数组研究炎症性肠病的相关基因表达变化,发现IFITM1与结肠黏膜免疫和防御反应有关,并强调了表观遗传变化之间的关系以及在小儿溃疡性结肠炎的潜在病原学诊断和治疗的标志物。实验表明,在肝脏细胞接受干扰素治疗的早期IFITM1就被诱导表达,并且在干扰素治疗的HCV感染的人类肝脏中呈现升高[8]。在制定对抗人畜共患埃博拉病毒(EBOV)的策略中,IFITM1与其他效应分子组成的IFN系统可以构成强有力的抑制EBOV传播的屏障[9]。XU等[10]应用DNA基因芯片发现,在咽部肿瘤标记物中IFITM1是代表性的差异表达基因,与肿瘤的发生及紫杉醇耐药相关。IFITM1在人卵巢癌中的作用报道较少。本研究前期实验显示,IFITM1阳性表达定位于细胞膜上,顺铂耐药株CP70的IFITM1染色强度及蛋白表达水平较顺铂敏感株A2780增强。使用相同浓度梯度的顺铂诱导卵巢癌敏感株A2780和耐药株CP70后,IFITM1蛋白的表达水平都呈现增强趋势,并且随顺铂剂量的增加和作用时间的延长而逐渐增强,呈现出剂量及时间的同步依赖性[11]。
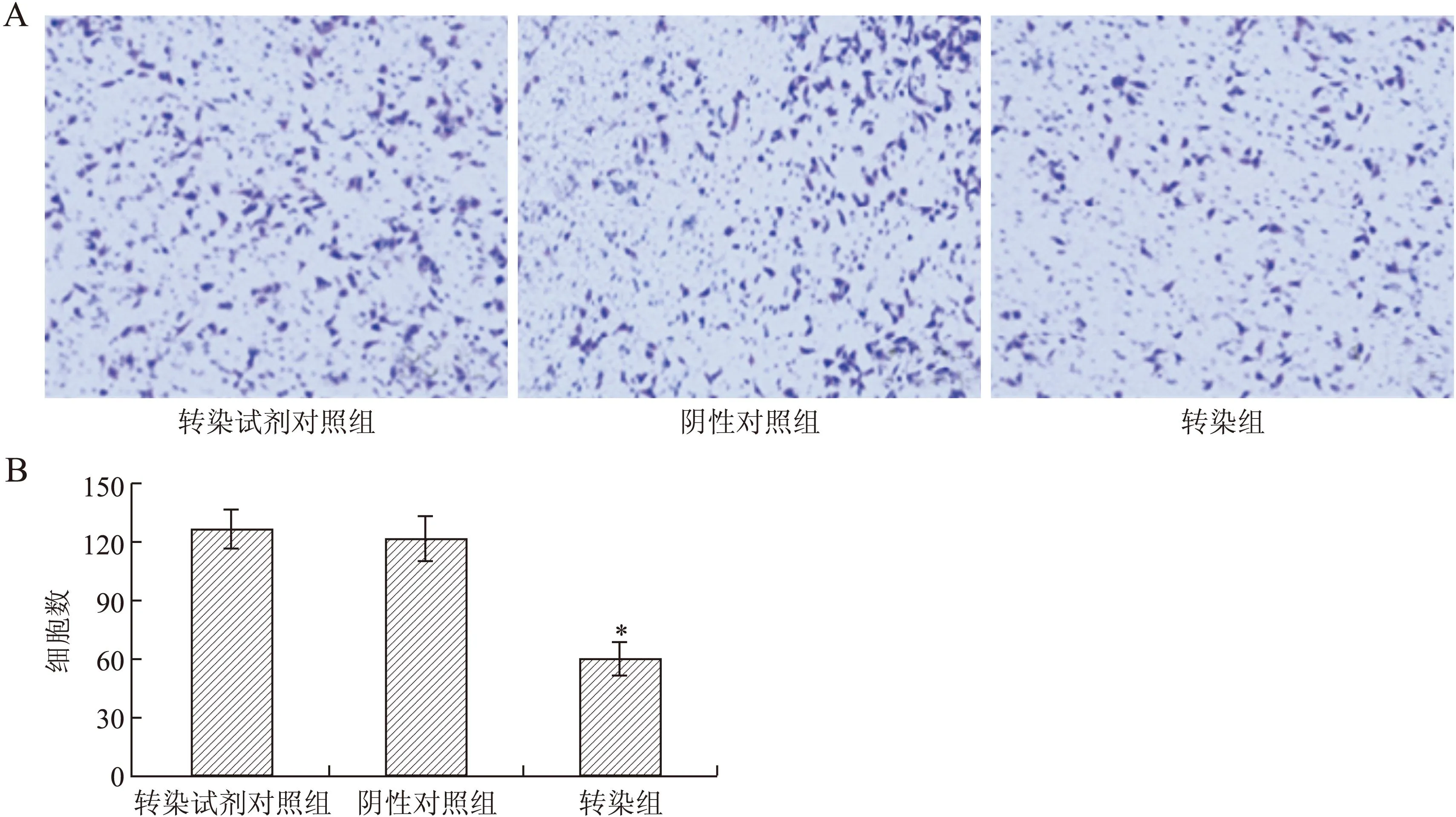

图4 Transwell小室检测IFITM1基因沉默对CP70细胞侵袭能力的影响Fig.4TheeffectoftransfectedsiRNAonthemi-grationofCP70cellstestedbyTranswellchamberA:Transwell实验结果,×100;B:3组穿膜数量统计(与阴性对照组和转染试剂对照组相比,*P<0.05)。
RNAi是一种能够高效抑制靶基因表达的方法[12]。siRNA可对特定基因产生专一性的沉默现象,利用siRNA的互补性标记已知序列的基因,这种功能使siRNA成为基因功能分析、信号传导通路研究、新药物研究及肿瘤基因治疗等领域的重要手段[13]。YU等[14]研究发现,siRNA沉默IFITM1基因能显著抑制神经胶质瘤细胞的迁移和侵袭,可能归因于基质金属蛋白酶9的表达和酶活性下降,降低脑胶质瘤细胞株IFITM1的表达可能抑制脑胶质瘤细胞的增殖、迁移和侵袭。本实验以卵巢癌顺铂耐药细胞株CP70为研究对象,利用IFITM1 siRNA沉默IFITM1的表达,发现敲除IFITM1后CP70细胞中IFITM1在mRNA和蛋白水平表达明显下调。顺铂作用IFITM1siRNA转染组后细胞增殖数量减少,提示通过沉默IFITM1可能抑制CP70的增殖,表明IFITM1与卵巢癌细胞的增殖和耐药可能密切相关。确切的分子作用机制将在后续的实验中探究。迁移能力是肿瘤细胞离开原发灶进行播散的先决条件。有研究表明,MMPs与IFITM1在肿瘤的迁移过程中相互作用, 大多数卵巢癌患者发生顺铂耐药后,出现临床复发转移,直接影响患者的预后[15]。我们通过Transwell显示,IFITM1siRNA转染组中卵巢癌耐药细胞株CP70的细胞穿膜数量显著下降,提示下调IFITM1表达后,卵巢癌细胞侵袭能力明显减弱。
综上所述,IFITM1可能参与了卵巢癌的增殖和迁移,并可能与卵巢癌耐药具有相关性。本发现有助于进一步探讨IFITM1基因在卵巢癌侵袭进展和铂类耐药中的作用机制,为寻找治疗卵巢癌的基因靶点提供新的分子思路。
参考文献:
[1] ARION D, UNGER T, LEWIS D A, et al. Molecular evidence for increased expression of genes related to immune and chaperone function in the prefrontal cortex in schizophrenia[J]. Biol Psychiatry, 2007, 62(7):711-721.
[2] HARRIS RA, NAGY-SZAKAL D, MIR SA, et al. DNA methylation-associated colonic mucosal immune and defense responses in treatment-naive pediatric ulcerative colitis[J]. Epigenetics, 2014, 9(8):1131-1137.
[3] 杨蓉,孙萍,王建. 卵巢上皮性癌中干扰素介导的跨膜蛋白1的表达意义[J]. 现代生物医学进展, 2015, 5(11):839-843.
[4] ARION D, UNGER T, LEWIS D A, et al. Molecular evidence for increased expression of genes related to immune and chaperone function in the prefrontal cortex in schizophrenia[J]. Biol Psychiatry, 2007, 62(7):711-721.
[5] 刘灝,林智琪,付方勇,等. 抗IFITM1单克隆抗体的制备及检测[J]. 现代生物医学进展, 2014, 9(2):1606-1610.
[6] 骆红蕾,喻晓娟,何敬东,等. 干扰素诱导跨膜蛋白1对结肠癌SW480细胞株侵袭和转移能力的影响[J]. 临床肿瘤学杂志, 2011, 16(12):1063-1067.
[7] LEE J, GOH SH, SONG N, et al. Overexpression of IFITM1 has clinicopathologic effects on gastric cancer and is regulated by an epigenetic mechanism[J]. Am J Pathol, 2012, 181(1):43-52.
[8] WILKINS C, WORODWARD J, LAU DT, et al. IFITM1 is a tight junction protein that inhibits hepatitis C virus entry[J]. Hepatology, 2013, 57(2):461-469.
[9] KUHL A, POHLMANN S. How Ebola virus counters the interferon system[J]. Zoonose Public Health, 2012, 59(2):116-131.
[10] XU CZ, SHI RJ, CHEN D, et al. Potential biomarkers for paclitaxel sensitivity in hypopharynx cancer cell[J]. Int J Clin Exp pathol, 2013, 6(12):2745-2756.
[11] 杨蓉,孙萍,宋芳霞,王建. 干扰素介导的跨膜蛋白1与卵巢上皮性癌耐药相关性研究[J]. 现代肿瘤医学, 2015, 10(23):1428-1431.
[12] WANG Z, RAO DD, SENZER N, et al.RNA interference and cancer therapy[J]. Pharm Res, 2011, 28(12):2983-2995.
[13] YEO JH, CHONG MM. Many routes to a micro RNA[J]. Iubmb Life, 2011, 63(11):972-978.
[14] YU F, NG SS, CHOW BK, et al. Knockdown of interferon-induced transmembrane protein 1(IFITM1) inhibits proliferation, migration, and invasion of glioma cells[J]. J Neuro-Oncol, 2011, 103(2):187-195.
[15] HATANO H, KUDO Y, OGAWA I, et al. IFN-induced transmembrane protein 1 promotes invasion at early stage of head and neck cancer progression[J]. Clin Cancer Res, 2008, 14(19):6097-6105.
(编辑卓选鹏)
收稿日期:2015-06-21修回日期:2015-12-03
基金项目:国家自然科学基金资助项目(No.81172458/H1621);陕西省重点课题资助项目(No.2012KTCL03-08)
通讯作者:陈必良. E-mail: cblxjh@fmmu.edu.cn
中图分类号:R692
文献标志码:A
DOI:10.7652/jdyxb201604014
Effect of down-regulated IFITM1 expression on proliferation and migration of ovarian carcinoma cell line CP70
YANG Rong1, GAO Ting-ting2, YAO Nian-ling3, WANG Jian3, CHEN Bi-liang3
(1. Department of Gynecology and Obstetrics, Shaanxi Provincial Second People’s Hospital,Xi’an 710004; 2. Department of Gynecology and Obstetrics, Tangdu Hospital of Fourth Military Medical University, Xi’an 710038; 3. Department of Gynecology and Obstetrics,Xijing Hospital of Fourth Military Medical University, Xi’an 710033, China)
ABSTRACT:ObjectiveTo investigate the inhibitory effect of synthetic interferon-induced transmembrane protein 1(IFITM1) siRNA on the proliferation and migration of human ovarian cancer cell line CP70. MethodsThe siRNA targeted IFITM1 was transfected into CP70 cells by LipofectamineTM2000. Expressions of IFITM1 mRNA and protein were examined by qRT-PCR and Western blot. Plate clone assay and Transwell chamber were used to observe the proliferation and migration of CP70 cells. ResultsIFITM1 siRNA significantly inhibited the expression of IFITM1 in human ovarian cancer cell line CP70 at both mRNA and protein levels. The colony formation assay indicated that the clone number was 84 in IFITM1siRNA, which was much fewer than 181 in negative control group and 178 in mock transfection group. The colony-forming efficiency (CFE) was 42%, 90.5% and 89%, respectively. Transwell chamber results showed that the number of migrated cells was 59, 121 and 126, respectively; the siRNA transfection group differed significantly from the other two groups, indicating that downregulated IFITM1 expression greatly inhibited the proliferation and migration of CP70 cells. ConclusionKnockdown of IFITM1 inhibited the proliferation and migration of CP70 cells. IFITM1 is a potential therapeutic target for human ovarian cancer.
KEY WORDS:interferon-induced transmembrane protein 1 (IFITM1); small interfering RNA; ovarian cancer; cell proliferation; cell migration
Supported by the National Natural Foundation of China (No. 81172458/H1621) and the Key Program of Shaanxi Province (No.2012KTCL03-08)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160615.0846.002.html(2016-06-15)
