热休克蛋白70对小鼠颅脑创伤相关急性胃黏膜病变的保护作用
2016-07-14严贵忠王登峰杨文桢刘吉星侯博儒任海军
严贵忠,王登峰,杨文桢,刘吉星,侯博儒,任海军
(兰州大学第二医院神经外科,甘肃兰州 730030)
◇基础研究◇
热休克蛋白70对小鼠颅脑创伤相关急性胃黏膜病变的保护作用
严贵忠,王登峰,杨文桢,刘吉星,侯博儒,任海军
(兰州大学第二医院神经外科,甘肃兰州730030)
摘要:目的探索热休克蛋白70(HSP70)在小鼠颅脑创伤急性胃黏膜病变模型中的保护作用机制。方法40只成年雄性小鼠,随机分为假手术组(A组)、模型组(B组)、模型组+GGA组(C组)、模型组+生理盐水对照组(D组)。模型制作采用Feeney改良方法制成颅脑创伤急性胃黏膜病变模型;C组同时给予HSP70诱导剂GGA(geranylgeranylacetone,800 mg/kg)灌胃。分别应用免疫组织化学法、TUNEL法检测小鼠脑组织及胃黏膜内HSP70的表达和细胞凋亡。结果B组小鼠脑组织挫伤及胃黏膜损伤范围大于A、C组(P<0.05)。B组小鼠脑组织及胃黏膜内HSP70的表达均有不同程度的升高,高于A组(P<0.05);B、D组脑组织和胃黏膜内细胞凋亡最明显,明显高于A、C组(P<0.05);经GGA灌胃后HSP70蛋白表达明显升高,而细胞凋亡指数明显降低,C组的HSP70表达高于B、D组,而细胞凋亡指数低于B、D组(P<0.05)。结论GGA灌胃后能够诱导HSP70在脑组织和胃黏膜内的表达;抑制细胞凋亡途径是HSP70保护脑组织和胃黏膜的机制之一;GGA可以用于颅脑创伤急性胃黏膜病变的预防和治疗。
关键词:颅脑创伤;急性胃黏膜病变;热休克蛋白70(HSP70);细胞凋亡
急性胃黏膜病变为颅脑创伤(traumatic brain injury, TBI)后发生率较高的严重并发症,严重影响患者的预后[1]。热休克蛋白的表达是机体在应激情况下,发挥防御保护的重要机制之一[2]。早期的研究证实,GGA(geranylgeranylacetone)可以诱导HSP70在胃肠黏膜、肝脏、心脏、中枢神经系统等组织中表达[3]。通过研究GGA诱导HSP70在颅脑创伤急性胃黏膜病变模型中小鼠脑组织和胃黏膜内的表达变化,探讨HSP70在应激状态下的保护作用机制。
1材料与方法
1.1实验动物与分组健康清洁级雄性小鼠,体质量约18~22 g,由兰州大学实验动物中心提供。将40只小鼠随机分为假手术组(A组)、模型组(B组)、模型组+GGA组(C组)、模型组+生理盐水组(D组),每组10只。
模型为颅脑创伤急性胃黏膜病变模型,采用Feeney改良方法制作。小鼠腹腔注射100 g/L水合氯醛(350 mg/kg)麻醉,固定头部后,在右侧顶部磨直径约4 mm的骨窗,骨窗前缘距冠状缝1 mm,内侧缘距中线1 mm,保持硬脑膜完整,将40 g的打击锤从20 cm高处自由落下打击骨窗。C组小鼠在建模前1 d,GGA(800 mg/kg,Sigma公司,美国)灌胃给药;D组以等体积的无菌盐水灌胃作为对照组。
1.2标本取材及病理观察建模6 h,戊巴比妥腹腔麻醉各组大鼠,40 g/L多聚甲醛全身灌注后取出大脑和胃组织,观察脑组织发生挫裂伤、出血、蛛网膜下腔出血的程度,并固定在40 g/L多聚甲醛中,常规脱水,石蜡包埋,5 μm厚度连续切片,常温保存,部分常规进行苏木素-伊红(HE)染色并观察病理改变;部分进行免疫组化、TUNEL细胞凋亡检测分析。
1.3免疫组化染色按HSP70免疫组化试剂盒(Affinity公司,美国 )说明书操作。将制备好的脑及胃组织切片脱蜡去水,内源性过氧化物酶封闭,高温抗原修复,依此滴加羊血清、兔抗HSP70抗体(1∶100),常温结合1 h,生物素标记羊抗兔IgG室温15 min,辣根酶标记链酶卵白素室温15 min,DAB显色,苏木素复染。每张玻片随机取5个视野,OlymPus FSX100显微镜捕捉图片,用Image J图像分析软件分析阳性表达细胞数。
1.4TUNEL检测细胞凋亡按TUNEL试剂盒(七海生物公司,上海)说明操作。切片脱蜡去水,蛋白酶K增加细胞通透性,滴加FITC-标记反应混合物和TdT酶组成的反应液,室温孵育90 min,滴加PI染色液,在暗室中放置5 min。荧光显微镜下分析样本,并统计凋亡细胞数和细胞凋亡率。

2结果
2.1形态学改变小鼠脑组织均观察到明显的挫裂伤、出血及蛛网膜下腔出血;胃黏膜HE染色可见炎性细胞浸润、黏膜脱落、出血等改变。证明颅脑创伤急性胃黏膜病变造模成功(图1)。
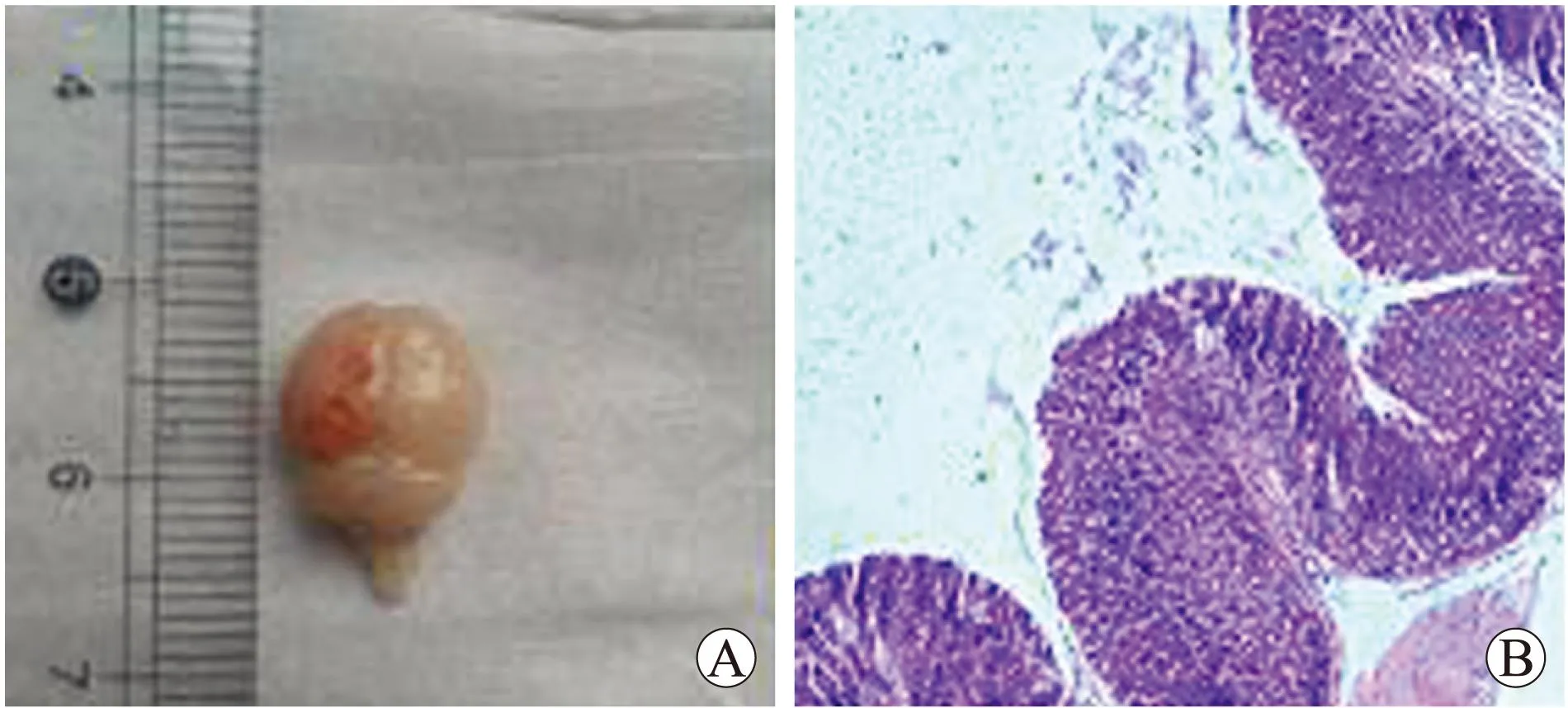
图1小鼠大脑半球可见挫伤及广泛性蛛网膜下腔出血(A)和小鼠胃黏膜HE染色可见炎性细胞浸润和黏膜脱落(B)
Fig.1 Gross view of the contusion and extensive subarachnoid hemorrhage in mouse brain hemisphere (A) and HE staining view of the inflammatory cell infiltration and mucosal shedding in mice gastric mucosa (B)
2.2HSP70在应激时的改变免疫组化标记后,HSP70阳性部位位于胞质;脑组织内广泛表达,包括丘脑、海马等部位;胃内以胃腺部最明显。造模后脑组织及胃黏膜组织HSP70蛋白的表达均有不同程度的升高,B、D组小鼠脑组织和胃黏膜组织HSP70表达明显高于A组(P<0.05,图2、图3)。
2.3TBI引起的细胞凋亡TUNEL标记凋亡细胞发现,脑组织内凋亡细胞主要聚集在损伤灶局部;胃黏膜凋亡细胞广泛存在,无明显的特异性部位。B、D组脑组织和胃黏膜组织细胞凋亡的发生最明显,明显高于A、C组(P<0.05)。
2.4GGA对HSP70及细胞凋亡的影响C组小鼠经GGA灌胃后,在脑组织和胃黏膜组织均可检测到HSP70蛋白表达明显升高,而细胞凋亡数量明显减少,C组小鼠脑组织和胃黏膜内HSP70表达高于B、D组,而细胞凋亡数量低于B、D组(P<0.05,图4)。
3讨论
重型颅脑创伤患者在伤后数小时到数天内即可出现急性胃黏膜病变,主要表现为胃、十二指肠黏膜的糜烂、浅溃疡、渗血等[1]。一般认为,重型颅脑创伤后发生上消化道出血的原因,可能与丘脑、脑干受损后,神经内分泌功能紊乱,致使胃肠黏膜微循环障碍、胃酸分泌增加、黏膜屏障破坏等[4]。颅脑创伤后,很多患者最后死于多脏器功能障碍,而非颅脑创伤原发病。研究认为,多脏器功能障碍的发生与胃肠功能障碍密切相关;颅脑创伤后,胃肠黏膜屏障被破坏,肠道内的细菌及毒素移位,激发了全身免疫炎症反应,释放大量的细胞因子和炎症介质,进一步加剧了全身炎症反应[5]。
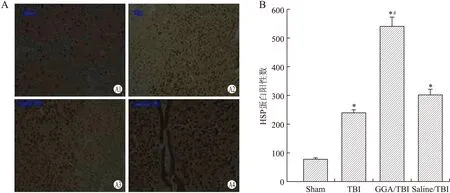
图2不同组间小鼠脑组织HSP70免疫阳性细胞数(A)及统计学比较(B)
Fig.2 Comparison of the expression of HSP70 positive cells in mouse brain(A) in different groups and the statistical comparison (B)A1:Sham(假手术组);A2:TBI(颅脑外伤应激性溃疡模型组);A3:GGA/TBI(模型组+GGA)组;A4:Saline/TBI(模型组+生理盐水)组。与Sham组比较,*P<0.05;与TBI组比较,#P<0.05。

图3不同组间小鼠胃黏膜HSP70免疫阳性细胞数(A)及统计学比较(B)
Fig.3 Comparison of the expression of HSP70 positive cells in mouse gastric mucosa (A) in different groups and the statistical comparison (B)A1:Sham(假手术组);A2:TBI(颅脑外伤应激性溃疡模型组);A3:GGA/TBI(模型组+GGA)组;A4:Saline/TBI(模型组+生理盐水)组。与Sham组比较,*P<0.05;与TBI组比较,#P<0.05。

图4小鼠脑组织(A1)和胃黏膜(A2)凋亡细胞染色及凋亡细胞数的统计学比较(B)
Fig.4 Comparison of the TUNEL positive cells in mouse brain (A1) and gastric mucosa (A2), and the number of TUNEL positive cells (B)
与相应组织Sham组比较,*P<0.05;与相应组织TBI组比较,#P<0.05。
HSP对正常细胞的稳定生长和应激条件下细胞的存活起着重要作用。研究发现,颅脑创伤的程度与HSP70表达的时相及部位密切相关。轻微脑损伤1 h 后,在损伤局部皮层可以检测到HSP70的免疫反应性显著增高;而在重型脑损伤后,HSP70表达的时间推迟到伤后6 h,且表达部位位于局部脑损伤深部的皮层中[6]。HSP70的表达水平与颅脑创伤的程度呈正相关性,且其急性期表达水平对预测预后具有临床意义[7]。KIM等[8]在颅脑创伤中使用HSP70敲除和转基因小鼠的研究发现,HSP70转基因小鼠在颅脑创伤后,与野生型小鼠相比,脑损伤的范围较小,出血量不明显;而相反的,HSP70敲除小鼠在颅脑创伤后,与野生型小鼠相比,脑损伤的范围、出血量明显增加,神经行为学能力更差。这说明HSP70对颅脑创伤具有保护作用。
在HSP家族中,HSP70在保护胃黏膜中起重要作用。下丘脑-垂体-肾上腺轴(the hypothalamic-pituitary-adrenal axis, HPA)激活时,交感神经系统兴奋,引发外周脏器应激性反应,其中包括胃肠黏膜。HSP70在血管内和胃黏膜细胞内的表达,能够明显减轻应激性相关血流动力学障碍,缓解胃黏膜结构的损害[9]。颅脑创伤后,胃黏膜组织中HSP70表达水平的明显增高,可显著减轻应激后胃黏膜损伤程度,对促进溃疡的愈合有着积极的作用。束缚-浸水实验模型小鼠口服HSP70诱导剂GGA后,能诱导胃黏膜细胞高表达HSP70,抑制黏膜炎症反应,促进溃疡的愈合。研究证实,经过GGA灌胃的大鼠能够诱导出HSPs的表达,通过HSPs的保护作用可减轻非甾体抗炎药物(NSAID)药物诱发的急性胃炎病变程度[10]。
HSP70作用广泛,可以作为一种抗凋亡的分子伴侣,控制凋亡的发生,调节炎症反应,保护神经细胞,主要作用机制可能与抑制细胞色素C的释放、抑制凋亡蛋白酶活性因子(Apaf-1)活化、抑制caspase-3诱导的凋亡通路有关[11]。HSP70与Apaf1结合后,抑制凋亡小体的形成,阻止了caspase-3的活化;HSP70还是糖皮质激素受体伴侣分子,参与调节炎症反应。在HSP70存在的情况下,糖皮质激素与受体结合后,抑制了TNFα刺激的IκBα的降解及NF-κB p65的核转运。最近还发现,HSP还能与受体相互作用蛋白-3(RIP3)结合,使TNF诱导的细胞发生程序性死亡[12]。这说明在多个过程中,HSP70维持细胞的存活具有重要作用。EROGLU等[6]发现,HSP70基因缺失的小鼠在遭受颅脑创伤后,脑组织损伤的严重程度及神经细胞的死亡明显重于野生型小鼠。其可能的机制是,HSP70缺失时,ROS诱导的P53靶向基因Pig1、Pig8、Pig12表达明显上升。当使用HSP70诱导剂药物Celastrol或BGP-15干预后,可以发现,在损伤后的第1周内,小鼠脑损伤的程度明显减轻,并且后期的神经功能也能显著改善,可能对减少后期后遗症的发生有重要作用。
GGA是一种无毒性的HSP70诱导剂,经应激作用后,GGA可以放大HSP70对应激的保护作用。由于其脂溶性的分子结构,使其在颅脑创伤后能很容易通过血脑屏障,发挥神经保护的作用。GGA可以迅速、大量诱导HSP70的表达。ZHAO等[13]发现,实验前给予小鼠口服GGA后,能够明显改善颅脑创伤后脑组织的损伤,这种保护作用与HSP70的大量表达有关。另外,GGA对神经系统的保护作用还可能与调节热休克转录因子(heat shock transcription factor-1, HSF-1),影响其他HSPs的上调有关;还可以与重要的转录因子相互作用,抑制TNF-α、IL-1β、IL-6等炎症因子的释放,减轻继发性神经毒性。GGA对胃黏膜的保护作用,不仅与诱导HSP70的大量表达有关,还参与了抑制中性粒细胞浸润,缓解氧化应激损伤相关[14]。
综上所述,颅脑创伤后脑组织及胃黏膜内HSP70表达上调,GGA诱导HSP70的表达参与了创伤后细胞凋亡的病理生理过程。因此,GGA诱导HSP70可以作为保护颅脑创伤急性胃黏膜病变发生机制研究的靶点。
参考文献:
[1] SAPIN MR, AMINOVA GG, SHVETSOV EV, et al. Structure of gastric wall in Wistar rats in health and after experimental traumatic brain injury[J]. Bull Exp Biol Med, 2011, 152(2):245-248.
[2] KACIMI R, YENARI MA. Pharmacologic heat shock protein 70 induction confers cytoprotection against inflammation in gliovascular cells[J]. Glia, 2015, 63(7):1200-1212.
[3] SILVERSTEIN MG, ORDANES D, WYLIE AT, et al. Inducing muscle heat shock protein 70 improves insulin sensitivity and muscular performance in aged mice[J]. J Gerontol A Biol Sci Med Sci, 2015, 70(7):800-808.
[4] 高玉松,扈俊华,罗新名,等. 颅脑损伤大鼠下丘脑前部、延髓内脏带突触膨体素和突触蛋白Ⅰ的表达变化[J]. 中国临床神经外科杂志, 2014, 19(7):418-420.
[5] 徐晓筑,齐玉昌,李强,等. 严重脑外伤患者血浆内毒素和肿瘤坏死因子水平变化与多器官功能障碍综合征的关系[J]. 中国危重病急救医学, 2000, (6):362-363.
[6] EROGLU B, KIMBLER DE, PANG J, et al. Therapeutic inducers of the HSP70/HSP110 protect mice against traumatic brain injury[J]. J Neurochem, 2014, 130(5):626-641.
[7] ROCHA AB, ZANONI C, FREITAS GR, et al. Serum HSP70 as an early predictor of fatal outcome after severe traumatic brain injury in males[J]. J Neurotrauma, 2005, 22(9):966-977.
[8] KIM JY, KIM N, ZHENG Z, et al. The 70 kDa heat shock protein protects against experimental traumatic brain injury[J]. Neurobiol Dis, 2013, 58:289-295.
[9] KO JK, CHO CH. Adaptive cytoprotection and the brain-gut axis[J]. Digestion, 2011, 83(1):19-24.
[10] UMEGAKI E, KURAMOTO T, KOJIMA Y, et al. Geranylgeranylacetone, a gastromucoprotective drug, protects against NSAID-induced esophageal, gastroduodenal and small intestinal mucosal injury in healthy subjects: A prospective randomized study involving a comparison with famotidine[J]. Int Med, 2014, 53(4):283-290.
[11] 王小龙,冯斐斐,孙鹏辉. HSP70、JNK和p38在放线菌素D 诱导的A549细胞凋亡中的作用[J]. 郑州大学学报(医学版), 2014, 49(5):668-671.
[12] BECK IM, DREBERT ZJ, HOYA-ARIAS R, et al. Compound A, a selective glucocorticoid receptor modulator,enhances heat shock proteinHsp70 gene promoter activation[J]. PLoS One, 2013, 8(7):e69115.
[13] ZHAO Z, FADEN AI, LOANE DJ, et al. Neuroprotective effects of geranylgeranylacetone in experimental traumatic brain injury[J]. J Cereb Blood Flow Metab, 2013, 33(12):1897-1908.
[14] KAWAI T, TESHIMA S, KUSUMOTO K, et al. A non-toxic heat shock protein 70 inducer, geranylgeranylacetone, restores the heat shock response in gastricmucosa of protein-malnourished rats[J]. J Lab Clin Med, 2000, 136(2):138-148.
(编辑国荣)
收稿日期:2015-08-08修回日期:2015-11-29
基金项目:甘肃省自然科学基金资助项目(No.145RJZA146)
通讯作者:任海军. E-mail: renhaijunldey@163.com
中图分类号:R641
文献标志码:A
DOI:10.7652/jdyxb201604015
Effects of heat shock protein 70 on mice with traumatic brain injury-related acute gastric mucosal lesions
YAN Gui-zhong, WANG Deng-feng, YANG Wen-zhen, LIU Ji-xing, HOU Bo-ru, REN Hai-jun
(Department of Neurosurgery, Lanzhou University Second Hospital, Lanzhou 730030, China)
ABSTRACT:ObjectiveTo explore the protective mechanism of HSP70 protein in traumatic brain injury (TBI)-related acute gastric mucosal lesions in mice. MethodsForty adult male Balb/c mice were randomly divided into sham (A), TBI (B), TBI+ geranylgeranylacetone (GGA) (C), and TBI+saline (D) groups. TBI was induced via the Feeney impact model. GGA (800 mg/kg) was administered via oral tube beginning before the model was built in group C. The expressions of HSP70 protein in brain and gastric mucosa were determined by immunohistochemistry, and the apoptotic index was detected by TUNEL method. ResultsThe injury area in mouse brain and gastric mucosa was greater in group B than in groups A and C (P<0.05). After model induction, the content of HSP70 protein in group B was markedly higher in the brain and gastric mucosa, which was notably higher than in group A (P<0.05). Obviously apoptotic cells were observed in groups B and D, which were significantly higher than in groups A and C. GGA pretreatment enhanced the up-regulated expression of HSP70 and decreased the apoptotic index distinctly; HSP70 expression was higher in group C than in groups B and D, but the apoptotic index was lower (P<0.05). ConclusionGGA can induce HSP70 protein expression in mouse brain and gastric mucosa. HSP70 is involved in the process of apoptosis inhibition. GGA can be used in the prevention and therapy of TBI-related acute gastic mucosal lesions.
KEY WORDS:traumatic brain injury (TBI); acute gastric mucosal lesions; heat shock protein 70; apoptosis
Supported by the Natural Science Foundation of Gansu Province (No.145RJZA146)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160618.2017.006.html(2016-06-18)
