低压低氧暴露条件下肺动脉高压大鼠循环microRNA表达及其意义
2016-07-14徐娇阳司马玲是文辉刘江伟余伍忠桂俊豪
徐娇阳,司马玲,是文辉,付 勇,刘江伟,周 瑾,余伍忠,桂俊豪
(1. 开封市中心医院检验科,河南开封 475000;2. 兰州军区乌鲁木齐总医院,新疆乌鲁木齐 830000)
◇基础研究◇
低压低氧暴露条件下肺动脉高压大鼠循环microRNA表达及其意义
徐娇阳1,2,司马玲2,是文辉2,付勇2,刘江伟2,周瑾2,余伍忠2,桂俊豪2
(1. 开封市中心医院检验科,河南开封475000;2. 兰州军区乌鲁木齐总医院,新疆乌鲁木齐830000)
摘要:目的研究低压低氧暴露条件下肺动脉高压(HPH)模型大鼠循环microRNA(miRNA)表达的变化。方法利用基因芯片技术定量检测、分析HPH组及对照组大鼠血清中潜在的循环miRNA的表达及其差异。基于病例-对照设计,采用荧光定量PCR技术对差异化表达miRNA进行验证。受试者工作特征曲线(ROC)分析测试4种差异化表达miRNA对HPH组及对照组的鉴别效能。结果与对照组比较,HPH组大鼠13种miRNA表达上调,10种miRNA表达下调,其中,荧光定量PCR初步证实miR-451、miR-505及let-7d表达上调,而miR-214表达下调。ROC分析结果显示,miR-451、miR-505及let-7 d用于鉴别HPH组大鼠和对照组大鼠的曲线下面积(AUC)分别为0.979、0.938和0.993。结论低压低氧暴露条件下HPH组大鼠与对照组大鼠循环miRNA的表达存在显著差异,提示血清miRNA差异化表达可能与HPH病理变化相关。
关键词:低氧性肺动脉高压;循环miRNA;基因芯片;荧光定量PCR
低压低氧暴露能够诱发机体的一系列生理病理变化,其中,慢性缺氧诱发的低氧性肺动脉高压(hypoxic pulmonary hypertension, HPH)是高原心脏病、高原肺水肿等高原特有的多发疾病发生发展的中心环节,低压低氧暴露条件下HPH相关生物标志物的发掘对于疾病的早期预警和治疗具有重要意义。
近来研究发现[1-2],血清或血浆中稳定存在的循环microRNA(miRNA)有望成为多种临床疾病的新型生物标志物。本文采用基因芯片及荧光定量PCR技术对低压低氧诱发的HPH大鼠及其对照组血清miRNA表达谱进行分析和初步验证,探索低压低氧暴露条件下HPH大鼠循环miRNA表达的变化及意义。
1材料与方法
1.1主要试剂血清总RNA抽提试剂盒及荧光定量PCR试剂均购自Applied Biosystem公司;基因芯片购自Agilent Technologies公司。
1.2研究对象及分组6周龄清洁级SD雄性大鼠24只[体质量为(200±20 g)],购自新疆医科大学实验动物中心,采用随机数字表法分为HPH组和常氧对照组,每组12只。本研究方案经由新疆医科大学动物伦理委员会审查通过。
1.3动物模型建立①西北特殊环境人工实验舱(兰州军区乌鲁木齐总医院)参数设定。模拟海拔高度为6 000 m;舱内压力47.3 kPa;温度22 ℃;湿度23.4% RH;相对氧浓度约为11.3%。
②低压低氧处理。将HPH组SD大鼠置于人工气候舱内,运行时间为24 h/d,昼夜比12 h∶12 h,保证其水及饲料充足,每2 d开舱半小时为其更换饲料、水以及垫料。根据预实验结果,以低压低氧14 d作为暴露终点。常氧对照组除低压低氧条件外,其他条件均同低氧组。
1.4肺动脉压力检测将两组大鼠在出舱后立即进行肺动脉压力检测:大鼠经麻醉、固定后,气管插管行机械通气(呼吸频率60次/min,潮气量6 mL,呼吸比3∶2),开胸后,用7号针头在肺动脉根部1 cm处逆血流方向刺入肺动脉,针头另一端连接压力传感器及生理信号记录仪,记录平均肺动脉压力(mPAP)。
1.5标本采集经下腔静脉采集大鼠静脉血5 mL于无抗凝剂普通管,室温静置30 min,3 000×g离心10 min,将上层血清转移至1.5 mL离心管,12 000×g离心10 min,将上清液转移至新的离心管,-80 ℃冻存备用。
1.6基因芯片检测参考相关文献[3]制备血清池样本,即:从每一份HPH组大鼠血清各取200 μL,共计12份,然后随机将每3份血清充分混匀,获得1份血清池样本,由此共获得4份HPH组大鼠血清池样本。同法制备4份对照组大鼠血清池样本。将此8个研究样本用于miRNA的基因芯片检测。基因芯片检测步骤如下:血清池样本经过总RNA抽提、样本质检合格后,进行芯片杂交、洗涤、扫描及数据处理。芯片样本根据变异系数(CV值)判定芯片体系的稳定性,通过两组数据间的比较分析判断芯片体系是否稳定。
1.7miRNA的荧光定量PCR检测将HPH组及对照组共24份血清样本,加入外源性人工合成的线虫miR-39作为参照,随后按照mirVana PARIS Kit(Ambion公司)试剂盒说明书进行血清总RNA抽提,对抽提得到的血清总RNA浓度进行定量,根据定量结果,将每一份样本总RNA水平统一调整至2 ng/μL。
反转录(RT)和miRNA的荧光定量PCR检测按照Applied Biosystem公司的TaqMan(R) microRNA RT Kit和TaqMan microRNA Assay试剂盒说明书进行。
PCR反应体系共10 μL,包括RT产物稀释液4.5 μL、TaqMan基因表达定量主反应液(Universal Master Mix II)5.0 μL和探针引物混合液0.5 μL。同时每次扩增均设立无模板对照(no template controls, NTCs)以判断系统是否出现污染。PCR循环参数设置为:95 ℃ 10 min,95 ℃ 15 s、60 ℃ 1 min 40个循环,60 ℃进行荧光收集。每个样本均做3个复孔。

2结果
2.1两组大鼠平均肺动脉压力(mPAP)的比较HPH组大鼠mPAP[(28.13±2.53)mmHg]较对照组大鼠[(19.13±1.25)mmHg]显著升高(P<0.01)。
2.2两组大鼠血清池总RNA的定量结果对8份血清池样本进行血清总RNA的抽提,定量结果显示,8份血清标本总RNA浓度差异不大,在8.6~9.8 ng/μL之间,抽提总体积为15 μL,标本RNA总量介于129.0~147.0 ng之间,符合芯片检测限要求。
2.3基因芯片的数据分析结果本研究累计用于基因芯片检测的血清池样本共8份,其中4份来自HPH组大鼠(编号分别为H-1、H-2、H-3、H-4),另外4份来自对照组大鼠(编号分别为C-1、C-2、C-3、C-4)。本实验用经过10次重复的探针点信号的CV值计算芯片和技术的稳定性,芯片样本符合Agilent芯片质控标准(CV值<15%,平均小于10%)。
聚类分析结果显示,血清中差异化表达的循环miRNA可以明确地将8份样本区分为HPH组和对照组(图1)。其中,与对照组比较,HPH组大鼠13种miRNA表达上调,10种miRNA表达下调(图2)。

图18个血清池样本循环miRNA表达的聚类分析(P<0.05)
Fig.1 Circulating miRNAs of 8 serum pool samples profiled using cluster analysis (P<0.05)
红绿色阶表明miRNA的表达量由低(绿色)到高(红色)的变化。

图223种差异化表达miRNAs及其倍数变化
Fig.2 Fold change of 23 differentially expressed miRNAs
2.4候选miRNA荧光定量PCR的检测结果根据FC>2,P<0.05的阈值标准,对基因芯片筛选的6种候选miRNA进行荧光定量PCR的验证。结果显示,除miR-455、miR-455-5P外,miR-451、miR-505、let-7d及miR-214的PCR结果与基因芯片结果基本一致(图3)。
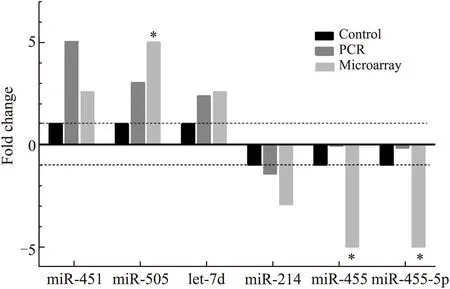
图36种差异化表达miRNAs PCR结果与芯片结果一致性的比较
Fig.3 Consistence comparison between PCR and microarray of 6 differentially expressed miRNAs
*基因芯片检测出倍数差异>5倍,其中miR-505、miR-455和miR-455-5P的倍数差异分别为22.67倍、7.14倍和100倍以上。
2.5差异化表达miRNA的ROC曲线分析结果为探讨差异化表达miRNA的意义,本文采用ROC曲线分析方法测试了4种差异化表达miRNA对HPH组及对照组的鉴别效能。除miR-214在两组间△Ct值比较的P值>0.05外,miR-451、miR-505、let-7d的P值均<0.01,且用于鉴别HPH组和对照组的曲线下面积(area under curve,AUC)均大于0.9。通过最佳cut-off值分析,得到这3种miRNA的敏感性和特异性分别为91.67%和91.67%、75%和91.67%、100%和91.67%(图4)。
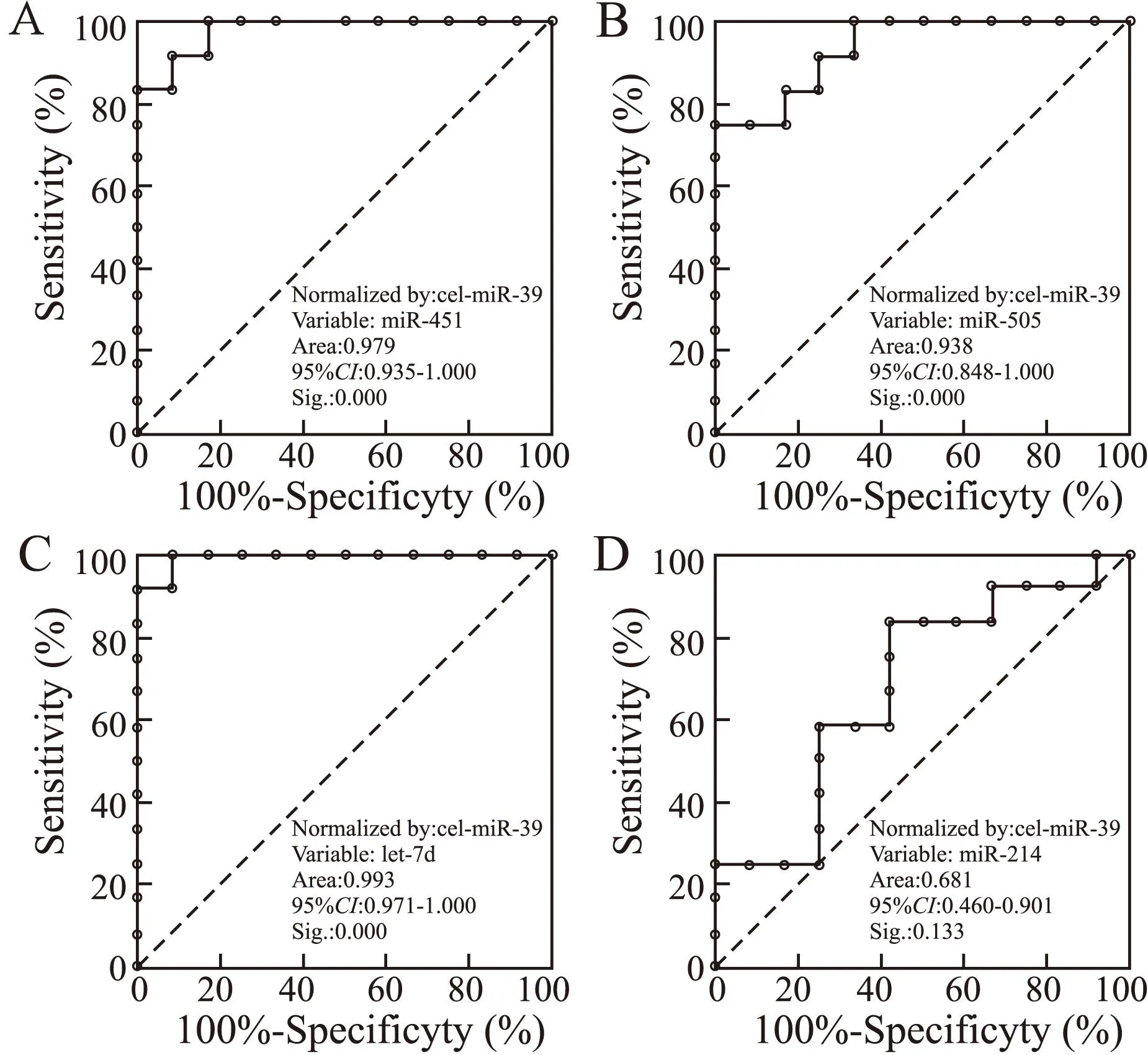
图4miR-451(A)、miR-505(B)、let-7d(C)及miR-214(D)对HPH组及对照组的鉴别效能
Fig.4 ROC curve analysis of miR-451 (A), miR-505 (B), let-7d (C) and miR-214 (D) in distinguishing different groups
3讨论
多项研究表明,循环miRNA的表达可随人体生理病理状况、疾病进程等的不同而发生变化,进而可能为不同疾病的诊断、病程管理等提供新的参考[3-8]。
循环miRNA作为肺动脉高压的标志物已有研究。RHODES等[9]通过基因芯片技术筛选了8名肺动脉血压患者和8名健康对照志愿者的血浆总RNA中miRNA表达的变化,之后通过PCR技术证实miR-150表达水平减低,并进一步证实miR-150水平是独立于年龄、6 min步行距离、病程、红细胞分布宽度等的肺动脉血压预后标志物。WEI等[10]通过基因芯片和荧光定量PCR等技术对肺动脉高压患者血浆miRNA表达情况进行了研究,发现了几种具有潜在诊断价值的miRNA。
大量研究表明,低压低氧能够诱发一系列机体应激反应。本研究应用基因芯片技术,筛选到HPH组和常氧对照组大鼠血清差异化表达的miRNAs 23种,其中上调的miRNA为13种,表达量下调的miRNA为10种,而后选取了6种miRNAs进行了荧光定量PCR验证,结果显示PCR定量结果与基因芯片结果基本一致,证实HPH组与对照组大鼠血清miRNAs表达谱存在显著差异。ROC曲线分析表明,miR-451、miR-505及let-7d用于鉴别HPH组大鼠和对照组大鼠的AUC均大于0.9,通过最佳cut-off值分析,得到这3种miRNA的敏感性和特异性分别为91.67%和91.67%、75%和91.67%、100%和91.67%,说明此3种miRNA对于HPH组及对照组的鉴别诊断可能具有较高的敏感性和特异性。
结合之前的研究,GRANT等[11]评估了miR-451在肺动脉高压病程发展中的作用,其表达上调,进而促进肺动脉平滑肌细胞迁移,这可能是导致肺动脉高压早期血管肌化作用增强的原因之一。YANG等[12]研究发现,miR-505能够抑制内皮细胞的迁移功能和管腔形成功能,在血管生成过程中也发挥一定程度的作用,而血管生成功能受损可能导致外周循环阻力增加进而引起血压升高。而let-7d能够影响血管平滑肌细胞增生[13],miR-214能够调控内皮细胞迁移和血管生成[14]。这些研究提示miR-451、miR-505、let-7d和miR-214可能参与了HPH的病程发展,进而导致了血清中的差异化表达。
总之,本文率先研究发现低压低氧暴露条件下HPH大鼠相对于常氧状态下大鼠存在差异化循环miRNA表达谱,可能为低氧暴露条件下HPH的诊断提供新思路。然而,本实验仅基于动物模型对循环miRNA表达做了初步的研究,其中,对于“差异化表达miRNA的组织细胞来源”、“本实验筛选出的3种循环miRNA是否可真正作为HPH的诊断标志物”等问题,尚需扩大样本做进一步研究。
参考文献:
[1] WEBER JA, BAXTER DH, ZHANG S, et al. The microRNA spectrum in 12 body fluids[J]. Clin Chem, 2010, 56(11):1733-1741.
[2] CHEN X, BA Y, MA L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res, 2008, 18(10):997-1006.
[3] GUI J, TIAN Y, WEN X, et al. Serum microRNA characterization identifies miR-885-5p as a potential marker for detecting liver pathologies[J]. Clin Sci (Lond), 2011, 120(5):183-193.
[4] YANG IP, TSAI HL, HUANG CW, et al. The functional significance of microRNA-29c in patients with colorectal cancer: a potential circulating biomarker for predicting early relapse[J]. PLoS One, 2013, 8(6):e66842.
[5] BALA S, TILAHUN Y, TAHA O, et al. Increased microRNA-155 expression in the serum and peripheral monocytes in chronic HCV infection[J]. J Transl Med, 2012, 10(1):151.
[6] 黄婷,杨桂玲. MicroRNA-21在急性髓系白血病骨髓细胞中的异常表达及意义[J].西安交通大学学报(医学版), 2016, 37(1):98-102.
[7] 张铭,赵朝,李晓利,等. 胰腺癌患者血浆中microRNA-100水平的测定及临床意义[J]. 川北医学院学报, 2015, 30(5):600-603.
[8] 季玉陈,李妍,胡京霞,等. 胶质瘤组织中microRNA-200a的表达及其与患者预后的关系[J]. 郑州大学学报(医学版), 2016, 51(1):105-108.
[9] RHODES CJ, WHARTON J, BOON RA, et al. Reduced microRNA-150 is associated with poor survival in pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2013, 187(3):294-302.
[10] WEI C, HENDERSON H, SPRADLEY C, et al. Circulating miRNAs as potential marker for pulmonary hypertension[J]. PLoS One, 2013, 8(5):e64396.
[11] GRANT JS, MORECROFT I, DEMPSIE Y, et al. Transient but not genetic loss of miR-451 is protective in the development of pulmonary arterial hypertension[J]. Pulm Circ, 2013, 3(4):840-850.
[12] YANG Q, JIA C, WANG P, et al. MicroRNA-505 identified from patients with essential hypertension impairs endothelial cell migration and tube formation[J]. Int J Cardiol, 2014, 177(3):925-934.
[13] YU ML, WANG JF, WANG GK, et al. Vascular smooth muscle cell proliferation is influenced by let-7d microRNA and its interaction with KRAS[J]. Circ J, 2011, 75(3):703-709.
[14] VANBALKOM BW, DEJONG OG, SMITS M, et al. Endothelial cells require miR-214 to secrete exosomes that suppress senescence and induce angiogenesis in human and mouse endothelial cells[J]. Blood, 2013, 121(19):3997-4006, S1-S15.
(编辑韩维栋)
收稿日期:2015-11-29修回日期:2016-03-15
基金项目:新疆维吾尔自治区自然科学基金资助项目(No.2015211C233)
通讯作者:桂俊豪. E-mail: Junhaog@gmail.com;余伍忠. E-mail: yuwz2013@126.com
中图分类号:R446.1
文献标志码:A
DOI:10.7652/jdyxb201604017
The expression and significance of circulating microRNA of rats with hypobaric hypoxia-induced pulmonary hypertension
XU Jiao-yang1,2, SI Ma-ling2, SHI Wen-hui2, FU Yong2,LIU Jiang-wei2, ZHOU Jin2, YU Wu-zhong2, GUI Jun-hao2
(1. Clinical Laboratory, Kaifeng Central Hospital, Kaifeng 475000;2. Urumqi General Hospital of Lanzhou Military Command, Urumqi 830000, China)
ABSTRACT:ObjectiveTo investigate the expression of circulating microRNA (miRNA) of rats with hypobaric hypoxia-induced pulmonary hypertension (HPH). MethodsCommercial rat miRNA microarray was employed to detect and analyze the circulating miRNA profile in the serum samples of Sprague-Dawley rats with hypobaric hypoxia-induced HPH and controls. Furthermore, differentially expressed candidate circulating miRNAs between HPH and control groups were validated by Real-time quantitative PCR based on the case-control study, and receiver operating characteristic curve (ROC) analysis was used to test the performance of four differentially expressed circulating miRNAs in discriminating HPH and control groups. ResultsCompared with those in the control group, 13 upregulated miRNAs and 10 downregulated miRNAs were identified in hypobaric hypoxia-induced HPH rats by using miRNA microarray. And differentially expressed miR-451, miR-505, let-7d and miR-214 were validated by using RT-PCR. ROC analysis showed that the area under the curve of miR-451, miR-505 and let-7d was 0.979, 0.938 and 0.993 in discriminating HPH and control groups, respectively. ConclusionThe aberrant expression of circulating miR-451, miR-505 and let-7d in serum may be correlated with the pathogenesis of HPH.
KEY WORDS:hypoxic pulmonary hypertension; circulating miRNA; microarray; RT-qPCR
Supported by the Natural Science Foundation of Xinjiang Uygur Autonomous Region (No.2015211C233)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160615.1029.016.html(2016-06-15)
