替吉奥在晚期非小细胞肺癌三线治疗中的临床研究
2016-07-14胡建兵沈二冻谢王踢岳阳市一人民医院肿瘤科湖南岳阳414000
翁 洁 胡建兵 文 芳 沈二冻 周 强 谢王踢(岳阳市一人民医院肿瘤科,湖南 岳阳 414000)
替吉奥在晚期非小细胞肺癌三线治疗中的临床研究
翁 洁 胡建兵 文 芳 沈二冻 周 强 谢王踢
(岳阳市一人民医院肿瘤科,湖南 岳阳 414000)
【摘要】目的 探讨替吉奥单药在晚期非小细胞肺癌三线治疗的临床疗效及不良反应。进一步研究肺癌患者替吉奥代谢相关酶表达水平与替吉奥疗效及毒性反应相关性。方法 搜集2010年1月至2014年12月我院共60例经病理学或组织学确诊的非小细胞肺癌患者进行随机对照研究。所有患者均为二线或二线以上治疗失败的患者,既往患者接受过含铂类化疗方案(不包含分子靶向治疗)。患者随机分为2组,实验组30例患者据体表面积接受替吉奥胶囊口服,即BS<1.25 m2予80 mg/d,1.25 m2≤BS<1.5 m2时予100 mg/d,BS≥1.5 m2时予120 mg/d,分2次口服,d1~14,每21 d为1个周期,至少完成2个周期,抽外周血检测二氢嘧啶脱氢酶(DPD)活性,胸苷磷酸化酶(TP)及胸苷酸合成酶(TS)的表达情况,均接受最佳的支持治疗。对照组30例患者只接受最佳的支持治疗。结果 实验组患者疾病控制率(CR+PR+SD)为26.67%(8/30),中位无进展生存期(mPFS)为2个月,中位生存期(MST)为5个月。单纯支持治疗组mPFS和MST分别为1个月、3个月。两组比较实验组MST较对照组延长2个月,有统计学意义(P<0.05),而实验组mPFS较对照组延长0.5个月,无统计学差异(P>0.05)。实验组患者替吉奥不良反应主要为消化道及血液学毒性,所有不良反应均无Ⅳ度情况发生。血DPD活性与实验组不良反应无明显相关性(P>0.05)。实验组TP(+)者总生存时间(OS)及无进展生存时间(PFS)均优于TS(-)者,但无统计学意义(P>0.05)。实验组TS(+)者总生存时间(OS)及无进展生存时间(PFS)优于TS(-)者,有统计学意义(P<0.05)。结论 替吉奥治疗三线及以上晚期非小细胞肺癌效有一定的疗效,不良反应可耐受,值得临床推广。TP、TS检测对预测替吉奥用于肺癌患者的预后有一定的指导意义。
【关键词】非小细胞肺癌;替吉奥;二氢嘧啶脱氢酶;胸苷磷酸化酶;胸苷酸合成酶
肺癌是近年来全世界癌症死亡的首因,其中非小细胞肺癌(nonsmall cell lung cancer,NSCLC)高达80%左右[1],按病理组织学分为鳞癌、腺癌、大细胞癌等。大多数肺癌患者在初诊时已属晚期,失去了手术机会,治疗上主要是以全身化疗为主的综合治疗。20世纪90年代后期以来,含铂双药联合化疗方案逐步确立在晚期非小细胞肺癌一线治疗领域中的标准地位,二线治疗以多西紫杉醇或培美曲塞或口服靶向药物治疗为主[2]。但几乎所有的患者经过多线治疗后都会出现药物抵抗,因此有必要尝试更多的其他抗肿瘤药物用于NSCLC的治疗,替吉奥(S-1)就是其中之一,目前替吉奥在国外已被证实可使晚期非小细胞患者生存获益[3-4]。
本研究旨在研究探讨替吉奥单药在我市晚期非小细胞肺癌三线治疗的临床疗效及不良反应。
1 资料与方法
1.1 一般资料:我院2010年1月至2014年12月我院肿瘤科ⅢB~Ⅳ期NSCLC的复治患者60例,男44例,女16例,年龄18~75岁,中位年龄54岁。均经病理学检查确诊为鳞癌26例,腺癌34例,ECOG评分0~2分。有明确的可测量病灶,均经一线和二线化疗方案治疗后复发,均未行分子靶向治疗,化疗结束>1个月,预计生存期>3个月。所有患者白细胞计数>3.5×109/L,血小板计数>70×109/L,血红蛋白>80 g/L,ALT≤2×正常值,AST≤2×正常值,肾功能、电解质及心电图正常。随机分为2组:实验组和对照组,每组30例。两组患者各项资料均具有可比性,无统计学差异(P>0.05)。见表1。
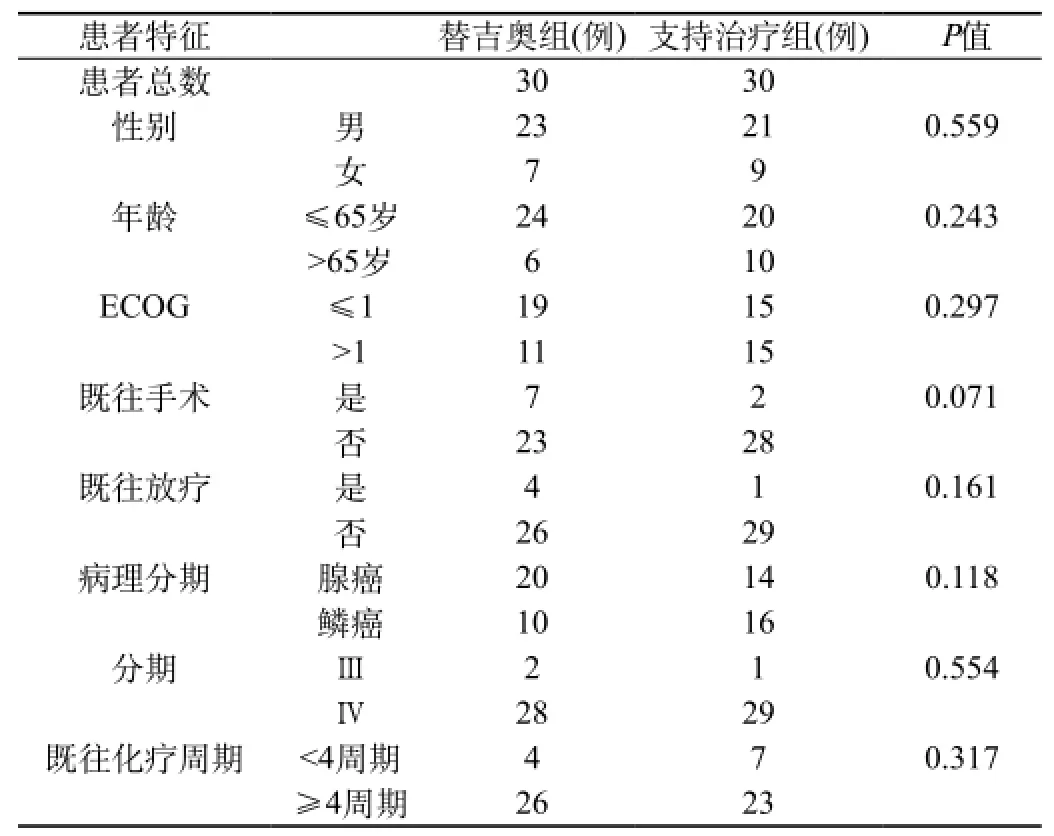
表1 两组患者基本资料对比
1.2 方法:①实验组30例患者按体表面积BS<1.25 m2接受口服替吉奥胶囊(商品名:维康达,山东新时代药业有限公司生产,S-1)40毫克/次,1.25 m2≤BS<1.5 m2时予50毫克/次,BS≥1.5 m2时予60毫克/次,2 次/天,口服,d1~14,每21 d为1个周期,至少完成2个周期。化疗终止指征:病情进展或出现不可耐受的不良反应。化疗期间给予常规止吐、护肝、护胃治疗,白细胞或中性粒细胞下降超过Ⅱ度时给予G-CSF支持治疗,血小板下降超过Ⅱ度时给予升血小板支持治疗。每周监测血常规、肝肾功能、心电图。对照组30例患者仅接受最佳的支持治疗。2个周期(42 d)经影像学(如CT、MRI、ECT、PET等)评价病情。②观察指标及评定标准:近期疗效参照RECIST疗效评价标准。完全缓解(CR),部分缓解(PR),病变进展(PD),病变稳定(SD)总有效率为(CR+PR),疾病控制率为(CR+PR+SD)。实验组和对照组PFS为患者开始口服替吉奥到肿瘤发生进展或死亡的时间。实验组OS为患者从开始治疗到死亡的时间。对照组0S为末次化疗进展时间到患者死亡时间。在数据截止时未进展或未死亡的患者及研究中失访的患者以最后一次肿瘤评价的日期计算。③不良反应:按WHO抗肿瘤药物不良反应标准进行评价,分为0~Ⅳ级。④实验组化疗2周期后抽取外周血检测DPD活性、TP表达及TS表达情况,其中TS、TP表达采用免疫组化方法检测,DPD活性采用高效液相色谱法(high performance liquid chromatography,HPLC)测定血内源性二氢尿嘧啶(dihydrouracil,UH2)/尿嘧啶(uracil,U)值代表血DPD活性。⑤随访:所有患者采用按时返院复查或电话方式随访,病情进展患者继续随访,观察终点事件的发生。截止最终随访日期,仍然生存者列为截尾数据。
1.3 统计学分析:所有数据采用SPSS19.0分析处理,计数资料采用卡方检验,计量资料采用t检验,MST和PFS采用Kaplan-Meier法和Log-rank检验,采用双侧检验,血DPD活性与不良反应相关分析采用Pearson线性相关分析法,均以P<0.05为差异有统计学意义。
2 结 果
2.1 近期疗效:实验组30例患者均完成2周期单药化疗,CR0例,PR2例,SD6例,PD22例。总有效率6.67%,疾病控制率26.67%。
2.2 PFS及MST:实验组中位无进展生存期(mPFS)和中位生存期(MST)分别为2个月和5个月,对照组mPFS和MST分别为1和3个月。两组比较实验组MST较对照组延长2个月,有统计学意义(P<0.05),而实验组mPFS较对照组延长0.5个月,无统计学差异(P >0.05)。见图1、2。

图1 替吉奥组与对照组生存时间曲线

图2 替吉奥组与对照组PFS曲线
2.3 不良反应:实验组替吉奥主要不良反应为粒细胞下降、血小板下降、贫血、恶心呕吐及腹泻等,发生率分别为50.00%、43.33%、40.00%、33.33%、23.33%,其中Ⅲ度不良反应发生率分别为10.00%、13.33%、6.67%、0、0。无Ⅳ度不良反应,无药物相关性死亡发生。见表2。
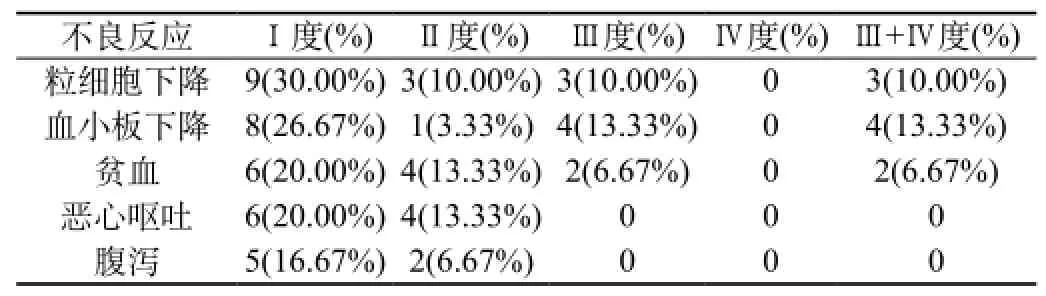
表2 不良反应
2.4 血DPD活性与化疗毒性的关系:实验组替吉奥主要不良反应为粒细胞下降、血小板下降、贫血、恶心呕吐及腹泻,血DPD水平的高低与化疗不良反应无明显相关性(P值均>0.05)。见表3。
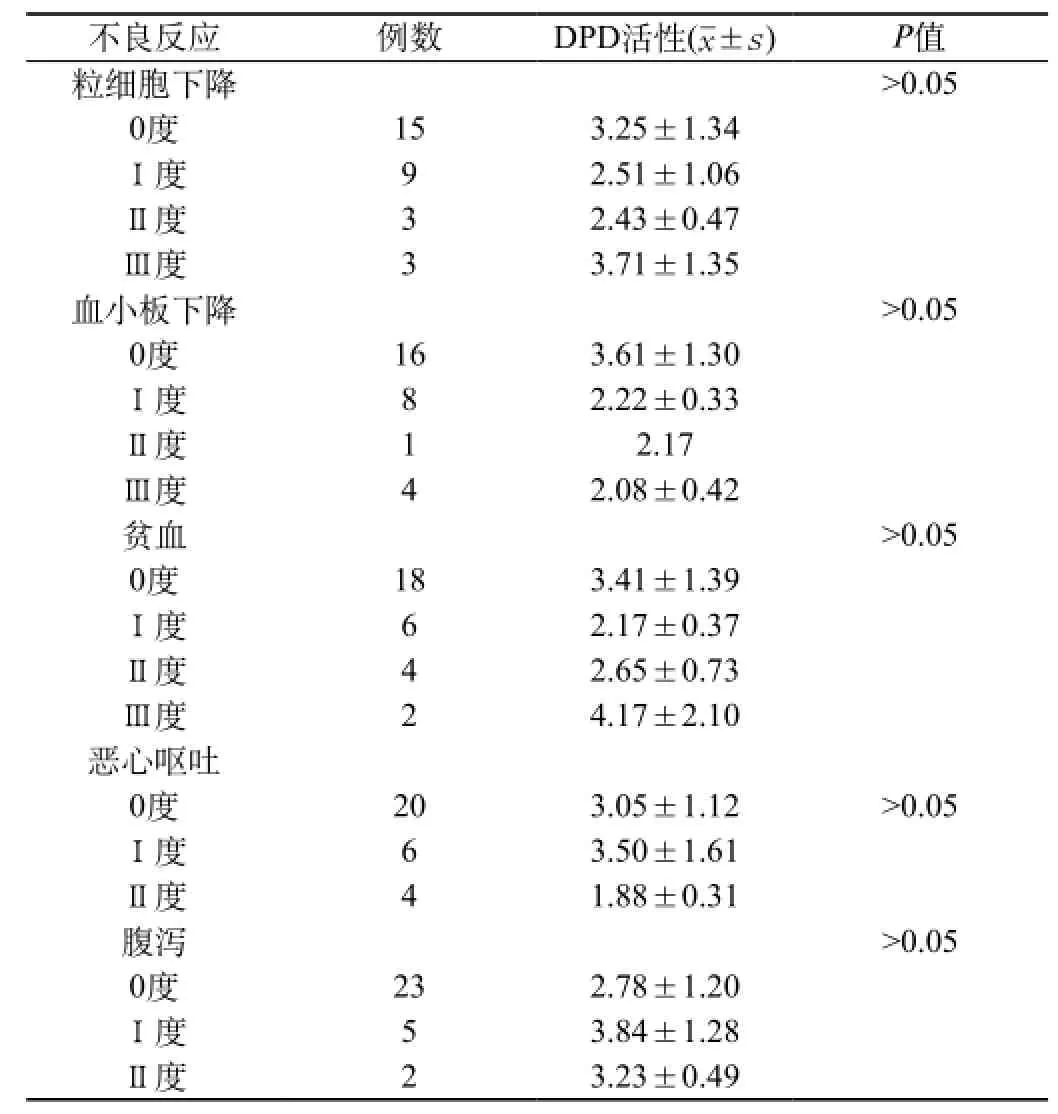
表3 实验组不同DPD活性与毒性反应关系
2.5 实验组TS表达与生存时间之间的关系:实验组患者TS(+)者具有一定的生存优势,患者总生存时间(OS)长于TS(-)者,分别为(4.62±0.79)和(2.66±0.33),无进展生存时间(PFS)长于TS(-)者,分别为(2.16±0.43)和(1.00±0.00)(P<0.05)(表4)。

表4 实验组TS表达与生存时间之间的关系
2.6 实验组TP表达与生存时间之间的关系:实验组患者TP(+)者具有一定的生存优势,患者总生存时间(OS)长于TS(-)者,分别为(4.60± 0.76)和(2.40±0.24),无进展生存时间(PFS)长于TS(-)者,分别为(2.12±0.42)和(1.00±0.00),但无统计学意义(P>0.05)(表5)。

表5 实验组TP表达与生存时间之间的关系
3 讨 论
替吉奥(s-1)为复方制剂,是一种二氢嘧啶脱氢酶(DPD)抑制类口服氟尿嘧啶类抗肿瘤药物,主要由替加氟(FT)、吉美嘧啶(CDHP)及奥替拉西钾(OXO)按照1∶0.4∶1比例组成。其中FT能在体内转化为5-Fu而发挥抗肿瘤作用,CDHP起增加疗效作用,OXO能降低毒性反应。大量临床试验证实S-1单药在胃癌[5]、结直肠癌[6]、乳腺癌[7]、胰腺癌[8]、头颈部肿瘤[9]等多种肿瘤中显示出很好的抗肿瘤活性和较低的不良反应发生率。与胃、肠、乳腺等器官相比,肺组织中DPD活性最高[10]。国内外多个临床试验表明替吉奥单药或联合用药Ⅰ线或Ⅱ线治疗晚期非小细胞肺癌均取得较好疗效,Kawahara[11]等报道了一项S-1单药一线治疗进展期肺癌的临床研究,该研究共入组62例患者,结果显示总体缓解率(ORR)为22%,中位生存期为10.2个月,1年生存率为41.1%,表明替吉奥单药治疗晚期非小细胞肺癌的疗效与多西他赛、伊立替康、吉西他滨、长春瑞滨相似,且不良反应较少。2010年美国临床肿瘤学会(ASCO)年会上公布了一项比较卡铂联合S-1或紫杉醇一线治疗晚期NSCLC患者的随机临床研究LETS研究的结果[12],该研究共入组563例初治的ⅢB/Ⅳ期的NSCLC患者,随机分为卡铂联合S-1、卡铂联合紫杉醇组,结果显示卡铂联合S-1方案一线治疗NSCLC获得的总生存(15.3个月)与卡铂联合紫杉醇方案(13.3个月)相近,耐受性好,有望成为NSCLC一线治疗的新选择。Totani Y等[13]报道了一项S-1单药二线治疗晚期非小细胞肺癌的试验结果,50例患者入组,6例患者取得了部分缓解,总体缓解率(ORR)为12.5%(95%CI,25.7%~53.4%),mPFS为2.5个月,中位生存期为8.2个月,1年生存率为29.6%,无Ⅳ级不良反应发生,Ⅲ级血液学毒性粒细胞减少及贫血发生率均为2.1%,Ⅲ级非血液学毒性发生率为10.4%,无治疗相关性死亡发生。Yoshiok等[14]在ASCO会议上公布一项比较卡铂联合S-1或紫杉醇一线治疗晚期NSCLC患者的Ⅲ期随机临床试验(LETS研究)。结果显示主要终点(OS)达到非劣效性,疗效相当,不良反应相似。尤其对于肺鳞癌显示出更好的优势,S-1联合铂类有望成为晚期NSCLC的一线治疗的新选择。
晚期非小细胞肺癌患者经过一线、二线治疗失败后,可考虑行替吉奥单药化疗。Ono等[15]报道晚期非小细胞肺癌35例患者临床研究,S-1单药作为三线或三线以上治疗,结果显示总缓解率和疾病控制率分别为5.7% 和40%。中位生存期为208 d,不良反应轻。显示S-1作为三线或以上治疗晚期非小细胞肺癌时,表现出了适度的抗肿瘤活性及微弱的不良反应。
针对S-1作为三线或以上治疗晚期非小细胞肺癌的效果,我科从2010年1月起开展了单药S-1三线治疗晚期非小细胞肺癌的临床研究,取得了一定的效果,S-1单药化疗与最佳的支持治疗(BSC)相比,可以延长患者的PFS及MST。入组患者大多为Ⅰ~Ⅱ级不良反应,所有患者均能耐受,未出现1例因不良反应延迟或中止治疗。S-1关键酶TP及TS(+)者使用替吉奥能延长肺癌患者的生存时间。
综上所述,单药S-1治疗晚期非小细胞肺癌有一定的疗效,不良反应轻微,可考虑作为晚期非小细胞肺癌的三线治疗的一种选择。但该药目前尚未进入非小细胞肺癌临床实践指南用药,在安全性和有效性上仍需进一步证实。TP、TS检测对预测替吉奥用于肺癌患者的预后有一定的指导意义。
参考文献
[1] 汪进良,焦顺昌.替吉奥用于非小细胞肺癌治疗的研究及展望[J].中华医学杂志,2010,90(36):2582.
[2] 薛慧,王文武,欧阳学农.S-1治疗晚期非小细胞肺癌临床新进展[J].实用临床医药杂志,2011,15(3):125.
[3] Osamu N,Hiroyuki T.Phase II study of S-1 monotherapy as a first-line treatment for elderly patients with advanced non smallcell lung cancer :the Central Japan Lung Study Group trial 0404 [J].Anticancer Drugs,2011,22(8):811-816.
[4] Nobuyuki K,Akihiko G,Hiroshi S,et al.Randomized phase III trial of S-1 plus cisplatin wersus docetaxel plus cisplantin fou advanced non-small-cell lung cancer (TCOGO701)[G].J Clinical Oncology,2012,30(suppl):abstr7515.
[5] Shinichi S,Mitsuru S,Toshiharu Y,et al.Adjuvant Chemotherapy for Gastric Cancer with S-1,an Oral Fluoropyrimdine[J].N Engl J Med,2007,357(18):1810-1820.
[6] Ohtsu A,Baba H,Sakata Y,et al,Phase II study of S-1,a novel Fluoropyrimidine derivative with metastatic colorectal carcinoma[J].British J Cancer,2000,83(2):141-145.
[7] Toshiaki S,Shigemitsu T,Muneaki S,et al.A Phase II Study of S-1 in patients with metastatic breast cancer-A Japanese Trial by the S-1 Cooperative Study Group,Breast Cancer Working Group[J]. Breast Cancer,2004,11(2):194-202.
[8] Nakamura K,Yamaguchi T,Ishihara T,et al.Phase II trial of oral S-1 combined with gemcitabine in metastatic pancreatic cancer[J].Br J Cancer,2006,94(11):1575-1579.
[9] Inuyama Y,Kida A,Tsukuda M,et al.Late phase IIstudy of S-1 in patients with advanced head and neck cancer.Gan to kagaku roho[J].Cancer Chemotherapy,2001,28(10):1381-1390.
[10] Fukushima M,Morita M,Ikeda K,et al.Population study of expression of thymidylate synthase and dihydropyrimidine dehydrogenase in patients with solid tumors[J].Int J Mol Med,2003,12(6): 839-844.
[11] Yumine K,Kawahara M.Phase II study of S-1,a novel oral fluorouracil,in advanced non-small-cell lung cancer[J].Gan To Kagaku Ryoho,2006,33(1):189.
[12] Okamoto I,Fukuoka M.S-1: a new oral fluoropyrimidine in the treatment of patients with advanced non-small-cell lung Cancer[J].Clin Lung Cancer,2009,10(4): 290-294.
[13] Totani Y,Saito Y,Hayashi M,et al.A phase II study of S-1 monotherapy as second -line treatment for advanced non-small cell lung Cancer[J]. Cancer Chemother Pharmacol,2009,64(6):1181-1185.
[14] Yoshioka H,Okamoto I,Morita S,et al.Randomized phase Ⅲstudy of carboplatin plus S-1 compared with carboplatin plus paclitaxel as first-line chemotherapy in advanced Nsclc[J].Clin Oncol,2010,28(36):5240-5246.
[15] Ono A,Naito T,Murakami H,et al.Evaluation of S-1 as thirdor further-line chemotherapy in advanced non-smallcell lung Cancer[J].Int J Clin Oncol,2010,15(2): 161-165.
中图分类号:R734.2
文献标识码:B
文章编号:1671-8194(2016)08-0001-03
基金项目:湖南省科技厅社会发展支撑计划一般项目(项目编号:I2014SK3165)
A Clinical Study of S-1 Monotherapy as Third-line Treatment for Advanced Non-small Cell Lung Cancer
WENG Jie, HU Jian-bing, WEN Fang, SHEN Er-dong, ZHOU Qiang, XIE Wang-ti
(Department of Oncology, the First People's Hospital of Yueyang, Yueyang 414000, China)
[Abstract]Objective To observe the efficacy and toxicity of an oral anticancer fluoropyrimidine derivative (S-1) for previously treated patients with advanced non-small cell lung cancer (NSCLC). To investigate the relationship between the activities of dihydropyrimidine dehydrogenase (DPD) and the toxicity, the level of the thymidylate synthas (TS), thymidine phosphorylase (TP) and the sensitivity of chemotherapy. Methods The records of non-smallcell lung cancer patients who had received S-1 monotherapy between in January 2010 to Decembe 2014. ALL the patients who were advanced non-smallcell lung cancer had previously received second-or further-line chemotherapy. Thirty cases of them were give S-1 for fourteen consecutive days and received seven days of drug-free period (twenty-one days in one course). The drug was administered in two divided doses daily at 80 mg/day for patients with a body surface area<1.25 m2,100 mg/day for those with a body surface area of 1.25-1.5 m2, and 120 mg/day for those with a body surface area >1.5 m2. They were completed at least 2 cycles and received best supportive care. The other thirty cases were only received best supportive care after failure of second- or futherline chemotherapy. Results In the thirty cases who were give S-1, the disease control rates (CR+PR+SD) were 26.67% (8/30). The median progressionfree survival time (mPFS) was 2.0 months, and the median survival time(MST)was 5.0 months. In the thirty cases who had received best supportive care, the mPFS and MST were 1.0 and 3.0 months respectively. Between the two groups, the mPFS were not statistically different, the MST were statistically different. The toxicity profile of S-1 was mild, and grade 3 or more severe toxicity was rare. The main side effects were gastrointestinal reaction and bone marrow suppression, no Ⅳ adverse reactions occur. The S-1 associated toxicities had a negative relationship with DPD activity in blood. The TP(+) and Ts(+) patients had longer overall survival (OS) and Progression-free survival (PFS) than that of TP(-) and Ts(-) patients respectively. Conclusion S-1 exhibits modest activity and acceptable toxicity when used as a third or subsequent line of chemotherapy in patients with advanced NSCLC. Expression of thymidylate synthase (TS), thymidine phosphorylase (TP) can predict for clinical outcome of fluoropyrimidine-based therapy.
[Key words]Non-small cell lung cancer; S-1; Dihydropyrimidine dehydrogenase; Thymidylate synthas; Thymidine phosphorylase
