磁共振灌注加权成像评价宫颈癌同步放化疗疗效的初步研究
2016-07-14王晓煜罗娅红辽宁省肿瘤医院医学影像科辽宁沈阳110042
王晓煜,王 越,于 韬,罗娅红辽宁省肿瘤医院医学影像科,辽宁 沈阳 110042
磁共振灌注加权成像评价宫颈癌同步放化疗疗效的初步研究
王晓煜,王 越,于 韬,罗娅红
辽宁省肿瘤医院医学影像科,辽宁 沈阳 110042

王晓煜,主治医师,医学博士。现就职于辽宁省肿瘤医院医学影像科,从事肿瘤的CT 及MR影像诊断工作。擅长神经系统肿瘤、乳腺及妇科肿瘤的MR影像诊断。目前主要从事神经系统及妇科肿瘤的功能性MR影像诊断研究。发表1篇SCI收录论文及多篇中文专业论文。参与编译及编写《乳腺介入成像:超声、X线及MR影像引导下的介入技术》、《乳腺影像诊断学》、《常见恶性肿瘤多学科综合诊断与治疗丛书:神经系统恶性肿瘤》、《常见恶性肿瘤多学科综合诊断与治疗丛书:淋巴系统恶性肿瘤》和《常见恶性肿瘤多学科综合诊断与治疗丛书:头颈肿瘤》多部学术专著。
【摘要】目的:研究磁共振灌注加权成像(perfusion-weighted imaging,PWI)在宫颈癌同步放化疗前后灌注参数的差异,探索宫颈癌同步放化疗疗效差异与PWI灌注参数之间的关系。方法:回顾性分析经病理确诊的宫颈癌患者20例,接受同步放化疗前后进行PWI扫描,以肿块强化最明显处作为感兴趣区,生成时间-强度曲线(time-intensity curve,TIC),并测量强化峰值(peak height,PH)、最大上升斜率(maximum slope of increase,MSI)及达峰时间(time to peak,TTP)。分析治疗前后各项灌注参数的变化。结果:同步放化疗后,PH、MSI较治疗前降低(399.05±45.39 vs. 278.32±35.09、38.57±2.77 vs. 19.55±2.49,P=0.000、0.000),TTP较治疗前延长(40.49±4.18 vs. 66.15±5.11,P=0.000)。治疗有效组PH、MSI高于治疗无效组(411.79±43.40 vs. 360.80±27.44、39.53±2.27 vs. 35.69±2.16,P=0.025、0.004)。结论:PWI在宫颈癌同步放化疗的疗效评价和治疗前预测同步放化疗疗效中均有价值,为临床提供除形态学之外的功能性评价。
【关键词】宫颈癌;磁共振灌注加权成像;疗效评价;同步放化疗
目前,对于宫颈癌分期在Ⅱb期以上及有手术禁忌证的患者,治疗手段主要以放疗联合化疗为主[1]。早期准确判断放化疗的效果是调整治疗方案的前提,临床上主要以测量肿块治疗前后的大小来评价治疗效果,这也是肿瘤个体化治疗的基础。MRI对软组织有很高的分辨率,已成为妇科肿瘤的重要检查手段[2]。但宫颈肿瘤在接受放化疗后,早在形态学发生改变之前肿瘤的微血管就出现变化,而且放疗后水肿、纤维化对准确判断肿瘤体积变化也造成了一定干扰[3]。磁共振灌注加权成像(perfusion-weighted imaging,PWI)能反映组织内的血流灌注情况,帮助进一步判断肿瘤内部的微血管生成情况,在脑部肿瘤中得到广泛应用。其能在肿瘤出现形态改变之前就探测到肿瘤内微血管生成的状态[4],大大提前了对肿瘤放化疗效果的判断,同时对病灶水肿、纤维化造成的假阳性和假阴性判断有一定意义。本研究回顾性分析宫颈癌患者接受放化疗后灌注参数的变化,探索宫颈癌同步放化疗疗效差异与其灌注参数之间的关系。
1 资料和方法
1.1 一般资料
收集2013年1月—2014年12月在本院被确诊为宫颈癌并接受放疗的患者20例,回顾性分析所有患者包括PWI在内的MRI资料。患者年龄29~67岁[(51±9)岁],以接触性出血、阴道不规则流血、下腹不适及腹痛等为主诉来就诊。所有患者均经过活检证实为宫颈癌,其中鳞癌18例、腺癌2例。根据国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO) 2009年分期,20例患者中ⅡB 期4例、ⅢA期6例、ⅢB期4例、ⅣA期4例、ⅣB期2例。所有患者在本院接受放疗联合化疗。放疗方案为腔内放疗(20~30 Gy)+体外放疗(30~40 Gy),放疗时间2~4个月不等。化疗药物为:奥沙利铂(或顺铂)+多西他赛(或紫杉醇酯质体)。所有患者在检查前均签署增强MRI扫描知情同意书。
1.2 MR扫描设备及参数
使用SIEMENS公司Magnetom Verio 3.0 T磁共振,8通道相控阵体线圈,采用呼吸门控技术。扫描范围由髂骨翼上缘至耻骨联合下缘,检查前适量饮水以充盈膀胱。
常规扫描包括轴位T1WI、轴位脂肪抑制T2WI、矢状位T2WI,以及轴位、矢状位、冠状位脂肪抑制增强T1WI。T1WI扫描采用快速自旋回波(fast spin echo,FSE)序列:重复时间(repetitive time,TR)=514 ms,回波时间(echo time,TE)=11 ms,层厚=5 mm,层间距=1 mm,矩阵=320×224,视野(field of view,FOV) 38 cm,NEX=2。T2WI采用快速恢复快速自旋回波(fast recovery fast spin echo,FRFSE) 序列:TR=6 470 ms,TE=120 ms,层厚=5 mm,层间距=1 mm,矩阵=320×224,FOV=38 cm,NEX=2。
PWI扫描取轴位,参考常规扫描,以肿瘤最大层面为中心层面进行扫描。采用小角度激发快速梯度回波(fast low angle shot,FLASH)序列:TR=5.08 ms,TE=1.74 ms,层厚=3.6 mm,层间距=1 mm,矩阵=128×128,FOV=26 cm,NEX=1,翻转角=15°,扫描层数=20,每层35个时期,间隔约0.5 s,采集时间约330 s。启动扫描后于第3个时相用高压注射器由肘静脉注射对比剂钆喷酸葡胺(gadopentetate dimeglumine,Gd-DTPA),剂量0.1 mmol/kg,速率3 mL/s,注射完毕后以生理盐水15 mL冲洗管道。
扫描时,轴位、矢状位和冠状位脂肪抑制增强T1WI扫描于PWI扫描结束后进行。
1.3 图像分析及数据处理
扫描结束后,将所有数据导入MRI后处理工作站(Syngo 4.2)进行分析,使用Mean Curve软件包。选择肿瘤强化最明显处为感兴趣区(region of interest,ROI),避开坏死、出血或囊变区。由软件自动生成时间-强度曲线(time-intensity curve,TIC),并计算出相关灌注参数值,包括强化峰值(peak height,PH)、最大上升斜率(maximum slope of increase,MSI)及达峰时间(time to peak,TTP)。TIC分为4 型:Ⅰ型,速升速降型;Ⅱ型,速升平台型;Ⅲ型,缓升平台型;Ⅳ型,持续上升型[5]。
1.4 统计学处理
2 结 果
2.1 放化疗前后常规MRI分析
宫颈癌主要表现为内生或外生型的规则或不规则形肿块,主要表现为长T2等或稍长T1信号,治疗后肿瘤体积缩小(图1)。其中T1WI呈等信号者占85% (17/20),T1WI呈稍低信号者占15%(3/20);T2WI上均呈均匀稍高信号100% (20/20);增强扫描肿块明显强化,强化不均匀。接受放化疗后,15例肿瘤缩小,占75%;3例肿瘤大小无变化,占15%;2例肿瘤较治疗前增大,占10%。治疗后肿瘤T1WI和T2WI信号均降低,增强扫描不均匀强化。
2.2 放化疗前后PWI分析
本组患者在接受放化疗前TIC以Ⅱ型为主(图2),占75% (15/20);Ⅰ型占20%(4/20)(图3);Ⅳ型占5% (1/20)(图4)。放疗后,TIC以Ⅳ型为主,占45% (9/20);Ⅲ型占30% (6/20)(图5);Ⅱ型占25% (5/20)。放化疗前后灌注参数比较见表1,PH、MSI在治疗后显著减低(P=0.000、0.000),TTP治疗后较治疗前延长(P=0.000)。
2.3 放化疗有效组与无效组放疗前PWI分析
本组放化疗后肿瘤体积缩小(有效)者15例、无效者(肿瘤体积未变化、增大)者5例。放化疗有效组治疗前TIC Ⅰ型占20% (3/15)、Ⅱ型占80% (12/15)。放化疗无效组中,TICⅠ型占20% (1/5)、Ⅱ型占60% (3/5)、Ⅳ型占20% (1/5)。比较两组治疗前的灌注参数发现(表2),两组TTP无统计学差异(P=0.324),治疗有效组PH高于治疗无效组(P=0.025),治疗有效组MSI高于无效组(P=0.004)。

图1 ⅡB期宫颈低分化鳞癌MRI表现患者48岁,病理为宫颈低分化鳞癌,ⅡB期。图A~C为治疗前轴位T1WI (A)、轴位T2WI (B)以及增强T1WI (C),肿块(箭头所指)呈长T1、长T2信号,增强扫描明显强化;图D~F为治疗后轴位T1WI (D)、轴位T2WI (E)以及增强T1WI (F),显示肿块(箭头所示)体积缩小,T2WI信号减低
3 讨 论
宫颈癌是一种严重威胁妇女健康的恶性肿瘤,发病率在我国女性生殖系统恶性肿瘤中居首位,也是女性生殖系统恶性肿瘤死亡的主要原因之一[6]。此外,宫颈癌的发病率呈现上升及年轻化的趋势。宫颈癌中晚期患者主要以放疗为主,近年来同步放化疗越来越得到临床认可,其治疗时间短,还被认为有协同增敏作用,在宫颈癌治疗中扮演重要角色。但是,如何预测、早期评价同步放化疗的治疗效果是一个难题,因为这关系到治疗方案的调整。以往对于实体肿瘤,多采用基于体积测量的评价体系,如实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)[7]。然而,单纯通过测量肿瘤体积大小无法预测其对同步放化疗的治疗效果。此外,宫颈癌在接受同步放化疗早期会出现水肿,肿瘤体积可能会比治疗前增大;后期由于出现纤维化,尽管体积变化不明显,但仍有肿瘤复发的可能。因此,找到一种不仅能从形态,还能从功能方面进行综合评价的检测方法尤为迫切。
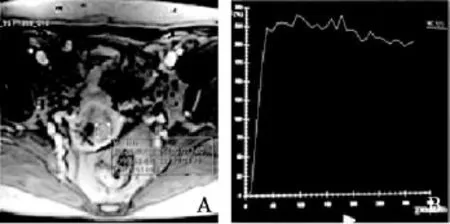
图2 ⅡB期宫颈高分化鳞癌TIC II型患者58岁,病理结果为宫颈高分化鳞癌,ⅡB期。显示宫颈占位不均匀明显强化(A),TIC为Ⅱ型(B)

图3 ⅡB期宫颈中分化鳞癌TIC Ⅰ型患者45岁,病理结果为宫颈中分化鳞癌,ⅡB期。宫颈肿块不均匀明显强化,伴阴道受累(A),TIC为Ⅰ型(B)

图4 ⅡB期宫颈高分化鳞癌TIC Ⅳ型患者42岁,病理结果为宫颈高分化鳞癌,ⅡB期。显示肿块强化明显(A),TIC为Ⅳ型(B)
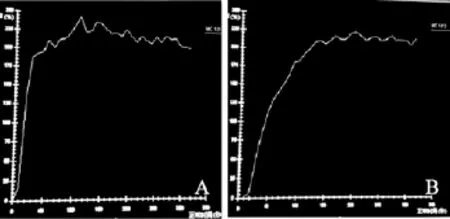
图5 ⅡA期宫颈中分化鳞癌治疗前后TIC比较患者39岁,病理结果为宫颈中分化鳞癌,ⅡA期。A: 宫颈肿块治疗前TIC;B; 治疗后TIC

表1 放化疗前后PWI灌注参数比较

表2 放化疗有效组与无效组放化疗前PWI灌注参数比较
目前,临床上主要使用超声、CT、MRI进行宫颈癌诊断和治疗评价。尤其是MRI,由于其有很高的软组织分辨力,在宫颈癌诊治中越来越得到重视。但常规MRI扫描只能提供一些解剖学、形态学方面的信息。PWI是一种日趋成熟的功能性MRI方法,其通过静脉团注对比剂后,对ROI进行快速连续多次扫描,获得相应TIC,利用数学模型计算出各项灌注参数,评价组织的血流灌注情况[8]。PWI可通过无创方法检测肿瘤内微血管生成和分布情况,反映肿瘤内部和周围组织内血流灌注情况,以帮助分析肿瘤的生物学特性,对肿瘤的诊断、疗效评价均有重要意义。以往PWI多用于脑部,随着MRI设备的不断发展,越来越多地用于腹部脏器,如肝脏、胰腺、前列腺等[9-11]。近年来,PWI逐渐应用于宫颈癌的诊断和治疗评价。PWI的评价体系主要包括TIC和一系列灌注参数,包括PH、MSI、最大下降斜率(maximum slope of descending,MSD)及TTP等。PH反映对比剂流入的多少,间接反映微血管血容量和血管外间隙的共同容积,与组织的氧含量呈正相关。MSI反映对比剂流入的速率,与肿瘤微血管密度有关。MSD反映对比剂流出的速率,与血管通透性有关。TTP是指组织开始增强至强化达到峰值的时间,反映血管阻力,与灌注速率成反比。
本研究发现,治疗前后PH、MSI、TTP等参数和TIC发生了显著变化。PH、MSI治疗后降低,反映治疗后肿瘤内部微血管数目和密度减低;TTP延长则反映微血管阻力增加;相应的TIC也由“速升”向“缓升”变化。表明治疗前肿瘤细胞生长活跃,微血管密度及血流灌注高;治疗后肿瘤细胞和血管内皮细胞大量坏死,随着逐渐纤维化、瘤内血管内皮增厚、管腔狭窄甚至闭塞等病理变化,进一步导致微血管数目减少、血流灌注量及灌注速率降低,使肿瘤处于缺氧状态,从而促进肿瘤细胞死亡。本研究结果与以往研究基本一致。除提供解剖学信息,PWI所提供的肿瘤微血管变化能更全面地评价治疗效果,为后续治疗提供依据。宫颈癌对同步放化疗的敏感性与病理类型、特征及病程长短等因素有关。本研究在对比同步放化疗敏感与不敏感患者的PWI参数后发现,治疗敏感者的PH、MSI均高于不敏感者,表明肿瘤微血管密度越高,血供越丰富,其对治疗越敏感,这为选择治疗手段提供了一些参考依据,从而帮助临床医师更好地选择治疗方案。本研究放疗敏感组和不敏感组中,TIC均以Ⅱ型为主,主要是因为本组收集的病例数较少,且主要以Ⅱ型为主,也表明宫颈癌的主要TIC为Ⅱ型。
本研究不足之处在于病例数相对较少,所以TIC在疗效评价和放化疗敏感性评估方面还需进一步完善。而且,由于腺癌病例数少,不同病理类型之间的灌注参数差异还需进一步大样本研究。
总之,PWI在宫颈癌同步放化疗的疗效评价和治疗前预测同步放化疗疗效中均有价值,能提供除形态学改变之外肿瘤微血管生成和血流灌注方面的信息,让临床医师能更全面地评估治疗效果。
参考文献
[1] GREEN J A, KIRWAN J M, TIERNEY J F, et a1. Survival and recurrence after concomitant chemotherapy and radiotherapy for cancer of the uterine cervix∶ a systematic review and meta-analysis [J]. Lancet, 2001,358(9284)∶ 781-786.
[2] ZHANG W, ZHANG J, YANG J, et al. The role of magnetic resonance imaging in pretreatment evaluation of early-stage cervical cancer [J]. Int J Gynecol Cancer,2014, 24(7)∶ 1292-1298.
[3] BIEDKA M, MAKAREWICZ R, MARSZAŁEK A, et al. Labeling of microvessel density, lymphatic vessel density and potential role of proangiogenic and lymphangiogenic factors as a predictive/prognostic factors after radiotherapy in patients with cervical cancer [J]. Eur J Gynaecol Oncol,2012, 33(4)∶ 399-405.
[4] LEE E Y, YU X, CHU M M, et al. Perfusion and diffusion characteristics of cervical cancer based on intraxovel incoherent motion MR imaging-a pilot study [J]. Eur Radiol, 2014, 24(7)∶ 1506-1513.
[5] GORDON Y, PARTOVI S, MÜLLER-ESCHNER M, et al. Dynamic contrast-enhanced magnetic resonance imaging∶ fundamentals and application to the evaluation of the peripheral perfusion [J]. Cardiovasc Diagn Ther, 2014,4(2)∶ 147-164.
[6] PARKIN D M, BRAY F, FERLAY J, et al. Global cancer statistics [J]. CA Cancer J Clin, 2005, 55(2)∶ 74-108.
[7] EISENHAUER E A, THERASSE P, BOGAERTS J,et al. New response evaluation criteria in solid tumours∶revised RECIST guideline (version 1.1) [J]. Eur J Cancer,2009, 45(2)∶ 228-247.
[8] DONALDSON S B, WEST C M, DAVIDSON S E,et al. A comparison of tracer kinetic models for T1-weighted dynamic contrast-enhanced MRI∶ application in carcinoma of the cervix [J]. Magn Reson Med, 2010,63(3)∶ 691-700.
[9] LUNA A, PAHWA S, BONINI C, et al. Multiparametric MR imaging in abdominal malignancies [J]. Magn Reson Imaging Clin N Am, 2016, 24(1)∶ 157-186.
[10] D E ROBERTIS R, TINAZZI MARTINI P,DEMOZZI E, et al. Prognostication and responseassessment in liver and pancreatic tumors∶ The new imaging [J]. World J Gastroenterol, 2015, 21(22)∶ 6794-6808.
[11] SUNG Y S, KWON H J, PARK B W, et al. Prostate cancer detection on dynamic contrast-enhanced MRI∶ computer-aided diagnosis versus single perfusion parameter maps [J]. AJR Am J Roentgenol, 2011, 197(5)∶1122-1129.
Primary study on perfusion-weighted imaging in concurrent chemoradiotherapy of cervical cancer
WANG Xiaoyu, WANG Yue, YU Tao, LUO Yahong (Department of Medical Imaging, Liaoning Cancer Hospital & Institute,Shenyang 110042, Liaoning Province, China)
Correspondence to: WANG Xiaoyu E-mail: 13516001093@163.com
【Abstract】Objective: To study the differences and relationship of perfusion-weighted imaging (PWI) between pre- and post-concurrent chemoradiotherapy of cervical cancer. Methods: Twenty patients with cervical cancer confirmed by pathology were retrospectively analyzed. All the patients underwent PWI before and after concurrent chemoradiotherapy. The most enhanced region of tumor was selected as region of interest (ROI). The time-intensity curve (TIC) was made, then peak height (PH), maximum slope of increase (MSI), and time to peak (TTP) were analyzed. Results: After concurrent chemoradiotherapy, PH and MSI were decreased (399.05±45.39 vs. 278.32±35.09, 38.57±2.77 vs. 19.55±2.49; P=0.000 and 0.000), and TTP was prolonged (40.49±4.18 vs. 66.15±5.11, P=0.000). PH and MSI in the effective treatment group were higher than those in the ineffective treatment group (411.79±43.40 vs. 360.80±27.44, 39.53±2.27 vs. 35.69±2.16; P=0.025 and 0.004). Conclusion: PWI is valuable in the evaluation and prediction of the efficacy of concurrent chemoradiotherapy of cervical cancer. It can provide functional evaluation besides morphology.
【Key words】Cervical cancer; Perfusion-weighted imaging; Evaluation of therapeutic effect; Concurrent chemoradiotherapy
中图分类号:R445.2
文献标志码:A
文章编号:1008-617X(2016)01-0075-06
基金项目:国家公益性行业科研专项(No:201402020);国家科技支撑计划子课题(No:2014BAI17B01)
通信作者:王晓煜 E-mail:13516001093@163.com
收稿日期:(2016-01-18)
