MRI鉴别交界性与恶性上皮性卵巢肿瘤
2016-07-14李勇爱强金伟马风华李海明赵书会复旦大学附属金山医院影像科上海0508复旦大学附属妇产科医院放射科上海000上海交通大学医学院附属新华医院放射科上海0009
李勇爱,强金伟,马风华,李海明,赵书会.复旦大学附属金山医院影像科,上海 0508;.复旦大学附属妇产科医院放射科,上海 000;.上海交通大学医学院附属新华医院放射科,上海 0009
MRI鉴别交界性与恶性上皮性卵巢肿瘤
李勇爱1,强金伟1,马风华2,李海明1,赵书会3
1.复旦大学附属金山医院影像科,上海 201508;2.复旦大学附属妇产科医院放射科,上海 200011;3.上海交通大学医学院附属新华医院放射科,上海 200092
【摘要】目的:探讨交界性上皮性卵巢肿瘤(borderline epithelial ovarian tumor,BEOT)的常规MRI表现,明确MRI鉴别BEOT与恶性上皮性卵巢肿瘤(malignant epithelial ovarian tumor,MEOT)的价值。方法:回顾性分析经手术和病理证实的67例BEOT患者的临床及MRI资料,观察肿瘤双侧性、大小、形态、边界、囊实性分界、构型、乳头或结节、信号、强化程度、同侧卵巢显示、腹膜种植灶及腹腔积液,并与69例MEOT的征象比较。结果:67例BEOT共86个肿瘤,平均大小(13.0±6.7) cm,其中19例(28%)累及双侧卵巢;69例MEOT共98个病灶,平均大小(9.3±4.2) cm,其中29例(42%)累及双侧卵巢。两组肿瘤大小和双侧性差异无统计学意义(P=0.864,P=0.095)。两组肿瘤在形态、边界和囊实性分界方面差异有显著统计学意义(P均<0.001)。BEOT多呈(类)圆形、边界和囊实性分界清;而MEOT多呈分叶或不规则,边界和囊实性分界不清。纯囊性[9/86 (10%) vs. 1/98 (1%),P=0.007]、囊性为主伴赘生物[31/86 (36%) vs. 11/98 (11%),P<0.001]、外生型乳头或结节[23/86 (27%) vs. 7/98 (7%),P<0.001)、分支乳头[28/86 (33%) vs. 0/98 (0%),P<0.001)、同侧卵巢显示[29/86 (34%) vs. 0/98 (0%),P<0.001)5个征象在BEOT较MEOT多见,五者联合诊断BEOT的灵敏度、特异度和准确率分别为84%、81%和82%。结论:MRI可显示BEOT和MEOT不同的征象,有助于两者鉴别。
【关键词】卵巢癌;交界性卵巢肿瘤;磁共振成像;鉴别诊断
交界性上皮性卵巢肿瘤(borderline epithelial ovarian tumor,BEOT)是一种无间质浸润,但有细胞核增生与核异型性的低度恶性肿瘤,占上皮性卵巢肿瘤的15%~20%[1]。与恶性上皮性卵巢肿瘤(malignant epithelial ovarian tumor,MEOT)相比,BEOT发病年龄较低,预后较好,5年生存率达92%,明显高于MEOT的35%[2-3]。对于有生育要求或希望保留卵巢功能的BEOT患者,可行保留生育能力的保守手术;而MEOT患者须行全面分期手术,并辅以术后化疗。故术前准确的鉴别诊断将有助于制订恰当的治疗方案,并可避免不必要的卵巢和子宫切除及再次手术,提高患者术后生活质量。
由于肿瘤巨大,超声和CT对鉴别BEOT与MEOT价值有限[4-5]。MRI具有非常好的组织分辨能力,可较好显示BEOT的形态学特征[6-9]。但目前常规MRI用于鉴别BEOT与MEOT的研究较少,个别小样本研究仅显示了MRI有限的鉴别诊断价值[5]。本研究通过回顾性分析67例 BEOT和69例MEOT患者的临床及MRI资料,旨在探讨MRI鉴别BEOT与MEOT的价值,提高术前诊断准确率。
1 资料和方法
1.1 病例资料
收集2010—2014年于复旦大学附属金山医院和复旦大学附属妇产科医院行MRI检查,且经手术和病理证实的 BEOT和MEOT患者136例。其中BEOT患者67例,年龄16~82岁,平均(38±14.6)岁;MEOT患者69例,年龄36~75岁,平均(56±8.4)岁。两组患者年龄差异具有统计学意义(P<0.001)。
1.2 检查方法
使用1.5 T或3.0 T MR超导扫描仪(SIEMENS公司Symphony Avanto或Verio)和体部相控阵线圈。扫描前取出带金属的节育环,患者仰卧位,平静呼吸。采用自旋回波序列,横断面T1WI及抑脂,T2WI及抑脂(TIRM法),矢状面T2WI序列扫描。增强扫描包括横断面、矢状面和冠状面T1WI抑脂序列,动脉期和静脉期双期扫描。对比剂为钆喷酸葡胺(马根维显),剂量20 mL,注射速率2~3 mL/s。扫描层厚4~5 mm,层间距1.5 mm,矩阵256×256,视野340 mm,激励次数4。扫描范围从耻骨联合下缘至髂动脉分叉处,病灶巨大时扩大范围扫描。
1.3 图像分析
由2名从事体部影像的医师共同阅片,意见不同时讨论达成一致。观察内容:① 肿瘤的部位、大小(最大径)、形态、边界、囊实性分界。② 肿瘤构型:分为完全囊性、囊性为主伴赘生物、囊实性和实性4类。③ 乳头或结节的生长方式:分为内生型、外生型和混合型;分支状乳头显示。④ 信号:以邻近子宫肌层为参照,分为低、等及高信号。⑤ 实性成分强化程度:测量增强动脉期、静脉期病灶与髂腰肌信号强度,并计算其比值,肿瘤强化不均时选择强化明显区域进行测量,重复3次取平均值。BEOT和MEOT组分别获61和85个肿瘤/髂腰肌强化比值(排除缺少标准动脉期或静脉期扫描病例、纯囊性和壁结节<0.5 cm难以测量者,各25个和13个)。⑥ 腹腔积液:根据Bent等[6]标准分3级:腹腔积液仅限于子宫直肠窝为少量,上限高于子宫底部为大量,介于两者之间为中等量。⑦ 同侧卵巢是否显示。⑧ 腹膜种植灶。
1.4 统计学处理
使用SPSS 22.0软件包进行统计分析。采用独立样本t检验比较两组间患者年龄、病变最大径、强化程度比值,采用Pearson Chi-square χ2检验比较两组肿瘤双侧性、形态、边界、囊实性分界、乳头或结节的生长方式、信号、腹膜种植灶、腹腔积液,采用Fisher精确检验比较两组肿瘤纯囊性、分支乳头结构和同侧卵巢显示的差异,P<0.05为差异有统计学意义。
2 结 果
2.1 BEOT与MEOT的MRI形态学征象比较
67例BEOT患者共86个肿瘤,累及双侧卵巢19例(28%),最大径1.5~36.0 cm,平均(13.0±6.7) cm。69例MEOT患者共98个肿瘤,累及双侧卵巢29例(42%),最大径2.4~21.8 cm,平均(9.3±4.2) cm。两组肿瘤双侧性和大小差异无统计学意义(P=0.095,P=0.846)。BEOT与MEOT的MRI形态学征象比较见表1,图1~4。
2.2 BEOT与MEOT在形态、边界和囊实性分界等方面的比较
两组肿瘤在形态、边界和囊实性分界方面差异有显著统计学意义(P均<0.001)。BEOT多呈(类)圆形、边界清、囊实性分界清;而MEOT多分叶或不规则,边界和囊实性分界不清明显较BEOT多。BEOT表现为纯囊性(10%)或囊性伴乳头或结节(36%)明显高于MEOT (分别为1%和11%)(P=0.007,P<0.001);BEOT表现为囊实性或实性者较MEOT略少见,差异无统计学意义。BEOT和MEOT的乳头或结节均以内生型为主,发生率相仿;外生型以BEOT多见(27% vs. 7%);混合型以MEOT多见(42% vs. 7%),差异均有统计学意义(P<0.001);分支乳头仅见于BEOT (33%,P<0.001)。同侧卵巢显示仅见于BEOT (34%,P<0.001)。腹膜种植灶及大量腹腔积液多见于MEOT,差异有统计学意义。

表1 BEOT与MEOT的MRI征象比较

图1 右侧卵巢交界性黏液性囊腺瘤MRI表现患者60岁,腹腔膨隆入院。右侧卵巢交界性黏液性囊腺瘤,完全囊性。横断位(A)可见盆腔内14.7 cm巨大囊性占位,边界清(星号所示)。病灶内一侧可见蜂房(箭头所示,B~D),诸房信号不等,囊内未见明显实性成分,部分分隔增厚。增强后可见蜂房囊壁明显强化
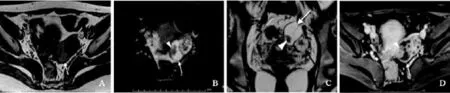
图2 左侧卵巢交界性浆液性乳头状瘤MRI表现患者21岁,体检发现,左侧卵巢交界性浆液性乳头状瘤,囊性为主伴乳头。横断位T1WI (A)、横断位和冠状位T2WI (B和C)显示左附件区囊性肿块伴乳头(白箭头所示),囊液呈T1WI略高和T2WI高信号;囊内乳头呈T1WI和T2WI等信号,增强后(D)明显强化(箭头所示);肿块旁见正常形态卵巢(黑箭头所示)
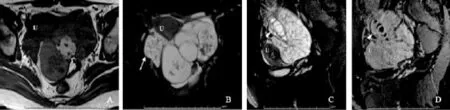
图3 双侧卵巢交界性浆液性乳头状肿瘤MRI表现患者27岁,腹痛1个月,双侧卵巢交界性浆液性乳头状肿瘤,右侧实性,左侧囊实性。横断位 T1WI (A)、横断位和矢状位T2WI抑脂(B和C)可见两侧附件区肿块,右侧呈T1WI等/T2WI高信号(白箭头所示),中央可见正常结构卵巢(箭头所示);左侧呈T1WI等高/T2WI高信号(黑箭头所示);两侧肿块内均可见典型分支乳头结构,T2WI见低信号分支轴心,增强后(D)强化高于子宫(U),分支轴心呈弱强化

图4 左侧卵巢高级别浆液性腺癌MRI表现患者54岁,腹胀、腹痛1个月,左侧卵巢高级别浆液性腺癌,实性。横断位T1WI (A)可见左附件区实性肿块(白箭头所示),形态不规则,内见不规则坏死;增强后(B)可见肿块强化低于子宫(U),其内坏死区无明显强化;矢状位T2WI抑脂及T1WI抑脂增强(C和D)可见大网膜种植(黑箭头所示)
2.3 BEOT与MEOT在T1WI、T2WI 序列和动脉期强化比值方面的比较
在T2WI序列,两组肿瘤实性成分以等及低信号为主,高信号区在MEOT更常见(14% vs. 33%,P=0.019);在T1WI抑脂序列,囊性成分高信号BEOT较MEOT多见(56% vs. 31%,P=0.006)。两组肿瘤动脉期强化比值差异无统计学意义;静脉期强化比值BEOT高于MEOT([0.99~2.54 (1.73±0.38) vs. 0.71~3.33 (1.56±0.53)],差异有统计学意义(P=0.036)。
完全囊性、囊性伴乳头或结节、外生型乳头或结节、分支乳头结构、同侧卵巢显示5个征象在BEOT较MEOT多见,诊断BEOT的灵敏度、特异度和准确率分别为90%、56%和57%,74%、61%和70%,77%、59%和70%,100%、63%和69%,100%、63%和69%,五者联合诊断BEOT的灵敏度、特异度和准确率分别为84%、81%和82%。
3 讨 论
BEOT在生长方式和组织病理学特征方面介于良性与明显恶性的同类肿瘤之间,无间质浸润,预后比临床分期相同的卵巢癌好,但可发生腹膜种植和淋巴结转移,也称为低度恶性肿瘤,占卵巢上皮性肿瘤的4%~14%。BEOT平均发病年龄约38岁,比MEOT平均发病年龄提前10~15岁。BEOT患者临床症状与MEOT类似,以腹胀、腹痛、腹部增大、尿急或尿频等特异性症状为主,也可无症状;血清糖类抗原125(carbohydrate antigen 125,CA125)可升高,幅度较MEOT略低,但不可作为独立判断肿瘤类型和侵袭性的指标[10-11]。
本组资料表明,虽然BEOT平均直径更大,双侧发生率较MEOT低,但差异无统计学意义。以往研究显示,BEOT肿瘤的构型可分为4种[6,8-9]:完全囊性、囊性为主伴赘生物、囊实性和实性。本研究显示,纯囊性和囊性伴乳头或结节表现主要见于BEOT (46%),囊实性和实性表现在BEOT与MEOT间无显著差异。BEOT多呈(类)圆形,边界和囊实性间分界清。MEOT多呈分叶状或不规则,边界和囊实性分界不清。
乳头或结节生长方式不一,可为单纯内生或外生型,也可为内生和外生混合型生长。BEOT 和MEOT的乳头或结节均以内生型为主,分别为56%及50%,但单纯外生型以BEOT多见,而混合型以MEOT多见。研究显示[4-5,12-13],乳头或结节数目越多,实性成分越小,则BEOT的可能性越大。本研究未计数乳头和测量实性成分的大小。有文献报道[8]实性成分内树枝状T2WI低信号为浆液性BEOT的特异性征象,病理上为纤维分支轴心。本研究28个(33%)病灶可见分支乳头,病理类型均为BEOT。
两组肿瘤实性成分T2WI上等低信号在BEOT 较MEOT多见(86% vs. 67%,P=0.019),考虑与交界性肿瘤中纤维成分较多,而恶性肿瘤中肿瘤血管较多有关[14]。囊性成分T1WI上含高信号在BEOT较MEOT多见(56% vs. 31%,P=0.006)。Bent等[6]认为,T1WI高信号对应囊内出血及黏液,见于50%的黏液性BEOT。Zhao等[8]研究显示,BEOT的实性成分坏死、出血较少,囊性成分内未见出血,故推测两组肿瘤的囊液蛋白含量差异导致了T1WI信号的不同。
注射对比剂增强后扫描,两组肿瘤实性成分呈中度或明显强化为主,乳头的显示优于平扫序列,尤其是较小乳头仅在增强时显示。本研究显示两组肿瘤动脉期强化比值无显著差异,而静脉期强化比值在BEOT较MEOT高,差异有统计学意义(P=0.036)。原因可能是MEOT新生血管丰富,管壁通透性高,强化虽较明显,但对比剂流出较快;而BEOT纤维成分较多,对比剂流出较慢。Thomassin-Naggara等[15-16]的小样本动态增强研究显示,BEOT的时间-强度曲线呈Ⅱ型曲线(缓升平台型),MEOT呈Ⅲ型曲线(速升平台型);BEOT的曲线强化峰值和最大斜率明显低于MEOT,与本研究结果并不一致,需进一步行大样本动态增强扫描研究。
29个(34%) BEOT可见同侧卵巢,其中61%卵巢位于肿块中央,其余39%位于肿瘤一侧。卵巢可见正常结构,但变形扭曲,卵巢周围为分支乳头状实性肿块[1],为肿瘤起源于卵巢表面上皮并呈外生型生长所致。MEOT均未见同侧卵巢结构,考虑与恶性肿瘤呈侵袭性生长,对卵巢实质侵犯较大有关。
BEOT多为早期病变,虽可发生腹膜种植,但发生率明显低于MEOT (10% vs. 64%)。MEOT患者就诊时多为晚期,多数已发生广泛转移,尤其易侵犯子宫,且可形成网膜饼,易于两者鉴别[17]。
是否有腹腔积液及腹腔积液量常被用作经验性判断肿瘤良恶性的指标,但有文献[5,18]认为是否存在腹腔积液难以鉴别交界性与恶性卵巢肿瘤。本研究分别有49% BEOT及64% MEOT患者合并腹腔积液,无统计学差异。虽然MEOT更易产生大量腹腔积液,但因发生率较低,无法作为有效的鉴别诊断指标。
综上所述,BEOT有价值的征象包括患者年龄较小、肿瘤呈(类)圆形、边界和囊实性分界清、纯囊性或囊性伴乳头或结节、外生型乳头或结节、分支乳头、同侧卵巢可见。而倾向于MEOT的征象包括患者年龄较大、肿瘤不规则或分叶状、边界不清、囊实性分界不清、混合型生长乳头或结节、腹膜种植灶、大量腹腔积液。MRI可显示两类肿瘤的形态学特征,有助于鉴别。
参考文献
[1] NAQVI J, NAGARAJU E, AHMAD S. MRI appearances of pure epithelial papillary serous borderline ovarian tumours [J]. Clin Radiol, 2015, 70(4)∶ 424-432.
[2] BOUIC-PAGÈS E, PERROCHIA H, MÉRIGEAUD S, et al. MR imaging of primary ovarian tumors with pathologic correlation [J]. J Radiol, 2009, 90 (7-8)∶ 787-802.
[3] STEWART BW, KLEIHUES P. World cancer report [M]. Lyon∶ IARC Press, 2003.
[4] BURKHOLZ K J, WOOD B P, ZUPPAN C. Best cases from the AFIP∶ borderline papillary serous tumor of the right ovary [J]. RadioGraphics, 2005, 25(6)∶ 1689-1692.
[5] DE SOUZA N M, O’NEILL R, MCINDOE G A, et al. Borderline tumors of the ovary∶ CT and MRI features and tumor markers in differentiation from stage I disease [J]. AJR, 2005, 184(3)∶ 999-1003.
[6] BENT C L, SAHDEV A, ROCKALL A G, et al. MRI appearances of borderline ovarian tumors [J]. Clin Radiol,2009, 64(4)∶ 430-438.
[7] BAZOT M, HAOUY D, DARAÏ E, et al. Is MRI a useful tool to distinguish between serous and mucinous borderline ovarian tumours? [J]. Clin Radiol, 2013, 68(1)∶e1-e8.
[8] ZHAO S H, QIANG J W, ZHANG G F, et al. MRI appearances of ovarian serous borderline tumor∶pathological correlation [J]. J Magn Reson Imaging, 2014, 40(1)∶ 151-156.
[9] MA F H, ZHAO S H, QIANG J W, et al. MRI appearances of mucinous borderline ovarian tumors∶pathological correlation [J]. J Magn Reson Imaging, 2014,40(3)∶ 745-751.
[10] VAN CALSTER B, TIMMERMAN D, BOURNE T, et al. Discrimination between benign and malignant adnexal masses by specialist ultrasound examination versus serum CA-125 [J]. J Natl Cancer Inst, 2007, 99(22)∶ 1706-1714.
[11] SHIN J E, CHOI H J, KIM M H, et al. The serum CA-125 concentration data assists in evaluating CT imaging information when used to differentiate borderline ovarian tumor from malignant epithelial ovarian tumors [J]. Korean J Radiol, 2011, 12(4)∶ 456-462.
[12] ACS G. Serous and mucinous borderline (low malignant potential) tumors of the ovary [J]. Am J Clin Pathol, 2005,123(Suppl)∶ S13-S57.
[13] JUNG S E, LEE J M, RHA S E, et al. CT and MR imaging of ovarian tumors with emphasis on differential diagnosis [J]. RadioGraphics, 2002, 22(6)∶ 1305-1325.
[14] ZHAO S H, QIANG J W, ZHANG G F, et al. Diffusion-weighted MR imaging for differentiating borderline from malignant epithelial tumours of the ovary∶pathological correlation [J]. Eur Radiol, 2014, 24(9)∶2292-2299.
[15] THOMASSIN-NAGGARA I, DARAI E, CUENOD C A, et al. Dynamic contrast-enhanced magnetic resonance imaging∶ a useful tool for characterizing ovarian epithelial tumors [J]. J Magn Reson Imaging, 2008, 28(1)∶ 111-120.
[16] THOMASSIN-NAGGARA I, BAZOT M, DARAI E, et al. Epithelial ovarian tumors∶ value of dynamic contrast-enhanced MR imaging and correlation with tumor angiogenesis [J]. Radiology, 2008, 248(1)∶ 148-159.
[17] NOUGARET S, ADDLEY H C, COLOMBO P E, et al. Ovarian carcinomatosis∶ how the radiologist can help plan the surgical approach [J]. RadioGraphics, 2012, 32(6)∶1775-1800.
[18] SHEN-GUNTHER J, MANNEL R S. Ascites as a predictor of ovarian malignancy [J]. Gynecol Oncol, 2002,87(1)∶ 77-83.
MRI features for differentiating borderline from malignant epithelial ovarian tumors
LI Yong’ai1, QIANG Jinwei1, MA Fenghua2, LI Haiming1, ZHAO Shuhui3(1. Department of Radiology, Jinshan Hospital, Fudan University,Shanghai 201508, China; 2. Department of Radiology, Obstetrics and Gynecology Hospital of Fudan University,Shanghai 200011, China; 3. Department of Radiology, Xinhua Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China)
Correspondence to: QIANG Jinwei E-mail: dr.jinweiqiang@163.com
【Abstract】Objective: To investigate MRI features of borderline epithelial ovarian tumors (BEOTs) and to differentiate BEOT from malignant epithelial ovarian tumors (MEOTs). Methods: The clinical and MRI data of 67 patients with BEOT and 69 patients with MEOT proven by surgery and pathology were reviewed retrospectively. MRI features including bilaterality, size, shape,margin, cystic-solid interface, configuration, papilla or nodule, signal, enhancement, presence of ipsilateral ovary, peritoneal implants and ascite were analyzed. Results: There were 67 BEOT patients with 86 tumors [mean size of (13.0±6.7) cm], and bilateral ovaries were involved in 19 cases. There were 69 MEOT patients with 98 tumors [(9.3±4.2) cm], and bilateral ovaries were involved in 29 cases. There were no significant differences in size and bilaterality between the two groups. There were significant differences in shape, margin and clear cystic-solid interface (all P<0.00 1) between the two groups. BEOT frequently presented as round or oval shape, clear margin and cystic-solid interface. In contrast, MEOT often demonstrated the lobulated or irregular shape, unclear margin and unclear cystic-solid interface. Purely cystic papilla or nodules [9/86 (10%) vs. 1/98 (1%), P=0.007], predominantly cystic papilla or nodules [31/86 (36%) vs. 11/98 (11%), P<0.001], exophytic papilla or nodules [23/86 (27%) vs. 7/98 (7%), P<0.001], branching papilla [28/86 (33%) vs. 0/98 (0%), P<0.001] and presence of ipsilateral ovary [29/86 (34%) vs. 0/98 (0%), P<0.001] were found more frequently in BEOT than in MEOT. The combination of these five features yielded a sensitivity, specificity and accuracy of 84%, 81% and 82%. Conclusion: MRI can manifest different morphological features between BEOT and MEOT, and help todistinguish BEOT from MEOT.
【Key words】Ovarian cancer; Borderline ovarian tumor; Magnetic resonance imaging; Differential diagnosis
中图分类号:R445.2
文献标志码:A
文章编号:1008-617X(2016)01-0060-06
基金项目:国家自然科学基金项目(No:81471628);上海市卫生系统先进适宜技术推广项目(No:2013SY075);上海市医学重点建设专科(No:ZK2015A05)。
通信作者:强金伟 E-mail:dr.jinweiqiang@163.com
收稿日期:(2016-03-01)
