子宫肉瘤病例分析及文献复习
2016-07-14陈佩文陈欣林杨小红湖北省妇幼保健院超声诊断科湖北武汉430070
陈佩文,陈欣林,杨小红湖北省妇幼保健院超声诊断科,湖北 武汉 430070
·晓航读片窗·
子宫肉瘤病例分析及文献复习
陈佩文,陈欣林,杨小红
湖北省妇幼保健院超声诊断科,湖北 武汉 430070
【关键词】子宫;肉瘤;超声
资料
患者,女性,69岁。绝经23年,下腹疼痛、腹胀2个月,便秘1月余。当地超声检查示:盆腔包块(大小13.6 cm×9.8 cm×9.4 cm)。转诊至本院再次行超声检查,示膀胱后方巨大混合性肿块,实质为主,其内回声不均,可见形态不规则的无回声区,肿块内可见丰富的血流信号,部分子宫及宫颈可显示。超声造影:12秒开始灌注,呈非均匀高增强,内灌注不均匀。妇科检查:阴道外口可见脱垂的小宫颈,可触及萎缩的子宫体,及超过胎头大的肿块,质硬,活动欠佳,无压痛。患者无高血压、高血糖等慢性疾病,既往无手术病史,G4产4,平时体健。入院后,各项实验室检查未见异常。糖类抗原125 (carbohydrate antigen 125,CA125) 35.16 U/mL,甲胎蛋白(α fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、CA199均正常。术前诊断为卵巢肿瘤,行全子宫+双附件切除+大网膜切除术。术中所见:子宫完全瘤化,大小15 cm×10 cm,质软,浆膜层完整,其下方血管怒张,子宫后壁与盆腔及直肠表面粘连。双侧附件外观无异常,卵巢均萎缩。盆腔无积液。术后子宫标本剖视:宫体与宫颈完全瘤化,均呈鱼肉状,质软,宫腔消失,大网膜未见异常。术中快速病理切片:子宫恶性肿瘤,考虑为肉瘤。术后病理:恶性肿瘤,肉瘤,结合免疫表型符合恶性血管周上皮样细胞肿瘤Ⅲ期(肿块大小9 cm×7 cm,侵及2/3以上肌层)(图1)。
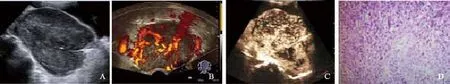
图1 子宫肉瘤超声及病理表现A:经腹部超声示膀胱后方巨大非均质肿块,子宫及宫颈显示不清;B:经阴道超声显示肿块呈非均质,能量多普勒显示肿块内血流信号丰富;C:超声造影示肿块呈非均匀性主高灌注;D:术后病理示恶性肿瘤,肉瘤,结合免疫表型符合恶性血管周上皮样细胞肿瘤
鉴于该病例罕见,我们总结2014年1月—2015年12月本院病科理诊断为子宫肉瘤的另5例患者,就临床表现、超声、MRI、CT等影像学表现及术后病理(表1)并结合文献进行回顾性分析。
讨论
子宫肉瘤是罕见肿瘤,占女性生殖道恶性肿瘤1%,占子宫癌3%~7%[1]。虽然多数病例具有侵犯性,但其临床表现无特异性及组织病理学的多样性,使人们对这一疾病的诊断及优化治疗缺乏共识[2]。
表1显示3例为癌肉瘤(3/6,50%);1例为(盆腔肿块,肠系膜病灶)复发性平滑肌肉瘤;1例为罕见的宫颈腺泡状软组织肉瘤;1例为子宫恶性肿瘤,肉瘤。患者平均年龄为55.3岁,5例为绝经后妇女。组织学上,子宫肉瘤是子宫间叶组织起源恶性肿瘤的笼统称谓,组成子宫的间叶成分包括平滑肌、各种纤维细胞、子宫内膜间质、血管、淋巴管、神经和淋巴组织等,每一种间叶成分均可发生相应的恶性肿瘤。常见的组织学类型癌为肉瘤,约占40%,其他有平滑肌肉瘤(40%)、子宫内膜间质肉瘤(10%~15%)和未分化肉瘤(5%~10%)[3]。2009年国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)制定了子宫肉瘤分级[4]。

表1 2014—2015年病理诊断的6例子宫肉瘤的基本概况
本组中子宫异常出血3例,其中2例为绝经后阴道出血,宫腔镜检并诊刮病理检查提示癌肉瘤;1例表现为月经量增大一次,宫颈管刮出物病理示宫颈腺泡软组织肉瘤。1例表现为全身乏力,超声示绝经后子宫增大,宫腔局限性病灶,腹腔积液,宫腔镜检,刮宫病理示癌肉瘤。盆腔肿块1例,为全宫术后2年,病理诊断为平滑肌肿瘤恶性潜能不确定,腹胀1年余,发现盆腔包块6个月,超声示阴道残端上方混合性包块,术前肿瘤穿刺病理检查考虑平滑肌肿瘤复发,术后病理示(盆腔肿块,肠系膜病灶)复发性平滑肌肉瘤。本组6例子宫肉瘤患者,临床表现各异,无明显特异性,包括子宫异常出血、腹痛、在短期内迅速长大的肿瘤[1],难与子宫肌瘤、子宫腺肌瘤等良性子宫疾病相鉴别。
尽管各种成像技术不断进步,术前诊断子宫肉瘤仍存在一定难度。三维能量超声、MRI、CT作为子宫肉瘤的辅助诊断工具,在术前预测子宫肉瘤中的作用仍不很清楚[5-7]。经阴道超声检查是临床了解病灶的首选成像技术。本组中超声对内膜宫腔及宫颈的病灶提供了一些诊断信息,术前宫腔镜检查和刮宫及刮宫组织送病理检查对确定手术方式及手术范围具有决定性的意义。超声对内膜和宫腔回声及血流改变的描述,与子宫内膜增生、息肉等病变具有重叠性,对明确诊断仍有难度。
本组中有1例膀胱后方巨大混合性包块,应用二维超声示非均质性肿块,能量多普勒显示肿块内血流信号丰富,该病例同时进行超声造影显示肿块的血流呈不均匀灌注。大的、单个的、不断增长并伴囊性变、中央区多血管的超声特征多提示子宫肌层恶性病变存在,这些超声特征也见于非典型的良性病变如囊性变、黏液性变性、红色变性、水肿或透明变性[8]。能量多普勒虽然对小血管及低速血流的显示优于彩色多普勒[9],但多普勒图像不能用于良恶性肿瘤的鉴别[8-11]。
本组中术前仅1例行MRI检查,提示子宫内膜增厚,信号不均匀,与子宫后壁浅肌层分界不清,给临床提供了重要的诊断信息。笔者的体会是:MRI在显示内膜病变与肌层和(或)肌层病变与肌层的关系中有价值;同时,其视野宽,可明确肿块与子宫及周边组织的关系。有几项研究描述子宫平滑肌肉瘤在MRI的表现为:单个、大的、快速生长的、浸润子宫肌层生长的、边界不清的肿块,在T1WI上为非均质低信号,T2则为中-高信号(由于坏死及出血灶)[12-13]。弥散加权成像(diffusion-weighted imaging,DWI)和表面弥散系数(apparent diffusion coefficient,ADC)是评估子宫病变最重要的工具。最新文献认为,DWI上中-高信号强度可作为发现“高风险病变”的首选条件;当ADC值低于正常子宫肌层,仅用DWI即可提高诊断率[14-15]。关于MRI对子宫肉瘤的诊断价值,还需更多病例进一步证实。
本组1例患者剖腹全宫术后发现肿块,术前CT检查结果并不支持子宫肉瘤与子宫肌瘤的鉴别,但对应用CT了解盆腔肿块与周边组织的关系及怀疑继发性病变有一定帮助,与文献报道一致[16]。
最近研究证明各种恶性肿瘤与全身炎症有关,患者血液的中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)是诊断与预测恶性肿瘤的有用标记[17-21]。与血清CA125相比,NLR预测肿瘤复发和进展更准确[22]。NLR>2.1是子宫肉瘤的一个有效独立预测因子[23]。本组病例选自2014—2015年,目前均存活,尚无法将NLR作为预测因子。
子宫肉瘤是罕见的子宫恶性肿瘤,通过临床表现及影像学特征对子宫肉瘤与子宫良性肿瘤进行术前鉴别诊断仍是一项具有挑战性的课题。对于不规则阴道出血(尤其是绝经后的)、短期内迅速增大的盆腹腔非均质性包块且血流丰富,应该考虑恶性病变的可能性。由于本组样本例数有限,需更多病例来加深对这一疾病的认识。
参考文献
[1] MAJOR F J, BLESSING J A, SILVERBERG S G, et al. Prognostic factors in early stage uterine sarcoma∶ a Gynecologic Oncology Group study [J]. Cancer, 1993,71(4 Suppl)∶ 1702-1709.
[2] GIUNTOLI R L, METZINGER D S, DIMARCO C S, et al. Retrospective review of 208 patients with leiomyosarcoma of the uterus∶ prognostic indicators,surgical management, and adjuvant therapy [J]. Gynecol Oncol, 2003, 89(3)∶ 460-469.
[3] World Health Organization classification of tumours. In∶Tavassoli FA, Devilee P. eds. Pathology and genetics of tumours of the breast and female genital organs [M]. Lyon∶IARC Press, 2003.
[4] PRAT J. FIGO staging for uterine sarcomas [J]. Int J Gynaecol Obstet, 2009, 104(3)∶ 177-178.
[5] TIMOR-TRITSCH I E, MONTEAGUDO A. Three and four-dimensional ultrasound in obstetrics and gynecology [J]. Curr Opin Obstet Gynecol, 2007, 19(2)∶157-175.
[6] NAMIMOTO T, YAMASHITA Y, AWAI K, et al. Combined use of T2-weighted and diffusion-weighted 3-T MR imaging for differentiating uterine sarcomas from benign leiomyomas [J]. Eur Radiol, 2009, 19(11)∶2756-2764.
[7] MURAKAMI M, TSUKADA H, SHIDA M, et al. Whole-body positron emission tomography with F-18 fluorodeoxyglucose for the detection of recurrence in uterine sarcomas [J]. Int J Gynecol Cancer, 2006, 16(2)∶854-860.
[8] EXACOUSTOS C, ROMANINI M E, AMADIO A, et al. Can gray-scale and color Doppler sonography differentiate between uterine leiomyosarcoma and leiomyoma? [J]. J Clin Ultrasound, 35(8)∶ 449-457.
[9] NAGAI T, TAKAI Y, AKAHORI T, et al. Novel uterine sarcoma preoperative diagnosis score predicts the need for surgery in patients presenting with a uterine mass [J]. Springerplus, 2014, 3∶ 678.
[10] VAN DEN BOSCH T, DUEHOLM M, LEONE F P,et al. Terms, definitions and measurements to describe sonographic features of myometrium and uterine masses∶a consensus opinion from the Morphological Uterus Sonographic Assessment (MUSA) group [J]. Ultrasound Obstet Gynecol, 2015, 46(3)∶ 284-298.
[11] WU T I, YEN T C, LAI C H. Clinical presentation and diagnosis of uterine sarcoma, including imaging [J]. Best Pract Res Clin Obstet Gynaecol, 2011, 25(6)∶ 681-689.
[12] SANTOS P, CUNHA T M. Uterine sarcomas∶ clinical presentation and MRI features [J]. Diagn Interv Radiol,21(1)∶ 4-9.
[13] SALA E, ROCKALL A G, FREEMAN S J, et al. The added role of MR imaging in treatment stratification of patients with gynecologic malignancies∶ what the radiologist needs to know [J]. Radiology, 266(3)∶ 717-740.
[14] TAMAI K, KOYAMA T, SAGA T, et al. The utility of diffusion-weighted MR imaging for differentiating uterine sarcomas from benign leiomyomas [J]. Eur Radiol,18(4)∶ 723-730.
[15] SATO T, YUASA N, FUJITA M, et al. Clinical application of diffusion-weighted imaging for preoperative differentiation between uterine leiomyoma and leiomyosarcoma [J]. Am J Obstet Gynecol, 210(4)∶368.
[16] GURRAM M K, PULIVARTHI S, MCGARY C T, et al. Brain and multiorgan metastases from uterine leiomyosarcoma [J]. Tumori, 100(1)∶ e8-e13.
[17] WALSH S R, COOK E J, GOULDER F, et al. Neutrophil-lymphocyte ratio as a prognostic factor in colorectal cancer [J]. J Surg Oncol, 2005, 91(3)∶ 181-184.
[18] CHO H, HUR H W, KIM S W, et al. Pre-treatment neutrophil to lymphocyte ratio is elevated in epithelial ovarian cancer and predicts survival after treatment [J]. Cancer Immunol Immunother, 2009, 58(1)∶ 15-23.
[19] HALAZUN K J, ALDOORI A, MALIK H Z, et al. Elevated preoperative neutrophil to lymphocyte ratio predicts survival following hepatic resection for colorectal liver metastases[J]. Eur J Surg Oncol, 2008, 34∶ 55-60.
[20] LEITCH E F, CHAKRABARTI M, CROZIER J E, et al. Comparison of the prognostic value of selected markers of the systemic inflammatory response in patients with colorectal cancer [J]. Br J Cancer, 2007, 97(7)∶ 1266-1270.
[21] MCMILLAN D C. Systemic inflammation, nutritional status and survival in patients with cancer [J]. Curr Opin Clin Nutr Metab Care, 2009, 12(3)∶ 223-226.
[22] KIM H S, HAN K H, CHUNG H H, et al. Neutrophil to lymphocyte ratio for preoperative diagnosis of uterine sarcomas∶ a case-matched comparison [J]. Eur J Surg Oncol, 2010, 36(7)∶ 691-698.
[23] CHO H Y, KIM K, KIM Y B, et al. Differential diagnosis between uterine sarcoma and leiomyoma using preoperative clinical characteristics [J]. J Obstet Gynaecol Res, 2016, 42(3)∶ 313-318.
中图分类号:R445.1
文献标志码:A
文章编号:1008-617X(2016)01-0084-04
收稿日期:(2016-01-14)
