动态增强MRI在卵巢良恶性肿瘤鉴别中的价值
2016-07-14李海明强金伟马风华赵书会夏淦林复旦大学附属金山医院影像科上海0508江苏省南通市肿瘤医院放射科江苏南通66复旦大学附属妇产科医院放射科上海000上海交通大学医学院附属新华医院放射科上海0009
李海明,强金伟,马风华,赵书会,夏淦林,冯 峰.复旦大学附属金山医院影像科,上海 0508;.江苏省南通市肿瘤医院放射科, 江苏 南通 66;.复旦大学附属妇产科医院放射科,上海 000;.上海交通大学医学院附属新华医院放射科,上海 0009
动态增强MRI在卵巢良恶性肿瘤鉴别中的价值
李海明1,2,强金伟1,马风华3,赵书会4,夏淦林2,冯 峰2
1.复旦大学附属金山医院影像科,上海 201508;2.江苏省南通市肿瘤医院放射科, 江苏 南通 226361;3.复旦大学附属妇产科医院放射科,上海 200011;4.上海交通大学医学院附属新华医院放射科,上海 200092
【摘要】目的:探讨动态增强MRI(dynamic contrast-enhanced MRI,DCE-MRI)对卵巢良恶性肿瘤的诊断和鉴别诊断价值。方法:回顾性分析经手术和病理证实、含有实质成分的86例卵巢良恶性肿瘤(良性15个、恶性71个)的DCE-MRI资料。评价标准包括时间-强度曲线(time-intensity curve,TIC)类型(分为Ⅰ、Ⅱ、Ⅲ型)和3项半定量参数:增强幅度(enhancement amplitude,EA)、最大斜率(maximal slope,MS)及达峰值一半时间(time of half rising,THR),比较良恶性肿瘤的差异。结果:恶性肿瘤中,TIC Ⅲ型59例(83%)、Ⅱ型12例(17%),未见Ⅰ型;良性肿瘤中,TIC Ⅰ型5例(33%)、Ⅱ型10例(67%),未见Ⅲ型;TIC类型在良恶性肿瘤中差异有统计学意义(P<0.001)。恶性肿瘤的平均EA及MS值均大于良性肿瘤[(267.4±86.2) vs.(220.2±90.5),(11.0±6.3)vs.(6.1±4.7),P值分别为0.05和<0.001],而THR值则低于良性肿瘤[(32.8±7.6)s vs. (55.5±15.4)s,P<0.001)]。THR值是诊断效能最高的指标,受试者工作特性曲线的曲线下面积为89%。当THR<45 s时,诊断灵敏度、特异度、准确率、阳性和阴性预测值分别为94%、80%、92%、96%和75%。结论:DCE-MRI的TIC类型及其3个半定量参数有助于卵巢良恶性肿瘤的鉴别。
【关键词】卵巢肿瘤;磁共振成像;动态增强;鉴别诊断
卵巢肿瘤种类繁多,组织学类型复杂,术前主要依赖影像学检查进行定性诊断和鉴别诊断[1-2]。常规MRI具有较高的软组织分辨率和多参数、多方位成像的优点,能很好地显示卵巢病变的形态学特征,但良恶性肿瘤之间仍有很多征象相互重叠,鉴别诊断困难[2]。动态增强MRI (dynamic contrast-enhanced MRI,DCE-MRI)可根据扫描所得到的时间-强度曲线(time-intensity curve,TIC)和量化参数来反映肿瘤的微血管生成及血管通透性等血流动力学情况,有助于良恶性卵巢肿瘤的鉴别诊断[3]。本研究就卵巢良恶性肿瘤的DCE-MRI表现进行回顾性分析,旨在探讨DCE-MRI曲线类型和各半定量参数在鉴别卵巢良恶性肿瘤中的价值。
1 资料和方法
1.1 一般资料
回顾性分析2011年2月—2014年10月在复旦大学附属金山医院就诊并符合下列条件的卵巢恶性肿瘤71例和良性肿瘤15例。病例入选标准:①经手术和病理证实的含实性成分(≥1.0 cm)的卵巢良性和恶性肿瘤;② 术前行常规MRI平扫和DCE-MRI检查,图像质量能满足诊断需要。排除标准:① 卵巢肿瘤以囊性为主且实性成分最大径<1.0 cm者;② 术后病理证实为交界性卵巢肿瘤;③ 术前行放、化疗等其他辅助治疗;④图像质量不佳,不符合诊断要求。
卵巢良性肿瘤组患者年龄24~88岁,平均(57±15)岁,中位年龄57岁;恶性肿瘤组患者年龄15~83岁,平均(54±12)岁,中位年龄56岁;两组患者年龄差异无统计学意义(P=0.476)。良性卵巢肿瘤组织学类型如下:(纤维)卵泡膜细胞瘤11例、卵巢纤维瘤3例、含少量性索成分的卵巢间质瘤1例,均单侧发生。卵巢恶性肿瘤组织学类型如下:高级别浆液性腺癌31例、内膜样腺癌4例、透明细胞癌4例、黏液性腺癌3例、低级别浆液性腺癌3例、混合型腺癌6例、低分化腺癌5例、恶性生殖细胞肿瘤4例、转移性肿瘤9例、恶性Sertoli-Leydig细胞瘤1例、神经内分泌癌1例。其中25例见双侧肿瘤。
1.2 仪器和方法
采用SIEMENS公司Avanto/Espree 1.5 T MR超导扫描仪,相控阵体线圈。患者仰卧位,平静呼吸,先行常规MRI平扫,序列如下。矢状位T2WI抑脂:重复时间(repetition time,TR)/回波时间(echo time,TE)为4 000/83 ms;横断位T1WI:TR/TE为761/10 ms;横断位T2WI抑脂:TR/TE为8 000/83 ms;冠状位T2WI:TR/ TE为4 000/98 ms。视野(field of view,FOV)为(300~380)×(320~400) mm;矩阵256×256或320×320;层厚4.0~8.0 mm,层距1.2~1.5 mm;激励次数4。DCE-MRI扫描选择病灶实性成分显示最清晰层面为最佳层面进行。采用FLASH-2D序列,TR为5.6 ms,TE为2.38 ms,反转角10°;层厚4 mm,间距1 mm;共扫描20层,单期扫描时间7 s,连续无间隔扫描30期,总时间3.5 min。对比剂为钆喷酸葡胺(马根维显),剂量0.2 mmol/kg,采用自动高压注射器于平扫4期后开始注药,速率3.0 mL/s,结束后注射20 mL生理盐水冲洗导管。
1.3 图像分析和后处理
由两名从事妇科肿瘤影像诊断的医师(6年和31年经验)共同阅读图像,意见不同时讨论达成一致。选取DCE扫描强化最明显且均匀的区域作为感兴趣区(region of interest,ROI),在SIEMENS后处理工作站上使用Mean Curve方法,选择同一层面得到ROI内的TIC,计算出半定量参数:增强幅度(enhancement amplitude,EA)、最大线性斜率(maximal slope,MS)和达峰值一半时间(time of half rising,THR)。参照Thomassin-Naggara等[4]的研究,将TIC类型分为3种。Ⅰ型:增强后缓慢逐渐上升型;Ⅱ型:增强后中等度上升(相对于子宫肌层)平台型;Ⅲ型:增强后呈速升平台或速升缓降型。Ⅰ型和Ⅱ型TIC多为良性,Ⅲ型多为恶性。EA值为TIC纵坐标上最高值,MS为增强后整个扫描周期内信号强度增加的最大比率,THR为从注入对比剂至最大强化幅度一半所需的时间。当MRI上表现为双侧卵巢肿块时,仅分析较复杂一侧的肿块。
1.4 统计学处理
使用SPSS 23.0统计分析软件,采用两独立样本Mann-Whitney U检验比较良恶性肿瘤半定量参数的差异,Pearson卡方检验比较两组间TIC类型的差异。利用受试者工作特征 (receiver operating characteristic,ROC)曲线评价TIC类型及各半定量参数鉴别良恶性卵巢肿瘤的诊断效能,并确定最佳诊断阈值。P≤0.05为差异有统计学意义。
2 结 果
2.1 良恶性肿瘤的TIC类型分析
71例恶性肿瘤中,59例(83%)为Ⅲ型(图1~2),12例(17%)为Ⅱ型,未见Ⅰ型;15例良性肿瘤中,10例(67%)为Ⅱ型(图3),5例(33%)为Ⅰ型(图4),未见Ⅲ型。良恶性肿瘤的TIC类型有统计学差异(χ2=48.120,P<0.001)。
2.2 良恶性肿瘤的EA、MS及THR值
良恶性肿瘤的半定量参数EA、MS及THR值见表1,均具有统计学差异(P=0.05、P<0.001、P<0.001)。

图1 TIC Ⅲ型右侧卵巢高级别浆液性腺癌DCE-MRI表现患者60岁,右侧卵巢高级别浆液性腺癌。A:动态增强示右侧卵巢囊性为主型肿块,壁结节显著强化;B:TIC类型为Ⅲ型(红色),EA=324.4,MS=18.5,THR=20 s。黄色曲线为子宫TIC

图2 TIC Ⅲ型左侧卵巢高级别浆液性囊腺癌DCE-MRI表现患者55岁,左侧卵巢高级别浆液性囊腺癌。A:动态增强示左侧卵巢囊性为主型肿块,壁结节显著强化;B:TIC类型为Ⅲ型,EA=312.6,MS=14,THR=35 s

图3 TIC Ⅱ型左侧卵巢间质瘤DCE-MRI表现患者66岁,左侧卵巢间质瘤伴少量性索成分。A:动态增强示左侧卵巢实性肿块,呈轻-中度不均匀强化;B:TIC类型为Ⅱ型,EA=261.8,MS=5.6,THR=83 s

图4 TIC Ⅰ型左侧卵巢纤维卵泡膜细胞瘤DCE-MRI表现患者42岁,左侧卵巢纤维卵泡膜细胞瘤。A:动态增强示左侧卵巢实性肿块,呈轻-中度不均匀强化;B:TIC类型为Ⅰ型,EA=141,MS=1.7,THR=68 s
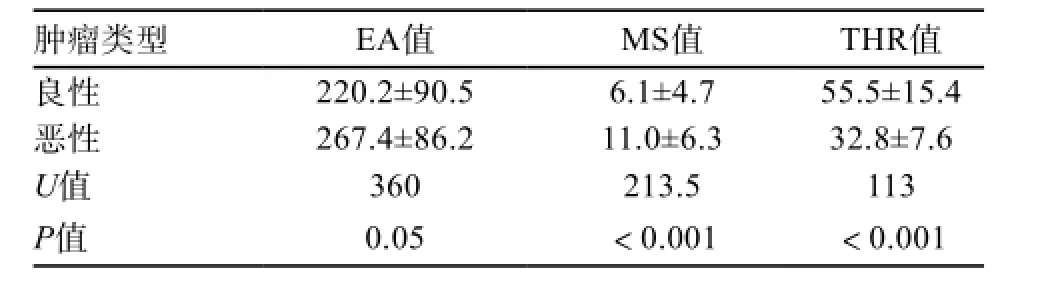
表1 良恶性卵巢肿瘤的半定量参数(EA、MS、THR)比较
2.3 TIC类型及半定量参数诊断效能比较
EA、MS和THR值鉴别良恶性卵巢肿瘤的ROC曲线下面积分别为66%、80%和89%,最佳诊断阈值分别为264.3、6.6和45 s。TIC类型(Ⅲ型)及半定量参数诊断良恶性卵巢肿瘤的效能见表2。当出现THR<45 s和Ⅲ型TIC其中一项时,诊断恶性卵巢肿瘤的灵敏度、特异度、准确率、阳性预测值和阴性预测值分别为97%、80%、94%、96%和86%(表2)。

表2 TIC类型及半定量参数诊断效能比较
3 讨 论
血管新生是指组织利用既存血管产生新生血管的过程,是所有肿瘤发生、发展、浸润和转移的基础。肿瘤血管形成过程受多种血管生成因子的共同调控,如血管内皮生长因子(vascular endothelial growth factor,VEGF)。恶性肿瘤血供丰富,新生血管多且迂曲、紊乱,结构不完整,内皮通透性增高;而良性肿瘤一般血供较少,血管形态和结构完整。DCE-MRI的理论基础正是基于肿瘤血管生成,通过显示病灶的血供情况而间接评价微血管生成和通透性的一种检查方法[5]。良恶性肿瘤的不同血供特征使其强化模式也不同,这为DCE-MRI鉴别卵巢良恶性肿瘤提供了理论依据[6]。利用DCE-MRI可对卵巢肿瘤的血供特点进行定性和定量分析,前者是指对TIC类型的分析,后者包括半定量分析和定量分析两种[7],其中半定是分析是TIC形态的相关参数,操作较简便易行,而定量分析对扫描要求高,需复杂的后处理模型来得出相关参数。
采用TIC类型鉴别肿瘤的良恶性已广泛应用于乳腺和前列腺肿瘤[8-9],而在卵巢肿瘤中的应用较少见。本研究显示,卵巢恶性肿瘤的TIC类型绝大多数为Ⅲ型(83%),少数为Ⅱ型(16.9%),未见Ⅰ型;而良性肿瘤则以Ⅱ型(67%)多见,其次为Ⅰ型(33%),未见Ⅲ型。以Ⅲ型曲线作为卵巢恶性肿瘤的标准,其诊断灵敏度、特异度、准确率、阳性预测值和阴性预测值分别为83%、100%、86%、100%和56%。这表明Ⅲ型TIC仅发生于恶性肿瘤,Ⅰ型TIC仅见于良性肿瘤,但其灵敏度较低,而Ⅱ型TIC在良恶性肿瘤间有一定的重叠。本研究表明,TIC类型有助于肿瘤良恶性卵巢的鉴别,与其他学者的研究结果一致[10]。由于肿瘤增强程度与血流量、血管密度、毛细血管通透性、毛细血管表面积及血管外细胞外间隙大小等多种因素相关[11];且部分恶性肿瘤可血管生成不良,良性肿瘤也可能有明显的血管生成;加上卵巢肿瘤病理类型复杂,不同的组织学类型也可有不同的强化模式。这些因素均易导致两类肿瘤的TIC类型重叠。因此,在鉴别诊断时还需结合其他定量参数来提高诊断的准确率。
EA值的大小代表对比剂流入量的多少,理论上恶性肿瘤的EA值应大于良性肿瘤。本研究也显示卵巢恶性肿瘤的EA值为267.4,大于良性肿瘤的220.2,差异有统计学意义(P=0.05)。MS值和THR值代表对比剂进出肿瘤血管的速率。本研究显示卵巢恶性肿瘤的MS值显著大于良性肿瘤(11.0 vs. 6.1),THR值显著低于良性肿瘤(32.8 s vs. 55.5 s),与其他研究结果基本一致[4,12-14]。这主要是因为卵巢恶性肿瘤的新生微血管不但丰富,而且多不成熟,缺乏肌层使通透性增高,对比剂更易快速进入癌组织间隙;卵巢良性肿瘤虽然可能血供丰富,如部分卵泡膜细胞类肿瘤可见较大的增强幅度,但其血管相对成熟,微循环和通透性并未明显改变。卵巢恶性肿瘤高灌注和高渗透性的特点决定了其比良性肿瘤具有更高的EA、MS值和更低的THR值的血流动力学特点。
本研究利用ROC曲线分析了3个半定量参数鉴别良恶性卵巢瘤的效能,发现THR值是效能最高的指标,其ROC曲线下面积为89%。当THR值取45 s为阈值,其诊断灵敏度、特异度、准确率、阳性预测值和阴性预测值分别为94%、80%、92%、96%和75%。而EA值是鉴别效能最低的指标,灵敏度和准确率仅为51%和57%。当出现THR<45 s和Ⅲ型TIC其中一项时,诊断恶性卵巢肿瘤的效能会进一步提高,其灵敏度、特异度、准确率、阳性预测值和阴性预测值分别为97%、80%、94%、96%和86%。
DCE-MRI能无创性评价肿瘤微血管的生成情况。有研究显示,EA值和MS值与VEGF受体2呈正相关,MS值还与微血管内平滑肌细胞的密度成反比[13]。这进一步肯定了DCE-MRI在卵巢肿瘤中的应用前景。本研究也有一定的局限性:① 卵巢良性肿瘤患者较少,肿瘤的组织学类型也较少,可能存在选择偏倚。② 由于交界性卵巢肿瘤发生率较低且不少无明显实性成分,故未纳入本研究。③ 部分TIC易受邻近组织及腹部呼吸运动的影响。因此,本研究结果尚需进一步扩大样本量、丰富肿瘤的组织学类型来证实。临床工作中,DCE-MRI应与常规MRI及其他功能成像技术如扩散加权成像或磁共振波谱联合应用,以提高卵巢肿瘤诊断的准确率。
综上所述,DCE-MRI的TIC类型和相关半定量参数有助于卵巢良恶性肿瘤的鉴别诊断。Ⅲ型TIC仅见于卵巢恶性肿瘤,Ⅰ型TIC为卵巢良性肿瘤,卵巢恶性肿瘤的EA和MS值显著高于良性肿瘤,而THR值显著低于良性肿瘤。
参考文献
[1] KURMAN R J, CARCANGIU M L, HERRINGTON C S, et al. WHO classification of tumors of female reproductive organs [M]. Lyon∶ IARC, 2014.
[2] MOHAGHEGH P, ROCKALL A G. Imaging strategy for early ovarian cancer∶ characterization of adnexal masses with conventional and advanced imaging techniques [J]. RadioGraphics, 2012, 32(6)∶ 1751-1773.
[3] 李海明, 强金伟. 动态增强MRI在卵巢肿瘤中的研究进展 [J]. 放射学实践, 2013, 28(9)∶ 987-989.
[4] THOMASSIN-NAGGARA I, DARAÏ E, CUENOD C A, et al. Dynamic contrast-enhanced magnetic resonance imaging∶ a useful tool for characterizing ovarian epithelial tumors [J]. J Magn Reson Imaging, 2008, 28(1)∶ 111-120.
[5] PATEL N, HARRIS A L, GLEESON F V, et al. Clinical imaging of tumor angiogenesis [J]. Future Oncol, 2012, 8(11)∶ 1443-1459.
[6] CARMELIET P. VEGF as a key mediator of angiogenesis in cancer [J]. Oncology, 2005, 69(Suppl 3)∶ 4-10.
[7] FRANIEL T, HAMM B, HRICAK H. Dynamic contrast-enhanced magnetic resonance imaging and pharmacokinetic models in prostate cancer [J]. Eur Radiol,2011, 21(3)∶ 616-626.
[8] 何东峰, 马大庆, 靳二虎. 动态增强MRI在鉴别乳腺良、恶性肿瘤和提示恶性肿瘤病理分级中的作用 [J].中华放射学杂志, 2012, 46(12)∶ 1075-1078.
[9] REN J, HUAN Y, WANG H, et al. Dynamic contrastenhanced MRI of benign prostatic hyperplasia and prostatic carcinoma∶ correlation with angiogenesis [J]. Clin Radiol, 2008, 63(2)∶ 153-159.
[10] 单军, 徐坚民, 龚静山, 等. 早期动态增强MRI对良恶性卵巢肿瘤的鉴别诊断价值 [J]. 中华放射学杂志,2003, 37(11)∶ 1001-1006.
[11] O’CONNOR J P, JACKSON A, PARKER G J, et al. DCE-MRI biomarkers in the clinical evaluation of antiangiogenic and vascular disrupting agents [J]. Br J Cancer, 2007, 96(2)∶ 189-195.
[12] LI X, HU L J, ZHU L M, et al. The clinical value of dynamic contrast-enhanced MRI in differential diagnosis of malignant and benign ovarian lesions [J]. Tumor Biol,2015, 36(7)∶ 5515-5522.
[13] THOMASSIN-NAGGARA I, BAZOT M, DARAÏ E, et al. Epithelial ovarian tumors∶ value of dynamic contrast-enhanced MR imaging and correlation with tumor angiogenesis [J]. Radiology, 2008, 248(1)∶ 148-159.
[14] BERNARDIN L, DILKS P, LIYANAGE S, et al. Effectiveness of semi-quantitative multiphase dynamic contrast-enhanced MRI as a predictor of malignancy in complex adnexal masses∶ radiological and pathological correlation [J]. Eur Radiol, 2012, 22(4)∶ 880-890.
Application of dynamic contrast-enhanced MRI in differentiating malignant from benign ovarian tumors
LI Haiming1,2, QIANG Jinwei1, MA Fenghua3, ZHAO Shuhui4, XIA Ganlin2, FENG Feng2(1. Department of Radiology,Jinshan Hospital, Fudan University, Shanghai 201508, China; 2. Department of Radiology, Nantong Tumor Hospital,Nantong 226361, Jiangsu Province, China; 3. Department of Radiology, Obstetrics and Gynecology Hospital of Fudan University, Shanghai 200011, China; 4. Department of Radiology, Xinhua Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200092, China)
Correspondence to: QIANG Jinwei E-mail: dr.jinweiqiang@163.com
【Abstract】Objective: To investigate the value of dynamic contrast-enhanced MRI (DCE-MRI) in the differential diagnosis of ovarian malignant and benign tumors. Methods: DCE-MRI data of 86 ovarian tumors with solid compositions (benign 15,malignant 71) confirmed by surgery and pathology were retrospectively analyzed. The patterns (Ⅰ, Ⅱ and Ⅲ) of time-intensity curve (TIC) and three semi-quantitative parameters including enhancement amplitude (EA), maximal slope (MS) and time of half rising (THR) were evaluated and compared between ovarian benign and malignant tumors. Results: Among malignant ovarian tumors, 59 (83%) were type Ⅲ, 12 (17%) were type Ⅱ, and no type Ⅰ. Among benign ovarian tumors, 5 (33%) were typeⅠ, 10 (67%) were type II, and no type Ⅲ. There was significant difference in TIC pattern between benign and malignant tumors (P<0.001). The mean values of EA and MS in malignant ovarian tumors were significantly higher than those in benign tumors [(267.4±86.2) vs. (220.2±90.5),(11.0±6.3) vs. (6.1±4.7); P=0.05 and P<0.001, respectively]. Whereas the mean value of THR in malignant tumors was significantly lower than that in benign tumors [(32.8±7.6) s vs. (55.5±15.4) s; P<0.001]. THR was the best diagnostic indicator among three semiquantitative parameters, and the area under the receiver operating characteristic (ROC) curve was 89%. When the cutoff value of THR was 45 s, the sensitivity, specificity, accuracy, positive and negative predictive values were 94%, 80%, 92%, 96% and 75%,respectively. Conclusion: TIC patterns and semi-quantitative parameters of DCE-MRI are helpful in distinguishing malignant from benign ovarian tumors.
【Key words】Ovarian neoplasm; Magnetic resonance imaging; Dynamic contrast enhancement; Differential diagnosis
中图分类号:R445.2
文献标志码:A
文章编号:1008-617X(2016)01-0066-05
基金项目:国家自然科学基金项目(No:81471628);上海市医学重点建设专科项目(No:ZK2015A05);上海市科委医学引导项目(No:124119a3300);上海市卫生系统先进适宜技术推广项目(No:2013SY075)。
通信作者:强金伟 E-mail:dr.jinweiqiang@163.com
收稿日期:(2016-02-18)
