棕榈酸和硬脂酸对HepG2细胞血红素加氧酶-1和核转录因子Nrf2表达的影响
2016-07-13郝丽红张秀英张金铭崔晓旭孙晓琦关舒函
郝丽红,张秀英,张金铭,崔晓旭,孙晓琦,关舒函
(东北农业大学动物医学学院,哈尔滨 150030)
棕榈酸和硬脂酸对HepG2细胞血红素加氧酶-1和核转录因子Nrf2表达的影响
郝丽红,张秀英*,张金铭,崔晓旭,孙晓琦,关舒函
(东北农业大学动物医学学院,哈尔滨 150030)
摘要:研究棕榈酸(PA)和硬脂酸(SA)作用HepG2细胞后,对其血红素加氧酶-1 (HO-1)和核转录因子Nrf2在转录和蛋白质水平的影响。PA和SA分别以0.25、0.5、0.75、1.0 mmol·L-1浓度刺激HepG2细胞24 h后,采用荧光定量PCR以及蛋白免疫印迹法(Western blotting)检测细胞HO-1和Nrf2的mRNA转录及蛋白质表达量的变化。结果表明:PA作用细胞后,与对照组相比,随着PA浓度的递增HepG2细胞中Nrf2和HO-1的mRNA转录及蛋白质的表达量均极显著增加(P<0.01);而SA组浓度为0.25、0.5、0.75 mmol·L-1时,Nrf2和HO-1的mRNA转录及蛋白质的表达量与对照组相比极显著增加(P<0.01),当SA浓度为1.0 mmol·L-1时其增加量相对减少。在1 mmol·L-1范围内,较高浓度的PA和较低浓度的SA对HepG2细胞Nrf2和HO-1的mRNA转录及其蛋白质的诱导作用显著。
关键词:棕榈酸;硬脂酸;HepG2细胞;血红素加氧酶-1;核转录因子Nrf2
棕榈酸(PA)和硬脂酸(SA)是饱和脂肪酸(SFA)中典型代表,具有重要的生理功能,大量研究表明,SFA可以通过调节脂类代谢,减少机体炎症反应及抗氧化应激进而在一定程度上拮抗酒精性肝病的发生发展[1],PA和SA可以通过降低血清中胆固醇的含量而减少血栓和动脉硬化的形成[2-4]。HepG2细胞系人肝癌细胞株,生物学特性与正常肝细胞相类似,其高度分化而易于培养,对遗传病毒学以及肝疾病发病机制的研究具有重要意义[5]。转录因子NF-E2相关因子2(Nrf2)是抗氧化应激的中枢调节者,其特异性受体是Kelch样ECH联合蛋白1(Keap1),在细胞核中形成Keap1_Nrf2/ARE通路后诱导多种抗氧化酶和Ⅱ相解毒酶的表达。血红素加氧酶-1 (HO-1) 作为Nrf2调控的下游靶基因之一,是细胞内重要的抗氧化应激酶,而其降解血红素的产物胆绿素、CO和Fe2+同样具有抗氧化作用。因此研究PA和SA与HO-1和Nrf2的相关性具有重要生物学意义[6-9]。Nrf2具有抗应激、抗肿瘤、调节GSH合成、抗凋亡、抗炎症反应等多种功能而有望成为药物作用的潜在靶点[10],Nrf2/ARE抗氧化系统在肝损伤、脂肪肝、肝纤维化及肝癌等方面具有重要作用[11],研究证明,PA引起的细胞脂毒性可以诱导Nrf2表达增加,进而一定程度上控制NASH的形成[12],SA可能作为过氧化物酶增生激活受体的天然配体,并且可以保护细胞免受氧化应激损伤[13]。而有关不同浓度PA和SA对HepG2细胞HO-1及Nrf2表达的影响国内外鲜有报道,本文将主要探究这两种饱和脂肪酸对HepG2细胞血红素加氧酶-1(HO-1)和核转录因子Nrf2的mRNA转录和蛋白质表达影响。
1材料与方法
1.1材料
HepG2细胞由哈尔滨医科大学某实验室赠送。DMEM培养基购于Gibco;胎牛血清(FBS)购自杭州四季青生物工程材料有限公司;棕榈酸和硬脂酸购于Sigma公司;RT-PCR试剂盒购自全式金试剂公司;Trizol购自Invitrogen公司;鼠抗人内参β-actin和兔抗人细胞核转录因子Nrf2购自武汉博士德生物技术有限公司;兔抗人HO-1购于北京博奥森生物技术有限公司;辣根过氧化物标记羊抗鼠和羊抗兔二抗均购自武汉博士德生物技术有限公司;BCA蛋白浓度测定试剂盒和RIPA裂解液购自碧云天生物技术研究所。
1.2细胞培养与处理
HepG2细胞用含10%胎牛血清的DMEM培养基培养于25 mL培养瓶,5% CO2、37 ℃条件下培养。将对数生长期细胞经0.25%的胰蛋白酶消化后接种于六孔板,待细胞生长稳定、融合率达80%以上时,将皂化后的PA和SA稀释至所需浓度后加入六孔板中。其中处理组PA和SA的作用浓度分别是0.25、0.5、0.75、1.0 mmol·L-1,作用24 h,收集细胞,每个处理6个重复。
1.3PA和SA对HepG2细胞诱导浓度的选择
将HepG2细胞接种于96孔板中,孵育过夜至融合度达80%~90%,按4、2、1、0.75、0.5、0.25 mmol·L-1浓度梯度加入PA和SA,每个浓度梯度6个重复,并设空白对照,每孔加入100 μL培养基,培养24 h,加入10 mL MTT溶液,37 ℃培养4 h,加入100 μL DMSO,酶标仪检测,检测波长为490 nm,计算脂肪酸对HepG2细胞活性的影响,计算公式:
细胞成活率=(样品孔OD值/对照孔OD值)×100%
1.4总RNA提取和RT-PCR检测Nrf2和HO-1的转录量
用Primer Premier 5.0 软件设计β-actin、Nrf2、HO-1引物,具体序列如下,β-actin上游引物:5′-GATCCACATCAGCTGGGAAGG-3′,下游引物:5′-AAGTGTGACGTTGACATCCG-3′;Nrf2上游引物:5′-CCAGCACATCCAGACAGACAC-3′,下游引物:5′-GATATCCAGGGCAAGCGACTC-3′;HO-1上游引物:5′-TCAAAGGCAGGGAAGTAGC-3′,下游引物:5′-TCAAAGGCAGGGAAGTAGC-3′。
Trizol法提取细胞总RNA,立刻使用反转录试剂盒(全式金生物技术公司)反转录成cDNA,取2 μL进行荧光定量PCR(仪器为ABI 7500 RT-PCR SDS system),条件为94 ℃预变性30 s;94 ℃ 5 s,60 ℃ 30 s,40个循环,通过荧光定量染料法定量。
1.5细胞总蛋白质提取及蛋白免疫印迹法(Western blotting)检测Nrf2和HO-1蛋白质表达量
24 h后六孔板置于冰上,弃去原培养液,用PBS冲洗3次,采用RIPA法提取细胞总蛋白质,即每孔加入100 μL RIPA蛋白裂解液,作用5 min后刮取细胞于1.5 mL EP管,于4 ℃,14 000 r·min-1离心30 min,取上清。BCA试剂盒测定蛋白质浓度,按试验需要定量后进行Western blotting检测。蛋白质样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),条件为100 V,2 h;经100 V,90 min湿转至硝基纤维素膜(NC膜);TTBS稀释的5%脱脂乳室温封闭1 h(NC膜可根据目的条带大小剪开);兔抗人Nrf2(1∶500)、HO-1(1∶500)一抗37 ℃孵育1 h;羊抗兔二抗(1∶5 000)室温作用1.5 h后ECL显影。对照组为β-actin肌动蛋白。
1.6统计分析
2结果
2.1PA和SA对HepG2诱导浓度的选择
由表1可知,与对照组相比,低浓度PA和SA对HepG2细胞生长没有显著影响(P>0.05);但当浓度达到2.0 mmol·L-1时,则极显著抑制了HepG2细胞生长(P<0.01),并随着浓度的增加,细胞成活率呈逐渐下降趋势。所以,本试验选择0.25、0.5、0.75、1.0 mmol·L-1四个作用浓度。

表1 不同浓度的PA和SA对HepG2细胞成活率的影响
同行数据无符号表示差异不显著(P>0.05),*表示差异显著(P<0.05),**表示差异极显著(P<0.01)
The same line datas with no signs mean no significant difference (P>0.05),while with * mean significant difference (P<0.05),with ** mean significant difference (P<0.01)
2.2PA和SA对HepG2细胞Nrf2和HO-1转录的影响
2.2.1不同浓度PA和SA对HepG2细胞Nrf2 转录的影响由图1可知,与对照组相比,PA浓度为0.25 mmol·L-1时,Nrf2 mRNA转录量变化不显著(P>0.05),当PA浓度为0.5、0.75和1 mmol·L-1时,Nrf2 mRNA转录量依次提高了5.27、6.97和10.47倍,差异极显著(P<0.01)。与对照组相比,SA各浓度处理组Nrf2 mRNA转录量均变化极显著(P<0.01),SA浓度为0.25、0.5、0.75以及1 mmol·L-1时,Nrf2 mRNA转录量分别提高了8.33、15.56、18.35 和12.50倍。
2.2.2不同浓度PA和SA对HepG2细胞HO-1转录的影响由图2可知,与对照组相比,PA各浓度处理组HO-1 mRNA转录量均变化极显著(P<0.01),分别提高了7.26、18.10、21.07和25.61倍。与对照组相比,SA浓度为0.25 mmol·L-1时,HO-1 mRNA转录量变化不显著(P>0.05),SA浓度为0.5、0.75和1 mmol·L-1时,HO-1 mRNA转录量分别提高了3.98、8.22和3.40倍,差异极显著(P<0.01)。

数据上标*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下图同Datas with * mean significant difference(P<0.05),with ** mean mean significant difference(P<0.01).The same as below图1 不同浓度PA和SA对Nrf2 mRNA 转录的影响Fig.1 Effects of different PA and SA concentrations on transcription of Nrf2 mRNA
2.3PA和SA对HepG2细胞Nrf2和HO-1蛋白表达的影响
2.3.1不同浓度的PA对HepG2细胞Nrf2和HO-1蛋白表达的影响由图3可知,与对照组相比,PA各浓度处理组Nrf2蛋白表达量均变化极显著(P<0.01),分别提高了0.71、0.79、1.23和1.29倍;与对照组相比,PA浓度为0.25 mmol·L-1时,HO-1蛋白表达量提高了0.25倍,变化不显著(P>0.05);PA浓度为0.5、0.75和1 mmol·L-1时,HO-1蛋白表达量分别提高了0.38、0.83和6.52倍,差异极显著(P<0.01)。
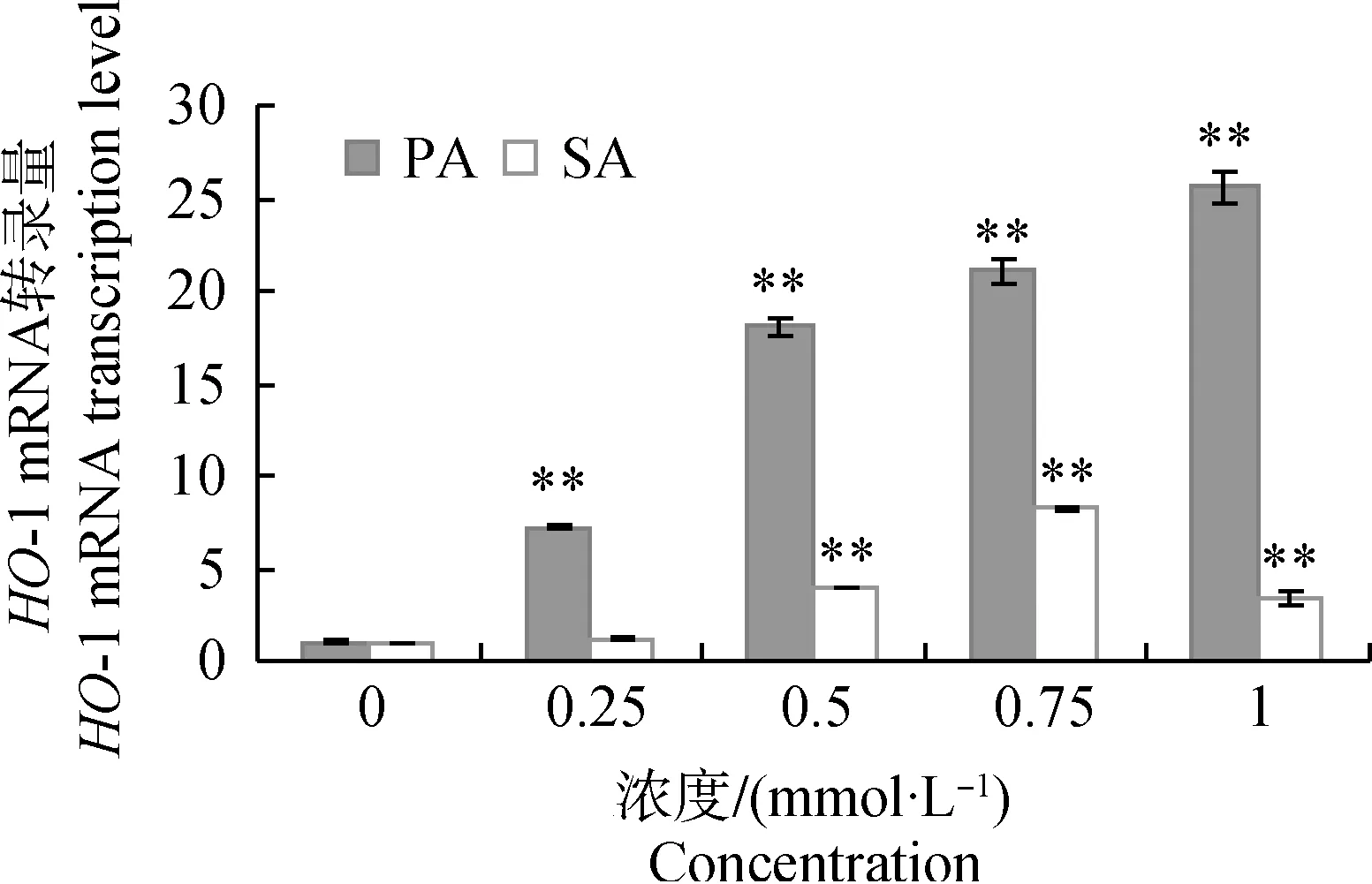
图2 不同浓度PA和SA对HO-1 mRNA 转录的影响Fig.2 Effects of different PA and SA concentrations on transcription of HO-1 mRNA

图3 不同浓度的PA对Nrf2和HO-1蛋白表达量的影响Fig.3 Effects of defferent PA concentration on protein expression of Nrf2 and HO-1
2.3.2不同浓度的SA对HepG2细胞Nrf2和HO-1蛋白表达的影响由图4可知,与对照组相比,SA浓度为0.25、0.5和0.75 mmol·L-1时,Nrf2蛋白表达量提高了0.59、0.70和0.82倍,差异极显著(P<0.01);SA浓度为1 mmol·L-1时,Nrf2蛋白表达量提高了0.53倍,虽差异极显著(P<0.01),但不及0.25~0.75 mmol·L-1时。与对照组相比,SA浓度为0.25 mmol·L-1时,HO-1蛋白表达量提高0.44倍,差异不显著(P>0.05);SA浓度为0.5和0.75 mmol·L-1时,HO-1蛋白表达量提高0.80和0.84倍,差异极显著(P<0.01);SA浓度为1 mmol·L-1时,HO-1蛋白表达量提高0.53倍,虽差异极显著(P<0.01),效果不及0.5~0.75 mmol·L-1时。
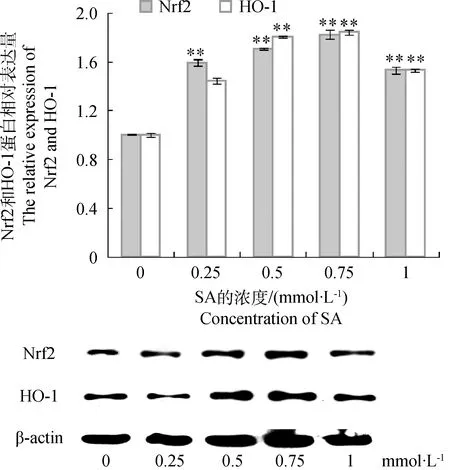
图4 不同浓度的SA对Nrf2和HO-1蛋白表达量的影Fig.4 Effects of defferent SA concentration on protein expression of Nrf2 and HO-1
3讨论
饱和脂肪酸具有潜在的生理功能,在食物中适量添加可以对某些疾病产生治疗作用,如胰岛素抵抗(IR)、 酒精性肝病以及某些代谢性疾病。随后研究表明,适量的PA和SA具有一定的抗炎症和抗氧化应激作用。SA可以通过PI-3K和PPARγ途径来拮抗氧化应激造成的脑片损伤[14];Y.Nishitani等发现,适量摄入SA可减轻胆汁阻塞引起的肝损伤、肝纤维化以及炎症反应,可以作为保肝药[15];P.H.Pan等研究表明,适量的摄入SA可以预防酒精引起的肝损伤[16];所以,日常饮食中合理控制饱和脂肪酸的摄入量对机体健康具有重要作用。目前,在细胞水平上,不同浓度PA及SA通过细胞关键信号通路对其相关代谢酶的调节作用基本没有报道。
核转录因子Nrf2是细胞抗氧化应激反应的关键因子,与抗氧化反应元件ARE结合后,通过转录激活其下游的靶基因,包括过氧化物酶(CAT)、醌氧化还原酶(NQO1)以及血红素加氧酶(HO-1)等[7],进而起到保护机体的作用。HO-1主要通过抗氧化应激反应来维持细胞内环境的稳态,同时也是催化血红素生成胆绿素、CO和Fe2+的限速酶[8-9]。故提高Nrf2及其相关代谢酶的表达量可以对机体的脂肪肝和代谢综合征等多种疾病产生治疗和预防作用,适量的摄入PA和SA,对于保证机体的健康至关重要。本试验结果表明,不同浓度的PA和SA均提高了Nrf2和HO-1的mRNA转录和蛋白质的表达量,但提高表达量的变化趋势不同。S.Joshi-Barve等报道,PA代谢可刺激细胞产生ROS和炎性细胞因子,而ROS可诱导Nrf2基因的表达[17],与本试验结果相符。在试验浓度范围内,HepG2细胞Nrf2和HO-1的mRNA转录和蛋白质表达量随PA浓度增加而逐渐提高。而SA浓度为0.75 mmol·L-1时,对HepG2细胞诱导作用最强,Nrf2和HO-1的mRNA转录和蛋白质的表达量提高的最多;SA浓度为1 mmol·L-1时,提高HO-1和Nrf2的mRNA转录和蛋白质的表达量相对减少。PA和SA在试验浓度范围内都能增强HO-1和Nrf2的mRNA转录和蛋白质的表达,只是不同浓度PA和SA对两种基因mRNA和蛋白质的表达量增加的幅度不尽相同。PA和SA作为饱和脂肪酸,对于机体代谢发挥重要的作用。PA和SA在体内含量不同时,对于机体代谢及产生的生物学特征反应的机制还需进一步研究。
4结论
在0.25、0.5、0.75、1.0 mmol·L-1,HepG2细胞Nrf2和HO-1的mRNA转录和蛋白质表达量随PA浓度增加而逐渐提高;硬脂酸(SA)随浓度增加,Nrf2和HO-1的mRNA转录和蛋白质表达也呈增加趋势,只是SA浓度较低时,诱导作用较强。
参考文献(References):
[1]王春晖,卿笃信.饱和脂肪酸对酒精性肝病的作用及机制[J].国际消化病杂志,2010,30(6):346-348.
WANG C H,QING D X.The function and mechanism of saturated fatty acids on alcoholic liver disease[J].InternationalJournalofDigestiveDiseases,2010,30(6):346-348.(in Chinese)
[2]CASTELLANOS-TAPIA L,LPEZ-ALVARENGA J C,EBBESSON S O,et al.Apolipoprotein E isoforms 3/3 and 3/4 differentially interact with circulating stearic,palmitic,and oleic fatty acids and lipid levels in Alaskan Natives[J].NutrRes,2015,35(4):294-300.
[3]HODSON L,FIELDING B A.Stearoyl-CoA desaturase:rogue or innocent bystander?[J].ProgLipidRes,2013,52(1):15-42.
[4]CRUZ L,FERNANDES V C,ARAúJO P,et al.Synthesis,characterisation and antioxidant features of procyanidin B4 and malvidin-3-glucoside stearic acid derivatives[J].FoodChem,2015,174:480-486.
[5]CHIANG C W,HUANG Y,LEONG K W,et al.PKCalpha mediated induction of miR-101 in human hepatoma HepG2 cells[J].JBiomedSci,2010,17:35.
[6]LI L R,DONG H,SONG E Q,et al.Nrf2/ARE pathway activation,HO-1 and NQO1 induction by polychlorinated biphenyl quinone is associated with reactive oxygen species and PI3K/AKT signaling[J].ChemBiolInteract,2014,209:56-67.
[7]MIN K J,KIM J H,JOU I,et al.Adenosine induces hemeoxygenase-1 expression in microglia through the activation of phosphatidylinositol 3-kinase and nuclear factor E2-related factor 2[J].Glia,2008,56(9):1028-1037.
[8]NAKAGAWA F,MORINO K,UGI S,et al.4-Hydroxy hexenal derived from dietary n-3 polyunsaturated fatty acids induces anti-oxidative enzyme heme oxygenase-1 in multiple organs[J].BiochemBiophResCommun,2014,443(3):991-996.
[9]BAUER M,HUSE K,SETTMACHER U,et al.The heme oxygenase-carbon monoxide system:regulation and role in stress response and organ failure[J].IntensiveCareMed,2008,34(4):640-648.
[10]SYKIOTIS G P,HABEOS I G,SAMUELSON A V,et al.The role of the antioxidant and longevity-promoting Nrf2 pathway in metabolic regulation[J].CurrOpinClinNutrMetabCare,2011,14(1):41-48.
[11]CHOWDHRY S,NAZMY M H,MEAKIN P J,et al.Loss of Nrf2 markedly exacerbates nonalcoholic steatohepatitis[J].FreeRadicBiolMed,2010,48(2):357-371.
[12]OKAWA H,MOTOHASHI H,KOBAYASHI A,et al.Hepatocyte-specific deletion of the keap1 gene activates Nrf2 and confers potent resistance against acute drug toxicity[J].BiochemBiophysResCommun,2006,339(1):79-88.
[13]WANG Z J,LIANG C L,LI G M,et al.Stearic acid protects primary cultured cortical neurons against oxidative stress[J].ActaPharmacolSin,2007,28(3):315-326.
[14]WANG Z J,LI G M,NIE B M,et al.Neuroprotective effect of the stearic acid against oxidative stress via phosphatidylinositol 3-kinase pathway[J].ChemBiolInteract,2006,160(1):80-87.
[15]NISHITANI Y,OKAZAKI S,IMABAYASHI K,et al.Saturated and monounsaturated fatty acids increase interleukin-10 production in rat hepatocytes[J].NihonArukoruYakubutsuIgakkaiZasshi,2007,42(1):32-35.
[16]PAN P H,LIN S Y,OU Y C,et al.Stearic acid attenuates cholestasis-induced liver injury[J].BiochemBiophyResCommun,2010,391(3):1537-1542.
[17]JOSHI-BARVE S,BARVE S S,AMANCHERLA K,et al.Palmitic acid induces production of proinflammatory cytokine interleukin-8 from hepatocytes[J].Hepatology,2007,46(3):823-830.
(编辑白永平)
Effects of Palmitic Acid and Stearic Acid on Genes and Protein Expressions of Heme Oxygenase 1 and Nuclear Transcription Factor Nrf2 in HepG2 Cell
HAO Li-hong,ZHANG Xiu-ying*,ZHANG Jin-ming,CUI Xiao-xu,SUN Xiao-qi,GUAN Shu-han
(CollegeofVeterinaryMedicine,NortheastAgriculturalUniversity,Harbin150030,China)
Abstract:The purpose of the study was to explore the effects of Palmitic acid (PA) and Stearic acid (SA) on genes and protein expression of heme oxygenase 1 (HO-1) and Nuclear Transcription Factor Nrf2 in HepG2 Cells.The HepG2 cells were treated with PA or SA of 0.25,0.5,0.75,1.0 mmol·L-1for 24 h,the mRNA and protein expression levels of HO-1 and Nrf2 were detected by quantitative reverse transcription PCR and western blotting,separately.The experimental results were as follows,compared with the control group,the mRNA and protein expressions of HO-1 and Nrf2 were significantly increased with the increasing of PA concentration (P<0.01);While the mRNA and protein expressions of HO-1 and Nrf2 were significantly increased with SA of the concentrations of 0.25,0.5,0.75 mmol·L-1(P<0.01),the increased amount of the mRNA and protein expressions of HO-1 and Nrf2 were relatively decreased when the concentration of SA was 1.0 mmol·L-1.In conclusion,a relatively higher concentration of PA and a relatively lower concentration of SA can elevate the mRNA and protein expressions of HO-1 and Nrf2 significantly within 1 mmol·L-1in HepG2 cells.
Key words:palmitic acid;stearic acid;HepG2 cells;heme oxygenase 1;nuclear transcription factor Nrf2
doi:10.11843/j.issn.0366-6964.2016.03.025
收稿日期:2015-07-10
基金项目:国家自然科学基金项目(31172369)
作者简介:郝丽红(1989-),女,黑龙江哈尔滨人,硕士生,主要从事基础兽医学研究,E-mail:15546036683@163.com
*通信作者:张秀英
中图分类号:S852.2
文献标志码:A
文章编号:0366-6964(2016)03-0603-06
