PCV2人工感染对猪肺泡巨噬细胞干扰素信号通路的调控研究
2016-07-13赵其岭张新晨陈萌萌孙嘉瑞鲍恩东张书霞吕英军
赵其岭,张新晨,陈萌萌,孙嘉瑞,鲍恩东,张书霞,吕英军
(南京农业大学动物医学院,南京 210095)
PCV2人工感染对猪肺泡巨噬细胞干扰素信号通路的调控研究
赵其岭,张新晨,陈萌萌,孙嘉瑞,鲍恩东,张书霞,吕英军*
(南京农业大学动物医学院,南京 210095)
摘要:通过建立PCV2亚临床感染模型,探究感染仔猪肺泡巨噬细胞中干扰素的变化及其调控,为PCV2复制和发病机制研究提供补充。30日龄猪圆环病毒2型(PCV2)和猪繁殖与呼吸综合征病毒(PRRSV)抗原和抗体均为阴性的仔猪15头,随机分成PCV2阴性对照0 d组、PCV2感染14 d组和PCV2感染28 d组。感染后荧光定量PCR方法检测肺泡巨噬细胞中干扰素、模式识别受体和模式识别受体接头分子mRNA水平。结果显示,IFN-β和IFN-γ mRNA转录水平在14和28 d均显著高于对照组(P<0.05);模式识别受体RIG-1、MDA-5、TLR4和TLR9 mRNA转录水平在14和28 d显著升高(P<0.05);DAImRNA转录水平在14 d显著升高(P<0.05),但28 d迅速下降;TLR3、TLR7和TLR8 mRNA转录水平无明显变化。接头分子MAVS、MyD88、IRF3和IRF7 mRNA转录水平在14和28 d均显著高于对照组(P<0.05)。以上结果表明,PCV2亚临床感染仔猪后导致肺泡巨噬细胞内IFN-β和IFN-γ的表达量上调,其上调和PCV2激活的TLR4/TLR9/MyD88和RIG-1/MDA-5/DAI/MAVS/IRF3信号通路有关。
关键词:PCV2;仔猪;肺泡巨噬细胞;干扰素;模式识别受体
猪圆环病毒(porcine circovirus,PCV),是无囊膜的单股环状负链DNA病毒,属于圆环病毒科圆环病毒属,有PCV1和PCV2两种血清型[1]。PCV1无致病性,PCV2通常以亚临床感染和断奶仔猪多系统衰竭综合征(postweaning multisystemic wasring syndrome,PMWS)的形式发病。 PCV2单独感染不会导致明显的临床症状,必须在其他病原微生物(如PRRSV、猪支原体)共感染或应激性因素的条件下导致疾病。目前对影响PCV2增殖的具体机制仍然不清楚,有体外试验表明感染过程中产生的氧化自由基、应激中产生的热休克蛋白70和27以及免疫刺激物ConA和LPS均可促使PCV2在PK-15或者淋巴细胞中的增殖[2-5];令人意外的是在PK-15细胞中添加干扰素α或γ也能导致PCV2病毒的增殖且呈剂量依赖性关系[6-7],而且研究表明干扰素导致的PCV2的增殖和该病毒的干扰素刺激元件(ISRE)有关,将其ISRE元件突变后,干扰素不能促进PCV2病毒的增殖[8],目前这是干扰素能促进病毒增殖的唯一报道;但在临床感染的在体试验中没有得到相同结果,注射干扰素γ没能促进PCV2在猪体内的增殖[9]。以上看似矛盾的研究结果表明干扰素和PCV2感染增殖存在密切关系,那么PCV2感染机体后是如何调控宿主细胞产生干扰素反应的,对此研究将有利于更加认清PCV2的复制和致病机制。
以往研究表明机体天然免疫能通过特定模式识别受体(pattern recognition receptors,PRRs)识别病原表面相关分子(pathogen associated molecular proteins,PAMPs),从而激活相关信号通路,进而诱导干扰素和炎症相关因子的生成,以发挥病原微生物的清除和免疫功能[10]。模式识别受体主要包括Toll样受体、RIG-1样受体和DAI受体,那么这些模式识别受体是否参与了PCV2感染过程中干扰素的生成,目前为止未见报道。本试验拟通过建立PCV2亚临床感染模型,以PCV2易感靶细胞巨噬细胞为研究对象,探究PCV2亚临床感染仔猪的干扰素变化及其调控,为研究PCV2的增殖和发病机制提供补充。
1材料与方法
1.1病毒
PCV2-Shanghai株(PCV2-HS,GenBank No.AY686763)由南京农业大学农业部细菌学重点开放实验室分离、保存,通过间接免疫荧光试验测定,病毒滴度为5×105TCID50·mL-1。
1.2主要仪器与试剂
主要仪器:多功能酶标仪Infinite200(瑞士TECAN公司),荧光定量PCR仪器ABI7500 (美国Applied Biosystems公司),Zeiss荧光显微镜(德国Carl Zeiss公司),高速冷冻离心机(美国Thermo公司)。
主要试剂:Trizol(日本TaKaRa公司);反转录试剂盒和荧光染料(诺维赞生物科技有限公司),动物基因组提取试剂盒(生兴生物科技有限公司)。
1.3实验动物
实验动物饲养和使用均按照南京农业大学实验管理条例进行。15头经ELISA和PCR检测血清中PCV2和PRRSV抗体和抗原均为阴性的30日龄断奶仔猪,常规饲养1周以消除应激,随机分成三组(每组5头):PCV2阴性对照0 d组,PCV2亚临床感染14 d组,PCV2亚临床感染28 d组。对照组仔猪每头滴鼻和肌肉注射各2 mL PBS,试验组仔猪每头滴鼻和肌肉注射各2 mL 5×105TCID50·mL-1PCV2悬液。接种后第0、14和28天处以安乐死,颈静脉注射10 mg·kg-1的3%戊巴比妥钠注射液,采取肺和血液,部分肺组织固定于3.7%~4%甲醛溶液,血液离心后收集血清并于-80 ℃冰箱保存备用。
1.4肺泡巨噬细胞的获取
无菌摘除肺,根据以往的实验方法[11],采用支气管肺泡灌洗法分离猪肺泡巨噬细胞(AMs),细胞纯度可达99%以上,将肺泡巨噬细胞液氮速冻后置于-80 ℃冰箱保存备用。
1.5血清中PCV2抗体和肺中PCV2抗原检测
根据以往报道[12-13],采用阻断ELISA的方法检测血清中PCV2抗体水平。血清阻断率PI=(阴性OD-待检OD)/阴性OD,当PI≥38%,判为阳性;PI≤30%,判为阴性;其间,判为可疑。
基因组提取试剂盒提取肺总DNA,常规PCR方法扩增肺中抗原PCV2,引物序列:primer 1 5′-TGACCTGTCTACTGCTGTG-3′,primer 2 5′-CC-GTGGATAGTTCTGTAGCA-3′,目的大小为476 bp。实时荧光定量PCR方法检测肺中PCV2的含量,以阳性质粒pT-SH(实验室保存)10倍倍比稀释作为模板,绘制标准曲线,根据样品Ct值和标准曲线计算出待检样品相应的拷贝数,实时定量PCR引物序列:primer 1 5′-CCAGGAGGGCGTTCTGAC-3′,primer 2 5′-CGTTACCGCTGGAGAAGGAA-3′。
1.6荧光定量PCR方法检测肺泡巨噬细胞干扰素、模式识别受体和信号通路接头分子mRNA转录水平
按照Trizol操作说明书提取肺泡巨噬细胞总mRNA,酶标仪测定RNA浓度和纯度,调整所有样品总mRNA为同一浓度,及时反转录成cDNA,-20 ℃储存备用。以β-actin为内参,荧光定量PCR方法检测肺泡巨噬细胞干扰素、模式识别受体和信号通路接头分子mRNA转录水平,引物序列见表1。反应体系为2 μL cDNA,10 μL SYBR®Green Master Mix,0.4 μL上游引物,0.4 μL下游引物,7.2 μL三蒸水。采用2-ΔΔCt方法进行基因水平变化的测定,计算公式为:目的基因mRNA相对表达量=2-ΔΔCt
ΔΔCt=(Ct目的基因mRNA-Ctβ-actin)试验组-(Ct目的基因mRNA-Ctβ-actin)对照组
1.7数据分析
2结果
2.1仔猪感染PCV2测定
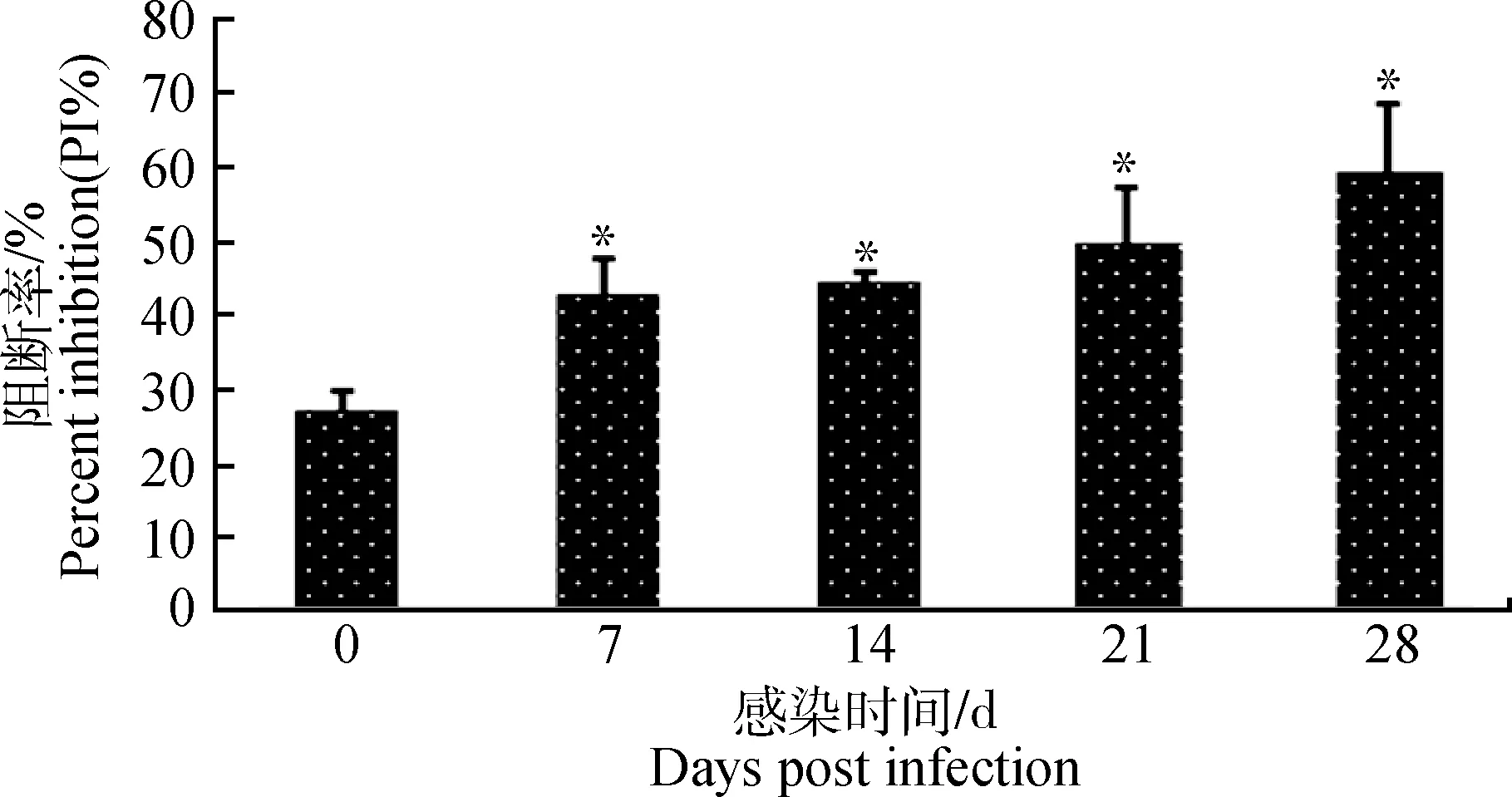
*.P<0.05,下图同*.P<0.05,the same as below图1 血清PCV2抗体检测Fig.1 The detection of PCV2 antibody
PCV2攻毒后0~28 d每隔1 d检测一次猪的直肠温度,期间温度保持正常水平,没有体温升高现象。肉眼观察各组脏器,除感染14 d组和28 d组淋巴结有轻微肿大外其他脏器形态结构均无明显变化。阻断ELISA方法检测猪血清中PCV2抗体水平,结果显示0 d对照组血清抗体阻断率均≤30%,为PCV2抗体阴性,PCV2感染后7到28 d血清中抗体阻断率均≥38%,为PCV2抗体阳性,感染组抗体阻断率与0 d对照组相比有显著升高(P<0.05)(图1)。普通PCR检测肺中PCV2抗原,PCR产物经1.5%琼脂糖凝胶电泳后,用凝胶成像系统分析,0 d对照组没有目的条带,为PCV2抗原阴性;感染14 d组和28 d组有明显的目的条带,为PCV2抗原阳性(图2A)。实时定量PCR检测PCV2 DNA含量,根据样品Ct值和标准曲线,计算对应病毒拷贝数,结果显示每50 mg肺组织中PCV2病毒DNA量在14和28 d平均值分别为7.0×103copies和1.9×104copies(图2B)。以上试验结果表明试验猪感染PCV2病毒,但没有表现出典型临床症状,根据J.Segalés[14]的评判标准(猪没有明显临床症状;淋巴结没有或者出现轻微病理损伤;可检测到一定量PCV2抗原和抗体),试验猪处于亚临床感染状态。2.2PCV2亚临床感染对肺泡巨噬细胞中β-actin的影响
PCV2亚临床感染对肺泡巨噬细胞中内参β-actin的影响(图3)。三个试验组分别以等量cDNA为模板进行PCR扩增反应,得到内参Ct值,表明对照组和试验组中β-actin的转录量处于同一水平,即PCV2感染后对肺泡巨噬细胞中内参基因β-actin的表达没有影响。
2.3PCV2亚临床感染对肺泡巨噬细胞产生的干扰素mRNA的影响
PCV2亚临床感染对仔猪肺泡巨噬细胞干扰素IFN-α、IFN-β、IFN-γ mRNA转录水平的影响(图4)。干扰素IFN-β和IFN-γ mRNA转录水平在14和28 d显著高于对照组(P<0.05); 然而IFN-α mRNA转录水平没有明显变化(P>0.05)。结果表明,PCV2亚临床感染上调IFN-β和IFN-γ的表达,但对IFN-α没有影响。
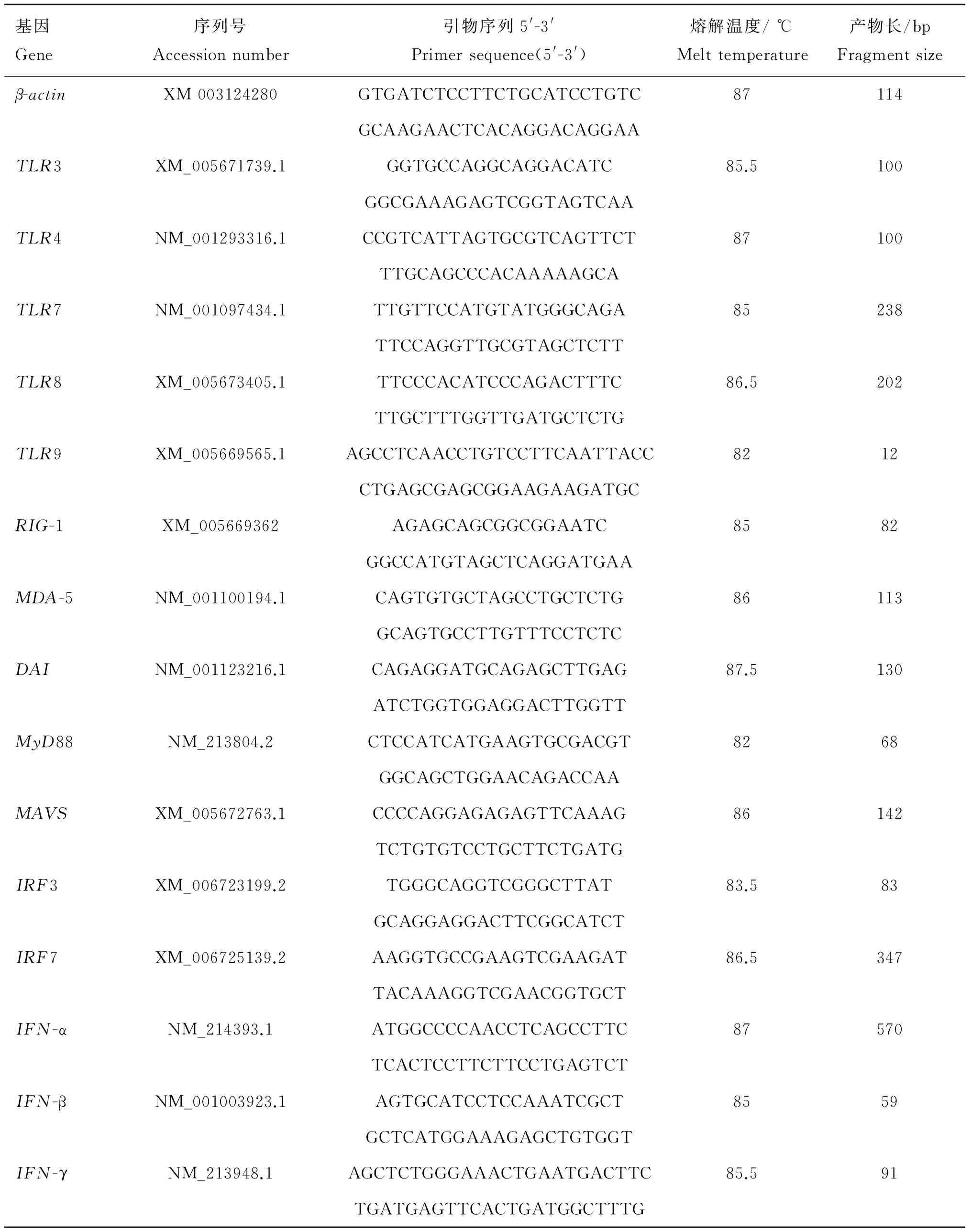
表1 RT-PCR测定肺泡巨噬细胞相关基因mRNA转录水平引物序列及其参数

图2 肺中PCV2 抗原和病毒拷贝数检测Fig.2 The detection of PCV2 antigens and DNA copies in lungs
2.4PCV2亚临床感染对肺泡巨噬细胞模式识别受体TLRs、RLRs和DAI的影响
PCV2亚临床感染对仔猪肺泡巨噬细胞模式识别受体(TLR3、TLR4、TLR7、TLR8、TLR9、RIG-1、MDA-5和DAI)相应mRNA转录水平的影响见图5。TLR4、TLR9、RIG-1和MDA-5 mRNA转录水平在14和28 d均显著升高(P<0.05),在28 d均有所下降,但仍显著高于0 d对照组(P<0.05);DAImRNA转录水平在14 d显著升高(P<0.05),但在28 d迅速下降;与阴性对照组比,TLR3、TLR7和TLR8 mRNA转录水平在14和
28 d没有明显变化。结果表明,PCV2亚临床感染影响模式识别受体TLR4、TLR9、RIG-1、MDA-5和DAI的转录,但对TLR3、TLR7和TLR8转录无作用。
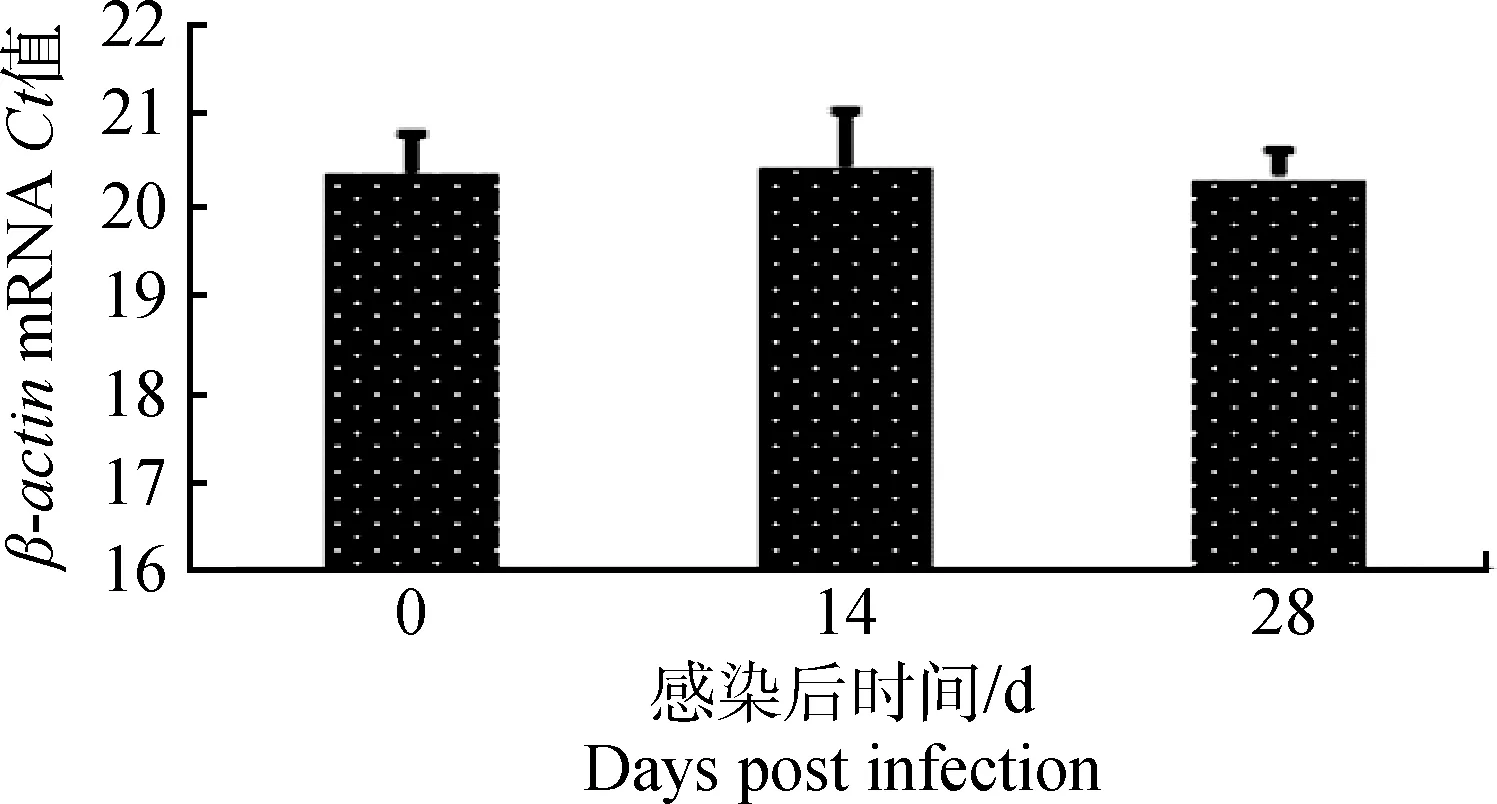
图3 PCV2亚临床感染对肺泡巨噬细胞中内参β-actin的影响Fig.3 Change of β-actin in AMs after piglets subclinically infected with PCV2
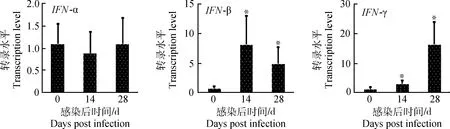
图4 PCV2亚临床感染后肺泡巨噬细胞干扰素的变化Fig.4 Changes of IFNs in AMs after piglets subclinically infected with PCV2
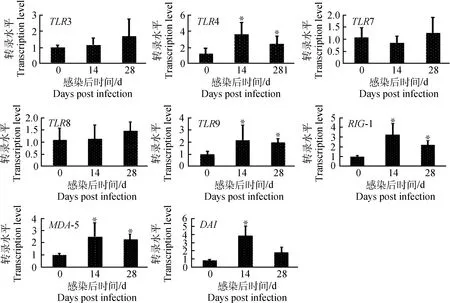
图5 PCV2亚临床感染后肺泡巨噬细胞TLRs、RLRs和DAI的变化Fig.5 Changes of TLRs,RLRs and DAI in AMs after piglets subclinically infected with PCV2
2.5PCV2亚临床感染对肺泡巨噬细胞信号通路接头分子MyD88、MAVS、IRF3和IRF7的影响
PCV2亚临床感染对仔猪肺泡巨噬细胞中MyD88、MAVS、IRF3和IRF7的相应mRNA水平影响见图6。MyD88和MAVSmRNA转录水平在14和28 d均显著升高(P<0.05);干扰素调节因子IRF3和IRF7 mRNA转录水平在14和28 d显著高于对照组(P<0.05)。结果表明,PCV2亚临床感染显著上调了接头蛋白MyD88、MAVS、IRF3和IRF7的基因转录。
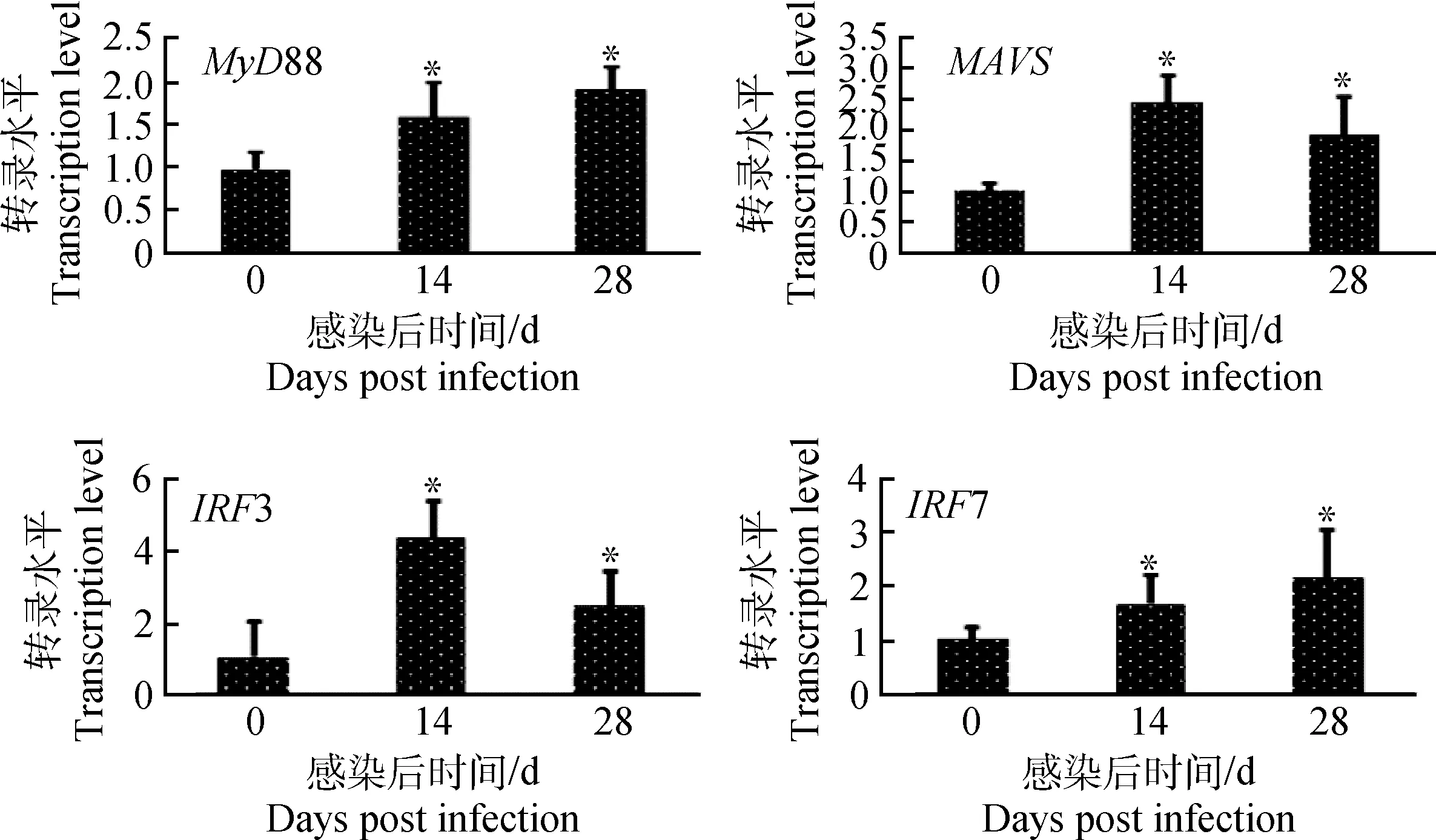
图6 PCV2亚临床感染后肺泡巨噬细胞MyD88、MAVS、IRF3和IRF7的变化Fig.6 Changes of MyD88,MAVS,IRF3 and IRF7 in AMs after piglets subclinically infected with PCV2
3讨论
以往的体外试验研究表明IFN-β和IFN-γ有利于PCV2的增殖[6-7],但体内试验没能观察到相同的现象,反而表明干扰素抑制病毒的增殖[9],这相互矛盾的研究结果引起了作者对干扰素在PCV2感染过程中作用的兴趣。干扰素作为机体先天性免疫中的第一道防线,在PCV2感染过程中是如何变化的,又是怎样调控的,目前报道甚少,对此的研究将有利于进一步认识PCV2复制和致病机制。在本试验中,PCV2感染仔猪14和28 d肺泡巨噬细胞中IFN-β和IFN-γ mRNA的水平明显高于阴性对照组,这和以往的试验结果一致[15-16],而IFN-α水平与对照组相比没有差异,在以往研究同样表明单独PCV2感染仔猪后淋巴细胞中的IFN-α转录无变化或仅轻微的上调[17]。
病毒、细菌等病原微生物入侵机体后,细胞上模式识别受体能侦测到病原微生物表面模式相关分子,进而激活干扰素生成而起抗病毒作用,或者通过NF-κB信号通路诱导细胞因子的产生发生炎症反应,从而构成机体抵御病原体入侵的第一道天然屏障。目前研究表明,参与病毒激活机体诱导干扰素生成的模式识别受体主要有Toll样受体、RIG-1样受体和DAI受体。
Toll样受体被激活后,可通过髓样分化因子(MyD88)依赖性的信号通路和MyD88非依赖性的TRIF信号通路促使NF-κB入核,从而诱导干扰素和细胞因子的生成。猪的TLRs主要包括定位于质膜上的TLR2、TLR3和定位于细胞器内的TLR4、TLR7、TLR8和TLR9,其中TLR2和TLR4主要识别病毒的脂质和蛋白质成分,TLR3、TLR7、TLR8和TLR9主要识别病毒的核酸成分,TLR9也可识别非甲基化CpG脱氧核苷酸(CpG oligoswoxy nucleotode,CpG ODN)。在本试验中仔猪感染PCV2后肺泡巨噬细胞中TLR4在14 d和TLR9在14和28 d的转录水平明显高于阴性对照组,而其他TLRs转录水平没有变化,并且MyD88的表达在14和28 d明显上调,这表明PCV2感染仔猪后激活了TLR4和TLR9,进而激活MyD88接头蛋白,从而可能导致了干扰素的产生。TLR4的上调可能是识别了PCV2编码的蛋白质(如衣壳蛋白)引起的,而TLR9上调可能是与PCV2基因组中存在65个CpG二核苷酸有关[18]。张亚群等[19]用PCV2体外感染猪肺泡巨噬细胞发现TLRs在处理的不同时间点均有不同程度的上升,而我们试验中仅看到TLR4和TLR9转录的上调,这可能和PCV2感染方式、感染数量或者体内外试验不同有关;另外,P.Y.Tu等[17]研究表明PCV2感染仔猪后淋巴结中TLR2上调,TLR7转录下调,而其他TLRs无变化,表明PCV2感染机体后在不同的免疫细胞中,激活TLRs的类型是不一样的。值得注意的是,PCV2感染过程中不仅会产生干扰素,也会对其他细胞因子(如IL-1、IL-6和TNF-α)的产生进行调控,而这些细胞因子的生成也需要激活NF-κB,因而PCV2感染过程中激活的TLR4和TLR9信号通路是否参与了干扰素生成以及其在干扰素生成过程中的贡献大小还有待进一步研究。
RIG-1样受体和DAI受体是位于细胞内另外一类受体,很多病毒感染机体后干扰素的生成和它们有关,如PRRSV、猪流感病毒、猪流行性腹泻病毒等。RIG-1样受体包括RIG-1和MDA-5,它们能识别病毒的RNA,激活的RIG-1和MDA-5,可通过MAVS接头蛋白导致IRF3和IRF7的磷酸化或者NF-κB入核,从而最后导致干扰素的生成。在作者试验中,PCV2感染仔猪后肺泡巨噬细胞中14和28 dRIG-1和MDA-5的转录水平明显上升,而且MAVS、IRF3和IRF7的转录水平也明显上调,这表明PCV2激活RIG-1/MAVS/IRF3和MDA-5/MAVS/IRF3信号通路从而导致了干扰素的上调。PCV2虽然是单股DNA病毒,但当感染宿主后,细胞内的RNA聚合酶可以以病毒DNA模板合成5′-三磷酸双链RNA[20],这可能是PCV2能被RIG-1和MDA-5识别的原因。DAI是最近新发现的模式识别受体,它能识别病毒的DNA,从而激活IRF3诱导干扰素的生成[21]。在本试验中PCV2感染后肺泡巨噬细胞中DAI转录水平在14 d显著上调,这表明PCV2也激活了DAI信号通路,从而调控干扰素的生成。
4结论
PCV2亚临床感染仔猪后可导致肺泡巨噬细胞内IFN-β和IFN-γ的上调,其上调和PCV2激活的TLR4/TLR9/MyD88信号通路以及RIG-1/MDA-5/DAI/MAVS/IRF3信号通路有关。
参考文献(References):
[1]SEGALÉS J,ALLAN G M,DOMINGO M.Porcine circovirus diseases[J].AnimHealthResRev,2005,6(2):119-142.
[2]GAN F,ZHANG Z,HU Z,et al.Ochratoxin A promotes porcine circovirus type 2 replicationinvitroandinvivo[J].FreeRadicBiolMed,2015,80:33-47.
[3]LIU J,BAI J,ZHANG L,et al.Hsp70 positively regulates porcine circovirus type 2 replicationinvitro[J].Virology,2013,447(1-2):52-62.
[4]LIU J,ZHANG L,ZHU X,et al.Heat shock protein 27 is involved in PCV2 infection in PK-15 cells[J].VirusRes,2014,189:235-242.
[5]YANG X,CHEN F,CAO Y,et al.Comparative analysis of different methods to enhance porcine circovirus 2 replication[J].JVirolMethods,2013,187(2):368-371.
[6]MEERTS P,MISINZO G,NAUWYNCK H J,et al.Enhancement of porcine circovirus 2 replication in porcine cell lines by IFN-gamma before and after treatment and by IFN-alpha after treatment[J].JInterferonCytokineRes,2005,25(11):684-693.
[7]MISINZO G,DELPUTTE P L,LEFEBVRE D J,et al.Increased yield of porcine circovirus-2 by a combined treatment of PK-15 cells with interferon-gamma and inhibitors of endosomal-lysosomal system acidification[J].ArchVirol,2008,153(2):337-342.
[8]RAMAMOORTHY S,HUANG F F,HUANG Y W,et al.Interferon-mediated enhancement ofinvitroreplication of porcine circovirus type 2 is influenced by an interferon-stimulated response element in the PCV2 genome[J].VirusRes,2009,145(2):236-243.
[9]LEFEBVRE D J,MEERTS P,COSTERS S,et al.Increased porcine circovirus type 2 replication in porcine leukocytesinvitroandinvivoby concanavalin A stimulation[J].VetMicrobiol,2008,132(1-2):74-86.
[10]秦成峰,秦鄂德.RIG-I样受体与RNA病毒识别[J].微生物学报,2008,48(10):1418-1423.
QIN C F,QIN E D.Retinoic acid-inducible gene-I-like receptors and RNA virus recognition—A reciew[J].ActaMicrobiologicaSinica,2008,48(10):1418-1423.(in Chinese)
[11]LIU J,BAI J,LU Q,et al.Two-dimensional liquid chromatography-tandem mass spectrometry coupled with isobaric tags for relative and absolute quantification(iTRAQ) labeling approach revealed first proteome profiles of pulmonary alveolar macrophages infected with porcine circovirus type 2[J].JProteomics,2013,79:72-86.
[12]HUANG L,LU Y,WEI Y,et al.Development of a blocking ELISA for detection of serum neutralizing antibodies against porcine circovirus type 2[J].JVirolMethods,2011,171(1):26-33.
[13]王丽敏,杨香林,侯成才,等.猪圆环病毒2型阻断ELISA抗体检测试剂盒的研制与应用[J].中国兽医学报,2014,34(10):1584-1588.
WANG L M,YANG X L,HOU C C,et al.Development and application of a blocking ELISA kit for detection of capsid protein antibody against porcine circovirus type 2[J].ChineseJournalofVeterinaryScience,2014,34(10):1584-1588.(in Chinese)
[14]SEGALÉS J.Porcine circovirus type 2(PCV2) infections:clinical signs,pathology and laboratory diagnosis[J].VirusRes,2012,164(1-2):10-19.
[15]ZHANG H,LUNNEY J K,BAKER R B,et al.Cytokine and chemokine mRNA expression profiles in tracheobronchial lymph nodes from pigs singularly infected or coinfected with porcine circovirus type 2(PCV2) and Mycoplasma hyopneumoniae(MHYO)[J].VetImmunolImmunopathol,2011,140(1-2):152-158.
[16]SHI K C,GUO X,GE X N,et al.Cytokine mRNA expression profiles in peripheral blood mononuclear cells from piglets experimentally co-infected with porcine reproductive and respiratory syndrome virus and porcine circovirus type 2[J].VetMicrobiol,2010,140(1-2):155-160.
[17]TU P Y,TSAI P C,LIN Y H,et al.Expression profile of Toll-like receptor mRNA in pigs co-infected with porcine reproductive and respiratory syndrome virus and porcine circovirus type 2[J].ResVetSci,2015,98:134-141.
[18]KRIEG A M,WU T,WEERATNA R,et al.Sequence motifs in adenoviral DNA block immune activation by stimulatory CpG motifs[J].ProcNatlAcadSciUSA,1998,95(21):12631-12636.
[19]张亚群,韩俊源,郭华,等.猪圆环病毒2型感染仔猪肺泡巨噬细胞Toll样受体mRNA转录的变化[J].畜牧兽医学报,2014,45(5):802-808.
ZHANG Y Q,HAN J Y,GUO H,et al.Changes of Toll-like receptor mRNA transcription in alveolar macrophages of piglets infected with porcine circovirus type 2[J].ActaVeterinariaetZootechnicaSinica,2014,45(5):802-808.(in Chinese)
[20]CHIU Y H,MACMILLAN J B,CHEN Z J.RNA polymerase Ⅲ detects cytosolic DNA and induces type 1 interferons through the RIG-1 pathway[J].Cell,2009,138(3):576-591.
[21]O’NEILL L A,BOWIE A G.Sensing and signaling in antiviral innate immunity[J].CurrBiol,2010,20(7):328-333.
(编辑白永平)
Regulation of Interferon Signaling Pathway in Alveolar Macrophages of Piglets Infected with Procine Circovirus Type 2
ZHAO Qi-ling,ZHANG Xin-chen,CHEN Meng-meng,SUN Jia-rui,BAO En-dong,ZHANG Shu-xia,LÜ Ying-jun*
(CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China)
Abstract:To understand the mechanism of PCV2 replication and pathogenesis,change and regulation of interferon in alveolar macrophages of piglets subclinically infected with procine circovirus type 2(PCV2) were studied.Fifteen 30-day-old piglets were selected as experiment animals,which were free of PCV2 and porcine reproductive and respiratory syndrome virus(PRRSV) antibody and antigen.The piglets were divided into three groups:control group(0 dpi),PCV2 infection group(14 dpi) and PCV2 infection group(28 dpi).After infection,the mRNA transcription of interferon,pattern recognition receptors(PRRs) and pathogen associated molecular proteins(PAMPs) in AMs were detected by real-time PCR.The results showed that the mRNA levels ofIFN-β andIFN-γ were significantly higher at 14 dpi and 28 dpi(P<0.05);the mRNA expression ofRIG-1,MDA-5,TLR4 andTLR9 were significantly increased at 14 dpi and 28 dpi(P<0.05);the mRNA level ofDAIwas significantly elevated at 14 dpi(P<0.05),and then decreased at 28 dpi;while there were no significant change in mRNA expression ofTLR3,TLR7 andTLR8.Compared with control,the mRNA transcription ofMAVS,MyD88,IRF3 andIRF7 were significantly increased at 14 dpi and 28 dpi(P<0.05).These results demonstrate that the up-regulations ofIFN-β andIFN-γ in alveolar macrophages of PCV2 subclinical infection are relative to TLR4/TLR9/MyD88 and RIG-1/MDA-5/DAI/MAVS/IRF3 signaling pathways.
Key words:procine circovirus type2;piglet;alveolar macrophages;interferon;pattern recognition receptors
doi:10.11843/j.issn.0366-6964.2016.03.023
收稿日期:2015-08-04
基金项目:江苏省自然科学基金(BK2011646);国家自然科学基金(31101786);江苏高校优势学科建设工程
作者简介:赵其岭(1989-),男,山东临沂人,硕士生,主要从事动物免疫病理学研究,E-mail:2013107032@njau.edu.cn *通信作者:吕英军,副教授,硕导,主要从事动物免疫病理学研究,Tel:025-84395316,E-mail:lyj@njau.edu.cn
中图分类号:S852.3
文献标志码:A
文章编号:0366-6964(2016)03-0587-08
