山羊DLK1基因分子克隆、生物信息学分析及表达研究
2016-07-13廖红海林亚秋邬杨楠朱武政
廖红海,林亚秋,邬杨楠,朱武政,李 倩,王 永*,陈 娟
(1.西南民族大学生命科学与技术学院,成都 610041; 2.青藏高原动物遗传资源保护与利用四川省重点实验室,成都 610041)
山羊DLK1基因分子克隆、生物信息学分析及表达研究
廖红海1,2,林亚秋1,邬杨楠1,朱武政1,2,李倩1,2,王永1,2*,陈娟1
(1.西南民族大学生命科学与技术学院,成都 610041; 2.青藏高原动物遗传资源保护与利用四川省重点实验室,成都 610041)
摘要:本研究旨在克隆山羊DLK1基因,预测编码蛋白的结构与功能,同时研究该基因在山羊组织器官中的表达规律及其与肌内脂肪含量的相关性。以简州大耳羊为试验动物,采用RT-PCR克隆DLK1基因序列,结合生物信息学方法分析其生物学特性,荧光定量检测DLK1mRNA表达情况,并将表达量与肌内脂肪含量进行相关性分析。结果显示,克隆得到山羊DLK1长度为1 137bp,开放阅读框(ORF)长度为927bp(GenBank登录号:KP686197),编码308个氨基酸,山羊核苷酸序列和氨基酸序列与牛的相似性最高(97%),系统进化树分析表明山羊与牛亲缘关系最近;生物信息学预测显示,该蛋白属于不稳定酸性疏水蛋白;有8个磷酸化位点和1个N-糖基化位点;亚细胞定位于内质网(44.4%)、高尔基体(33.3%)和质膜(22.2%),属于分泌跨膜蛋白;具有5个表皮生长因子结构域和2个表皮生长因子家族特有的保守结构域EGF-CA;预测二级结构由12.99%β-折叠和87.01%无规则卷曲组成的非常规蛋白。荧光定量PCR结果显示,DLK1基因在山羊不同组织中都存在表达,其在肾中表达水平最高,在脂肪组织中表达水平最低;DLK1基因在羔羊背最长肌组织中表达水平最高,高于育成羊和成年羊,但差异不显著(P>0.05);相关分析显示,山羊背最长肌、腿肌、臂三头肌中 DLK1mRNA表达与肌内脂肪含量分别呈显著负相关(R=-0.6,P<0.05)、无显著正相关(R=0.2,P>0.05)和无显著负相关(R=-0.2,P>0.05)。研究结果显示,DLK1可能对山羊肌内脂肪沉积起着重要作用。本结果为进一步研究DLK1在肌内脂肪沉积过程中的作用提供了参考。
关键词:山羊;DLK1;克隆;组织表达;时序表达;肌内脂肪
羊肉具有高营养、低脂肪、低胆固醇,口感好,独特风味等优点,并且羊以草食为主,很少饲喂添加剂,羊肉中药物残留量极低,符合当今绿色安全食品的消费观念,受到人们的亲睐。肌内脂肪(Intramuscularfat,IMF)是骨骼肌内沉积的脂肪[1],对肉的风味、嫩度和多汁性有着重要的影响[2],它的含量与肉的嫩度、口感和多汁性等呈正相关[3-4]。IMF的沉积主要取决于肌肉细胞和脂肪细胞的发育及其相互作用,深入挖掘影响肌内脂肪沉积相关候选基因是当前畜牧工作者研究的热点问题。
DLK1(Delta-likehomolog1)是表皮生长因子(Epidermalgrowthfactor,EGF)家族成员之一,在细胞膜外含有6个串联的EGF结构域,首次发现于神经母细胞瘤中。具有抑制前脂肪细胞分化的作用,又被称为脂肪前体细胞因子l(Preadipoeytefactor-l,pref-l),胚胎抗原1(Fetalan-tisenl,FAI)[5]。人的DLK1基因定位于14号染色体上,小鼠定位于12号染色体[6],绵羊定位于18号染色体[7],牛定位于21号染色体[8]。在机体代谢中DLK1具有重要调控作用,如调节脂肪的形成,骨骼肌的分化[9]和抑制造血干细胞分化与繁殖[10]。DLK1能影响转基因小鼠和Callipyge绵羊的葡萄糖代谢以及组织中脂肪的积累[11]。在绵羊上Callipyge表型与DLK1有关[12],DLK1表达上升可能是Callipyge表型肌肉肥大的主要原因[13]。另外,通过异位表达绵羊DLK1的转基因小鼠表现全身性的肌肉肥大,当缺乏DLK1时则表现出生长缓慢[14]。以上研究表明DLK1可能参与调控动物肌肉的生长发育过程。
目前,对DLK1的研究主要集中在人胚胎组织、癌症与肿瘤[10],在猪[15]、牛[16]、小鼠[17]上均已克隆得到 DLK1的全长cDNA序列,山羊上仅见DLK1部分cDNA序列报道[18],未见关于山羊DLK1基因序列的生物学特征,及其是否可以作为肌内脂肪沉积候选基因的报道。因此,本研究通过克隆简州大耳羊DLK1基因序列,阐明其组织及时序表达谱,并同时对肌肉组织中该基因的mRNA表达水平与IMF含量进行关联分析,研究结果为进一步研究DLK1在山羊肉质调控中的作用提供理论依据,为山羊的品种选育提供新的思路。
1材料与方法
1.1试验材料和试剂
1.1.1试验动物及组织的采集以四川省简阳市简州大耳羊公羊为试验动物,取相同条件下饲养健康、生长良好的羔羊、育成羊和成年羊各6头,现场屠宰。成年羊采集心、肝、脾、肺、肾、皮下脂肪、背最长肌、腿肌和臂三头肌等样本,迅速用DEPC处理水冲洗,装入处理的冻存管,标记,立即置于液氮中保存,用于提取RNA;背最长肌、腿肌和臂三头肌同时各另采集200g,锡箔纸包裹迅速保存于-20 ℃,用于测定IMF含量。羔羊和育成羊均采集背最长肌样品,迅速用DEPC处理水冲洗,装入处理的冻存管,标记,立即置于液氮中保存,用于提取RNA。1.1.2主要试剂Trizol、iQTMSYBR®GreenSupermix与pMD-19TVector均购自大连TaKaRa公司,RevertAidFirstStrandcDNASynthesisKit和2×TaqPCRMasterMix均购于Fermentas公司,Axygen胶回收试剂盒与DH5α感受态细胞购于天根生化科技有限公司。
1.2试验方法
1.2.1DLK1基因的扩增及与测序用Trizol试剂盒说明书提取总RNA,根据RevertAidFirstStrandcDNASynthesisKit试剂盒说明合成cDNA。参考GenBank上牛DLK1基因序列(登陆号:XM_005222112.1),采用PrimerPremier5.0软件设计引物(表1),由成都擎科梓熙生物技术有限公司合成。克隆体系:模板cDNA1μL,上下游引物10μmol·L-1,2 ×TaqPCRMasterMix12.5μL,补灭菌蒸馏水到25μL。反应条件: 94 ℃预变性4min;94 ℃变性20s,60 ℃退火30s,72 ℃延伸90s,39个循环;72 ℃延伸10min。用DNA凝胶回收试剂盒回收目的片段,产物与pMD-19T载体连接,转化DH5α感受态细胞,Amp+平板挑取阳性菌落,增菌后PCR鉴定,送成都擎科梓熙生物技术有限公司测序。

表1 引物序列、退火温度及PCR产物长度
S.正义链引物;A.反义链引物。GAPDH.3-磷酸甘油醛脱氢酶
S.Senseprimer;A.Antisenseprimer.GAPDH.Glyceraldehyde3-phosphatedehydrogenase
1.2.2DLK1生物信息学分析利用NCBI网站中的ORFFinder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)寻找开放阅读框;ProtParam(http://web.expasy.org/protparam/)分析蛋白理化性质;NCBI网站上BLAST软件进行同源比对;MEGA5.0和clustalx1.83构建进化树;TMHMM预测跨膜结构域;NetPhos2.0、NetOGlyc3.1、NetNGlyc1.0分析预测磷酸化位点、O-糖基化位点和N-糖基化位点;PSORTⅡPrediction进行亚细胞定位预测、SMART程序分析蛋白质结构域;SignalP4.1Server进行信号肽分析;PredictProtein预测二级结构、PHYRE2Server预测三级结构。
1.2.3山羊DLK1mRNA表达分析根据克隆的山羊DLK1cDNA片段以及内参基因3-磷酸甘油醛脱氢酶(Glyceraldehyde3-phosphatedehydrogenase,GAPDH)设计特异引物(表1)。分别以成年羊的心、肝、脾、肺、肾、脂肪和背最长肌等组织的cDNA为模板,实时荧光定量PCR法检测DLK1mRNA在成年羊组织的差异表达;分别以羔羊、育成羊和成年羊的背最长肌cDNA为模板,实时荧光定量PCR法检测DLK1mRNA的时序表达;分别以成年羊背最长肌、腿肌和臂三头肌cDNA为模板,荧光定量PCR,用于DLK1mRNA表达量与IMF相关性分析。反应体系为20μL: 包括SYBRGreen10μL,cDNA1μL,上、下游引物各 1μL,RNaseFreeddH2O7μL。PCR反应条件:95 ℃预变性3min;95 ℃变性10s,65 ℃/60 ℃退火 20s,72 ℃延伸30s,39个循环,每个待测样本设3个重复。1.2.4IMF含量的测定与数据分析肌内脂肪含量测定按国家标准,采用索氏抽提法测定(GB/T5009.6-2003)。荧光定量结果采用2-ΔΔCt法进行处理计算,试验结果用SPSS18.0中ANOVA程序进行单因素方差分析,以Duncan法进行多重比较。用SPSS18.0中CORR程序对DLK1mRNA表达量与IMF含量进行相关性分析,以Pearson作相关系数。试验数据采用“平均数±标准差”表示。P>0.05表示差异不显著,P<0.05表示差异显著。
2结果
2.1山羊DLK1基因克隆鉴定和序列分析
2.1.1目的基因片段的鉴定通过1%的琼脂糖凝胶进行电泳检测(图1),得到克隆产物条带单一特异片段,测序结果与预期目的片段大小相符。

M.DL2000 marker;1.DLK1图1 DLK1 基因扩增结果Fig.1 Amplification of DLK1 gene in goat
2.1.2核苷酸序列分析测序长度为1 137bp,并提交至GenBank(登录号:KP686197),其ORF长度为927bp,共编码308个氨基酸(图2)。进一步分析其碱基序列组成,A=16.6%,C=35.6%,G=29.6%,T=18.2%,X=0.0%。G+C=65.2%,高于(A+T)%,说明DLK1基因CDS区DNA双链较稳定。

上面为核苷酸序列,下面为氨基酸序列;*表示终止子;阴影部分为信号肽序列;预测的跨膜结构用下划线表示The upper sequence indicates the nucleotide and the lower shows the amino acids;Asterisk represents stop codon;The shade indicates the signal peptide sequence;The predicted transmembrane domains is underlined图2 DLK1 cDNA序列及其分析Fig.2 DLK1 cDNA sequence and analysis
2.2山羊DLK1与其他物种同源比较
通过NCBI进行同源性在线分析,将山羊DLK1基因与GenBank已经公布的物种牛(BC120429.1)、野猪(DQ309458.1)、人(U15981.1)、小家鼠(NM_001190704.1)以及大鼠(BC167752.1)等5个物种核苷酸序列以及氨基酸序列进行比对。结果显示(表2),山羊与牛的相似性最高。通过MEGA5.0和clustalx1.83构建核苷酸序列系统发育树(图3)。结果显示,山羊与牛聚为一支,符合物种进化规律。
2.3DLK1编码蛋白结构分析
2.3.1理化性质分析山羊DLK1蛋白分子式
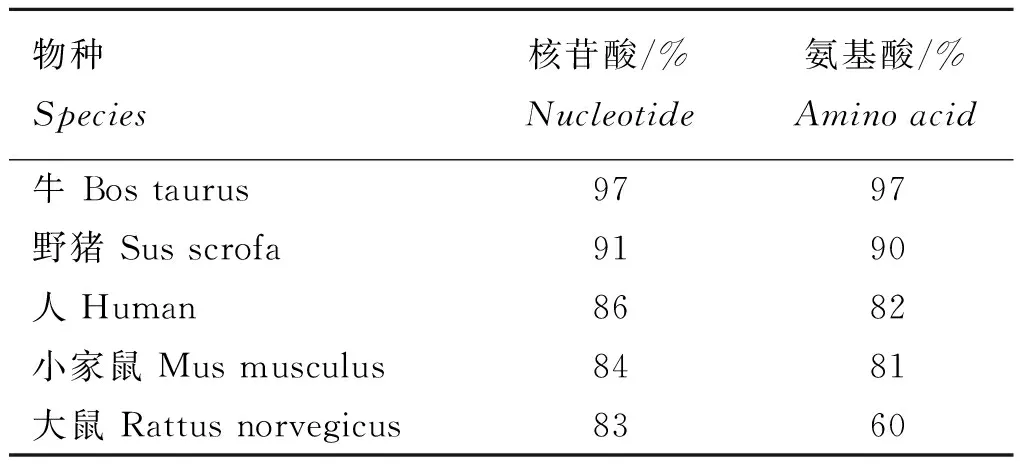
表2 山羊DLK1基因核苷酸和氨基酸序列与其他动物的一致性分析

图3 采用MEGA5.0构建DLK1基因系统进化树Fig.3 Phylogenetic tree of DLK1 gene constructed by MEGA5.0
为C1412H2194N390O445S39,相对分子质量33.00ku,理论等电点(pI)4.66,说明该蛋白为酸性蛋白质。不稳定系数为43.09,说明该蛋白属于不稳定性蛋白[19-20]。疏水指数73.08,疏水性平均值为0.014,说明该蛋白为疏水蛋白。含有20种常见氨基酸残基中Cys(11%)、Gly(10.1%)、Leu(8.4%)频率较高,带负电荷的氨基残基(Asp+Glu=36)多于带正电荷的氨基酸残基(Arg+Lys=18)。
2.3.2蛋白跨膜结构分析TMHMM在线跨膜分析显示(图4),在230~252位存在一个跨膜螺旋,表明该蛋白为跨膜蛋白,同时预测1~229氨基酸残基位于膜外,253~308位于膜内。
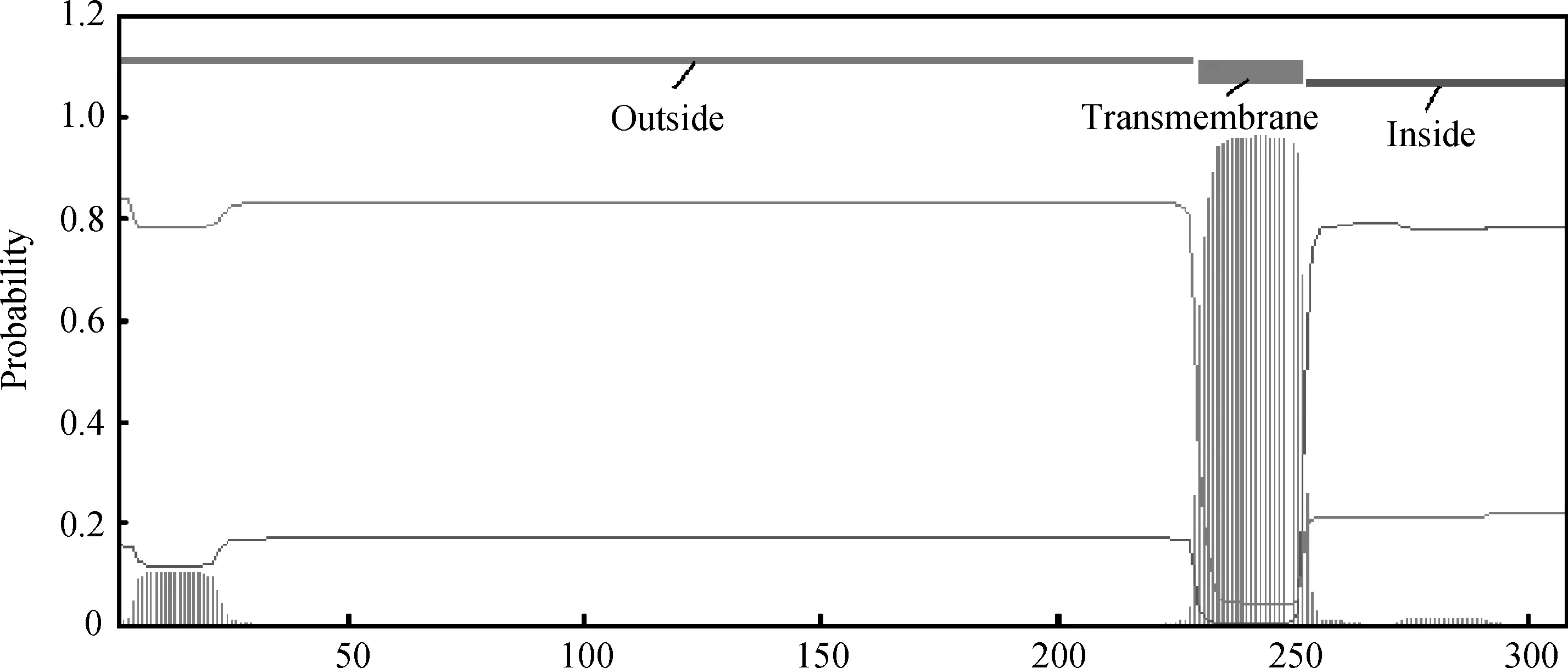
图4 DLK1跨膜蛋白分析Fig.4 DLK1 protein transmembrane region analyses
2.3.3DLK1蛋白修饰结构的预测DLK1蛋白修饰结构的预测显示,DLK1蛋白存在8个磷酸化位点;分别在第120、143、210和280位氨基酸序列共4个丝氨酸(Ser)磷酸化位点,第93和95位共2个苏氨酸(Thr)磷酸化位点,第111和264位共2个酪氨酸(Tyr)磷酸化位点。无O-糖基化位点。在第100位对应天冬氨酰氨残基的酰胺氮原子存在一个N-糖基化修饰位点,其概率为0.69。
2.3.4亚细胞定位和蛋白结构域预测DLK1蛋白亚细胞定位显示,该蛋白主要在内质网(44.4%)、高尔基体(33.3%)和质膜(22.2%)中发挥生物学作用。蛋白质结构域(图5)预测表明,山羊DLK1含有5个EGF结构域,分别位于25~55、56~86、91~125、130~168和173~206,跨膜结构域(Transmembraneregion)位于230~252,其结果与上述预测相符。利用NCBI蛋白结构保守域分析软件,发现克隆的基因具有表皮生长因子(EGF)家族特有的保守结构域钙结合EGF-CA区。

图5 DLK1结构域分析Fig.5 DLK1 domains analyses
2.3.5信号肽分析信号肽分析结果(图6)表明,DLK1蛋白N端有一段疏水性极高序列,其中第24位氨基酸残基的C-score和Y-score均达到最大值,分别为0.872和0.908,预测该信号肽区域位于1~23位氨基酸肽链,信号肽切割位点位于23~24位氨基酸。
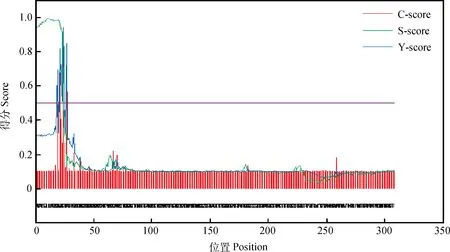
图6 DLK1信号肽预测Fig.6 Prediction of signal peptide in DLK1
2.3.6高级预测与分析二级结构中β-折叠占12.99%,无规则卷曲占87.01%,无α-螺旋,没有表现出α-类蛋白和β-类蛋白以及α-β类蛋白特性,预测该蛋白为非常规蛋白。三级结构预测发现,山羊DLK1蛋白序列与PDB数据库中c4cbzA模板序列相似性高达99.5%(图7),该结果同时也表明山羊DLK1由β-折叠和无规则卷曲构成,与二级结构预测结果基本一致。
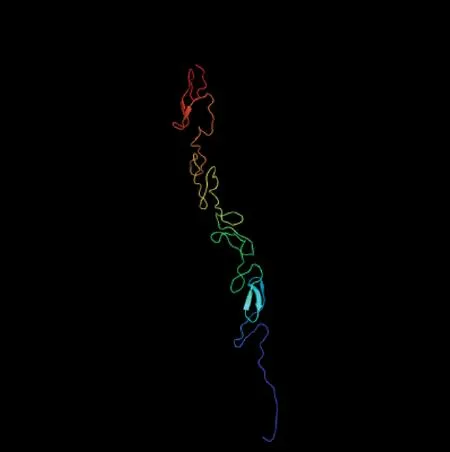
图7 DLK1三级结构预测Fig.7 Putativetertiary structure prediction of DLK1
2.4DLK1表达分析
2.4.1组织差异分析采用GAPDH作参照基因,荧光定量PCR检测DLK1基因在山羊不同组织中的表达情况,以肝为对照,结果显示(图8),DLK1基因在7个组织中都有表达,其表达趋势为:肾(10.27)>脾>肝(对照)>心>肺>背最长肌>脂肪(0.13)。在肾中表达最高,极显著高于的其他组织(P<0.01);其次是在脾表达显著高于肝组织(P<0.05),极显著高于其他组织(P<0.01);其他内脏组织,心、肝、肺均显著(P<0.05)或极显著(P<0.01)高于脂肪和背最长肌。
2.4.2时序表达分析时序表达分析显示(图9),在背最长肌DLK1mRNA丰度中,羔羊(2.05)>成年羊(1.39)>育成羊(1.38),但差异均不显著(P>0.05)。
2.5IMF含量测定及其与DLK1表达的相关分析
IMF测定结果显示(表3),简州大耳羊成年公羊中背最长肌、腿肌和臂三头肌3个部位的IMF含量差异不显著(P>0.05),并且DLK1基因在背最长肌、腿肌、臂三头肌中表达水平与各自IMF含量分别呈显著负相关(P<0.05)、无显著正相关(P>0.05)和无显著负相关(P>0.05)。

n=3。不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)n=3.Different lowercase letters indicate significant difference(P<0.05),and different superscript capital letters indicate extremely significant difference(P<0.01)图8 山羊DLK1基因的组织表达Fig.8 Expression of DLK1 in goat tissues

相同大写字母表示差异不显著(P>0.05)The same capital letters indicate no significant difference(P>0.05)图9 DLK1基因在不同年龄山羊背最长肌中的相对表达量Fig.9 Relative expression of DLK1 in longissimus dorsi of goat at different ages
3讨论
3.1DLK1 基因调节脂肪细胞分化机理的探讨
DLK1 基因是哺乳动物的一个印迹基因,充当Notch途径抑制剂,果蝇和哺乳动物中,DLK1能通过自身的重复串联EGF结构来抑制Notch通路,在维持细胞的分化中发挥重要的作用[20]。DLK1蛋白为跨膜蛋白,在不同的动物中存在不同的拼接转录本[21]。通过绵羊Callipyge表型[16]以及敲除DLK1的小鼠出现骨骼畸形以及肥胖等症状[22],推测其可能对肌肉生长具有作用。

表3 DLK1mRNA表达量与IMF含量的相关性分析
*.差异显著(P<0.05)
*.Significantdifference(P<0.05)
信号肽的分泌有赖于蛋白质N端信号肽的存在,信号肽预测发现,山羊DLK1信号肽位于1~23氨基酸残基,山羊DLK1蛋白的跨膜蛋白氨基酸残基较短,为23个氨基酸残基。研究发现,小鼠的DLK1基因的跨膜结构同样较短(23aa),但也能调控Notch通道[20]。DLK1与Notch配体有着高度的同源性,其区别在于DLK1的N端没有Notch配体的DSL区域[23],在3T3-L1中DLK1能降低Hes-1(Notch1下游靶细胞因子)的表达来抑制Notch1的活性,小鼠的肥胖可能与DLK1通过调节脂肪细胞Notch通道的表达有关,山羊DLK1是否具有小鼠同样的调控机制有待进一步研究。蛋白结构域预测有5个EGF结构域与其他研究者一致,缺乏第6个EGF,可能是第6个EGF与山羊正常发育和生理功能无关[18]。
3.2DLK1表达差异分析
在不同组织中基因mRNA表达分析是研究分子调控的一种方法,为了解该基因的功能提供有效的信息。DLK1基因在山羊各组织间存在显著或极显著差异,这种表达的差异性可能与DLK1基因在不同组织中的功能有关。这与其他物种的表达存在差异,如在猪脂肪组织中DLK1的表达要高于在心和肝组织的表达[24],人和鼠的胚胎时期,在多种组织中表达[25],结合本研究的结果表明DLK1基因的表达具有物种特异性。
在时序表达中,山羊背最长肌DLK1表达在羔羊中要高于成年羊与育成羊。这可能与DLK1主要在出生早期肌肉中发挥作用,同时也与DLK1基因在不同年龄段作用功能不同有关。
3.3DLK1mRNA与肌内脂肪沉积关系的探讨
某些磷酸化位点被磷酸化后,可以导致与肥胖相关基因的表达变化与功能失活,如脂联素表达减少,胰岛素表达的变化[26]。预测山羊DLK1存在多个磷酸化位点,有研究表明,DLK1通过引起细胞外调节蛋白激酶(Extracellularregulatedproteinkinases,ERK)蛋白磷酸化,从而激活促分裂素原活化蛋白激酶(Mitogen-activatedproteinkinases,MAPK)信号通路,抑制过氧化物酶体增殖物激活受体γ2(Peroxisomeproliferator-activatedreceptorγ2,PPARγ)活性,进而来抑制脂肪细胞的分化[27]。PPARγ为脂肪分化的核心调控因子,当PPARγ被激活之后,细胞表现出如形态学变化以及脂肪积累等多种相应的生理效应[28]。同时PPAR为影响IMF含量的候选主效基因,绵羊肌肉中PPAR基因表达量与IMF的相关系数为-0.835[29]。在本研究中,DLK1mRNA表达量与背最长肌和臂三头肌中肌内脂肪含量同样呈现负相关,因此推测,山羊DLK1基因可能通过这种类似磷酸化机制来影响IMF的沉积。在荷斯坦公牛的肌肉中DLK1高表达(P<0.05),DLK1通过与CCAAT/enhancer-bindingproteinbeta(CEBPB)结合在脂肪细胞骨骼肌的发育中起作用,同时还发现DLK1和脂肪含量呈负相关[30]。本实验室前期研究表明,DLK1mRNA与藏山羊肌肉组织肌内脂肪含量同样存在相关性,结合本试验研究,提示山羊肌内脂肪沉积可能有DLK1的参与。肉质性状的调控是一个复杂的过程,受多基因的控制,目前还有很多亟待解决的问题。
4结论
山羊DLK1分子量为33.00ku,属不稳定疏水酸性分泌蛋白,第1~23个aa为潜在的信号肽,有8个磷酸化位点、1个糖基化位点,具有5个表皮生长因子结构域,以及表皮生长因子家族特有的保守结构域EGF-CA区。由β-折叠和无规则卷曲构成的非常规蛋白。DLK1基因在山羊心、肝、脾、肺、肾、脂肪和背最长肌等组织中均有表达,同时在羔羊背最长肌的表达量高于育成羊和成年羊,背最长肌、腿肌和臂三头肌的mRNA表达与各自IMF含量具有一定的相关性。本研究结果为进一步研究DLK1在肌内脂肪沉积中的作用提供理论基础。
参考文献(References):
[1]ALBRECHTE,TEUSCHERF,ENDERK,etal.Growth-andbreed-relatedchangesofmarblingcharacteristicsincattle[J].J Anim Sci,2006,84(5):1067-1075.
[2]CALKINSC,DUTSONTR,SMITHGC,etal.Relationshipoffibertypecompositiontomarblingandtendernessofbovinemuscle[J].J Food Sci,1981,46(3):708-710.
[3]乔永,黄治国,李齐发,等.绵羊肌肉中FAS基因和HSL基因的发育性变化及其对肌内脂肪含量的影响[J].遗传学报,2007,34(10):909-917.
QIAOY,HUANGZG,LIQF,etal.DevelopmentalchangesoftheFASandHSLmRNAexpressionandtheireffectsonthecontentofintramuscularfatinKazakandXinjiangsheep[J].Journal of Genetics and Genomics, 2007,34(10):909-917.(inChinese)
[4]WANGYH,BOWERNI,REVERTERA,etal.Geneexpressionpatternsduringintramuscularfatdevelopmentincattle[J].J Anim Sci,2009,87(1):119-130.
[5]JENSENCH,TEISNERB,HØJRUPP,etal.Studiesontheisolation,structuralanalysisandtissuelocalizationoffetalantigen1anditsrelationtoahumanadrenal-specificcDNA,pG2[J].Hum Reprod,1993,8(4):635-641.
[6]KOBAYASHIS,WAGATSUMAH,ONOR,etal.MousePeg9/Dlk1andhumanPEG9/DLK1arepaternallyexpressedimprintedgenescloselylocatedtothematernallyexpressedimprintedgenes:mouseMeg3/Gtl2andhumanMEG3[J].Genes Cells,2000,5(12):1029-1037.
[7]CHARLIERC,SEGERSK,WAGENAARD,etal.Human-ovinecomparativesequencingofa250-kbimprinteddomainencompassingthecallipyge(clpg)locusandidentificationofsiximprintedtranscripts:DLK1,DAT,GTL2,PEG11,antiPEG11,andMEG8[J].Genome Res,2001,11(5):850-862.
[8]MINOSHIMAY,TANIGUCHIY,TANAKAK,etal.Molecularcloning,expressionanalysis,promotercharacterization,andchromosomallocalizationofthebovinePREF1gene[J].Anim Genet,2001,32(6):333-339.
[9]NUEDAML,GARCA-RAMREZJJ,LADORDAJ,etal.Dlk1specificallyinteractswithinsulin-likegrowthfactorbindingprotein1tomodulateadipogenesisof3T3-L1cells[J].J Mol Biol,2008,379(3):428-442.
[10]SULHS.Minireview:Pref-1:roleinadipogenesisandmesenchymalcellfate[J].Mol Endocrinol,2009,23(11):1717-1725.
[11]LEEK,VILLENAJA,MOONYS,etal.Inhibitionofadipogenesisanddevelopmentofglucoseintolerancebysolublepreadipocytefactor-1(Pref-1)[J].J Clin Invest,2003,111(4):453-461.
[12]MURPHYSK,FREKINGBA,SMITHTP,etal.AbnormalpostnatalmaintenanceofelevatedDLK1transcriptlevelsincallipygesheep[J].Mamm Genome,2005,16(3):171-183.
[13]FLEMING-WADDELLJN,OLBRICHTGR,TAXISTM,etal.EffectofDLK1andRTL1butnotMEG3orMEG8onmusclegeneexpressionincallipygelambs[J].PLoS One,2009,4(10):e7399.
[14]MOONYS,SMASCM,LEEK,etal.MicelackingpaternallyexpressedPref-1/Dlk1displaygrowthretardationandacceleratedadiposity[J].Mol Cell Biol,2002,22(15):5585-5592.
[15]DEIULIISJA,LIB,LYVERS-PEFFERPA,etal.Alternativesplicingofdelta-like1homolog(DLK1)inthepigandhuman[J].Comp Biochem Physiol B Biochem Mol Biol, 2006,145(1):50-59.
[16]VUOCOLOT,PEARSONR,CAMPBELLP,etal.DifferentialexpressionofDlk-1inbovineadiposetissuedepots[J].Comp Biochem Physiol B Biochem Mol Biol, 2003,134(2):315-333.
[17]WEIDMANJR,MALONEYKA,JIRTLERL.Comparativephylogeneticanalysisrevealsmultiplenon-imprintedisoformsofopossumDlk1[J].Mamm Genome,2006,17(2):157-167.
[18]曹贵玲.山羊印记基因H19、Dlk1、CLPG和毛囊发育相关基因Dkk1的研究[D].泰安:山东农业大学,2008.
CAOGL.StudiesonimprintedgeneH19,Dlk1,CLPGandhairfollicledevelopmentrelatedgeneDkk1ingoats[D].Tai’an:ShandongAgriculturalUniversity,2008.(inChinese)
[19]GURUPRASSADK,REDDYBV,PANDITMW.Correlationbetweenstabilityofaproteinanditsdipeptidecomposition:anovelapproachforpredictingin vivostabilityofaproteinfromitsprimarysequence[J].Protein Eng,1990,4(2):155-161.
[20]BRAYSJ,TAKADAS,HARRISONE,etal.TheatypicalmammalianligandDelta-likehomologue1(Dlk1)canregulateNotchsignallinginDrosophila[J].BMC Dev Biol,2008,8:11.
[21]WANGY,KIMKA,KIMJH,etal.Pref-1,apreadipocytesecretedfactorthatinhibitsadipogenesis[J].J Nutr,2006,136(12):2953-2956.
[22]MOONYS,SMASCM,LEEK,etal.MicelackingpaternallyexpressedPref-1/Dlk1displaygrowthretardationandacceleratedadiposity[J].Mol Cell Biol,2002,22(15):5585-5592.
[23]GORDONWR,AMETTKL,BLACKLOWSC.ThemolecularlogicofNotchsignaling--astructuralandbiochemicalperspective[J].J Cell Sci,2008,121(Pt19):3109-3119.
[24]杨宗林,蒋曹德,李跃民.猪DLK1基因序列特征、印记状况及组织表达分析[J].西南大学学报(自然科学版),2009,31(6):8-14.
YANGZL,JIANGCD,LIYM.Characterization,imprintingstatusandtissuedistributionofporcineDLK1gene[J].Journal of Southwest University(Natural Science Edition),2009,31(6):8-14.(inChinese)
[25]FLORIDONC,JENSENCH,THORSENP,etal.DoesFetalantigen1(FA1)identifycellswithregenerative,endocrineandneuroendocrinepotentials?AstudyofFA1inembryonic,fetal,andplacentaltissueandinmaternalcirculation[J].Differentiation,2000,66(1):49-59.
[26]罗森.抗糖尿病药通过Cdk5抑制肥胖相关的PPARγ磷酸化[J].中国病理生理杂志,2010,446(7305):451-456.
LUOS.Anti-diabeticdrugsinhibitobesity-linkedphosphorylationofPPARγbyCdk5[J].Chinese Journal of Pathophysiology,2010,446(7305):451-456.(inChinese)
[27]KIMKA,KIMJH,WANGY,etal.Pref-1(preadipocytefactor1)activatestheMEK/extracellularsignal-regulatedkinasepathwaytoinhibitadipocytedifferentiation[J].Mol Cell Biol,2007,27(6):2294-2308.
[28]FARMERSR.Transcriptionalcontrolofadipocyteformation[J].Cell Metab,2006,4(4):263-273.
[29]HUANGZG,XIONGL,LIUZS,etal.ThedevelopmentalchangesandeffectonIMFcontentofH-FABPandPPARγmRNAexpressioninsheepmuscle[J].Acta Genetica Sinica,2006,33(6):507-514.
[30]ALBRECHTE,KUZINSKIJ,KOMOLKAK,etal.Localizationandabundanceofearlymarkersoffatcelldifferentiationintheskeletalmuscleofcattleduringgrowth-areDLK1-positivecellstheoriginofmarblingflecks?[J].Meat Sci,2015,100:237-245.
(编辑郭云雁)
MolecularCloning,BioinformaticsAnalysisandExpressionofDLK1GeneinGoat
LIAOHong-hai1,2,LINYa-qiu1,WUYang-nan1,ZHUWu-zheng1,2,LIQian1,2,WANGYong1,2*,CHENJuan1
(1.College of Life Science and Technology,Southwest University for Nationalities,Chengdu 610041,China;2.Key Laboratory of Sichuan Province for Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Exploitation,Chengdu 610041,China)
Abstract:ThepresentstudyaimedtocloneDLK1geneofgoat,predictthestructureandfunctionofpeptoneencodedbyDLK1gene,furtherinvestigateitsexpressionregulationinorgansortissuesofgoatandanalyzethecorrelationbetweenDLK1mRNAexpressionandintramuscularfat(IMF)contentinmuscles.JianzhouDa’ergoatwasusedasexperimentalanimalsandtheRT-PCRtechniquewasemployedtoamplifytheDLK1gene.Thebiologicalcharacteristicsofthisgenewereanalyzedbybioinformatics,andthetissueexpressionspecificityaswellasthedevelopmentstageexpressionspecificityofthisgenewereanalyzedusingthefluorescencequantitativePCR.TheresultsshowedthattheDLK1cDNAwas1 137bpinlength(GenBankaccessionNo.:KP686197),927bpforORFand308aminoacidsforproteinencoded.ThenucleotidesequenceandthededucedaminoacidssequenceofgoatDLK1shared97%homologywiththeDLK1ofcattle.Accordingly,theclosegeneticrelationshipbetweengoatandcattlewasindicatedbythephylogenetictreeanalysis.TheDLK1proteinwasanunstable,acidityandhydrophobicityprotein.Therewere8phosphorylationsitesand1N-glycosylationsitewithintheDLK1protein.Thisproteinwaslocatedinendoplasmicreticulum(44.4%),golgi(33.3%)andplasmamembrane(22.2%),respectivelythroughthesub-cellularlevelprediction.Itwasasecretorytransmembranceprotein.Ithad5domainsoftheEGFfamily,whichhad2EGF-CAofEGFfamilyconservativedomains.Moreover,thesecondarystructureoftheDLK1proteinwascomposedof87.01%randomcoiland12.99%β-sheet,indicatinganunconventionalprotein.Theresultsofreal-timePCRexhibitedthattheDLK1genewasexpressedinvarioustissuesatdifferentlevels.ThemRNAexpressionleveloftheDLK1genewashighestinkidneyandlowestinfat.ThemRNAexpressionleveloftheDLK1geneinlongissimus dorsioflambwasnotsignificanthigherthanthatinlongissimus dorsiofyouthandadultgoat(P>0.05).TheresultsofcorrelationanalysisshowedthatthemRNAexpressionleveloftheDLK1geneinlongissimus dorsiwascorrelatednegativelywithIMFcontent(R=-0.6,P<0.05),inlegwasnotcorrelatedpositivelywithIMFcontent(R=0.2,P>0.05),inarmtricepswasnotcorrelatednegativelywithIMFcontent(R=-0.2,P>0.05).TheresultssuggestthattheDLK1genemayplayanimportantroleintheIMFdepositioningoat,whichwouldlayafoundationforfurtherstudiesaboutthefunctionofDLK1geneinIMFdeposition.
Keywords:goat;DLK1mRNA;clone;tissueexpression;temporalexpression;intramuscularfat
doi:10.11843/j.issn.0366-6964.2016.03.007
收稿日期:2015-03-12
基金项目:四川省“十二五”畜禽育种攻关项目(2011NZ0099-36) ;四川省科技创新产业链示范工程重大项目(2014NZ0003);西南民族大学研究生“创新型科研项目”(CX2015SZ069)
作者简介:廖红海(1988-),男,仡佬族,贵州正安人,硕士生,主要从事动物遗传育种与繁殖研究,E-mail:liaohonghaivip@163.com *通信作者:王永,博士,教授,博士生导师,主要从事动物遗传育种与繁殖研究,E-mail:wangyong010101@swun.cn
中图分类号:S827;S813.3
文献标志码:A
文章编号:0366-6964(2016)03-0467-10
