绵羊卵母细胞体外成熟过程中VEGF对DNMT3a表达的影响
2016-07-13邹云龙石国庆康相涛
曹 忻,邹云龙,蔡 勇,周 平,李 明,石国庆,康相涛*
(1.河南农业大学牧医工程学院,郑州 450002; 2.西北民族大学实验中心,兰州 730070;3.新疆农垦科学院畜牧所,石河子 832000)
绵羊卵母细胞体外成熟过程中VEGF对DNMT3a表达的影响
曹忻1,2,邹云龙2,蔡勇2,周平3,李明1,石国庆3,康相涛1*
(1.河南农业大学牧医工程学院,郑州 450002; 2.西北民族大学实验中心,兰州 730070;3.新疆农垦科学院畜牧所,石河子 832000)
摘要:旨在探究血管内皮生长因子(Vascularendothelialgrowthfactor,VEGF)在绵羊卵母细胞体外成熟过程中对DNMT3a的影响。本研究采用RNA干扰和显微注射技术将针对VEGF两个受体FLT1和KDR/Flk-1的有效干扰片段导入到绵羊卵丘-卵母细胞复合体(Cumulus-oocytescomplexes,COCs)中,检测体外成熟培养各时间卵母细胞和颗粒细胞中DNMT3amRNA和蛋白表达水平的变化。结果表明,COCs体外成熟培养过程中,无论是否添加VEGF,卵母细胞内DNMT3amRNA表达量都随着培养时间延续而降低,培养至8h时DNMT3amRNA表达量急速下降,之后下降速度放缓,至24h后各组趋于一致,且未注射干扰片段对照组的下降速度快于其他干扰组(P<0.01)。添加VEGF组DNMT3amRNA表达量的下降速度快于未添加组。干扰片段导入后发现,FLT1-siRNA和KDR-siRNA复合干扰组干扰效果优于KDR-siRNA干扰组,FLT1-siRNA干扰组干扰效果最弱(P<0.01)。无论是否添加VEGF,在COCs体外成熟培养过程中,颗粒细胞DNMT3amRNA表达量都随着培养时间延续而降低,且各组表达量差别不大。其中未注射干扰片段对照组的下降速度在COCs成熟培养中期快于其他干扰组(P<0.05或P<0.01),FLT1-siRNA干扰效果较好。无论是否添加VEGF卵母细胞内DNMT3a蛋白表达量从0~4h上升,之后匀速下降,至16h急速下降,24h为零。未导入干扰片段对照组下降速度最快。其中16h对照组、FLT1-siRNA干扰组、KDR-siRNA干扰组和FLT1-siRNA&KDR-siRNA复合干扰组DNMT3a蛋白表达量,添加VEGF后,分别下降到培养初期的23.12%、31.07%、41.47%和37.90%,未添加VEGF的组则分别下降到培养初期的37.38%、54.60%、57.58%和82.75%。颗粒细胞中,添加VEGF组DNMT3a蛋白表达量呈现逐渐下降趋势,至20h时,已无DNMT3a蛋白表达;未添加VEGF组从0~4h有略微上升,之后呈现逐渐均速下降趋势,20h时,急速下降,至24h时,无DNMT3a蛋白表达,且干扰片段对DNMT3a蛋白表达影响不大,而本身颗粒细胞中DNMT3a蛋白表达量也不高。结果提示,绵羊COCs体外成熟培养过程中,VEGF加快了卵母细胞中DNMT3amRNA和蛋白表达量的下降速度。而干扰片段的导入则使DNMT3amRNA和蛋白表达量下降速度放缓;颗粒细胞内VEGF的添加和受体干扰片段的导入,对DNMT3amRNA和蛋白表达影响效果不明显。
关键词:血管内皮生长因子;DNMT3a;卵母细胞;绵羊;体外培养
血管内皮生长因子(Vascularendothelialgrowthfactor,VEGF)是一种促进内皮细胞增生、迁徙,抑制细胞凋亡,提高血管和微血管对大分子物质通透性的生长因子[1-2],其研究多集中在人类医学,而关于动物方面的研究报道很少[3-4]。DNA甲基转移酶(DNAmethyltransferase,DNMT)保证基因印迹的建立和维持,DNMT的缺失或功能异常导致基因印迹的异常,这将严重阻碍胚胎的正常发育[5-6]。DNMT3a在细胞的生长和调亡中可以起到一定作用,能与P53直接作用而抑制P21的转录从而解除P21对细胞增殖的抑制作用[7]。
本课题组的前期研究发现,VEGF是通过绵羊卵丘-卵母细胞复合体(Cumulus-oocytescomplexes,COCs)体外成熟过程中同时促进卵母细胞核成熟和胞质成熟,以提高卵母细胞成熟率,为后期的体外授精和胚胎发育提供高质量的成熟卵母细胞[8-11]。VEGF是通过存在于卵母细胞和颗粒细胞中的两个受体FLT1(Thefms-liketyrosinekinase1)和KDR/Flk-1(Kinaseinsertdomainreceptor)相结合而发挥其生物学作用[12]。本研究采用RNA干扰(InterferenceRNA,RNAi)技术将前期研究试验筛选出的针对VEGF受体FLT1和KDR/Flk-1的两个有效干扰片段显微注射到绵羊COCs中进行体外培养,测定不同培养时间DNMT3amRNA和蛋白分别在绵羊卵母细胞和颗粒细胞中的表达变化。探究在绵羊卵母细胞体外成熟过程中,VEGF对卵母细胞的成熟起到的促进作用是否伴随DNMT3a的表达变化,为后期VEGF在绵羊卵母细胞体外成熟和胚胎发育中的表观遗传学研究奠定基础。
1材料与方法
1.1绵羊卵巢采集
新疆石河子市牛羊定点屠宰场屠宰的母羊,在30min内用无菌手术剪刀剪下两侧卵巢,置于含青霉素60mg·L-1和链霉素100mg·L-1的25~30 ℃生理盐水中,在3~4h内运回实验室。随后用生理盐水冲洗3或4次至无血水。剪去卵巢上附带的输卵管和系膜,随后在超净工作台上用灭菌纱布吸干水分备用。
1.2绵羊COCs采集和体外培养
将准备好的卵巢采用剖切法采集卵母细胞,即将清洗干净的卵巢置于2%FBS洗卵液的培养皿中,然后用灭菌手术刀片对卵巢表面所有卵泡(2~6mm)进行纵横方向切割。选取形态正常、胞质均匀并带有致密卵丘细胞的A、B级COCs,用洗卵液清洗3~4遍,然后在成熟液中清洗1~2遍,放于含有2mL成熟液的30mm培养皿中聚堆培养24h,每堆卵母细胞数量控制在100枚左右,培养条件为38.5 ℃、5%的CO2空气和饱和湿度。
成熟液成分:TCM199(GIBICOBRL.LotNo.1090183)+10%FBS+10μLFSH(中国科学院动物所)+10μg·mL-1LH(宁波第二激素厂)+1μg·mL-1E2(宁波第二激素厂)。
1.3siRNA干扰片段信息
筛选出的针对FLT1和KDR/Flk-1两个受体基因进行干扰的双链小RNA干扰片段由上海吉凯基因有限公司设计合成。

表1 siRNA干扰片段信息
1.4显微注射
在培养前将COCs表面部分颗粒细胞去除后,放入矿物油覆盖的操作液滴中,用内径为0.2~0.3μm的注射针吸取20μm的siRNA母液进行显微注射。每个卵注射约5~9pL的siRNA,然后分组培养。分别收集培养时间为0、4、8、12、16、20、24h的卵母细胞和颗粒细胞进行实时定量和Westernblot检测。
1.5试验分组
表 2中“+”表示添加5ng·mL-1VEGF,“-”表示不添加VEGF。VEGF添加剂量根据前期研究结果确定[8-9]。对照组为注射无效的干扰片段;FLT1干扰组为注射筛选出的FLT1-siRNA-2片段;KDR干扰组为注射筛选出的KDR-siRNA-1片段;FLT1和KDR干扰组为复合注射FLT1-siRNA-2及KDR-siRNA-1片段。
1.6RNA提取与cDNA合成
采用FastLineCellcDNAkit(天根生化科技有限公司)试剂盒,对卵母细胞和颗粒细胞进行RNA提取及cDNA第一链的合成。
1.7实时定量PCR
针对NCBI提供的mRNA序列,采用Primer5.0以及在线BLAST软件设计引物,GAPDH为内参。GAPDH (119bp)上游:5′-CCTGCCAAGTATGATGAGAT-3′;下游:5′-TGAGTGTCGCTGTT-GAAGT-3′;DNMT3a(60bp)上游:5′-TGTACG-
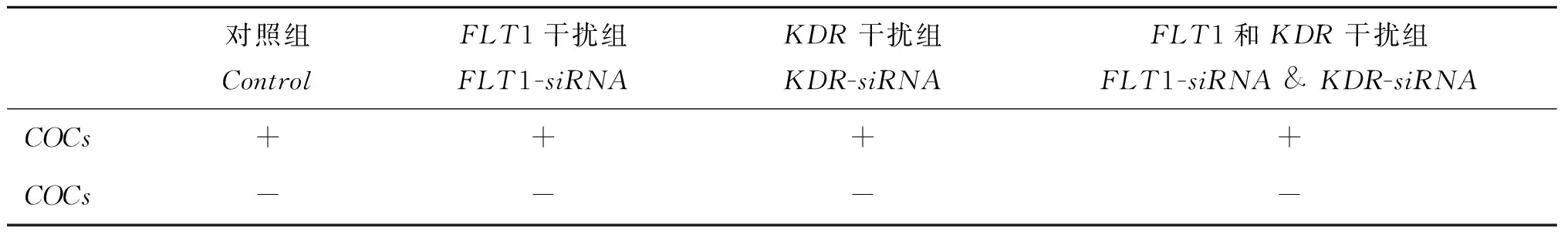
表2 试验分组
AGGTACGGCAGAAGTG-3′;下游:5′-GGCTCC-CACAAGAGATGCA-3′。引物由上海生工合成。
采用罗氏480II实时定量PCR仪进行实时定量PCR扩增。PCR反应体系为LightCycle480SYBRGreenIMaster96模块标准反应体系,PCR扩增条件为LightCycle480SYBRGreenIMaster96模块标准扩增条件(退火温度为60 ℃)。mRNA相对表达量采用2-ΔΔCT进行计算。
1.8Westernblot检测
取20μL经变性处理后的蛋白质样品,于SDS-PAGE(10%)分离蛋白。用湿转法,300mA1h,将电泳后的SDS-PAGE上的蛋白转移至PVDF膜上,通过彩虹MARK和示踪染料检查转膜效率。将转移后的PVDF膜用Westernblot封闭液Ⅰ(BSA,pH7.5)室温封闭1.5h,确保PVDF膜上非特异性的抗体结合位点被封闭。封闭后的PVDF膜经TBST洗涤后用一抗室温摇床孵育1h。再经TBST洗涤后,PVDF膜用二抗室温摇床孵育1h。PVDF膜用TBST冲洗两次,然后用TBST洗涤5min,重复5~6次。用ECL对PVDF膜进行光化学反应后,于暗室用X光片对发光后的PVDF膜进行曝光。Westernblot结果采用QuantityOne分析软件对蛋白含量做相对定量统计分析并制表。
2结果
2.1绵羊COCs体外成熟过程中添加VEGF卵母细胞DNMT3amRNA和蛋白表达效果

“O+”表示添加5 ng·mL-1VEGF。表达量标注相同大写字母表示差异不显著(P>0.05),标注不同大字母表示差异极显著(P<0.01)。下同“O+” represent for adding 5 ng·mL-1VEGF.The expression levels with the same capital letters have no significant difference(P>0.05);The expression levels with the different capital letters differ significantly (P<0.01).The same as below图1 COCs培养不同时间时卵母细胞中DNMT3a mRNA表达水平(添加VEGF)Fig.1 DNMT3a mRNA expression level of oocytes at different COCs cultured time(adding VEGF)
从图1中可以看出,添加VEGF的COCs体外成熟培养过程中,卵母细胞DNMT3amRNA表达量随着培养时间延续而降低,未注射干扰片段对照组的下降速度快于其他干扰组(P<0.01) 。培养8h是DNMT3amRNA表达量变化的拐点,即各组从培养初期的1.30×10-1骤降到8h的4.00×10-3左右,之后下降速度放缓,至24h时各组趋于一致。16h时FLT1-siRNA干扰组DNMT3amRNA表达量高于KDR-siRNA干扰组和FLT1-siRNA&KDR-siRNA复合干扰组表达量外,8h后其余时间点都低于这两组的测定值,且差异极显著(P<0.01) 。图2和表3表明,添加VEGF的COCs体外成熟培养过程中,卵母细胞各个组中DNMT3a蛋白表达量呈现先升高再下降最后为零的变化趋势,尤其在16h时下降明显。未注射干扰片段的对照组从0~4h时呈上升趋势,之后匀速下降,至16h时急速下降为培养初期的23.12%,下降速度最快。注射干扰片段各个组从0~4h呈上升趋势,之后下降,到16h时FLT1-siRNA干扰组、KDR-siRNA干扰组和FLT1-siRNA&KDR-siRNA复合干扰组DNMT3a蛋白表达量分别下降到培养初期的31.07%、41.47%和37.90%,24h时为0。
2.2绵羊COCs体外成熟过程中未添加VEGF卵母细胞DNMT3amRNA和蛋白表达效果
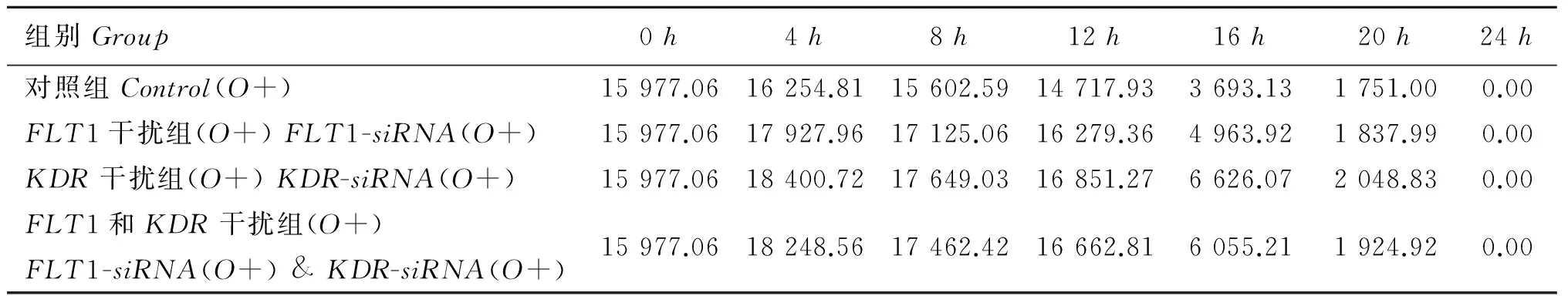
表3 COCs中卵母细胞DNMT3a蛋白表达水平(添加VEGF)

横坐标中每组的时间点为0、4、8、12、16、20和24 h。图4、6和8同The time point of each group in X axis are 0,4,8,12,16,20 and 24 h.The same as Fig.4,Fig.6 and Fig.8图2 COCs培养不同时间时卵母细胞中DNMT3a蛋白表达水平(添加VEGF)Fig.2 DNMT3a protein expression of oocytes at different COCs cultured time(adding VEGF)
从图3中可以看出,未添加VEGF的COCs体外成熟培养过程中,卵母细胞DNMT3amRNA表达量随着培养时间延续呈下降趋势,未注射干扰片段对照组的下降速度快于其他干扰组(P<0.01)。培养4和8h是DNMT3amRNA表达量变化的拐点,尤其8h骤降,FLT1-siRNA干扰组、KDR-siR-NA干扰组、FLT1-siRNA&KDR-siRNA复合干扰组和对照组从培养初期的1.3×10-1下降到8h的4.80×10-3、4.80×10-3、7.80×10-3和4.00×10-3左右,之后下降速度放缓,至24h时各组几乎趋于一致。在COCs体外成熟培养过程中,DNMT3amRNA表达量FLT1-siRNA&KDR-siRNA复合干扰组>KDR-siRNA干扰组>FLT1-siRNA干扰组>对照组(P<0.01)。图4和表4结果表明,未添加VEGF的COCs体外成熟培养过程中,卵母细胞各个组中DNMT3a蛋白表达量呈现从0~4h上升之后匀速下降,到16h后急速下降,最后为零的变化趋势。未注射干扰片段对照组、FLT1-siRNA干扰组、KDR-siRNA干扰组和FLT1-siRNA&KDR-siRNA复合干扰组DNMT3a蛋白表达量4h时分别上升了5.65%、14.46%、19.30%和22.12%,之后匀速下降,至16h时下降为培养初期的37.38%、54.60%、57.58%和82.75%,对照组下降速度最快。

“O-”表示未添加5 ng·mL-1VEGF“O-” represent for without adding 5 ng·mL-1VEGF图3 COCs培养不同时间时卵母细胞中DNMT3a mRNA表达水平(未添加VEGF)Fig.3 DNMT3a mRNA expression level of oocytes at different COCs cultured time(non-VEGF)

表4 COCs中卵母细胞DNMT3a蛋白表达水平(未添加VEGF)

图4 COCs培养不同时间时卵母细胞中DNMT3a蛋白表达水平(未添加VEGF)Fig.4 DNMT3a protein expression of oocytes at different COCs cultured time(non-VEGF)
2.3绵羊COCs体外成熟过程中添加VEGF颗粒细胞DNMT3amRNA和蛋白表达效果
从图5可以看出,添加了VEGF的COCs体外成熟培养过程中,颗粒细胞DNMT3amRNA表达量随着培养时间延续而降低,且各组表达量差别不大。其中未注射干扰片段对照组的下降速度在12h后快于其他干扰组,尤其快于KDR-siRNA和FLT1-siRNA&KDR-siRNA复合干扰组(P<0.05),而KDR-siRNA干扰组则较其他组略慢。DNMT3amRNA表达量从0h的6.00×10-2左右下降至16h后变为0,并维持到培养结束。图6和表5可见,添加了VEGF的COCs体外成熟培养过程中,颗粒细胞DNMT3a蛋白表达量呈现逐渐下降趋势,至20h时已无DNMT3a蛋白表达,且各组差异不大。从0~12h是匀速下降,到16h急速下降,各组下降到培养初期的25.07%。

表达量标注相同小写字母表示差异不显著(P>0.05);标注不同小写字母表示差异显著(P<0.05)The expression levels with the same small letters have no significant difference (P>0.05),with the different small letters significant difference (P<0.05)图5 COCs培养不同时间时颗粒细胞中DNMT3a mRNA表达水平(添加VEGF)Fig.5 DNMT3a mRNA expression level of granule cells at different COCs cultured time(with VEGF)

表5 COCs中颗粒细胞DNMT3a蛋白表达水平(添加VEGF)

图6 COCs培养不同时间时颗粒细胞DNMT3a蛋白表达水平(添加VEGF)Fig.6 DNMT3a protein expression of granule cells at different COCs cultured time(adding VEGF)
2.4绵羊COCs体外成熟过程中未添加VEGF颗粒细胞DNMT3amRNA和蛋白表达效果
从图7中可以看出,未添加VEGF的COCs体外成熟培养过程中,颗粒细胞DNMT3amRNA表达量随着培养时间延续而降低,到20h表达量为0,并持续到卵母细胞成熟,且各组表达量差别不大。其中FLT1-siRNA&KDR-siRNA复合干扰组较其他组DNMT3amRNA表达量略高。未注射干扰片段对照组8和16h时的DNMT3amRNA表达量略低于其他组(P<0.01)。图8和表6可见,未添加VEGF的COCs体外成熟培养过程中,颗粒细胞DNMT3a蛋白表达量从0~4h有略微上升,之后呈现逐渐均速下降趋势,20h时急速下降,至24h时无DNMT3a蛋白表达,且各组差异不大。FLT1-siRNA&KDR-siRNA复合干扰组较其他组DNMT3a蛋白表达量略高。20h时各组基本下降到培养初期的24.36%~24.49%。
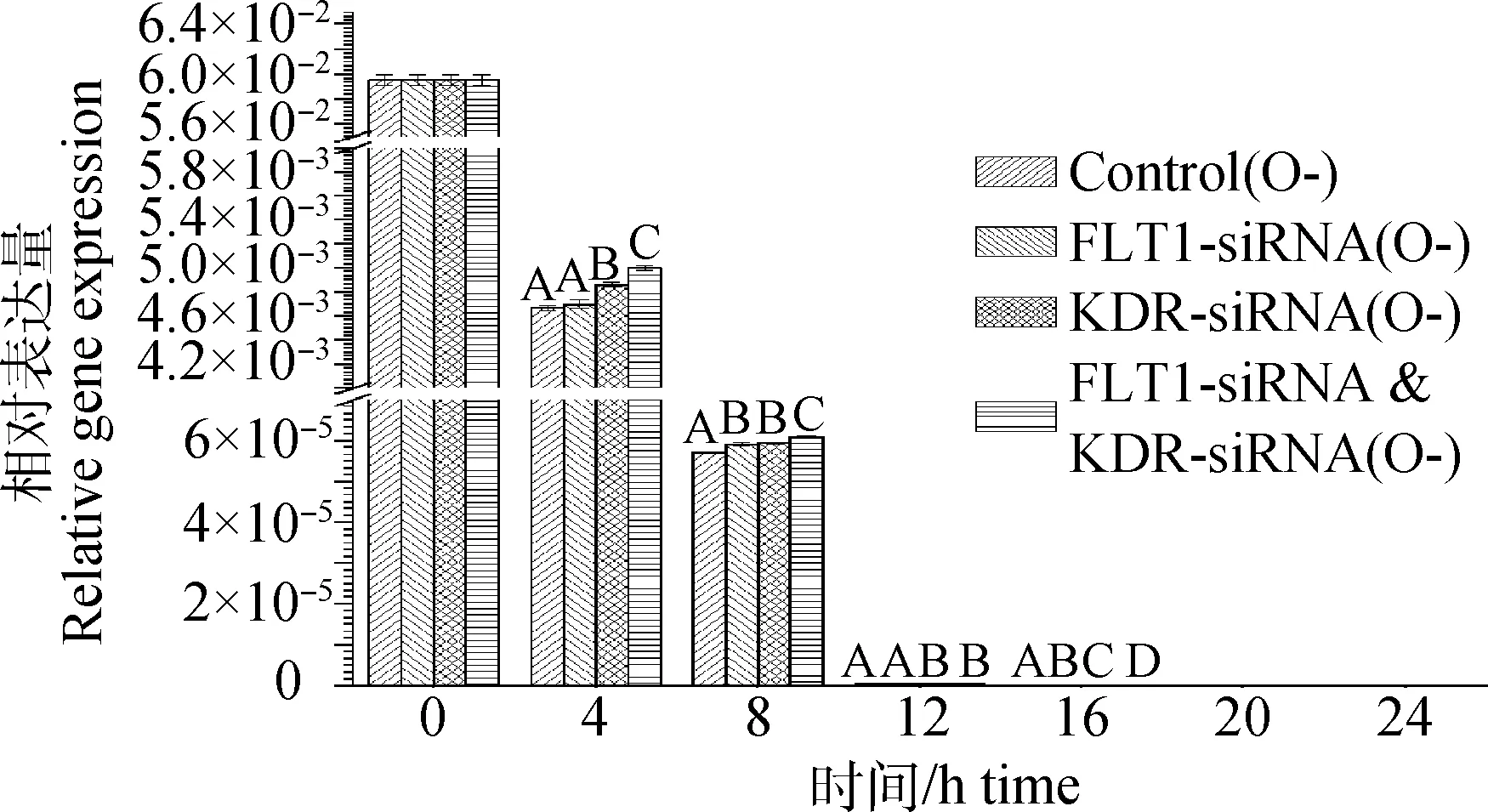
图7 COCs培养不同时间时颗粒细胞中DNMT3a mRNA表达水平(未添加VEGF)Fig.7 DNMT3a mRNA expression level of granule cells at different COCs cultured time(non-VEGF)
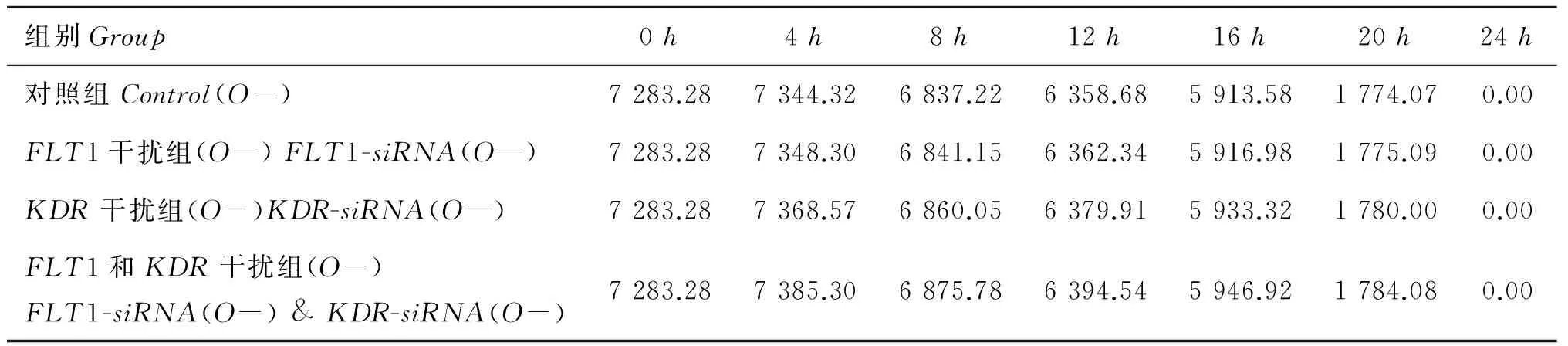
表6 COCs中颗粒细胞DNMT3a蛋白表达水平(未添加VEGF)

图8 COCs培养不同时间时颗粒细胞DNMT3a蛋白表达水平(未添加VEGF)Fig.8 DNMT3a protein expression of granule cells at different COCs cultured time(non-VEGF)
3讨论
1942年表观遗传学的概念“Epigenetics”首次被提出,并指出表观遗传与遗传是相对的[13-14],主要研究基因型和表型的关系,并将其定义为研究生物发育机制的学科[15-16]。DNA甲基化(DNAmethylation)是表观遗传学的调节机制之一[17-18],它是指在DNA甲基转移酶的作用下,以S-腺苷甲硫氨酸(SAM)为甲基供体,将甲基基团转移到胞嘧啶和鸟嘌呤(CpG)二核苷酸的胞嘧啶中5位碳原子上[19-20]。哺乳动物的DNMT家族主要成员:DNMT1、DNMT3a、DNMT3b和DNMT3L等[21-22]。有研究表明胚胎中的DNMT3a主要遗传于卵子并发挥表达作用[23]。在肺癌细胞系A549中,沉默DNMT3a不能诱导细胞调亡[24]。D.Watanabe等[25]发现DNMT3a在卵及受精的胚胎中高表达,随着胚胎发育至囊胚期逐渐降低。而有关VEGF在绵羊卵母细胞体外成熟及胚胎发育中对DNMT3a的影响少见报道。本研究结果表明,绵羊COCs体外成熟培养过程中,卵母细胞和颗粒细胞都存在DNMT3amRNA表达,且伴随培养时间的延续表达量呈下降趋势,说明DNMT3a在绵羊卵母细胞成熟过程中具有阶段性和时效性表达。添加VEGF无论是在卵母细胞内还是在颗粒细胞内都加速了DNMT3amRNA表达量的下降,尤其在培养16h之前,当卵母细胞成熟后(24h时)则表达量几乎趋于一致,说明VEGF在卵母细胞成熟过程中加速DNMT3amRNA表达量的下降。试验数据显示,在绵羊卵母细胞体外成熟前8hDNMT3amRNA表达量的下降速度很快,8h以后其下降速度放缓。一个好的、具有发育潜能的卵母细胞要首先获得生发泡破裂(Germinalvesiclebreakdown,GVBD)的能力,然后才能逐渐获得完成成熟分裂的能力,以产生高质量的、具有受精能力的卵母细胞[26]。而前期研究结果发现添加VEGF有效促进了绵羊卵母细胞体外培养过程中GVBD的完成[12]。说明DNMT3a的变化主要发生在卵母细胞成熟前期,尤其是生发泡破裂前,判断VEGF可能由于促进卵母细胞GVBD能力的获得使得DNMT3amRNA表达量的下降变快。另外本试验中有效干扰片段导入后DNMT3amRNA表达量的下降速度放缓,说明干扰片段确实有效抑制受体FLT1和KDR的表达,从而影响到DNMT3amRNA表达量下降速度发生变化。其中复合干扰组效果优于KDR干扰组,FLT1干扰组干扰效果最弱(P<0.01)。此外还可通过试验数据得知,卵母细胞中DNMT3amRNA的表达量高于在颗粒细胞中的,充分证明在绵羊卵丘卵母细胞体外成熟过程中DNMT3a的表达主要体现在卵母细胞中,此时颗粒细胞的辅助作用发挥不明显。
哺乳动物卵母细胞的大多数RNA在卵母细胞的生长过程中积累并合成,GVBD1h内RNA的合成维持低水平,一些新合成的RNA在GVBD前释放到细胞质,排卵时停止。因此卵母细胞和早期的胚胎的发育能力依赖于在排卵前mRNA和蛋白的积累[27]。本研究结果显示,绵羊卵丘卵母细胞体外培养过程中,虽然伴随培养时间的延续,DNMT3amRNA表达量呈下降趋势,但其蛋白表达则不同。无论是否添加VEGF,卵母细胞中DNMT3a蛋白表达量从0~4h上升,之后匀速下降,在16h急速下降,最后为0。说明在DNMT3amRNA表达量下降的情况下,为了能更好的完成GVBD,DNMT3a蛋白在关键时间点4~8h有强表达,而VEGF的介入使得DNMT3a蛋白下降速度加速,推测是因为添加VEGF较未添加组卵母细胞更好更早的完成整个成熟过程所致,且一旦成熟过程趋于完成,DNMT3a蛋白表达立刻消失。而未导入干扰片段的对照组下降速度最快,说明VEGF受体干扰片段的导入有效提高DNMT3a蛋白的表达。其中在添加VEGF的情况下,KDR干扰组干扰效果优于复合干扰组,FLT1干扰组效果最弱;未添加VEGF组复合干扰组效果优于KDR干扰组,KDR干扰组优于FLT1干扰组,说明KDR受体在整个卵母细胞成熟过程中是VEGF发挥生物学效应的主要途径。颗粒细胞中,添加了VEGF组DNMT3a蛋白表达量呈现逐渐下降趋势,至20h已无DNMT3a蛋白表达;未添加VEGF组从0~4h有略微上升,之后呈现逐渐均速下降趋势,20h急速下降,至24h无DNMT3a蛋白表达,且干扰片段对DNMT3a蛋白表达影响不大。说明VEGF的外源添加和干扰片段的导入对于颗粒细胞中的DNMT3a蛋白表达无影响,且本身颗粒细胞中DNMT3a蛋白表达量也不高。
总之绵羊卵母细胞体外成熟培养是个相当复杂的过程,受到诸多因素的影响,其卵母细胞成熟率仍然显著低于体内成熟卵母细胞。而VEGF在卵母细胞体外培养系统的改进方面有着积极的促进作用[8-12],保证了卵母细胞的高成熟率和成熟质量[8],这种促进作用也影响了DNMT3amRNA和蛋白表达。绵羊卵母细胞体外成熟培养过程中,VEGF加快了卵母细胞中DNMT3amRNA和蛋白表达量的下降速度。而干扰片段的导入则使DNMT3amRNA和蛋白表达量下降速度放缓;颗粒细胞中VEGF的添加和受体干扰片段的导入,对DNMT3amRNA和蛋白表达影响效果不明显。本试验结果可为进一步研究绵羊卵母细胞体外成熟过程中DNA甲基化变化奠定基础。
参考文献(References):
[1]SENGERDR,GALLISJ,DVORAKAM,etal.Tumorcellssecreteavascularpermeabilityfactorthatpromotesaccumulationofascitesfluid[J].Science,1983,219(4587):983-985.
[2]SIROISMG,EDELMANER.VEGFeffectonvascularpermeabilityismediatedbysynthesisofplatelet-activatedfactor[J].Am J Physiol,1997,272(6Pt2):2746-2756.
[3]BEHLT,KOTWANIA.Exploringthevariousaspectsofthepathologicalroleofvascularendothelialgrowthfactor(VEGF)indiabeticretinopathy[J].Pharmacol Res,2015,99:137-148.
[4]WANGH,WWANGY,LID,etal.VEGFinhibitstheinflammationinspinalcordinjurythroughactivationofautophagy[J].Biochem Biophys Res Commun,2015,464(2):453-458.
[5]HERMANNA,GOWHERH,JELTSCHA.BiochemistryandbiologyofmammalianDNAmethyltransferases[J].Cell Mol Life Sci,2004,61(19-20):2571-2587.
[6]JONESPA,LIANGG.RethinkinghowDNAmethylationpatternsaremaintained[J]. Nat Rev Genet,2009,10(11):805-811.
[7]WANGYA,KAMAROVAY,SHENKC,etal.DNAmethytransferase-3ainteractswithp53andrepressesp53-mediatedgeneexpression[J].Cancer Biol Ther,2005,4(10):1138-1143.
[8]CAOX,ZHOUP,LUOHL,etal.TheeffectofVEGFonthetemporal-spatialchangeofα-tubulinandcorticalgranulesofovineoocytesmaturedin vitro[J].Anim Reprod Sci,2009,113(1-4):236-250.
[9]曹忻,罗海玲,石国庆,等.血管内皮生长因子对绵羊卵母细胞体外受精及胚胎发育的影响[J].甘肃农业大学学报,2008,43(4):27-31.
CAOX,LUOHL,SHIGQ,etal.EffectsofVEGFontheovineoocytesmaturationandtheearlyembryodevelopmentin vitro[J].Journal of Gansu Agricultural University,2008,43(4):27-31.(inChinese)
[10]LUOHL,CAOX,ZHAOYZ,etal.EffectsofVEGFontheearlydevelopmentandthepolyspermyrateofovineembryoindifferentculturesystemsin vitro(abs)[J].Rep Fert Dev,2009,21(1):204.
[11]曹忻,赵有璋,罗海玲,等.血管内皮生长因子对体外成熟绵羊卵母细胞超微结构变化的影响[J].畜牧兽医学报,2010,41(2):167-173.
CAOX,ZHAOYZ,LUOHL,etal.EffectsofVEGFontheultrastructureofovineoocytesculturedin vitro[J].Acta Veterinaria et Zootechnica Sinca,2010,41(2):167-173.(inChinese)
[12]曹忻.血管内皮生长因子促进绵羊卵母细胞体外成熟机理研究[D].兰 州:甘肃农业大学,2008.
CAOX.Themechanismofvascularendothelialgrowthfactoronpromotingovineoocytematurationin vitro[D].Lanzhou:GansuAgriculturalUniversity,2008.(inChinese)
[13]ZHANGZM,ZHANGRX.Epigeneticsinautoimmunediseases:Pathogenesisandprospectsfortherapy[J].Autoimmun Rev,2015,14(10):854-863.
[14]LARDENOIJER,IATROUA,KENISG,etal.Theepigeneticsofagingandneurodegeneration[J].Prog Neurobiol,2015,131:21-64.
[15]NOTTERMANDA,MITCHELLC.Epigeneticsandunderstandingtheimpactofsocialdeterminantsofhealth[J].Pediatr Clin North Am,2015,62(5):1227-1240.
[16]SUAREZ-ULLOAV,GONZALEZ-ROMEROR,EIRIN-LOPEZJM.Environmentalepigenetics:Apromisingvenuefordevelopingnext-generationpollutionbiomonitoringtoolsinmarineinvertebrates[J].Mar Pollut Bull,2015,98(1-2):5-13.
[17]ZHANGL,XUYZ,XIAOXF,etal.DevelopmentoftechniquesforDNA-methylationanalysis[J].Trac Trend Anal Chen,2015,72:114-122.
[18]NEIDHARTM.Chapter1-DNAmethylation-introduction[M].DNAMethylationandComplexHumanDisease,2016:1-8.
[19]MONKD.Germline-derivedDNAmethylationandearlyembryoepigeneticreprogramming:Theselectedsurvivalofimprints[J].Int J Biochem Cell Biol,2015,67:128-138.
[20]TOGHILLBJ,SARATZISA,HARRISONSC,etal.ThepotentialroleofDNAmethylationinthepathogenesisofabdominalaorticaneurysm[J]. Atherosclerosis,2015,241(1):121-129.
[21]ZHAOXM,RENJJ,DUWH,etal.EffectofvitrificationonpromoterCpGislandmethylationpatternsandexpressionlevelsofDNAmethyltransferase1o,histoneacetyltransferase1,anddeacetylase1inmetaphaseIImouseoocytes[J].Fertil Steril,2013,100(1):256-261.
[22]LIUK,LIUYL,LAUJL,etal.EpigenetictargetsanddrugdiscoveryPart2:HistonedemethylationandDNAmethylation[J].Pharmacol Ther,2015,151:121-140.
[23]HIRASAWAR,CHIBAH,KANEDAM,etal.MaternalandzygoticDnmt1arenecessaryandsufficientforthemaintenanceofDNAmethylationimprintsduringpreimplantationdevelopment[J].Genes Dev,2008,22(12):1607-1616.
[24]KASSISES,ZHAOM,HONGJA.DepletionofDNAmethyltransferase1and/orDNAmethyltransferase3bmediatesgrowtharrestandapoptosisinlungandesophagealcancerandmalignantpleuralmesotheliomacells[J].J Thorac Cardiovasc Surg,2006,131(2):298-306.
[25]WATANABED,SUETAKEI,TADAT,etal.Stage-andcell-specificexpressionofDnmt3aandDnmt3bduringembryogenesis[J].Mech Dev,2002,118(1-2):187-190.
[26]LÉNRTP,ELLENBERGJ.Nuclearenvelopedynamicsinoocytes:fromgerminalvesiclebreakdowntomitosis[J].Curr Opin Cell Biol,2003,15(1):88-95.
[27]DELAFUENTER.Chromatinmodificationsinthegerminalvesicle(GV)ofmammalianoocytes[J].Dev Biol,2006,292(1):1-12.
(编辑程金华)
TheEffectsofVEGFonDNMT3aExpressioninOocytesMaturationofOvinein vitro
CAOXin1,2,ZOUYun-long2,CAIYong2,ZHOUPing3,LIMing1,SHIGuo-qing3,KANGXiang-tao1*
(1.College of Veterinary Medicine,Henan Agricultural University,Zhengzhou 450002,China;2.Scientific Experimental Center,Northwest University for Nationalities,Lanzhou 730070,China;3.Xinjiang Academy of Agriculture and Reclamation Science,Shihezi 832000,China)
Abstract:Tostudytheeffectofvascularendothelialgrowthfactor(VEGF)onDNMT3aexpressionduringovineoocytesmaturationin vitro.Inthisresearch,inordertotestDNMT3amRNAandproteinexpressionofoocytesandgranulecells(GCs)atdifferenttimepointsduringcumulus-oocytescomplexes(COCs)culturedin vitro,RNAiandmicroinjectionwereusedtoimport2pairsofeffectivedoublechainsmallinterferingRNA(dsRNA)fragmentswhichweredesignedforVEGFreceptorsFLT1andKDR/Flk-1intoCOCs.Theresultsindicatedthat,duringtheculturingprocessofCOCsmaturationin vitro,theexpressionlevelofDNMT3amRNAofoocyteswouldbedecreasedregardlessofthepresenceofVEGF. DNMT3amRNAexpressionquantityfellsharplyatthe8h,then,itdecreasedslowlyandtendedtobesimilartoeachothergroupsatthe24h. DNMT3amRNAwithoutdsRNAofcontrolgroupsignificantlydeclinedfasterthanthatoftheothertreatmentgroups(P<0.01).TheexpressionlevelofDNMT3amRNAofVEGFgroupsinoocytesshowedafasterdecreasethanthegroupswithoutVEGF.AfterdsRNAfragmentsmicroinjection,interferingeffectofFLT1-siRNA&KDR-siRNAgroupwasbetterthanthatoftheKDR-siRNAgroupandthatofFLT1-siRNAgroupwasthelowest(P<0.01).Duringthematurationprocess, DNMT3amRNAofGCswouldbedecreasedregardlessofthepresenceofVEGF,andthedifferencebetweeneachgroupweretiny.AtthemidmaturityofCOCs, DNMT3amRNAwithoutdsRNAofcontrolgroupdecreasedfasterthanthatoftheothertreatmentgroups(P<0.05orP<0.01),andtheeffectofRNAionFLT1-siRNAgroupwasthebest.WhetheraddingVEGFornot,theproteinexpressionlevelofDNMT3ainoocyteshadbeenincreasingfrominitialtimeuntilthe4h,thenitstartedtodecreaseataconstantspeed.AnoteworthydecreaseofDNMT3aproteinexpressionwasthenobservedatthe16handwascompletelyunexpressedatthe24h.TheproteinexpressionlevelofDNMT3aincontrolgroupwithoutdsRNAhadthefastestdecreasingspeed.Atthe16h,DNMT3aproteinlevelsofthecontrolgroup,FLT1-siRNAgroup,KDR-siRNAgroupandFLT1-siRNA&KDR-siRNAgroupweredecreasedto23.12%, 31.07%, 41.47%and37.90%respectivelywithVEGFcomparingtothatofthe0h.Atthesametime,thatofthenon-VEGFgroupshaddecreasedto37.38%, 54.60%, 57.58%and82.75%.InGCs,DNMT3aproteinexpressionlevelsofgroupswithVEGFdecreasedgraduallysince0handcouldnotbetestedatthe20h,andthatofgroupswithoutVEGFincreasedslightlyfrom0to4h,thenpresentedtheaveragedeclinegraduallyuntilthe20hwherearapiddropappearedandwentcompletelyundetectedatthe24h.Inaddition,dsRNAhadnegligibleeffectonDNMT3aproteinexpressionlevels,whiletheoriginalDNMT3aproteinexpressionlevelintheGCswerelow.Inconclusion,duringtheprocessofCOCsmaturationin vitro,VEGFcouldacceleratethedecreasingspeedofbothmRNAandproteinexpressionlevelsofDNMT3a.dsRNAfragmentsmicroinjectioncouldslowdownthedecreasingspeedofbothmRNAandproteinlevelsofDNMT3a.VEGFanddsRNAhadnoobviousinfluencesonbothDNMT3amRNAandproteinexpressionofGCs.
Keywords:vascularendothelialgrowthfactor(VEGF);DNMT3a;oocytes;ovine;in vitro
doi:10.11843/j.issn.0366-6964.2016.03.009
收稿日期:2015-07-15
基金项目:国家自然科学基金(31060309);中国博士后科学基金(2012M511579)
作者简介:曹忻(1978-),女,宁夏人,副教授,博士后,主要从事动物遗传育种与繁殖方面研究,E-mail:caoxin-juliet@163.com,Tel:0931-4512969 *通信作者:康相涛,教授,E-mail:Xtkang2001@263.net
中图分类号:S826.2
文献标志码:A
文章编号:0366-6964(2016)03-0484-09
