EphA2及EphrinA2在敖汉细毛羊皮肤中的表达及分布规律研究
2016-07-13贺建宁王春亮赵金山刘开东刘积凤
贺建宁,王春亮,赵金山,程 明,刘开东,刘积凤,柳 楠*
(1.青岛农业大学动物科技学院,青岛 266109; 2.公安部南昌警犬基地,南昌 330100; 3.青岛市畜牧兽医研究所,青岛 266121)
EphA2及EphrinA2在敖汉细毛羊皮肤中的表达及分布规律研究
贺建宁1,王春亮2,赵金山1,程明3,刘开东3,刘积凤1,柳楠1*
(1.青岛农业大学动物科技学院,青岛 266109; 2.公安部南昌警犬基地,南昌 330100; 3.青岛市畜牧兽医研究所,青岛 266121)
摘要:本文旨在探究EphA2及其配体EphrinA2基因在细毛羊毛囊发生、发育过程中的表达与分布规律,为毛囊发育的分子调控机制提供理论基础。试验以敖汉细毛羊生长发育不同时期体侧部皮肤为材料,采用实时荧光定量PCR和免疫组化技术,对EphA2和EphrinA2基因的mRNA和蛋白水平在皮肤毛囊中的表达规律进行研究。实时荧光定量PCR结果显示:EphA2和EphrinA2基因的表达量在胎龄120d时显著高于胎龄90d和出生后1d(P<0.01);出生后1和30d时差异不显著(P>0.05)。免疫组化结果表明:EphA2及EphrinA2蛋白在胎龄90和120d、出生后1和30d,4个时期的细毛羊体侧皮肤毛囊发育过程中,主要在毛囊、毛母质、外根鞘和表皮中表达,且呈现一定的特异性表达。综上结果表明,EphA2及EphrinA2与细毛羊皮肤毛囊形态发生、发育过程密切相关,可为相关研究提供借鉴。
关键词:细毛羊皮肤;EphA2;EphrinA2;表达;分布规律
敖汉细毛羊是中国优秀的细毛羊品种之一,其毛囊是皮肤的附属结构,也是产生被毛的重要组织,它的形态组织结构决定着被毛的品质和产量。毛囊的形态特征及发育规律,对羊毛性状有重要影响,并受多种因素的调控,其中基因是其最根本的调控因子。EphA2及其配体EphrinA2蛋白是细胞表面型酪氨酸蛋白激酶受体(Protein-tyrosinekinases,PTKs)的一种,都属于Eph蛋白家族。作为蛋白酪氨酸激酶家族中的最大的成员,Eph家族是外界信息在体内信号传递通路的关键组成部分,并广泛参与了各生物学过程的调控[1-2]。EphA2与EphrinA2均为膜蛋白,当只有以细胞膜附着的形式存在时才具有活性,其若要被活化则需要依赖细胞间的近距离接触[3]。由于其结构中都存在酪氨酸磷酸化的活性结构,故它们所在的细胞具有双向信号传递的功能。Eph受体的正向信号传递与经典细胞信号传递一样,当受体结合配体后,受体自身发生酪氨酸激酶磷酸化,并激活多种信号分子,进而通过相应信号通路来调节受体的细胞效应[4]。Ephrin介导的反向信号则向配体所在的细胞进行传递,其主要过程:Ephrin与Eph受体结合后,配体胞质区的酪氨酸磷酸化位点发生磷酸化,配体可以与相邻细胞的EphB受体相互作用,从而诱导细胞内反向信号的产生[5]。有研究表明,Eph/Ephrin系统的双向信号传导通路与多个生理和病理过程有关,如正常组织边界的形成、体节和血管的生成、细胞迁移、骨稳态的调节、肿瘤发生等方面[6-10]。迄今,有关EphA2和EphrinA2基因与细毛羊毛囊发育关系的研究还鲜有报道。本研究旨在通过对敖汉细毛羊皮肤毛囊组织中EphA2和EphrinA2表达量及表达位置变化的研究,了解其对细毛羊毛囊生长发育的作用,以期为毛囊形态发生、发育过程中的调控机制研究提供理论依据,为运用分子生物学加快育种进程提供技术支持。
1材料和方法
1.1试验动物
分别采集胎龄90、120d及出生后1、30d4个时期敖汉细毛羊体侧皮肤,每个时期3只,分别采集两份2cm2的皮肤样品,其中一份投入4%多聚甲醛溶液固定,用于石蜡切片制作;另一份投入液氮中,用于总RNA的提取。以上羊均来自同一羊场,饲养管理条件一致。
1.2主要仪器和试剂
罗氏RocheLightCycler480Ⅱ荧光定量PCR系统;罗氏TriPureRNAIsolationReagent,RocheTranscriptorFirstStrandcDNASynthesisKit1kit,SYBR®PremixEXTaqTMⅡ(2×);一抗(博奥森):RabbitAnti-EphrinA2antibody(bs-9758R)、RabbitAnti-EphA2antibody(bs-10209R);二抗(Sigma):Anti-RabbitIgG(wholemolecule)-FITC;LeicaRM2235切片机、FEATHERMICROTOMEBLADER35切片刀、OlympusBX51正置荧光显微镜;二甲苯、无水乙醇、4% 多聚甲醛、1%PBS溶液、枸橼酸缓冲溶液、抗荧光衰减封片剂均为分析纯。
1.3方法
1.3.1引物的设计与合成引物根据GenBank中绵羊相应基因的核苷酸序列,采用Primer5.0软件设计,由生工生物(上海)有限公司合成,相关引物的基本信息如表1所示,退火温度为60 ℃。
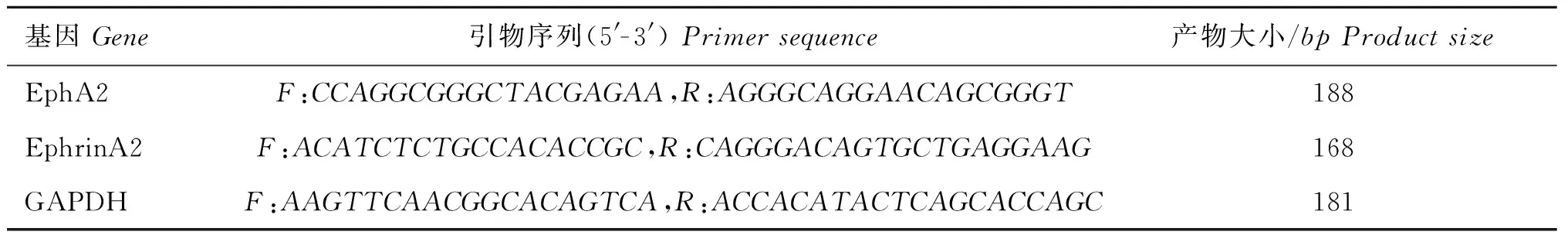
表1 EphA2、EphrinA2和GAPDH基因引物信息
1.3.2皮肤组织总RNA的提取及cDNA的合成利用Trizol法提取皮肤组织总RNA,并经Bioanalyzer2100(Agilent,CA,USA)检测合格后用于cDNA的合成。cDNA第一链的合成,按照罗氏反转录试剂盒的说明书进行。
1.3.3实时荧光定量PCR实时荧光定量PCR的反应体系20μL:SYBR®PremixEXTaqTMⅡ(2×)10μL,PCR正反向引物(10μmol·L-1)各0.5μL,DNA模板(<100ng)1.0μL,灭菌蒸馏水8.0μL。每个样品设置3个重复,以GAPDH为内参基因。采用 2-ΔΔCt法计算相关基因的表达量。
1.3.4石蜡切片制备将固定好的皮肤样品修整为5mm×5mm×3mm的小块,用PBS缓冲溶液浸泡10h,期间每隔1h更换一次液体;然后采用不同浓度酒精逐级脱水,二甲苯透明。随后用石蜡(Ⅰ)、石蜡(Ⅱ)、石蜡(Ⅲ) 依次各浸蜡1h,然后包埋于小纸盒内用于下一步试验。将包埋好的蜡块修整后固定到切片机上进行连续切片,厚度为5μm,共制得2套切片,1套用于EphA2和EphrinA2的免疫组化分析,另1套用于空白对照。
1.3.5荧光免疫组化常规脱蜡至水后,用PBS缓冲液浸泡10min。然后,在抗原修复盒中加入0.01mol·L-1枸橼酸钠缓冲液,将玻片浸入,在98 ℃ 温度下保持15min后,自然冷却至室温。用PBS缓冲液洗3次,每次5min。滴加山羊血清后,放入湿盒中,置于37 ℃ 恒温箱中20min进行封闭。随后,倾去封闭血清,并小心拭去组织片周围的液体,滴加一抗(兔抗绵羊EphrinA2、兔抗绵羊EphA2)1∶150,覆盖组织片。置于4 ℃ 冰箱过夜,同时利用PBS缓冲液代替一抗,作为阴性对照。用PBS缓冲液洗3次,每次5min,滴加FITC标记的山羊抗兔IgG,覆盖组织片,放入湿盒内并置于37 ℃ 恒温箱中30min。用PBS缓冲液洗3次,每次5min,最后用抗荧光衰减剂封片,在荧光显微镜下镜检观察并拍片分析。
1.4统计分析
荧光定量PCR结果分析采用2-ΔΔCt法计算基因的相对表达量,所有数据采用SAS程序t检验进行差异显著性分析,P<0.05为差异显著,P<0.01为差异极显著。
2结果
2.1总RNA提取
皮肤总RNA提取后,检测结果如图1所示,28S和18SRNA条带明亮,且两条带的亮度比值接近2∶1;OD260nm/OD280nm比值为1.8~2.0。表明所提取的总RNA完整性良好,且浓度和纯度可以满足后续试验要求。
图1 RNA质量检测Fig.1 Results of RNA quality
2.2EphA2及EphrinA2实时荧光定量PCR结果
2.2.1EphA2及EphrinA2基因qRT-PCR扩增引物检测由图2、图3可知,EphA2和内参基因GAPDH的熔解曲线峰值图上只有1个特征峰,表明在实时荧光定量PCR过程中荧光信号均来自特异性引物扩增产物,EphA2和内参基因GAPDH均没有非特异性扩增及引物二聚体,可以进行下一步的数据分析。

图2 EphA2和GAPDH熔解曲线Fig.2 The melt curves of EphA2 and GAPDH
2.2.2EphA2和EphrinA2基因的mRNA表达水平由图4可知,不同时期细毛羊皮肤中EphA2基因mRNA相对表达量:胎龄120 d时显著高于胎龄90 d和出生后1 d (P<0.01);出生后30和1 d时差异不显著(P>0.05)。由图5可见,不同时期细毛羊皮肤中EphrinA2基因mRNA相对表达量:胎龄120 d时显著高于胎龄90 d和出生后1 d(P<0.01);出生后30和1 d时差异不显著(P>0.05)。结果与EphA2基因mRNA的表达趋势一致。
2.3EphA2及EphrinA2在细毛羊皮肤发育过程中的分布规律
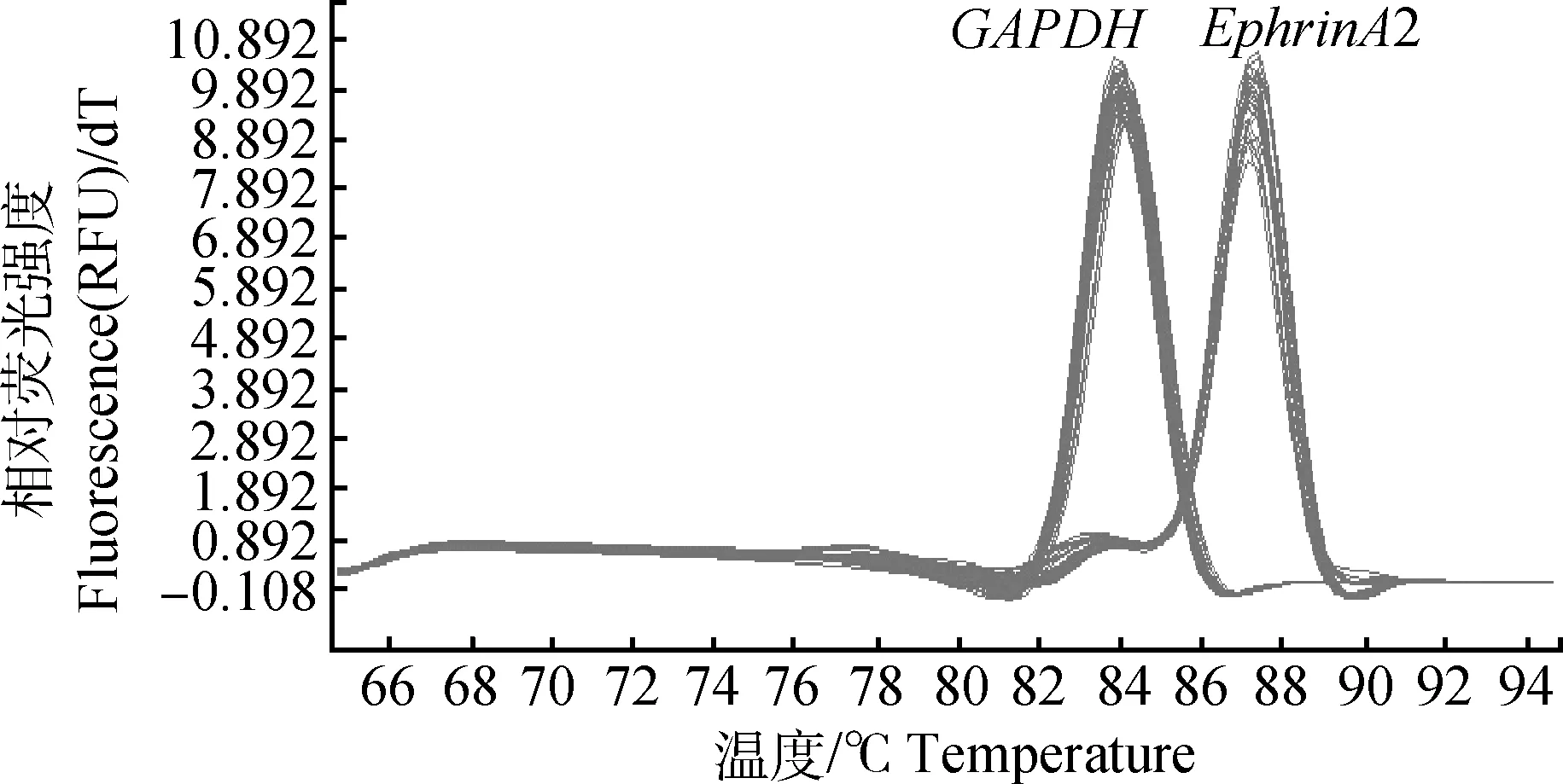
图3 EphrinA2和GAPDH熔解曲线Fig.3 The melt curves of EphrinA2 and GAPDH
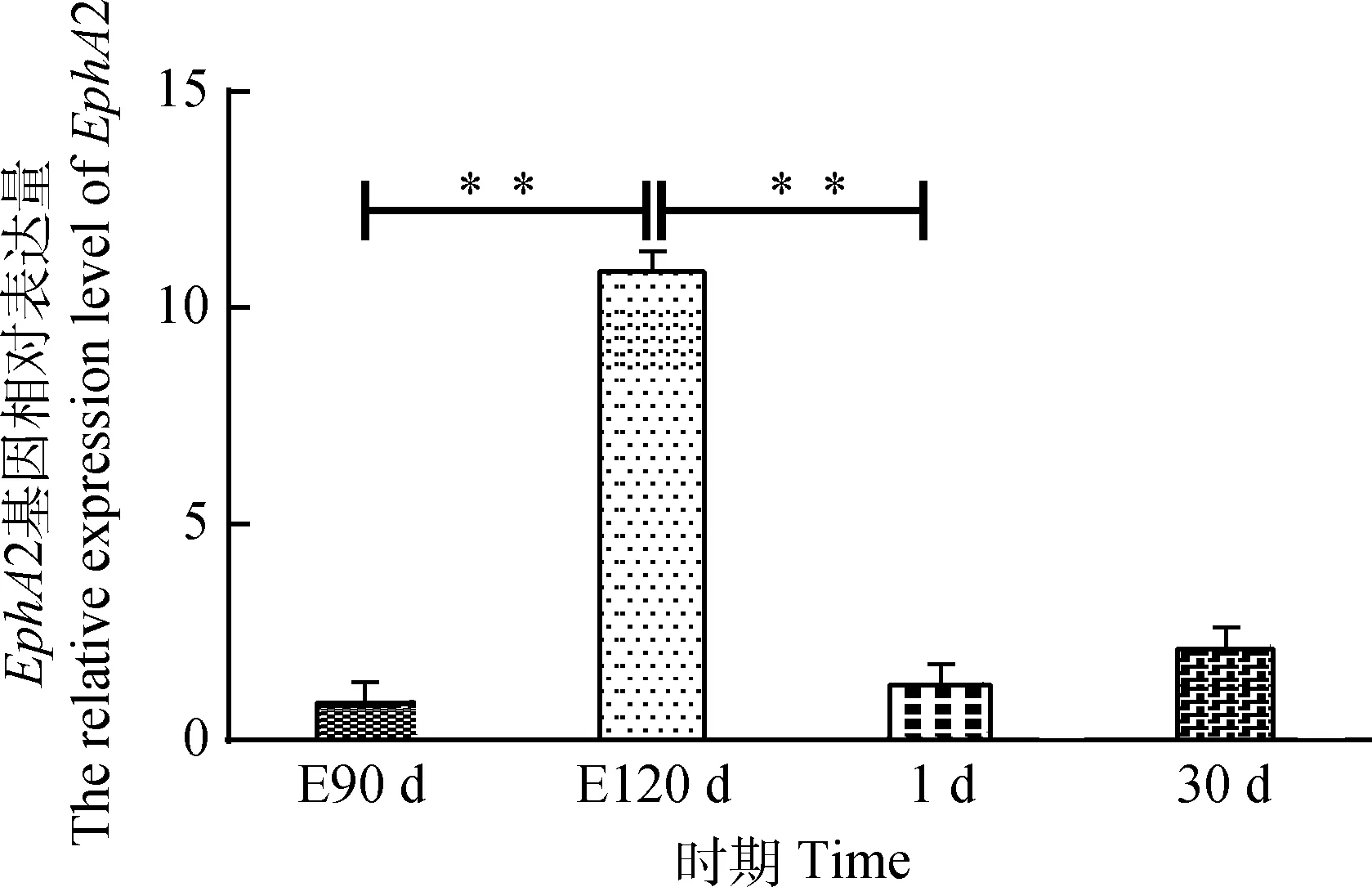
图4 不同时期细毛羊体侧皮肤中EphA2基因的相对表达量Fig.4 The relative expression level of EphA2 gene in skin of Fine Wool sheep in the different periods
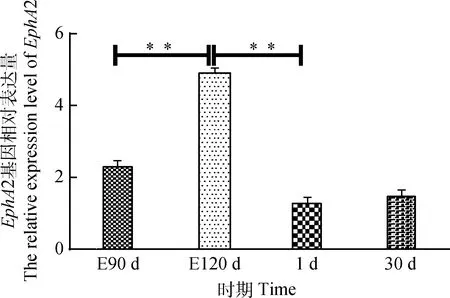
图5 不同时期细毛羊体侧部皮肤中EphrinA2基因的相对表达量Fig.5 The relative expression level of EphrinA2 gene in skin of Fine Wool sheep in the different periods
2.3.1EphA2蛋白在细毛羊皮肤发育过程中表达及分布规律结果表明,EphA2蛋白,在胎龄90 d时,主要在表皮细胞、初级毛囊毛钉上皮细胞中表达(图6A);在胎龄120 d时,主要在皮脂腺细胞和毛囊的毛母质细胞及靠近毛球的内、外根鞘集束细胞中表达(图6B)。在出生后1 d时,主要在表皮细胞、毛囊的毛母质细胞及部分皮脂腺细胞中表达(图6C);在出生后30 d时,主要在毛囊的毛母质细胞和外根鞘细胞中表达,在毛干及表皮上皮细胞中仅有少量表达(图6D)。
2.3.2Ephrin A2蛋白在细毛羊皮肤发育过程中表达及分布规律结果表明,Ephrin A2蛋白,胎龄90 d时,主要在表皮细胞表达,而在初、次级毛囊细胞中几乎不表达(图7A);胎龄120 d时,主要在毛囊外根鞘细胞及毛母质细胞中表达,少量表达于表皮细胞及皮脂腺细胞中(图7B);出生后1 d时,主要在毛囊的外根鞘细胞、毛母质细胞和表皮细胞中表达(图7C);出生后30 d时,主要在毛囊的毛干细胞、外根鞘集束细胞中表达,少量表达于皮脂腺细胞和表皮细胞中(图7D)。
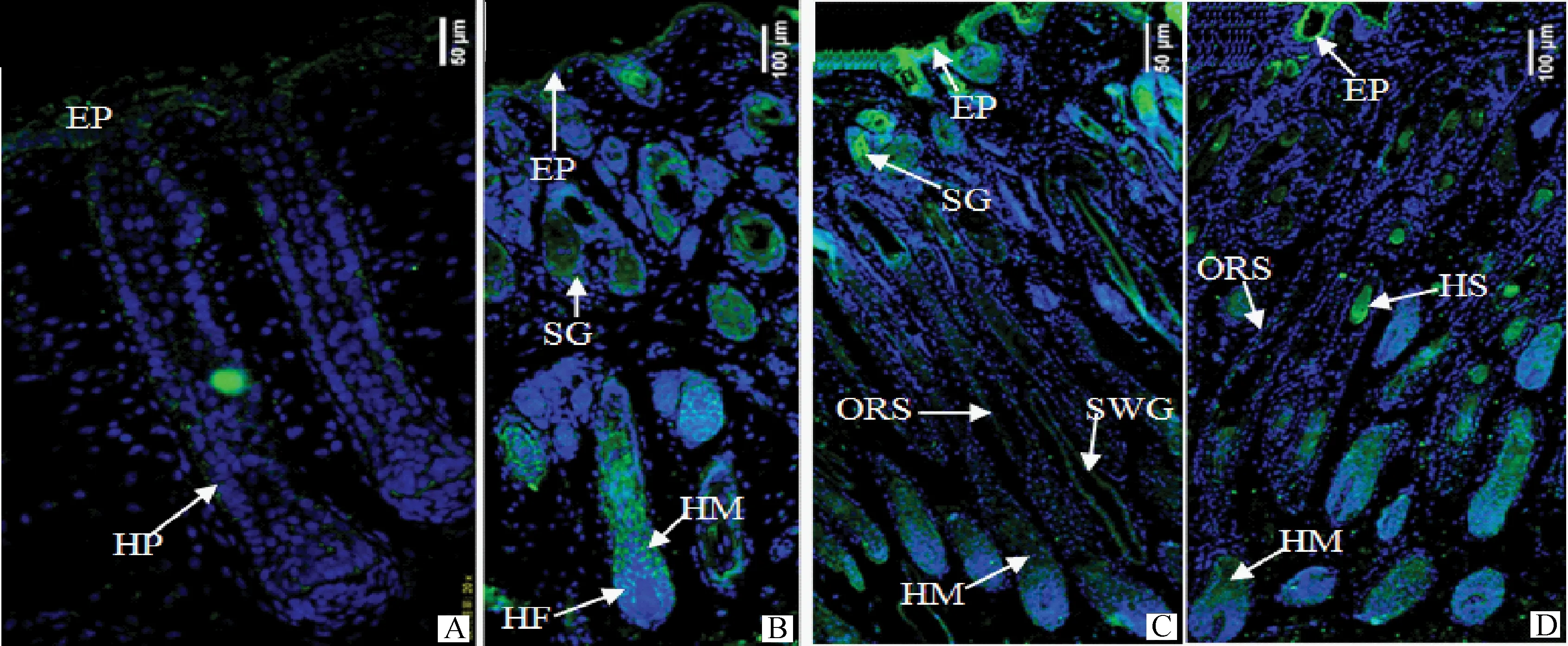
EP.表皮;HP.初级毛囊毛钉;HF.毛囊:HM.毛母质;SG.皮脂腺;SWG.汗腺;HS.毛干;ORS.外根鞘。A.胎龄 90 d(400×);B.胎龄120 d(200×);C.出生后1 d(100×);D.出生后30 d(100×)。下同EP.Epidermis;HP.Hair peg;HF.Hair follicle;HM.Hair matrix;SG.Sebaceous gland;SWG.Sweat gland;HS.Hair shaft;ORS.Outer root sheath.A.E90 d of fetal period(400×);B.E120 d of fetal period(200×);C.1 d after birth(100×);D.30 d after birth (100×).The same as below图6 不同时期的细毛羊皮肤毛囊中EphA2蛋白的表达特征Fig.6 Expression characteristics of EphA2 protein in skin of Fine Wool sheep in the different period

SHG.次级毛囊毛芽。A.胎龄90 d;B.胎龄120 d;C.出生后1 d;D.出生后30 dSHG.Secondary follicles germ.A.E90 d of fetal period;B.E120 d of fetal period;C.1 d after birth;D.30 d after birth图7 不同时期的敖汉细毛羊皮肤毛囊中Ephrin A2蛋白的表达特征Fig.7 Expression characteristics of Ephrin A2 protein in skin of Fine Wool sheep in the different periods 100×
3讨论
细胞外调节蛋白激酶( Extracellular regulated protein kinases,ERK)包括ERK1和ERK2,统称为ERK1/2,主要通过进入细胞核作用于E1k-1、c-myc、c-jun和ATF等转录因子起作用。ERK1/2调控基因的转录与表达,主要与细胞的增殖、分化密切相关。EphA2和EphA3则通过抑制ERK信号,从而促进胶质瘤干细胞的自我更新[11]。研究表明,在野生型小鼠中,EphA2的活化能抑制ERK1/2的活性并减少细胞的增殖。在细胞中EphrinA1是ERK1/2 MAPK的活性抑制因子;在角质细胞和成纤维细胞中,EphA2对EphrinA1诱导/抑制ERK1/2 MAPK的活性是必不可少的[12];通过对小鼠的研究发现,可溶性Eph和Ephrin的胞外模拟肽可以促进毛囊角质细胞的增殖。EphA2和EphrinA1可能通过调节ERK1/2 MAPK的活性,来参与毛囊的凋亡和再生[13]。有研究显示,破骨细胞中EphrinA2基因的表达,可以激活成骨细胞中的EphA2,进而抑制成骨细胞中某些特异基因的激活[14]。在牙槽骨的成骨细胞中,EphrinA2依赖Ras和ERK1/2的作用,进而抑制成骨细胞标志基因的表达,延迟成骨细胞分化的信号传递[15],而Ras和ERK1/2是EphA2信号系统的主要中间媒介。综上,EphA2可能通过调节ERK1/2参与了毛囊的凋亡和再生,推断EphA2/EphrinA2系统可能在毛囊发育中发挥重要作用。本试验结果表明,EphA2和EphrinA2基因mRNA表达水平,在胎龄120 d时显著高于胎龄90 d时,在出生后1 d时显著低于胎龄120 d时,出生后30 d时和出生后1 d时差异不显著。有研究表明,在胚胎期的后三分之一时间段,细毛羊胎儿的次级毛囊数量增加缓慢,有时甚至停止[2]。这与本试验结果中,次级毛囊密度在出生后1 d时显著低于胎龄120 d时,及与EphA2和EphrinA2 mRNA表达量水平趋势相一致,由此初步推测EphA2和EphrinA2基因可能与此时期毛囊细胞增殖速度降低有一定关系。EphA2和EphrinA2基因mRNA表达趋势与理论上次级毛囊密度的升降趋势一致,结合相关研究,综合推测EphA2/EphrinA2系统可能在诱导次级毛囊再分化为次级毛囊中具有重要作用,但由于样本量的局限,其具体的作用机制仍需进一步研究。
EphA2作为典型的细胞表面受体,主要在人皮肤角质细胞的外膜上表达,同时也在人正常皮肤的表皮基底层及毛囊内根鞘的角质细胞,以及在小鼠皮脂腺和毛囊的外根鞘中表达[12,16-17]。研究显示,在小鼠整个毛囊周期中,EphA2在不同的区域表达。在第一个生长期,主要在毛乳头表达;在静止期到生长期的过渡阶段,则在杵状毛周围的一些隆突区的细胞中表达;在第二个生长期,主要在新形成的毛囊周围的血管内皮细胞中表达,而在表皮和毛囊的上皮细胞内几乎没有表达[18]。本试验研究结果显示,EphA2蛋白在不同时期敖汉细毛羊皮肤中,主要在毛囊的毛母质细胞、内根鞘细胞和外根鞘细胞及表皮上皮细胞中表达。由于毛母质的生长分化决定毛发的粗细和形状,会诱导毛囊的再生;内根鞘则包围毛干,决定毛干的形状;外根鞘包裹内根鞘,起保护作用;由此推测EphA2蛋白可能在这些部位对细毛羊毛囊形态发育,特别是毛囊再生和细度方面起着一定的作用。综上,EphA2和EphrinA2蛋白在与毛囊形成和形态变化相关的组织中呈现特异性表达,表明其对毛囊的生长发育具有作用,但其作用机制尚需进一步研究。
4结论
综上表明,EphA2和EphrinA2的mRNA表达量在细毛羊毛囊发育的不同时期呈现差异性表达,特别在次级毛囊的分化再生过程中表达量显著升高;其蛋白在与毛囊发育相关的部位特异表达;综合以上结果及结合相关文献,推测EphA2和EphrinA2可能参与了毛囊的形态变化和发育过程,可能诱导次级毛囊的再分化,促进毛囊密度的增加。结果可为细毛羊毛囊发育的分子调控机制提供依据。
参考文献(References):
[1]KLEIN R.Eph/ephrin signaling in morphogenesis,neural development and plasticity[J].CurrOpinCellBiol,2004,16(5):580-589.
[2]PASQUALE E B.Eph-ephrin bidirectional signaling in physiology and disease[J].Cell,2008,133(1):38-52.[3]WEI Q,LIU J,WANG N,et al.Structures of an Eph receptor tyrosine kinase and its potential activation mechanism[J].ActaCrystallogrDBiolCrystallogr,2014,70(Pt 12):3135-3143.
[4]HUOT J.Ephrin signaling in axon guidance[J].ProgNeuropsychopharmacolBiolPsychiatry,2004,28(5):813-818.
[5]SASAKI E,HIKONO H,KAKU Y,et al.EphA9,a novel avian receptor tyrosine kinase gene[J].Gene,2003,316:103-110.
[6]代胜军.EphA/EphrinA在癫痫小鼠海马的时空表达对颞叶癫痫形成的影响[D].成都:电子科技大学,2009.DAI S J.Effects of EphA/EphrinA expression levels to temporal lobe epilepsy formed in epilepticus mouse’ hippocampus[D].Chengdu:University of Electronic Science and Technology of China,2009.(in Chinese)
[7]SUBBARAYAL P,KARUNAKARAN K,WINKLER A C,et al.EphrinA2 receptor(EphA2) is an invasion and intracellular signaling receptor for Chlamydia trachomatis[J].PLoSPathog,2015,11(4):e1004846.
[8]LIM B K,MATSUDA N,POO M M.Ephrin-B reverse signaling promotes structural and functional synaptic maturationinvivo[J].NatNeurosci,2008,11(2):160-169.
[9]SURAWSKA H,MA P C,SALGIA R.The role of ephrins and Eph receptors in cancer[J].CytokineGrowthFactorRev,2004,15(6):419-433.
[10]蒋澍.EphA/EphrinA信号系统在小鼠视网膜细胞发育中的表达与意义[D].长沙:中南大学,2014.
JIANG S.Expression of EphA/EphrinA in mouse retinal cell development[D].Changsha:Central South University,2014.(in Chinese)
[11]CHEN J,SONG W Q,AMATO K.Eph receptor tyrosine kinases in cancer stem cells[J].CytokineGrowthFactorRev,2015,26(1):1-6.
[12]GUO H,MIAO H,GERBER L,et al.Disruption of EphA2 receptor tyrosine kinase leads to increased susceptibility to carcinogenesis in mouse skin[J].CancerRes,2006,66(14):7050-7058.
[13]GENANDER M,HOLMBERG J,FRISÉN J.Ephrins negatively regulate cell proliferation in the epidermis and hair follicle[J].StemCells,2010,28(7):1196-1205.[14]IRIE N,TAKADA Y,WATANABE Y,et al.Bidirectional signaling through ephrinA2-EphA2 enhances osteoclastogenesis and suppresses osteoblastogenesis[J].JBiolChem,2009,284(21):14637-14644.
[15]DIERCKE K,SEN S,KOHL A,et al.Compression-dependent up-regulation of ephrin-A2 in PDL fibroblasts attenuates osteogenesis[J].JDentRes,2011,90(9):1108-1115.
[16]HAFNER C,BECKER B,LANDTHALER M,et al.Expression profile of Eph receptors and ephrin ligands in human skin and downregulation of EphA1 in nonmelanoma skin cancer[J].ModPathol,2006,19(10):1369-1377.
[17]EASTY D J,HILL S P,HSU M Y,et al.Up-regulation of ephrin-A1 during melanoma progression[J].IntJCancer,1999,84(5):494-501.
[18]YAMADA Y,MIDORIKAWA T,OURA H,et al.Ephrin-A3 not only increases the density of hair follicles but also accelerates anagen development in neonatal mice[J].JDermatolSci,2008,52(3):178-185.
(编辑程金华)
ExpressionandDistributionofEphA2andEphrinA2inSkinofAohanFineWoolSheep
HEJian-ning1,WANGChun-liang2,ZHAOJin-shan1,CHENGMing3,LIUKai-dong3,LIUJi-feng1,LIUNan1*
(1.College of Animal Science and Technology,Qingdao Agricultural University,Qingdao 266109, China;2.Nanchang Police Dog Base of the Ministry of Public Security,Nanchang 330100, China;3.Qingdao Institute of Animal Science and Veterinary Medicine,Qingdao 266121,China)
Abstract:TheobjectivesofthestudyweretoidentifytheexpressionanddistributionofEphA2andEphrinA2geneinhairfolliclesdevelopmentandmorphogenesisofFineWoolsheep.Theresultsmightlayatheoreticalbasisforunderstandingmolecularregulationmechanismofhairfollicledevelopment.SkinsofAohanFineWoolsheepinthedifferentperiod(prenatalstage,E90dandE120d;afterbirth, 1dand30d)wereselected.TheqRT-PCRandimmunohistochemicaltechnologieswereusedtostudytheirlevelsofmRNAandprotein.TheqRT-PCRresultsshowedthatmRNAexpressionlevelofEphA2andEphrinA2geneinE120dweresignificantlyhigherthanthatofE90dand1d(P<0.01),but1dand30dwerenotsignificantlydifference(P>0.05).Immunohistochemicaldetectionresultsshowedthat,thelevelandlocalizationofEphA2andEphrinA2proteinwerespatialandtemporalspecificityamongE90d,E120d, 1dand30dofsheepskinbodyside.Andtheymainlyexpressedinhairfollicle,hairmatrixouterrootsheathandepidermis.Inconclusion, EphA2andEphrinA2mayplayimportantrolesinhairfollicledevelopmentandmorphogenesis.Theseresultswouldprovidefundamentalinformationfortherelatedresearchfields.
Keywords:finewoolsheepskin;EphA2;EphrinA2;expression;distribution
doi:10.11843/j.issn.0366-6964.2016.03.012
收稿日期:2015-09-08
基金项目:国家绒毛用羊产业技术体系专项资金(CARS-40);国家自然科学基金项目(31402047);青岛农业大学高层次人才科研基金(631410)
作者简介:贺建宁(1984-),男,陕西靖边人,博士,从事羊遗传育种与繁殖研究,Tel:0532-88030498,E-mail:hexingxing104@163.com *通信作者:柳楠,教授,博士,E-mail:nanliu@sina.com
中图分类号:S826.2
文献标志码:A
文章编号:0366-6964(2016)03-0509-06
