腹膜后脂肪肉瘤亚型转换的相关因素及预后分析
2016-07-12霍明科韩广森赵玉洲马鹏飞郑亚杰润增慈
霍明科 韩广森 赵玉洲 马鹏飞 郑亚杰 润增慈
腹膜后脂肪肉瘤亚型转换的相关因素及预后分析
霍明科韩广森赵玉洲马鹏飞郑亚杰润增慈
摘要目的:回顾性分析腹膜后脂肪肉瘤(retroperitoneal liposarcoma,RPLS)亚型转换及预后的影响因素,以指导临床实践。方法:回顾性分析1997年7月至2014年10月年河南省肿瘤医院收治的经术后病理证实的92例腹膜后脂肪肉瘤患者的临床资料,复习相关文献并对其预后进行随访,对可能影响亚型转换及预后的相关因素进行统计分析。结果:瘤体分叶(P=0.013)能促进亚型转换;符合入组条件的74例腹膜后脂肪肉瘤患者,总5年生存率48.65%,Log-rank检验首诊年龄>45岁(P=0.045)、联合脏器切除(P=0.042)、瘤体坏死(P<0.001)、亚型转换(P<0.001)、首发病理亚型的恶性级别(P<0.001)是影响患者预后的因素。多因素回归分析显示瘤体坏死及首发病理亚型是影响患者预后的独立影响因素。结论:瘤体分叶能促进脂肪肉瘤亚型转换,腹膜后脂肪肉瘤患者预后与首诊年龄、联合脏器切除、瘤体坏死、亚型转换和首发病理亚型有关,联合脏器切除不能改善复发性腹膜后脂肪肉瘤的5年生存率,放化疗不能改善患者的预后。
关键词腹膜后脂肪肉瘤联合脏器切除亚型转化预后
作者单位:郑州大学附属肿瘤医院,河南省肿瘤医院普外科(郑州市450008)
脂肪肉瘤是一种由分化程度及异型程度不等的脂肪细胞所组成的恶性肿瘤,发病率约占软组织肉瘤的第2位[1]。根据2011版NCCN指南,将脂肪肉瘤分为四种亚型:高分化、黏液性(圆形)、去分化、多形性。前两种亚型为低中度恶性,后两种为高度恶性。腹膜后脂肪肉瘤(retroperitoneal liposarcoma,RPLS)起源于腹膜后的潜在腔隙,其特殊位置为RPLS的生长提供了必要的空间,且往往具有隐匿性。由于脂肪肉瘤特殊的生物学特性,手术为目前最有效的治疗方法。RPLS的预后差异很大,进展迅速者生存期仅数月,缓慢者可迁延数十年。临床实践中发现多次复发患者的首发病理亚型和复发病理亚型不尽相同。亚型转换是否预示着更高的复发率、更少的手术次数及更差的预后值得普外科医师探索。哪些因素与腹膜后脂肪肉瘤的亚型转化相关?哪些因素与RPLS预后密切相关?本文将对上述两个问题进行探索。
1 材料与方法
1.1 材料
收集1997年7月至2014年10月河南省肿瘤医院收治并经术后病理证实的92例腹膜后脂肪肉瘤患者的临床资料。纳入标准:1)在河南省肿瘤医院普外科接受手术治疗的患者,包括初次及复发手术治疗患者;2)所有患者均确诊为腹膜后脂肪肉瘤且不合并其他恶性肿瘤;3)全部患者均获得完整的临床及病理资料且术后病理均经病理医师复诊;4)入组患者均获完善随访。92例患者中,围术期死亡3例,合并其他恶性肿瘤2例,失访13例;符合纳入标准共计74例患者,男性36例,女性38例,年龄20~88岁,平均年龄47.34岁。
1.2 方法
1.2.1 观察指标病理是否亚型转换、患者无瘤生存期(disease free survival,DFS)、总生存期(overall survival,OS)、1、3、5年生存率等。观察是否发生亚型转换的截点事件为下述情况之一:1)发生转化,含原发类型中出现部分异种亚型;2)患者死亡。
1.2.2 随访采用电话及门诊随访的联合方式,随访日期截至2015年5月31日。随访时间2~240个月,中位随访时间59个月。以末次随访或患者死亡为截点时间,统计患者术后生存时间。
1.3 统计学方法
采用SPSS 20.0软件进行统计分析,定性资料以例数表示,亚型转化采用四格表资料的χ2检验,单因素生存分析采用Kaplan-Meier法计算,Log-rank检验,多因素生存分析采用Cox风险比例模型,P<0.05为差异具有统计学意义。
2 结果
2.1 临床病理特点
本组74例患者中,男性36例,女性38例,首诊年龄20~88岁,其中首诊年龄≤40岁患者22例,>40岁患者52例,平均年龄47.34岁。临床表现主要为腹胀、腹痛、肠道梗阻及泌尿道梗阻。发生亚型转换者38例,未转化者36例。
2.2 手术情况
74例患者中共手术248次,平均手术次数3.35次/例。4例患者手术1次,19例患手术2次,25例患者手术3次,手术4次及以上患者共26例,其中1例患者接受13次手术。联合脏器切除者49例,单纯减瘤术25例。
2.3 预后及影响因素
随访截至2015年5月31日,74例患者死亡39例,皆因肿瘤复发而死。中位生存时间为59个月,1、3、5年生存率分别为94.6%、77.0%、48.7%。本研究发现,瘤体分叶是影响亚型转换的主要因素(表1)。亚型转换患者的1、3、5年生存率分别为92.1%、78.6%、56.9%,低于未转换患者100%、96.7%、80.5%的生存率,差异具有统计学意义(P<0.001)。单因素生存分析及生存曲线显示:瘤体坏死、亚型转化、联合脏器切除及首发病理亚型恶性级别显著改变患者预后(表2,图1);多因素分析显示:瘤体坏死和首发病理亚型对患者预后生存有独立的影响(表3)。

表1 亚型转化相关资料的χ2检验Table 1 χ2test of related data on subtype transformation
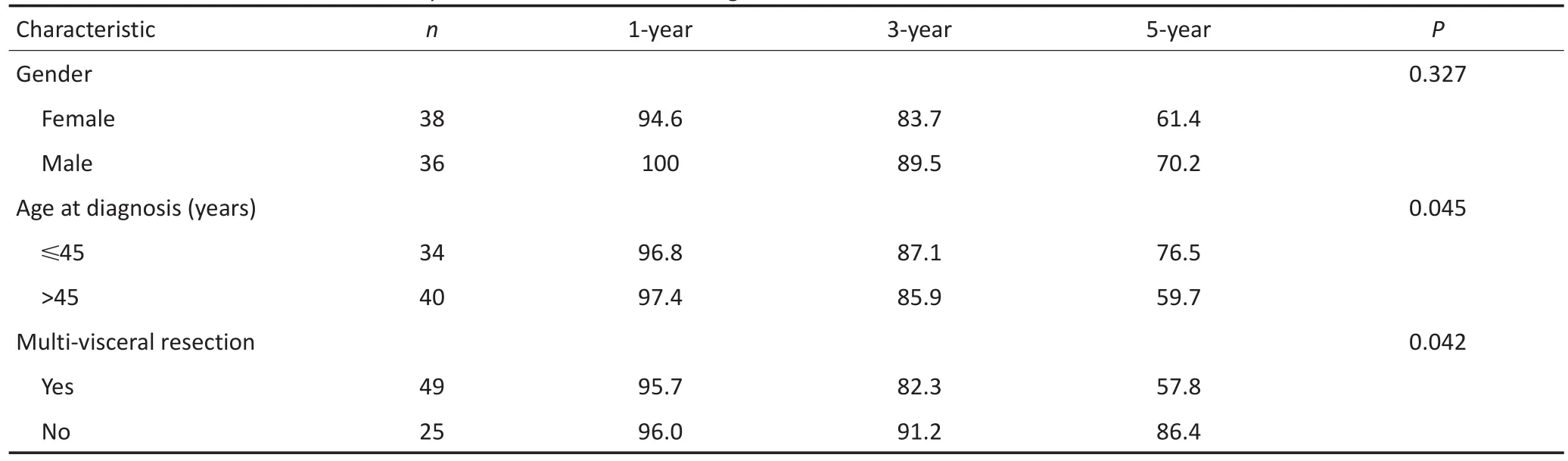
表2 RPLS患者临床特征及相关单因素Log-rank检验Table 2 Detailed clinical features of the patients and results of the Log-rank test
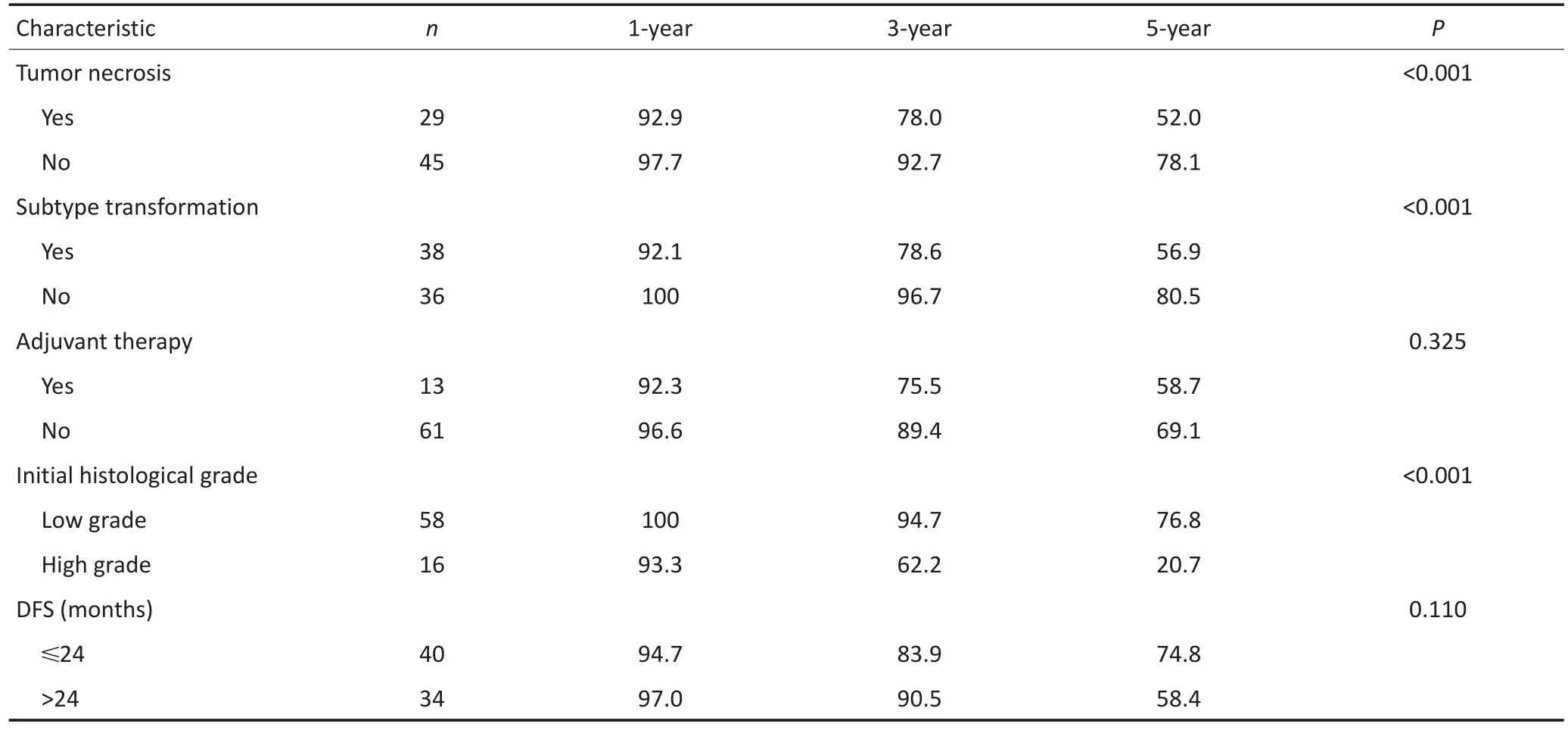
表2 RPLS患者临床特征及相关单因素Log-rank检验(续表2)Table 2 Detailed clinical features of the patients and results of the Log-rank test
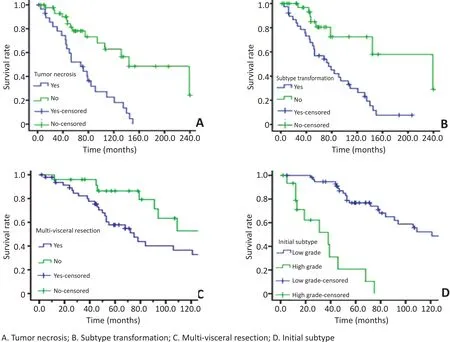
图1 影响预后各单因素的生存分析Figure 1 Survival curves of the single factor that affects the prognosis
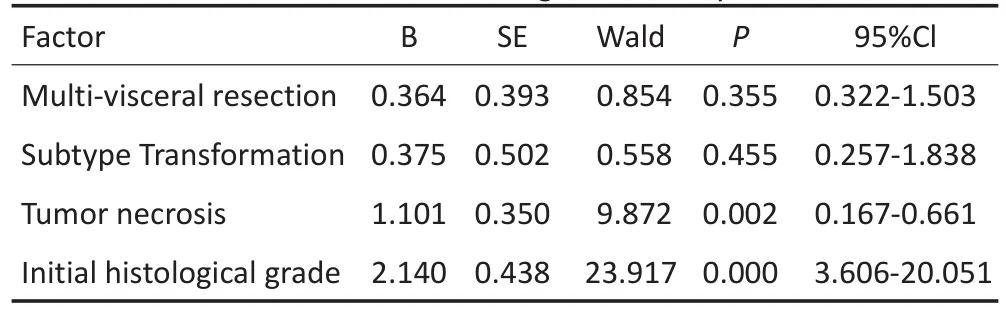
表3 Cox回归多因素生存分析Table 3 Results of multivariate Cox-regression analysis
3 讨论
软组织肉瘤少见,占所有成人肿瘤的不足1%,其中脂肪肉瘤约占所有软组织肉瘤的20%[2]。由于脂肪肉瘤特殊的生物学特性,放疗化疗效果均不明显,手术成为目前唯一有效缓解症状、解除患者痛苦的治疗方法。
3.1 亚型转化与复发
本研究中,脂肪肉瘤首发病理类型为低级别(黏液性和高分化)最为常见,占78.4%(58/74),高级别(去分化和多形性)占21.6%(16/74)。截至2015年5 月31日,末次病理亚型低级别占47.3%(35/74),高级别占52.7%(39/74)。统计结果显示,瘤体分叶是促进亚型转化的因素。瘤体分叶常继发于瘤体包膜溃破之后,手术刺激等导致残存于瘤灶之内的瘤细胞在经历挤压缺氧等一系列打击之后进而表现出更强的活性和耐受性。在复发过程中,进一步向高级别恶变。
高复发性是脂肪肉瘤的生物学特点之一,亚型转化常随复发次数递增而出现,手术再切除仍是目前唯一有效治疗复发RPLS的方法[3]。复发性RPLS往往边界不清,外科医生常为追求手术根治性而联合周围脏器切除,但联合脏器切除患者其术后复发率仍居高不下。高天等[4]一项关于软组织肉瘤扩大标本切除的病理研究显示:即便是达到肉眼R0,仍有52%患者显微镜下肿瘤残留,瘤灶的残余部分导致肿瘤原位多次复发并影响再手术时瘤体边缘的确定。本研究认为这与RPLS好发于肾后筋膜且易在肌间隙蔓延的铸型生长特点相关,铸型生长导致瘤体巨大且界限不清。术中分叶状巨大瘤体易被分块切除而造成组织残留,导致手术很难达到根治性,经历缺血缺氧手术刺激的残瘤可能是亚型转换后复发瘤体的原始胚体。近年来虽手术完整切除率很大提高,但文献报道术后复发率仍高达52%[5],本研究中患者术后5年复发率为90.5%,远高于文献报道,这可能与本组患者全部为腹膜后脂肪肉瘤有关,报道显示肢体脂肪肉瘤患者5年复发率低于腹膜后脂肪肉瘤患者。
纽约纪念斯隆凯特琳癌症中心(MSKCC)的一项关于500例原发性腹膜后脂肪肉瘤的研究认为术后切缘阳性是肿瘤复发的重要因素[6-7],反复局部复发是患者死亡主因[8],本研究结果与文献相符。目前手术根治性切除仍是公认治疗脂肪肉瘤的有效方法[9-10]。本研究中,首次手术联合脏器切除患者12例,复发患者行联合脏器切除者37例。RPLS发生亚型转换、瘤体内坏死、首次术后病理分级高度恶性的患者预后差。本研究中1例27岁女性患者2次复发瘤体1个月内由5 cm×5 cm×3 cm生长至48 cm×37 cm×25 cm,术中瘤体分叶且瘤内坏死伴小肠转移,术后病理亚型由首次手术的高分化合并部分去分化转化至多形性,患者总生存期为13个月,DFS为8个月。本研究推测瘤体生长速度较快则患者预后较差,大样本关于生长速度与预后的关系有待进一步开展。
3.2 外科治疗与预后
本组1例患者原发病理类型脂肪瘤,首次复发为高分化脂肪肉瘤,二次复发表现为平滑肌肉瘤。本研究推测,多潜能间叶细胞分化能力及方向非常活跃,复发类型不仅可为不同亚型,甚至为完全不同的组织学类型。高分化脂肪肉瘤与脂肪瘤外观相似,但前者除了大量成熟的脂肪组织外,尚有一定数量的异型细胞。众多脂肪源性肿瘤中均可发现COSA基因过度表达,此现象提示COSA基因在脂肪源性肿瘤的发生发展中可能起重要作用,但具体机制仍需要进一步研究[11]。黏液型脂肪肉瘤约占脂肪肉瘤的30%~55%[12],预后较好。文献报道,黏液样脂肪肉瘤的预后影响因素主要包括患者年龄≥45岁、瘤体直径≥10 cm、小圆细胞含量≥5%以及瘤体内是否有坏死[13]。本组48例术后行免疫组织化学检查,10例首发亚型为高度恶性,38例为低度恶性。Vemtin阳性对比阴性患者3年生存率为90.9% vs.87.0%,5年生存率为90.9% vs.50.6%;S-100阳性对比阴性患者的3年生存率为93.8% vs.75.5%,5年生存率为82.9% vs.33.6%。这可能与Vemtin、S-100在低度恶性脂肪肉瘤中高表达有关,尤其Vemtin在黏液性脂肪肉瘤中高表达。这提示Vemtin、S-100可能作为预估患者预后的独立指标,但值得注意本免疫组织化学研究入组患者较少,尚亟待大规模研究论证免疫组织化学的可靠性。
根治性手术切除是治疗脂肪肉瘤最有效的方法[10],诸多文献报道根治性切除患者预后优于部分切除者,但有文献报道减瘤术虽不能达到根治目的,但可有效缓解肿瘤压迫症状,延长生存时间[14-15]。首次根治性手术能提高患者的生存率,但若为复发患者,单纯减瘤术反而能使患者获得更长的生存时间,Keung等[15]认为切缘镜下与肉眼干净与否并不影响患者的生存时间,只对局部复发有重要意义。
亚型转换常伴随RPLS患者的多次手术而存在,本组74例患者中亚型转化者38例,本研究通过临床研究发现,脂肪肉瘤的亚型转化服从以下规律:当始发肿瘤亚型为高分化时,多次复发常表现为高分化中混合低分化或多形性成分;当始发亚型为黏液性时,多次复发亚型表现为黏液性脂肪肉瘤中含多形性成分。黏液性脂肪肉瘤和高分化脂肪肉瘤在本研究74例脂肪肉瘤的患者中罕见相互转化。本研究认为此现象是由于不同的分子遗传学机制导致,高分化脂肪肉瘤由于12q13-15染色体区域MDM2基因过度表达,而黏液样脂肪肉瘤则是发生t(12,16)(q13,p11)染色体异位形成TLS-CHOP融合基因导致。这可能会为今后针对不同亚型脂肪肉瘤的靶向药物研究提供甄选依据。
无瘤生存期(DFS)并不决定患者预后,部分患者虽首次术后肿瘤过早复发,但二次甚至多次复发并未亚型转化,单纯减瘤术使其获得良好预后。相比,部分患者首次病理或较长无瘤生存后二次复发病理即为高度恶性,此类患者预后较差。年龄及病理分级是影响患者预后的独立相关因素[16]。这与年轻患者对多次手术、联合脏器切除等打击因素有更好耐受性,各系统机能有更好代偿能力有关,而年长患者在多次手术打击后各系统机能下降。
伴随RPLS治疗研究的不断深入,放化疗及靶向治疗越来越受重视。报道显示,广泛切除联合术前放疗能将局部控制率提高到80%以上[5]。但由于脂肪肉瘤不同亚型的特点,放化疗目前尚无统一共识,不同中心研究结果不尽相同。本研究提示辅助治疗(不含中医中药治疗)不能增加患者的生存率。
综上所述,多次手术仍是治疗腹膜后脂肪肉瘤患者的首选方法。影响患者预后的因素很多,亚型转化往往预示着不良预后。大部分靶向药物证实对脂肪肉瘤的疗效差[17],但随着分子生物学技术的进步,期望能研发出像伊马替尼治疗间质瘤一样的靶向药物改善患者预后。
参考文献
[1] Fang ZW, Chen J, Teng S, et al.Analysis of soft tissue sarcomas in 1118 cases[J].Chin Med J (Engl), 2009, 122(1):51-53.
[2] Fernández-Ruiz M, Rodríguez-Gil Y, Guerra-Vales JM, et al.Primary retroperitoneal liposarcoma: clinical and histological analysis of ten cases[J].Gastroenterol Hepatol, 2010, 33(5):370-376.
[3] Erzen D, Sencar M, Novak J.Retroperitoneal sarcoma: 25 years of experience with aggressive surgical treatment at the institute of oncology, Ljubljana[J].J Surg Oncol, 2005, 91(1):1-9.
[4] Gao T, Fang ZW, Fan ZF, et al.Efficacy of Re-Excision for 78 Cases with Soft Tissue Sarcoma[J].Chin J Clin Oncol, 2012, 39(14):982-985[高天,方志伟,樊征夫,等.软组织肉瘤补充广泛切除78例原因和疗效分析[J].中国肿瘤临床,2012,39(14):982-985.]
[5] Kim B, Chen YL, Kirsch D, et al.An effective preoperative three-dimensional radiotherapy target volume for Extremity soft Tissue sarcoma and the effect of margin width on local control[J].Int J Radiat Oncol Biol Phys, 2010, 77(3):843-850.
[6] Ballo MT , Zagars GK , Pollock RE, et al.Retroperitoneal soft tissue sarcoma: an analysis of radiation and surgical treatment[J].Int J Radiat Oncol Biol Phys, 2007(1):158 -163.
[7] Grobmyer SR, Wilson JP, Apel B, et al.Recurent retroperitone al sarcoma:impact of biology and therapy on outcomes[J].J Am Coll Surg, 2010, 210(5):602-608.
[8] Kim EY, Kim SJ, Choi D, et al.Recurrence of retro-peritoneal liposarcoma:imaging findings and growth rates at follow-up CT[J].AJR Am J Roentgenol, 2008, 191(6):1841-1846.
[9] Lu W, Lau J, Xu MD, et al.Recurrent abdominal liposarcoma: analysis of 19 cases and prognostic factors[J].World J Gastroenterol, 2013, 19(25):4045-4052
[10] Lee SY, Goh BK, Teo MC, et al.Retroperitoneal liposarcomas: the experience of a tertiary Asian center[J].World J Surg Oncol, 2011, 9: 12.
[11] Nilsson M, Meza-Zepeda LA, Mertens F, et al.Amplification of chromosome 1 sequences in lipomatous tumors and other sarcomas[J].Int J Cancer, 2004, 109(3):363-369.
[12] El Ouni F, Jemnia H, Trabelsi A, et al.Liposarcoma of the extremiities : MR imaging features and their correlation with pathologic data[J].Orthop Traumatol Surg Res, 2010, 96(8):876-883.
[13] Na JC, Choi KH, Yang SC, et al.Surgical experience with retroperitoneal liposarcoma in a single korean tertiary medical center[J].Korean J Urol, 2012, 53(5):310-316.
[14] Dodd LG, Sara Jiang X, Rao K, et al.Pleomorphic liposarcoma:A cytologic study of five cases[J].Diagn Cytopathol, 2015, 43(2):138-143.
[15] Keung EZ, Hornick JL, Bertagnolli MM, et al.Predictors of outcomes in patients with primary retroperitoneal dedifferentiated liposarcoma undergoing surgery[J].J Am Coll Surg, 2014, 218(2):206-217.
[16] Liu JY, Fang ZW, Fan ZF, et al.Analysis of prognostic factors and the effect of adjuvant radiotherapy and chemotherapy for liposarcoma of the extremities[J].Chin J Clin Oncol, 2015, 42(6):351-356[刘佳勇,方志伟,樊征夫,等.肢体脂肪肉瘤的预后相关因素及放化疗疗效分析[J].中国肿瘤临床,2015,42(6):351-356.]
[17] Demetri GD, Chawla SP, Ray-Coquard I, et al.Results of an international randomized phase III trial of the mammalian target of rapamycin inhibitor ridaforolimus versus placebo to control metastatic sarcomas in patients after benefit from prior chemotherapy[J].J Clin Oncol, 2013, 31(19):2485-2492.
(2015-11-23收稿)
(2016-03-28修回)
(编辑:武斌校对:郑莉)

Analysis of prognostic factors and the related factors on subtype transformation of retroperitoneal liposarcoma
Mingke HUO, Guangsen HAN, Yuzhou ZHAO, Pengfei MA, Yajie ZHENG, Zengci RUN
Correspondence to: Guangsen HAN; E-mail: hnhanguangsen@126.com
General Surgery Department, Henan Provincial Tumor Hospital, Zhengzhou 450000, China
AbstractObjective: To retrospectively analyze related factors of subtype transformation and to identify prognostic factors for patients with retroperitoneal liposarcoma (RPLS).Methods: This study retrospectively analyzed the clinical data of 92 patients with RPLS, which were confirmed by postoperative pathology from July 1997 to October 2014 in Henan Provincial Tumor Hospital.Related studies were reviewed, and the prognoses were followed up.The factors may affect subtype transformation or prognoses were applied to the statistical analysis.Results: A total of 74 patients with RPLS were included according to the recruiting standard.The 5-year survival rate was 48.65%.Lobulated tumors (P=0.013) were the correlative factors that influenced subtype transformation.The Log-rank test showed that the age at diagnosis (P=0.045), multi-visceral resection (P=0.042), tumor necrosis (P<0.001), subtype transformation (P<0.001), and malignant level of pathological subtypes of the first operation (P<0.001) influenced overall survival.Multivariate Cox regression analysis showed that tumor necrosis and the malignant level of the initial histological grade were independent factors of overall survival.Conclusion: Lobulated tumors are likely to transform the subtype.The prognosis of patients with RPLS is correlated with multi-visceral resection, tumors necrosis, subtype transformation, and the malignant level of pathological subtypes of the first operation.Multi-visceral resection could not improve the 5-year survival rate of RPLS, and adjuvant therapy could not improve the prognosis.
Keywords:retroperitoneal liposarcoma, multi-visceral resection, subtype transformation, prognosis
doi:10.3969/j.issn.1000-8179.2016.08.310
通信作者:韩广森hnhanguangsen@126.com
作者简介
霍明科专业方向为胃肠道及腹膜后肿瘤的外科治疗。
E-mail:huomingke@163.com
·临床研究与应用·
