Shank1在肾细胞癌组织中的表达及临床意义
2016-07-12赵万里刘胜刘民周煦东孙鹏宇王宪杨继宏马晓丽
赵万里 刘胜 刘民 周煦东 孙鹏宇 王宪 杨继宏 马晓丽
Shank1在肾细胞癌组织中的表达及临床意义
赵万里①刘胜①刘民①周煦东①孙鹏宇①王宪①杨继宏②马晓丽③
摘要目的:检测Shank家族成员Shank1在肾细胞癌(renal cell carcinoma,RCC)中的表达,探讨在RCC癌组织与癌旁组织中Shank1的表达差异,分析其与RCC临床病理特征的关系。方法:收集2008年5月至2014年12月沧州市中心医院与济南市中心医院120例RCC术后患者的癌组织与癌旁组织标本,采用免疫组织化学染色及Western blot检测Shank1的蛋白表达水平,分析Shank1表达与RCC临床病理特征的关系。结果:免疫组织化学结果显示,RCC的癌组织中Shank1表达较癌旁组织明显上调,差异具有统计学意义(P<0.05)。Western blot检测发现RCC的癌组织中Shank1蛋白表达水平明显高于癌旁组织。对Shank1表达上调RCC患者的临床病理特征分析发现,Shank1在癌组织中的高表达与患者的性别、年龄、肿瘤的大小、TNM分期无显著性相关(P>0.05),但与RCC的不同病理类型显著性相关(P<0.05)。结论:Shank1在RCC的癌组织中异常表达,并与RCC的病理类型相关。
关键词肾细胞癌Shank1蛋白表达免疫组织化学
作者单位:①沧州市中心医院泌尿外二科(河北省沧州市061014);②华北油田总医院泌尿外科;③济南市中心医院中心实验室
肾细胞癌(renal cell carcinoma,RCC)是泌尿生殖系统常见的恶性肿瘤之一,占成人恶性肿瘤的2%~3%[1]。WHO(2004年)根据RCC组织形态学、遗传学、免疫表型及预后等临床特征,对肾细胞癌进行了新的分类,保留了1997年分类中的透明细胞性肾细胞癌、乳头状肾细胞癌(Ⅰ型和Ⅱ型)、嫌色细胞性肾细胞癌及未分类肾细胞癌,增加了Bellini集合管癌、肾髓质癌、多房囊性肾细胞癌、Xp11.2易位性/TFE3基因融合相关性肾癌、神经母细胞瘤相关性肾细胞癌和黏液管状梭形细胞癌9个类型[2]。透明细胞性肾细胞癌占RCC的70%~80%,近50%患者缺乏早期症状,25%患者就诊时已属于晚期,存在病灶的局部侵袭或转移[3]。了解RCC的起源、复发转移的分子机制对RCC的诊断、治疗和预后具有重要的指导意义。
Shank家族是一种“骨架蛋白”,Shank1是该家族的3个成员之一,可将多种细胞膜和胞浆的蛋白连接一起,从分子水平调节亚细胞结构、蛋白靶向连接和信号传递[4-5]。本研究旨在观察RCC患者的癌组织中Shank1在转录和蛋白水平的表达,并探讨Shank1的表达与临床病理特征的关系。
1 材料与方法
1.1 组织标本
组织标本来源于2008年5月至2014年12月沧州市中心医院和济南市中心医院120例的术后患者,病理均诊断为RCC,其中男性75例、女性45例。年龄2~79岁,中位年龄49岁,其中年龄>50岁57例、年龄≤50岁63例。术中分别切取癌组织,及距肿瘤边缘≥2 cm的约0.5 cm×0.5 cm×0.5 cm癌旁组织。
1.2 主要试剂
兔抗人Shank1单克隆抗体与鼠抗人GAPDH单克隆抗体均购自美国Proteintech公司。
1.3 方法
1.3.1 免疫组织化学染色采用两步法对组织切片行免疫组织化学染色。60℃烘烤切片2 h,4 μm厚度石蜡切片脱蜡至水,双氧水阻断内源性过氧化物酶,0.01 mol/L枸橼酸缓冲液中90℃微波抗原修复8 min,5%二抗正常血清室温孵育封闭2 h。Shank1鼠抗人一抗稀释(1:200),室温孵育1 h后4℃过夜,聚合物增强剂室温孵育20 min,酶标抗鼠聚合物室温孵育25 min,常规DAB显色。以磷酸缓冲液PBS代替一抗作为阴性对照组,同时设空白对照组。根据阳性、阴性和空白对照组的显色情况,在排除假阳性和假阴性的前提下,计数每例患者的肿瘤组织中所有肿瘤细胞,当阳性细胞率>10%则判断为表达阳性,且以细胞膜或胞浆染成棕黄色判定为弱阳性,棕褐色判定为强阳性。
1.3.2 Western blot检测取新鲜冰冻RCC的癌组织和癌旁组织,加入0.5 mL组织裂解液进行裂解,裂解液配方中Tris-Cl为10 mM、pH为8.0、NaCl为150 mM、 EDTA为1 mM、1%NP-40、10%甘油及蛋白酶抑制剂。BCA法测定总蛋白浓度。配置10%分离胶和8%浓缩胶,取50 μg组织总蛋白行SDS-PAGE凝胶电泳,湿转至PVDF膜上。5%脱脂奶粉封闭1 h后,抗Shank1(1:1 000)及抗内参GAPDH(1:20 000)抗体室温孵育1 h,TBST漂洗后辣根过氧化物酶标记的二抗(1:5000)室温孵育1h,TBST漂洗后电化学发光法检测。
1.4 统计学分析
采用SPSS 17.0软件进行统计学分析。将RCC患者癌组织高表达同时癌旁组织低表达的病例定义为Shank1表达上调病例,表达上调与表达无变化例数间的比较行χ2检验,Western blot灰度比较行t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 RCC的癌组织及癌旁组织中Shank1表达
免疫组织化学染色结果显示,Shank1特异性分布于肾细胞的细胞质,呈棕色颗粒状,弥漫或灶性分布。RCC的癌组织及癌旁组织中均有着色,癌组织中癌细胞染色为深棕色,而癌旁组织中细胞着色呈浅棕色,提示RCC的癌组织中Shank1表达高于癌旁组织(图1)。120例RCC的癌组织和癌旁组织中,47.5%(57/120)的癌组织存在不同程度的Shank1表达水平的上调。
为进一步证实免疫组织化学染色的结果,选取4 例RCC样本对Shank1的蛋白表达水平行Western blot分析,结果显示RCC的癌旁组织中Shank1蛋白低表达,而癌组织中高表达,与免疫组织化学染色的结果一致(P<0.05,图2)。
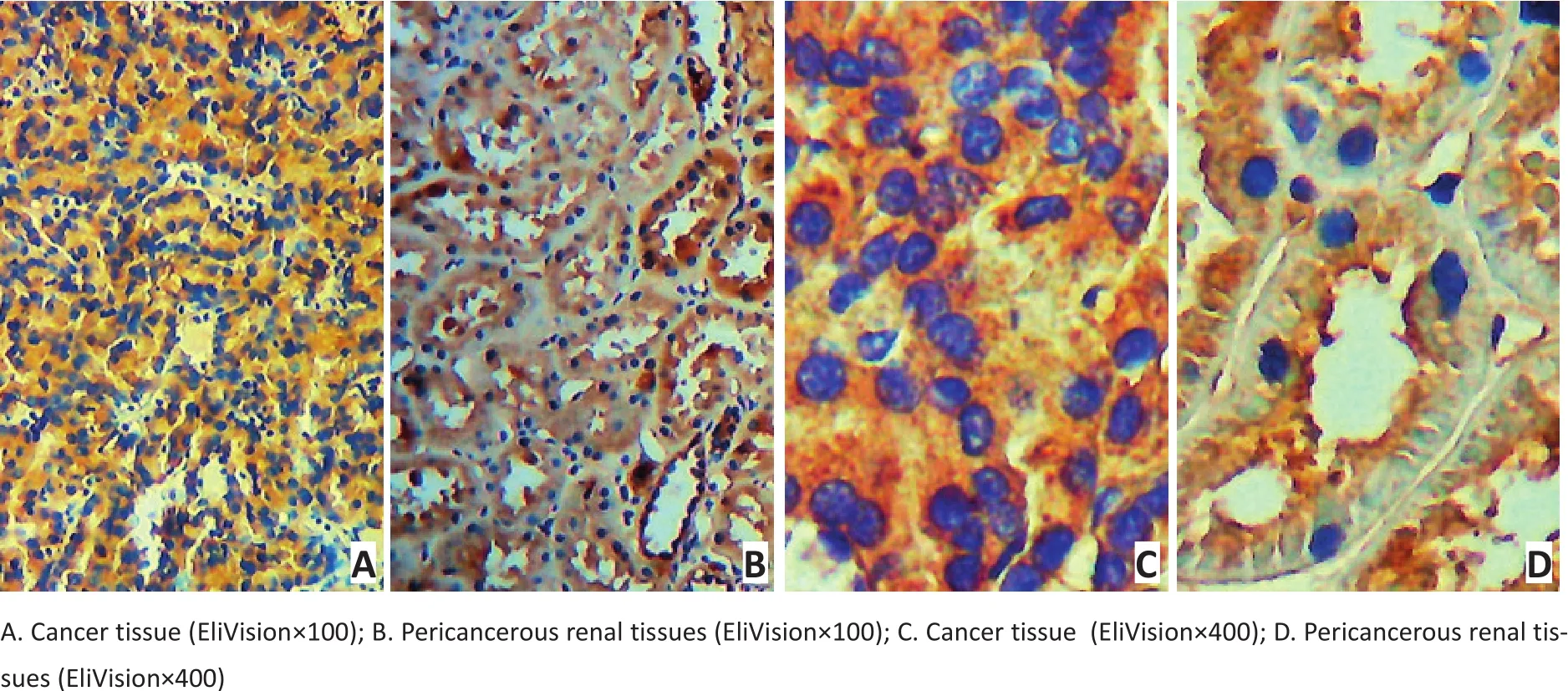
图1 免疫组织化学法检测RCC的癌组织和癌旁组织中Shank1的表达Figure 1 Immunohistochemistry result of the expression of Shank1 in RCC cancer tissue and pericancerous tissues

图2 Western blot检测RCC的癌组织和癌旁组织中Shank1的表达Figure 2 Western blot results of Shank1 expression in RCC cancer tissue and pericancerous tissues
2.2 RCC临床病理特征与Shank1蛋白表达水平的关系
分析RCC临床病理特征与Shank1蛋白表达的关系,对RCC患者的癌组织中Shank1表达上调与表达无变化例数的比较行χ2检验,结果显示120例RCC患者的癌组织中Shank1高表达与性别、年龄、肿瘤的大小、TNM分期无显著性相关(P>0.05),但与RCC的不同病理类型显著相关(P<0.05,表1)。
将RCC分型中Shank1上调表达率>60%定义为高表达型,分析高表达亚型的临床病理特征发现,在透明细胞性肾细胞癌、Ⅰ型及Ⅱ型乳头状肾细胞癌和嫌色细胞性肾细胞癌的癌组织中Shank1高表达与肿瘤大小显著相关(P<0.05),肿瘤越大Shank1表达水平越高(表2,3)。
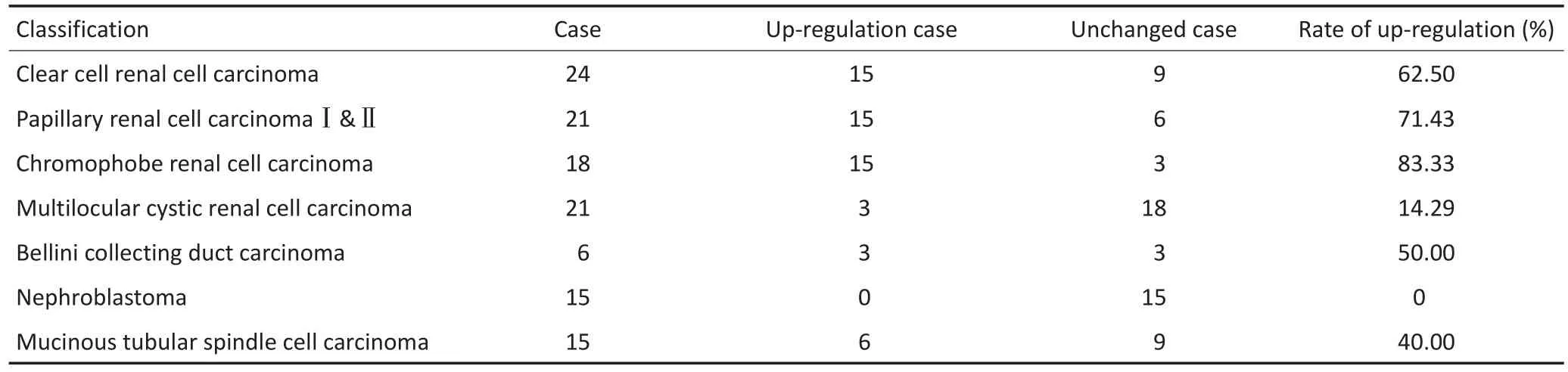
表1 RCC病理类型与Shank1表达水平的关系Table 1 Relationship between the histological differentiation and expression level of Shank1 in RCC cancer tissue
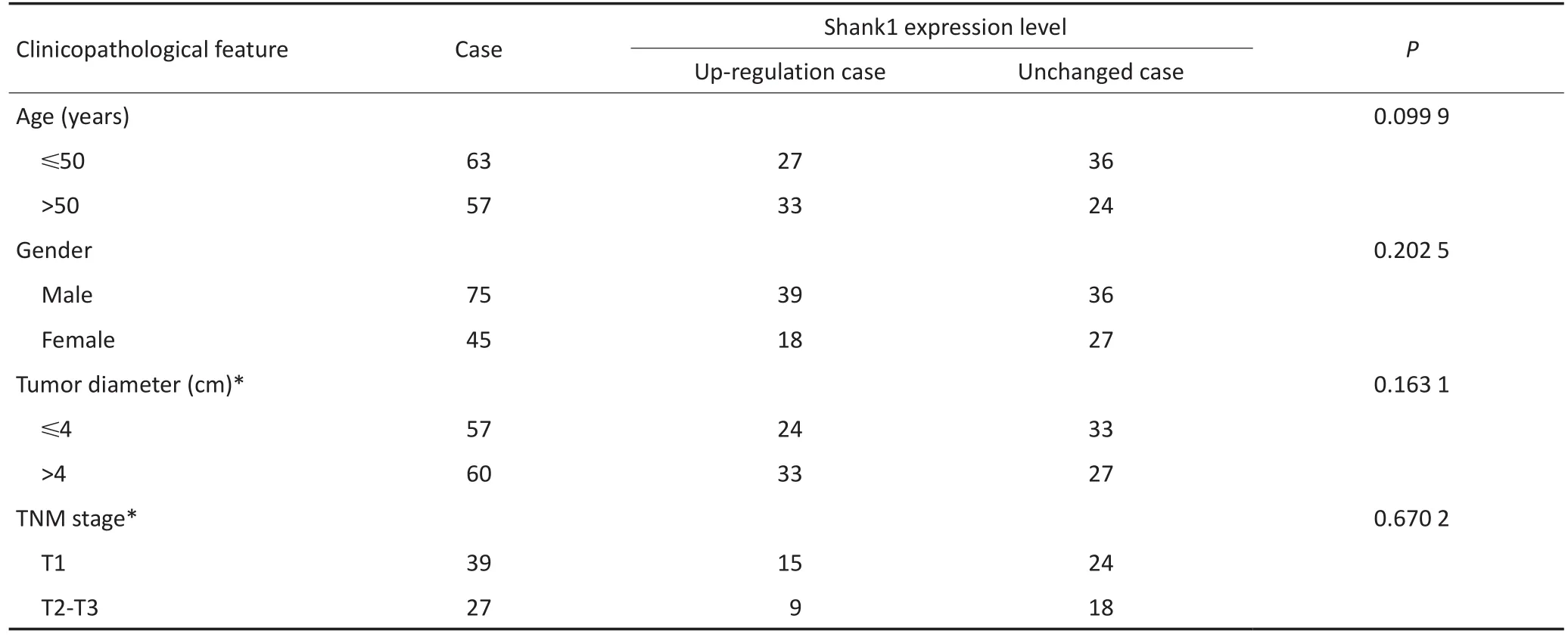
表2 120例RCC患者的癌组织中Shank1表达水平与临床病理特征的关系Table 2 Relationship between the expression level of Shank1 in 120 cases of RCC cancer tissue and clinicopathological characteristics
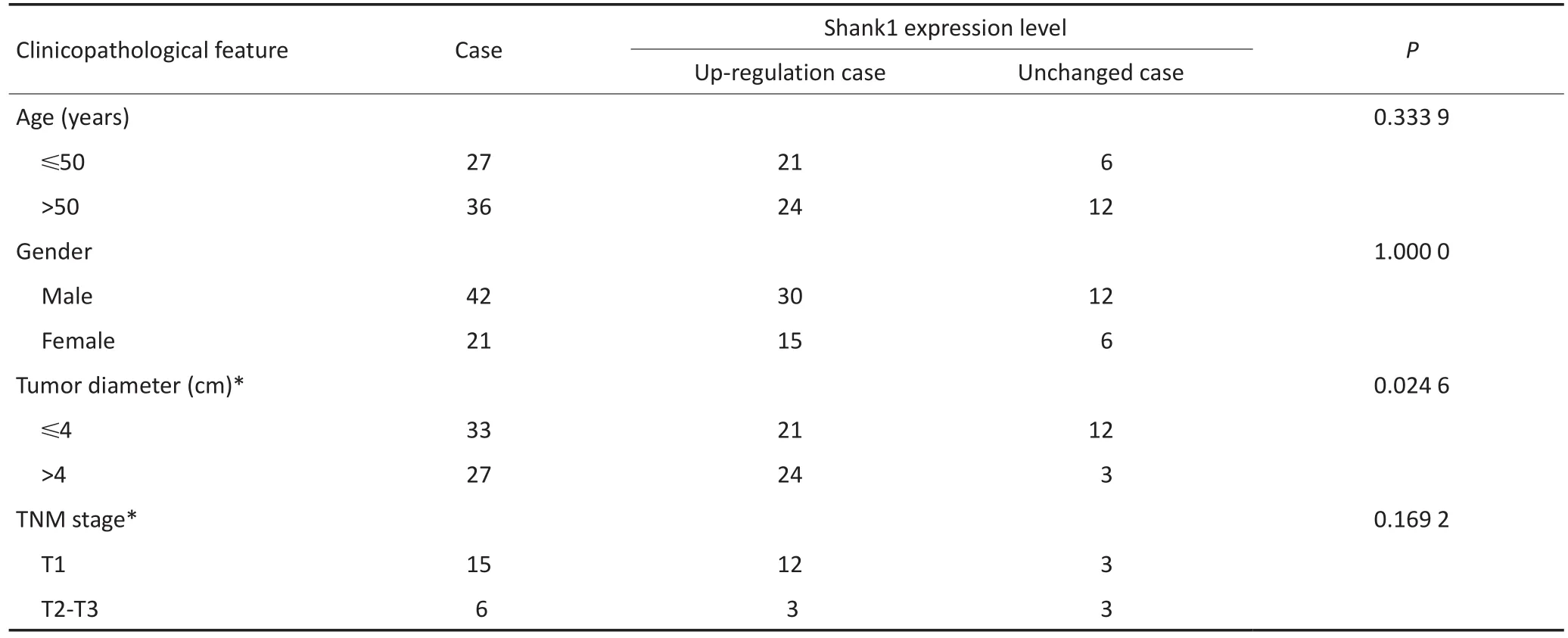
表3 63例透明细胞性肾细胞癌、Ⅰ型及Ⅱ型乳头状肾细胞癌和嫌色细胞性肾细胞癌患者的癌组织中Shank1表达水平与临床病理特征的关系Table 3 Relationship between the expression level of Shank1 and clinicopathological characteristics in 63 cases of clear cell RCC, papillary RCC, and chromophobe RCC cancer tissues
3 讨论
Shank家族,包括Shank1、Shank2和Shank3在多种组织中均有表达[6]。Shank是一种神经系统中重要的中心骨架蛋白,可连接多种受体、蛋白和细胞骨架,连接定位于细胞质和细胞膜上的多种受体和蛋白,因此在介导各种受体间的信号传导、维持突触正常功能方面具有重要作用[7]。
在大鼠组织中Shank1大量表达于大脑皮质、海马和杏仁核[8]。Shank1在神经组织中具有完整的Shank蛋白结构,自N端至C端共有5个结构域,这些完整的结构域使Shank1本身或通过其他骨架蛋白和连接蛋白与多种蛋白分子构成连接,其中有众多分子与肿瘤的发生、迁移、侵袭等相关[9]。本研究旨在检测RCC的癌组织和癌旁组织中Shank1是否表达,以及在RCC发生发展过程中是否发挥作用。本研究通过免疫组织化学染色及Western blot检测到RCC的癌旁组织中Shank1阳性表达,并且癌组织中蛋白表达水平明显高于癌旁组织,表达上调率达到47.5%。
对Shank1表达上调RCC患者的临床病理特征分析显示,癌组织中Shank1高表达与患者的年龄、性别、TNM分期无显著性相关(P>0.05),而与病理类型显著性相关(P<0.05)。在透明细胞性肾细胞癌、Ⅰ型及Ⅱ型乳头状肾细胞癌和嫌色细胞性肾细胞癌中Shank1高表达与肿瘤的大小呈正相关,即Shank1表达水平越高肿瘤越大。以上结果提示在RCC中Shank1可能发挥促进肿瘤生长的作用。
Shank1的PDZ结构域可通过骨架蛋白PSD-95与谷氨酸受体NMDA、KAR、mGluRs以及细胞黏附分子Semaphorin结合,在不同器官的肿瘤中均有异常表达[10];同时Shank1富含脯氨酸的结构域可通过Homer连接蛋白与mGluRs连接。mGluRs在多种肿瘤的发生、发展过程中具有重要的调节作用,并且极有可能参与RCC的发生、发展[11]。研究显示,所有类型的RCC均存在不同程度的代谢紊乱,也有研究提出RCC可能是一种代谢性疾病[12]。Shank1通过发挥细胞骨架作用介导多种信号传导途径,其中谷氨酸信号通路则在细胞代谢中发挥重要作用。除此之外,Shank1可通过骨架蛋白与RACl/CDC42、AMPA型谷氨酸受体等发生相互作用,并在众多肿瘤中均有异常表达。其中RACl/CDC42也是肿瘤研究中的热点,在肝癌、肺癌、乳腺癌、脑胶质瘤中均有促进肿瘤生长的作用[13-14]。有研究表明RACl/CDC42途径也参与了RCC的细胞迁移[15]。
综上所述,RCC癌组织中Shank1基因的高表达具有促进RCC癌细胞生长作用,在RCC诊断及基因治疗中具有一定的临床应用前景。Shank1基因可能通过介导谷氨酸受体等相关的信号传导促进RCC的发生发展,但具体的作用机制还有待进一步研究。
参考文献
[1] Lane BR, Kattan MW.Predicting outcomes in renal cell carcinoma[J].Curr Opin Urol, 2005, 15(5):289-297.
[2] Ma JH, Guan YY, Zheng S, et al.Progress in pathological classification of renal cell carcinoma[J].J Oncol, 2008, 14(5):334-336.[马建辉,关有彦,郑闪,等.肾细胞癌病理分类的新进展[J].肿瘤学杂志,2008,14 (5):334-336.]
[3] Ljungberg B, Bensalah K, Canfield S, et al.EAU guidelines on renal cell carcinoma: 2014 update[J].Eur Urol, 2015, 67(5):913-924.
[4] Naisbitt S , Kim E , Tu JC, et al.Shank, a novel family of postsynaptic density proteins that binds to the NMDA receptor/PSD-95/GKAP complex and cortactin[J].Neuron, 1999, 23(3):569-582.
[5] Jee C, Lee J, Lee JI, et al.SHN-1, a Shank homologue in C.elegans, affects defecation rhythm via the inositol-1, 4, 5-trisphosphate receptor[J].FEBS Lett, 2004, 561(1-3):29-36.
[6] Sheng M, Kim E.The Shank family of scaffold proteins[J].J Cell Sci, 2000, 113( Pt 11):1851-1856.
[7] Guilmatre A, Huguet G, Delorme R, et al.The emerging role of Shank genes in neuropsychiatric disorders[J].Dev Neurobiol, 2014, 74(2):113-122.
[8] Kreienkamp HJ, Zitzer H, Gundelfinger ED, et al.The calcium-independent receptor for alpha-latrotoxin from human and rodent brains interacts with members of the ProSAP/SSTRIP/Shank family of multidomainproteins[J].J Biol Chem, 2000, 275(42):32387-32390.
[9] Mao W, Watanabe T, Cho S, et al.Shank1 regulates excitatory synaptic transmission in mouse hippocampal parvalbumin-expressing inhibitory interneurons[J].Eur J Neurosci, 2015, 41(8):1025-1035.
[10] Worzfeld T, Offermanns S.Semaphorins and plexins as therapeutic targets[J].Nat Rev Drug Discov, 2014, 13(8):603-621.
[11] Lai P, Xu YF.Research progress of mGluR1 in renal cell carcinoma[J].Int J Urol Nephrol, 2015, 35(4):602-604.[赖鹏,许云飞.亲代谢型谷氨酸受体1(mGluR1)在肾癌中的研究进展[J].国际泌尿系统杂志,2015, 35(4):602-604.]
[12] Linehan WM, Srinivasan R, Schmidt LS.The genetic basis of kidney cancer: a metabolic disease[J].Nat Rev Urol, 2010, 7(5):277-285.
[13] Ma J, Xue Y, Liu W, et al.Role of activated Rac1/Cdc42 in mediating endothelial cell proliferation and tumor angiogenesis in breast cancer [J].Plos One, 2013, 8(6):e66275.
[14] Reyes SB, Narayanan AS, Lee HS, et al.αvβ8 integrin interacts with RhoGDI1 to regulate Rac1 and Cdc42 activation and drive glioblastoma cell invasion[J].Mol Biol Cell, 2013, 24(4):474-482.
[15] Ni S, Hu J, Duan Y, et al.Down expression of LRP1B promotes cell migration via RhoA/Cdc42 pathway and actin cytoskeleton remodeling in renal cell cancer[J].Cancer Sci, 2013, 104(7):817-825.
(2016-01-18收稿)
(2016-03-29修回)

Expression of Shank1 and its clinical significance in renal cancer tissue
Wanli ZHAO1, Sheng LIU1, Min LIU1, Xudong ZHOU1, Pengyu SUN1, Xian WANG1, Jihong YANG2, Xiaoli MA3
Correspondence to: Xiaoli MA; E-mail: mxl7125@126.com
1The Second Department of Urological Surgery, Cangzhou Central Hospital, Cangzhou 061014, China;2The General Hospital of North China Oil Field, Renqiu 062552, China;3Central Laboratory, Ji'nan Central Hospital, Ji'nan 250013, China
AbstractObjective: To detect the expression of Shank1 protein in renal cell carcinoma (RCC), to investigate its difference between the tumor and carcinoma adjacent tissue, and to analyze its correlation with RCC clinicopathological characteristics and prognosis.Methods: The renal carcinoma and carcinoma adjacent tissues of 120 patients were selected from Cangzhou Central Hospital and Ji'nan Central Hospital from May 2008 to December 2014.The expression level of Shank1 was determined by immunohistochemistry and Western blot.Statistical analysis was performed to determine the relationship between the expression of Shank1 and the clinicopathological features of RCC patients.Results: Results of immunohistochemistry showed that the expression level of Shank1 in renal cancer tissue was significantly higher than that in carcinoma adjacent tissue, and the difference was statistically significant (P<0.05).Western blot results showed that the expression level of Shank1 protein in renal cancer tissue was also significantly higher than in carcinoma adjacent tissue.Correlation analysis found that the high expression level of Shank1 in renal cancer tissue was not significantly related to gender, age, tumor size, and TNM stage, but was significantly associated with the histological differentiation of RCC (P<0.05).Conclusion: Shank1 is abnormally expressed in RCC renal cancer tissues and is correlated with the histological differentiation of RCC.
Keywords:renal cell carcinoma, Shank1, protein expression, immunohistochemistry
doi:10.3969/j.issn.1000-8179.2016.08.064
通信作者:马晓丽mxl7125@126.com
作者简介
赵万里专业方向为泌尿系统恶性肿瘤研究。
E-mail:tianxiajiankang148@163.com
·临床研究与应用·
