肝细胞肝癌中AOC4P表达和临床意义
2016-07-12何倩倩王浩联张金平李东颖李建生
何倩倩 王浩联 张金平 李东颖 李建生
肝细胞肝癌中AOC4P表达和临床意义
何倩倩王浩联张金平李东颖李建生
摘要目的:探讨肝细胞肝癌(hepatocellular carcinoma,HCC)组织中长链非编码RNA含铜胺氧化酶4的假基因(amine oxidase copper containing 4 pseudogene,AOC4P)表达及其临床意义。方法:选取2009年6月至2010年6月郑州大学第一附属医院行肝癌切除术的肝癌组织106例,采用实时荧光定量PCR(qRT-PCR)检测肝癌组织和癌旁组织中AOC4P表达,并分析其表达水平与临床病理因素及预后的关系。结果:qRT-PCR检测结果显示,106例肝癌组织中AOC4P相对表达量为0.66±0.34,低于癌旁组织的1.45±0.63,两者比较差异具有统计学意义(P<0.05)。单因素分析结果显示,AOC4P低表达与肿瘤直径、淋巴结转移和TNM分期相关(P<0.05)。AOC4P高表达组的患者生存期明显长于AOC4P低表达组,Cox多因素回归分析显示AOC4P表达水平、淋巴结转移和血管侵袭是影响肝癌患者预后的独立因素。结论:AOC4P在肝癌组织中表达降低,可能在肝癌的发生发展过程中发挥重要作用;AOC4P表达降低提示患者预后差,且为肝癌患者的独立危险因素,将来可能作为肝癌预后判断的分子标志物。
关键词肝细胞癌长链非编码RNA含铜胺氧化酶4的假基因TNM分期预后
作者单位:郑州大学第一附属医院消化内科(郑州市450052)
Okazaki等[1]于2002年首次提出长非编码RNA (lncRNA)这一概念,指长度大于200个核苷酸的非编码RNA转录本。早期研究认为lncRNA是转录过程中的副产物,不编码蛋白质,无任何生物学功能[2]。研究结果表明,lncRNA参与了表观遗传调控、转录翻译、细胞分化等重要的调控过程,在肿瘤的发生发展中起着重要作用[3-4]。我国肝癌的发病率呈上升趋势,最新的统计资料表明[5],2015年我国癌症新发病例约429.2万例,其中新发肝癌46.6万例,占10.9%,肝癌的患病率在男性恶性肿瘤中居第三位,在女性恶性肿瘤中居第五位。全国恶性肿瘤死亡病例约281.4万例,其中肝癌患者42.3万例,占15.1%,死亡率在我国恶性肿瘤中居第三位。目前肝癌的治疗手段是以手术治疗为主的综合治疗,手术治疗效果不佳的主要原因在于早期诊断率低和术后复发率高,有文献报道lncRNA中含铜胺氧化酶4的假基因(amine oxidase copper containing 4 pseudogene,AOC4P)可能为潜在的肝癌肿瘤标志物[6]。因此,本研究对AOC4P在肝癌中的表达水平与临床病理特征、预后关系进一步探究,为寻找新的肝癌预后标记物和治疗靶点提供思路。
1 材料与方法
1.1 材料
1.1.1 标本来源选取2009年6月至2010年6月郑州大学第一附属医院行肝癌切除术的肝癌组织106例,术前患者均未接受化疗、放疗等辅助治疗,术后经病理证实为肝细胞肝癌。对照组标本来自于同一患者的癌旁组织(距离手术切缘至少3 cm),术后病理检查未发现癌细胞。所有标本切除后,立即放入液氮中后转至-80℃超低温冰箱保存备用。患者术后均在门诊随访,并常规复查AFP、腹部B超,必要时复查腹部CT,检查结果资料完善,随访起点为病理确诊日期,末次随访时间为2015年9月30日,无失访病例。肿瘤分期按美国肿瘤研究联合委员会(Ameri⁃can Joint Committee on Cancer,AJCC)2010年发布的第七版分期系统的标准确定。本研究通过郑州大学第一附属医院伦理委员会审查批准。
1.1.2 试剂RNA提取试剂TRIzol购自美国Invitro⁃gen公司、RNA逆转录试剂盒购自日本Takara公司,定量PCR试剂盒购自美国Applied Biosystems公司。
1.2 方法
RNA提取及实时荧光定量PCR(qRT-PCR):取约100 mg冻存组织标本,按照试剂说明书抽提RNA,并使用分光光度计测定RNA浓度和纯度,RNA样品OD260/280值为1.8~2.1合格,按说明书逆转录成cDNA。实时荧光定量PCR按照SYBR Green说明书配制反应体系,每个样品重复3次。采用lncRNA AOC4P基因特异性引物进行RT-PCR,以GAPDH作为内参照。AOC4P引物序列如下:AOC4P:(Forward)5'- ACATGGATTGCT CCACGTGT-3';(Reverse)5'-GACCACCTATTTCTGAGT AG-3';GAPDH(Forward)5'-CCATGTTCGTCATGGGTG TGAACCA-3';(Reverse)5'-GCCAGTAGAGGCAGGGAT GATGTTC-3';数据应用2-ΔΔCt的方法进行相对定量分析。
1.3 统计学分析
釆用SPSS 21.0软件进行统计分析,配对的癌组织与癌旁组织中AOC4P表达比较采用配对t检验,AOC4P表达与肝癌患者的临床病理特征的关系采用χ2检验。应用Kaplan-Meier单因素和Cox多因素进行生存分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 qRT-PCR检测AOC4P在肝癌组织和癌旁组织中的表达水平
106例肝癌患者中,癌组织中AOC4P的表达水平0.66±0.34显著低于癌旁组织中的的表达水平1.45± 0.63(t=-17.730,P<0.001)。其中,与正常癌旁组织相比,表达量低于2倍认为AOC4P低表达,反之为高表达,结果显示70例癌组织中的AOC4P低表达。
2.2 肝癌组织中AOC4P表达水平与临床病理特征的关系
根据癌组织中AOC4P相对表达量低于癌旁组织2倍为标准,将106例标本分为AOC4P高表达组(n= 36)和AOC4P低表达组(n=70)。AOC4P在肝癌组织表达与肿瘤直径、淋巴结转移、TNM分期有显著性相关(P<0.05),而与患者年龄、性别、AFP、酗酒、HBV感染和血管侵袭无相关性(P>0.05,表1)。
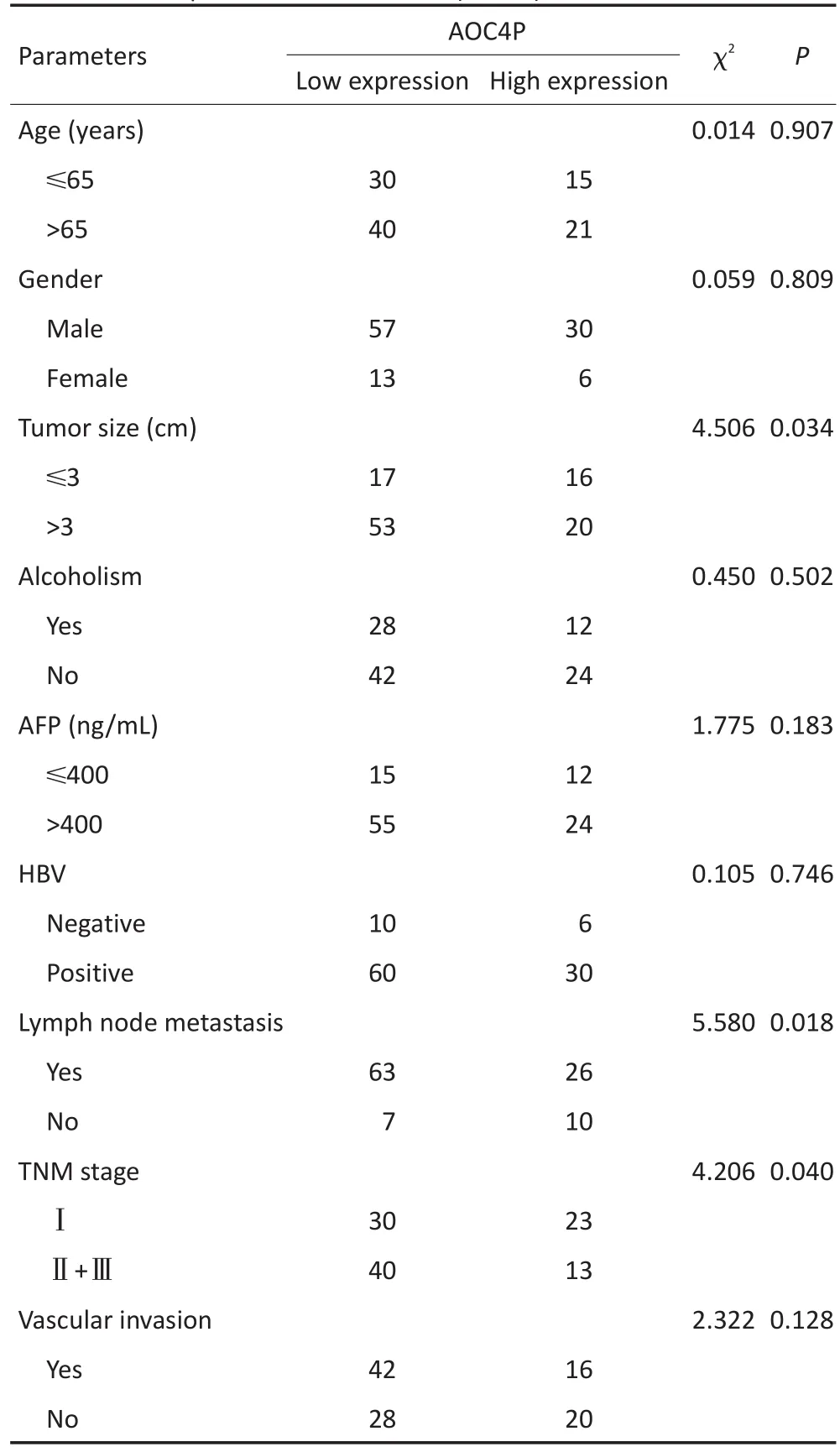
表1 肝癌组织中AOC4P的表达水平与临床病理特征之间的相关性(n=106)Table 1 Relationship between AOC4P expression and clinicopathological factors of hepatocellular carcinoma (n=106)
2.3 AOC4P表达与患者预后的关系
生存分析结果表明AOC4P低水平表达患者平均生存时间为(33.2±2.6)个月,中位生存时间为28.8个月,5年生存率为30%;AOC4P高水平表达患者平均生存时间为(42.7±3.4)个月,中位生存时间为34.8个月,5年生存率为52.8%。Kaplan-Meier单因素分析显示AOC4P表达水平与患者总生存相关,两组差异具有统计学意义(χ2=5.065,P=0.024,图1)。
Cox多因素生存分析提示AOC4P和肝癌患者预后相关,是反映预后的一个独立因素,AOC4P表达降低明显提示患者预后较差。同时结果显示淋巴结转移、血管侵袭表达均为肝癌患者的独立危险因素(表2)。

图1 AOC4P表达与肝癌患者生存期的关系Figure 1 Relationship between AOC4P expression and survival time of hepatocellular carcinoma patients

表2 肝癌患者预后影响因素的Cox回归分析Table 2 Cox multivariate regression analysis for the correlation between clinicopathological factors and prognosis of patients
3 讨论
肝癌是我国最常见的恶性肿瘤之一,其发病率及死亡率也呈逐年上升趋势[5]。肝癌死亡率高,较大程度上与其早期发现困难,就诊时能够接受根治性手术的患者少相关,因此寻找肝癌有效的肿瘤标志物显得尤为重要。早期研究认为lncRNA为基因组转录的“暗物质”,但近年来研究表明lncRNA与肿瘤的发生发展和侵袭转移等生物学行为有密切的联系[7-8]。Yang等[9]发现lncRNA表达升高与肝癌复发显著相关,是肝癌患者术后生存的一个独立的预后因素。此外,与肝癌密切相关的lncRNA还有HULC、HOTAIR、H19、MEG3等[10]。早期研究发现在人类中共有4种AOC基因,认为AOC3基因及其编码蛋白VAP-1在疾病中发挥重要作用,而AOC4是没有功能的拟基因[11]。目前关于AOC4P与除肝癌外的其他恶性肿瘤发生发展关系鲜见报道。
本研究结果显示,在肝癌患者组织中的AOC4P表达水平显著低于癌旁组织,提示AOC4P的表达水平与肝癌的发生可能存在一定关系。有文献报道在肝癌中作为抑癌基因的lncRNA(如MEG3、H19、Dreh等)显著下调[12]。本研究进一步分析了AOC4P与肝癌患者临床病理特征之间的关系,肝癌组织中AOC4P表达与肿瘤直径相关,提示AOC4P的低表达可能参与了肝癌的增殖。有研究指出当细胞增殖、凋亡机制失控时,癌变细胞数目将大量增加进而有可能导致肿瘤发生[13]。肝癌组织中AOC4P表达与淋巴结转移、TNM分期相关,提示AOC4P可能与肝癌的侵袭能力与进展密切相关。目前研究发现多种lncRNA(如HOTAIR、H19、BANCR等)可通过诱导上皮间充质转化(epithelial-mesenchymal transitions,EMT)参与肿瘤的转移过程[14]。EMT是指上皮细胞失去上皮表型转化为间质细胞的可逆过程,已被证实在肿瘤细胞转移播散的早期事件中起着关键性作用[15]。有研究报道[16],lncRNA结合到特定的蛋白伴侣并在调节其结合蛋白的活性和定位中发挥重要作用,MALAT-1是核lncRNA,通过与SR蛋白相互作用和影响SR蛋白及其他的剪接因子在核散斑区域的分布增加转录组和蛋白质组的复杂性。Wang等[6]发现肝癌细胞中的AOC4P表达可能通过与Vimentin蛋白结合、促进其降解从而抑制EMT过程。目前研究发现的参与调节EMT的信号通路主要包括TGF-β通路[17]、Wnt/β-catenin通路[18]、MEK-ERK通路[19]等,AOC4P是否通过上述信号通路调节EMT仍有待进一步的研究。
本研究通过Kaplan-Meier单因素生存分析结果发现,AOC4P低表达的患者无论生存时间还是生存率都低于高表达组,提示AOC4P的低表达可能与肝癌患者预后不良有关。另外,Cox多因素生存分析显示淋巴结转移、血管侵袭、AOC4P表达为肝癌患者的独立危险因素。
综上所述,在肝癌组织中AOC4P表达降低,且与肝癌的肿瘤直径、淋巴结转移、TNM分期和预后相关,同时AOC4P表达水平为肝癌患者的独立危险因素。提示AOC4P可能以抑癌基因的角色参与肝癌的发生发展过程,其有可能作为肝癌患者预后判断的生物标志物,但其是否能作为肝癌早期诊断的标记物及其抑制肝癌发生发展中的确切分子机制仍有待进一步研究。
参考文献
[1] Okazaki Y, Furuno M, Kasukawa T, et al.Analysis of the mouse transcriptome based on functional annotation of 60,770 full-length cDNAs[J].Nature, 2002, 420(6915):563-573.
[2] Wilusz JE, Sunwoo H, Spector DL.Long noncoding RNAs: functional surprises from the RNA word[J].Genes Dev, 2009, 23(13):1494-1504
[3] Tsai MC, Spitale RC, Chang HY.Long intergenic noncoding RNAs: new links in cancer progression[J].Cancer Res, 2011, 71(1):3-7.
[4] Batista PJ, Chang HY.Long noncoding RNAs: cellular address codes in development and disease[J].Cell, 2013, 152(6):1298-1307.
[5] Chen WQ, Zheng RS, Baade PD, et al.Cancer ststistics in China, 2015[J].CA Cancer J Clin, 2016, 66(2):115-132.
[6] Wang TH, Lin YS, Chen Y, et al.Long non-coding RNA AOC4P suppresses hepatocellular carcinoma metastasis by enhancing vimentin degradation and inhibiting epithelial- mesenchymal transition [J].Oncotarget, 2015, 6(27):23342-23357.
[7] Yarmishyn AA, Kurochkin IV.Long noncoding RNAs: a potential novel class of cancer biomarkers[J].Front Genet, 2015, 6:145.
[8] Shi XF, Sun M, Liu HB, et al.Long non-coding RNAs: a new frontier in the study of human diseases[J].Cancer Lett, 2013, 339(2):159-166.
[9] Yang F, Zhang L, Huo XS, et al.Long noncoding RNA high expression in hepatocellular carcinoma facilitates tumor growth through enhancer of zeste homolog 2 in humans[J].Hepatology, 2011, 54(5): 1679-1689.
[10] Mohamadkhani A.Long noncoding RNAs in interaction with RNA binding proteins in hepatocellular carcinoma[J].Hepat Mon, 2014, 14(5):e18794.
[11] Schwelberger HG.The origin of mammalian plasma amine oxidases [J].J Neural Transm (Vienna), 2007, 114(6):757-762.
[12] He Y, Meng X, Huang C, et al.Long noncoding RNAs: Novel insights into hepatocelluar carcinoma[J].Cancer Letters, 2014, 344(1):20-27.
[13] Gutschner T, Diederichs S.The hallmarks of cancer: a long non-coding RNA point of view[J].RNA Biol, 2012, 9(6):703-719.
[14] Zhao Y, Zhang XX, Xu M.Research progress of long noncoding RNA in tumer epithelial-mesenchymal transition[J].J Int Oncol, 2015, 42 (8):599-601.[赵义,张行行,徐岷.长非编码RNA在肿瘤上皮-间质转化中的研究进展[J].国际肿瘤学杂志,2015,42(8):599-601.]
[15] Hugo H, Ackland ML, Blick T, et al.Epithelial-mesenchymal and mesenchymal-epithelial transitions in carcinoma progression[J].J Cell Physiol, 2007, 213(2):374-383.
[16] Tripathi V, Ellis JD, Shen Z, et al.The nuclear-retained noncoding RNA MALAT1 regulates alternative splicing by modulating SR splicing factor phosphorylation[J].Mol Cell, 2010, 39(6):925-938.
[17] Mima K, Hayashi H, Kuroki H, et al.Epithelial-mesenchymal transition expression profiles as a prognostic factor or disease-free survival in hepatocellular carcinoma: Clinical significance of transforming growth factor-β signaling[J].Oncol Lett, 2013, 5(1):149-154.
[18] Zucchini- Pascal N, Peyre L, Rahmani R.Crosstalk between Beta-Catenin and Snail in the Induction of Epithelial to Mesenchymal Transition in Hepato carcinoma: Role of the ERK1/2 Pathway[J].Int J Mol Sci, 2013, 14(10):20768-20792.
[19] Guo Q, Zhao Y, Chen J, et al.BRAF-activated long non-coding RNA contributes to colorectal cancer migration by inducing epithelialmesenchymal transition[J].Oncol Lett, 2014, 8(2):869-875.
(2016-01-26收稿)
(2016-04-14修回)

Expression and clinical significance of AOC4P in hepatocellular carcinoma
Qianqian HE, Haolian WANG, Jinping ZHANG, Dongying LI, Jiansheng LI
Correspondence to: Jiansheng LI; E-mail: 415271633@qq.com
Department of Gastroenterology, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
AbstractObjective: This study investigates the expression of long non-coding RNA termed amine oxidase, copper containing 4, pseudogene (AOC4P) in hepatocellular carcinoma (HCC) and its relationship with clinicopathological factors and patient prognosis.Methods: The expression of AOC4P in 106 HCC tissues and adjacent non-tumor tissues were detected using qRT-PCR.The relationship between AOC4P expression and clinicopathological factors, as well as patient prognosis, in HCC was analyzed.Results: The relative expression of AOC4P in the cancer tissues was 0.66±0.34, which was significantly lower than the relative expression in adjacent non-tumor tissues, i.e., 1.45±0.63 (P<0.05).Univariate analysis showed that low AOC4P expression was correlated with tumor size, lymph node metastasis, and TNM stage (P<0.05).The group with high AOC4P expression levels has longer survival time compared with the group with low AOC4P expression levels.Cox multivariate regression analysis showed that AOC4P expression, lymph node metastasis, and vascular invasion were all independent factors that affect prognosis of patients.Conclusion: AOC4P expression was reduced in HCC tissues, and AOC4P may play crucial roles in the occurrence and development of HCC.For patients with poor prognosis, low AOC4P expression is an independent risk factor for patients with HCC.Thus, AOC4P expression may be used as a molecular marker for HCC.
Keywords:hepatocellular carcinoma, long non-coding RNA, AOC4P, TNM stage, prognosis
doi:10.3969/j.issn.1000-8179.2016.08.092
通信作者:李建生415271633@qq.com
作者简介
何倩倩专业方向为消化道肿瘤的诊治及其分子机制研究。
E-mail:1042689905@qq.com
·国家基金研究进展综述·
