一种钩藤属植物的rDNA ITS序列分析
2016-07-11王业胜李奇威周林管润锋曾常青朱
王业胜+李奇威+周林+管润锋+曾常青+朱爽


[摘要] 目的 以核糖体转录间隔区(rDNA ITS)序列作为分子条形码,对一种常用中药材钩藤进行分子鉴定和遗传分析,并阐明其在钩藤属内种间的分子系统发育关系。 方法 通过改良十六烷基三甲基溴化铵(CTAB)法对2015年7月采集的钩藤进行总DNA提取,利用通用引物对rDNA ITS序列进行PCR扩增,经克隆、测序后,运用MEGA软件进行系统发育分析和构建系统发育树。 结果 测序得到该钩藤的rDNA ITS区序列长度为718 bp,序列分析结果显示其与GenBank数据库中已有的钩藤(Uncaria rhynchophylla)rDNA ITS区序列之间相似度达99.8%,并且在系统发育树中并排聚类成一支。 结论 基于ITS区序列测定分析的分子生物学方法和构建系统发育树的分子遗传学方法,可以对钩藤属药用植物进行分子鉴定和遗传分析,为钩藤属药用植物的种间分类地位以及种类鉴定提供准确的分子证据。
[关键词] 钩藤;ITS序列;分子鉴定;系统发育树
[中图分类号] S567.239 [文献标识码] A [文章编号] 1674-4721(2016)03(a)-0004-04
[Abstract] Objective To clarify the phylogenetic relationship of one species of Uncaria,molecular identification and genetic analysis were carried out by using the rDNA ITS sequence as molecular barcoding. Methods Molecular identification and genetic analysis were carried out with the rDNA ITS sequence as molecular marker.Total DNA was extracted with modified CTAB method and thereby rDNA ITS regions were amplified with universal primer,sequenced and phylogenetic analysed with MEGA 6.0 at July 2015. Results The entire rDNA ITS sequence of Uncaria was 718 bp.Sequence analysis showed that the rDNA ITS sequence was closely related to Uncaria rhynchophylla available in GenBank and the similarity reached 99.8%. Conclusion Based on molecular biology methods of rDNA ITS region analysis,molecular identification is available in accurate classification on traditional Chinese medicinal material plants in Genus Uncaria and provide molecular evidence for taxonomy and identification of different species in Genus Uncaria.
[Key words] Uncaria;ITS sequence;Molecular identification;Phylogenetic tree
钩藤是茜草科钩藤属植物,主要分布于我国广东、广西、四川、云南、贵州等地区。《中国药典》2015年版规定的钩藤为茜草科植物钩藤[Uncaria rhynchophylla (Miq.)Miq.ex Havil.]、大叶钩藤[Uncaria macrophylla Wall.]、毛钩藤[Uncaria hirsuta Havil.]、华钩藤[Uncaria sinensis (Oliv.) Havil.]或无柄果钩藤[Uncaria sessilifructus Roxb.]的干燥带钩茎枝[1]。
钩藤为常用中药,药用历史悠久,具有息风定惊、清热平肝的功效。但是钩藤药材在市场上的分类鉴定比较混乱,影响了中药材用药的准确性和安全性。因此,有必要运用DNA分子标记技术进一步对钩藤属植物不同种间进行鉴定。核糖体转录间隔区(rDNA ITS)序列作为分子条形码的鉴定能力已经在药用植物很多个科属基原植物及药材的鉴定中得到验证[2-12]。本研究对采自广州中医药大学药王山的一种钩藤属药用植物进行分子鉴定和遗传分析。现报道如下。
1 材料与方法
1.1 材料来源与鉴定
实验用的钩藤样品于2015年7月采集于广州中医药大学药王山。常绿木质藤本;小枝四棱柱形,褐色,季净无毛;叶腋有成对或单生的钩,向下弯曲,先端尖;叶对生,具短柄,叶片卵形,卵状长圆形或椭圆形。本钩藤样品经广东药学院曾常青教授初步从形态上鉴定为钩藤[Uncaria rhynchophylla (Miq.)Miq.ex Havil.]。钩藤总DNA的提取采用新鲜采集的叶片,或者使用密封袋中已经用硅胶快速干燥过的新鲜采集的叶片。
1.2 仪器和试剂
BIO-RAD T100TM Thermal Cycler PCR仪(美国Bio-Rad公司),Thermo Scientific Heraeus Pico17台式离心机(美国赛默飞世尔科技公司),HHS-2S电子恒温不锈钢水浴锅(上海宜昌仪器纱筛厂),TP - 402电子分析天平(美国丹佛仪器北京有限公司),SW-CJ-1F清洁工作台(苏州安泰公司),BG-Sub MIDI水平电泳仪(北京永恒生物器材公司),天能-4100数码凝胶图像分析系统(上海天能公司),SPX智能型生化培养箱(广州深华公司)。
SYBR Green Ⅰ电泳染料购自北京百泰克生物技术有限公司,DL2000 DNA Marker购自TIANGEN生化科技(北京)有限公司,pMD18-T Vector、Taq酶以及DNA凝胶回收试剂盒均购自TaKaRa大连宝生物工程有限公司,通用引物合成由生工生物工程(上海)股份有限公司完成,十六烷基三甲基溴化铵(cetyltrimethyl ammonium bromide,CTAB)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、三羟甲基氨基甲烷(Tris)购自北京鼎国昌盛生物技术有限责任公司。其余试剂均为分析纯。
1.3 方法
1.3.1 钩藤植物基因组DNA的提取 钩藤植物基因组DNA的提取采用改良的CTAB法[13]:称量约1 g新鲜采集的叶片在液氮的低温条件下研磨成细粉末。将粉末转移到50 ml的离心管中,加入约5 ml 65℃预热的CTAB裂解液(4%CTAB,1.4 mol/L NaCl,100 mmol/L Tris-Cl,25 mmol/L EDTA,2%β-巯基乙醇,1%PVP,pH 8.0),65℃水浴2 h(每隔30 min轻摇振荡1次)。每1毫升混合液分装到1.5 ml Eppendorf管中,12 000 r/min离心10 min,取上清液,用等体积的Tris饱和酚(pH 8.0),酚-氯仿-异戊醇(25∶24∶1)和氯仿-异戊醇(24∶1)各抽提1次,12 000 r/min离心10 min,取上清液,加入0.1倍体积3 mol/L NaAc(pH 5.2)溶液,再加入2倍体积无水乙醇,-20℃沉淀1 h,12 000 r/min离心10 min,移去上清液,用1 ml 70%冷乙醇洗涤2次,干燥后用50 μl无菌1×三羟甲基氨基甲烷-乙二胺四乙酸(Tris-ethylene diamine tetraacetic acid,TE)缓冲液回溶。取2 μl回溶后的总DNA溶液进行电泳鉴定,记录凝胶成像结果。
1.3.2钩藤植物ITS序列的PCR扩增以及扩增产物的纯化 使用扩增ITS序列全长的引物组[14-15]ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和ITS5(5′-GGAA-GTAAAAGTCGTAACAAGG-3′)扩增药王山的钩藤植物总DNA的ITS序列。配制20 μl 的PCR体系:10×PCR Buffer(2.5 mmol/L,Mg2+ Plus)2 μl,dNTP Mixture(2.5 mmol/L)1.6 μl,引物量为8 pmol,Taq(5 U/μl)0.1 μl,加入模板DNA约50 ng,剩下体积以无菌超纯水补足。PCR扩增程序为:94℃预变性5 min,94℃变性30 s,52℃退火30 s,72℃延伸1 min,共循环30次,最后在72℃延伸10 min。PCR产物用1%的琼脂糖凝胶电泳鉴定,在凝胶成像系统下检测并记录结果。PCR扩增产物按照大连宝生物公司的DNA凝胶回收试剂盒的具体操作进行割胶回收和纯化。
1.3.3 ITS区片段的连接、转化以及测序 使用DNA凝胶回收试剂盒纯化后的PCR扩增产物与pMD18-T-Vecter连接,形成目的片段与载体构成的环形质粒并采用热激法转化到Escherichia coli JM109感受态细胞,在选择性培养基上进行氨苄西林的筛选。从平板上选取3个阳性重组单克隆菌落,进行过夜摇菌后各取1 ml菌液由华大公司进行ITS区序列测定,每个样品均进行正反双向测序。
1.3.4 ITS序列比对分析以及系统发育树的构建 将测序得到的峰图采用Bioedit软件查看和校对,去除低质量序列后在NCBI上采用Blast进行比对分析,得到国际基因数据上与其同源的序列片段以及序列相似性程度。根据相似性程度初步确定药王山钩藤样品的基源。将得到的序列运用MEGA软件(Version 6.06)进行分子系统发育分析。通过最大简约法(maximum parsimony,MP)进行计算分析,建立药王山钩藤植物的最大简约树。用自展检验法(Boot-strap text)1000次检验MP上各分支的置信水平。
2 结果
2.1 钩藤总DNA的提取结果
药王山的钩藤样品总DNA经琼脂糖电泳后扫描拍照并记录结果,可见总DNA电泳图谱呈现一条清晰完整的主条带,没有明显降解(图1),说明改良的CTAB法可以有效提取药王山钩藤样品的基因组DNA。
2.2 药王山钩藤样品的ITS序列PCR扩增结果
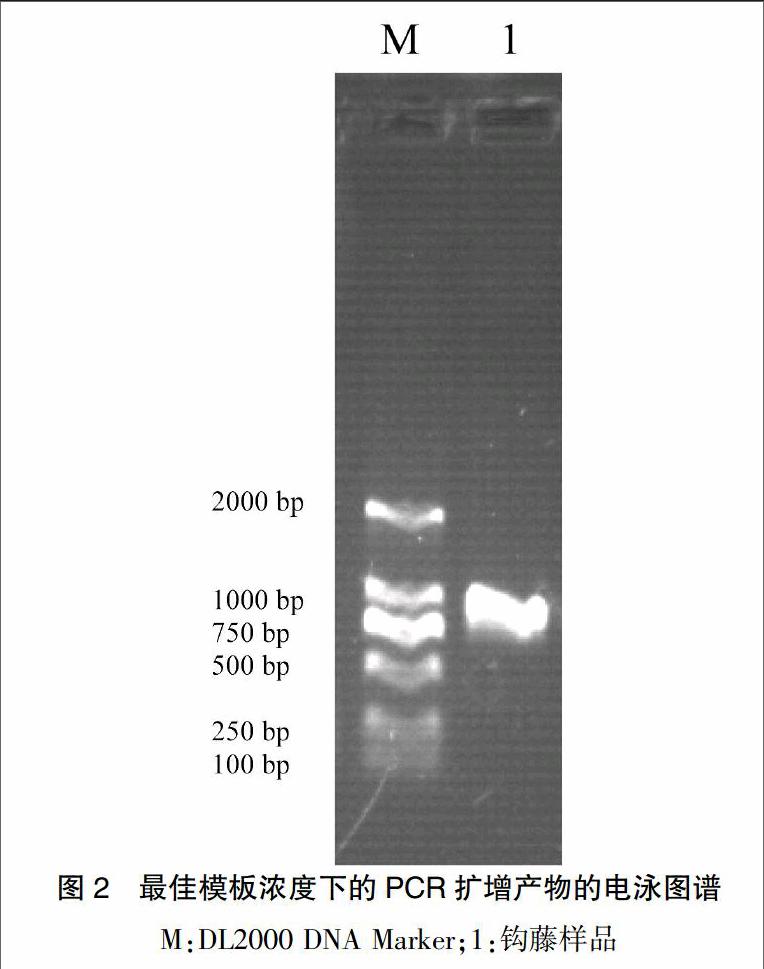
以提取的药王山钩藤样品的总DNA为模板,从模板原液开始分别稀释5个梯度浓度进行ITS区序列的PCR扩增。从PCR的扩增结果来看,模板DNA在1×102~1×103的稀释倍数时,PCR的扩增效果是最理想的。在模板浓度最佳的情况下,药王山钩藤样品的ITS区序列的PCR扩增产物的电泳图谱呈现清晰完整的条带,而且条带较亮,没有非特异扩增条带,大小在720 bp左右(图2),说明在最佳的模板浓度条件下能够有效扩增ITS区序列,钩藤基因组DNA中的抑制物对PCR的影响达到最小。
2.3 ITS序列分析
采用Bioedit软件查看和校对,可知测序得到的核糖体ITS区序列的长度为718 bp。为了获得与该序列亲缘关系相近的钩藤属其他种的序列,把测序得到的ITS序列与GenBank数据库中已有的ITS序列进行比较分析。应用Bioedit软件对DNA序列之间进行比较分析发现,该钩藤样品与GenBank数据库中已有的钩藤(Uncaria rhynchophylla,KF881265)的相似度最高,达到99.8%,故将该钩藤植物归类为钩藤[Uncaria rhynchophylla (Miq.)Miq.ex Havil.]。
2.4 分子系统发育分析
采用MEGA软件将测序得到的ITS序列与其亲缘关系相近的钩藤属的其他种的ITS序列进行序列比对后用MP计算和分析,并以Nauclea xanthoxylon(AJ346877)为外类群构建一棵药王山钩藤植物的系统发育树(图3),评估各物种之间的亲缘性。通过对14个物种ITS序列的简约性分析发现,发育树的枝长为107,一致性指数为0.739 130,保留指数为0.796 610,所有位点复合指数和简约性信息位点分别为0.707 271与0.588 799。
3 讨论
有文献表明,生物碱是钩藤的主要化学成分[16],而生物碱主要是以钩藤碱和异钩藤碱为主。钩藤生物碱的主要功效是抗血栓形成、抗惊厥作用、抗血小板聚集以及降血压等[17],但是对于钩藤的药效成分,钩藤属内不同种的钩藤中药材还是有明显的差别[18]。再者市场上销售的钩藤中药材种类比较混乱,仅靠形态学等传统的分析方法难以鉴别,经常出现以次充好的现象,严重影响了中药材用药的准确性和安全性。因此,有必要利用一种快速的、高灵敏的方法进一步鉴定钩藤属植物的种间关系。随着分子生物学的快速发展,应用DNA分子标记技术对药用植物进行鉴定已逐渐成为研究的热点[19-20]。而ITS序列作为DNA条形码的分析技术具有技术简单、结果准确、重复性好等优点,广泛应用于药用植物的鉴定。依靠ITS序列标记能够作为钩藤中药材种内和种间鉴别的有效分子标志,利用该方法的原理,对钩藤属中药材进行分子鉴定和遗传分析,有利于正本清源。
ITS序列的分析方法很好地弥补了中药材鉴定的传统分析方法(依据形态学、组织学和化学成分等)的不足,可以从分子遗传角度对钩藤等药用植物的种间分类地位以及种类鉴定提供分子生物学证据,从而增加中药材用药的准确性和安全性。本研究对采集自广州中医药大学药王山的一种钩藤植物进行基因组DNA提取,ITS区序列扩增,序列测定与分析,以及采用MP构建该钩藤样品在其近缘种之间的系统发育树,从树图可以看出,该钩藤样品与GenBank数据库中已有的钩藤(U.rhynchophylla,KF881265)聚类成为一枝,支持率达到84%;然后又与钩藤属其他种的常用钩藤植物,分别是华钩藤(U.sinensis,FJ980386)、毛钩藤(U.hirsute,GU937110)、北越钩藤(U.homomalla,KF881255)、白钩藤(U.sessilifructus,GU937111)以及攀茎钩藤(U.scandens,KF881275)聚类成一枝。由此可见,从分子生物学和遗传学的角度分析,该钩藤样品与GenBank数据库中钩藤(U.rhynchophylla,KF881265)的亲缘关系最近,并且与之序列的相似度高达99.8%,而与GenBank数据库中已有其他种常用钩藤植物的亲缘关系较远,并不直接与这些种的钩藤植物聚类成为一枝,所以从分子系统发育水平上支持了根据形态特征把该钩藤属中药材植物鉴定为钩藤[Uncaria rhynchophylla (Miq.)Miq.ex Havil.]的初步结果,表明基于rDNA ITS序列分析和构建系统发育树的分子生物学方法可以快速准确地对钩藤等药物植物进行分子鉴定和遗传分析。
[参考文献]
[1] 国家药典委员会.中国药典(一部)[M].北京:中国医药科技出版社,2015.
[2] Alvarez L,Wendel JF.Ribosomal ITS sequences and plant phylogenetic inference[J].Mol Phylogenet Evol,2003,29(3):417-434.
[3] Chen SL,Yao H,Han JP,et al.Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species [J].PLoS One,2010,5(1):e8613.
[4] Yao H,Song JY,Liu C,et al.Use of ITS2 Region as the universal DNA barcode for plants and animals [J].PLoS One,2010,5(10):e13102.
[5] Pang XH,Song JY,Zhu YJ,et al.Applying plant DNA barcodes for Rosaceae species identification[J].Cladistics,2011,27(2):165-170.
[6] Han JP,Liu C,Li MH,et al.Relationship between DNA barcoding and chemical classification of Salvia medicinal herbs [J].Chin Herb Med,2010,2(1):16-29.
[7] 陈贝贝,宋经元,姚辉,等.基于ITS2条形码的两面针药材及其混伪品的鉴别[J].中草药,2013,44(15):2150-2153.
[8] 李栎,肖憬,苏振宇,等.ITS2条形码序列对茜草科黎药植物的鉴定[J].中草药,2013,44(13):1814-1818.
[9] 叶子,卢叶,王峥涛,等.基于ITS序列鉴别石斛类药材[J].中国中药杂志,2014,39(20):3928-3935.
[10] 贺海波,熊超,郭力城,等.ITS2序列鉴定多基原药材老鹳草[J].中国药学杂志,2015,50(17):1505-1511.
[11] 吴波,李永波,饶建波,等.基于ITS2条形码的桔梗药材遗传多样性研究[J].中国中药杂志,2015,40(6): 1075-1078.
[12] 张文娟,康帅,魏锋,等.基于ITS序列分析鉴别冬虫夏草与古尼虫草[J].药物分析杂志,2015,35(9):1551-1555.
[13] Doyle JJ,Doyle JL.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochem Bull,1987,19(1):11.
[14] Innis MA,Gelf and DH,Sninsky JJ,et al.PCR Protocols:a guide to methods and applications[M].San Diego:Academic Press,Inc.CA.1990.
[15] Chou SJ,Yen JH,Fang CL,et al.Authentication of medicinal herbs using PCR-amplified ITS2 with spectific primers [J].Planta Med,2007,73(13):1421-1426.
[16] 宋欣濛,薛睿,季宇彬.钩藤中吲哚类生物碱化学成分及药理活性研究进展[J].亚太传统医药,2014,10(5):64-68.
[17] 王章姐,孙维矿.钩藤的化学成分及药理作用研究进展[J].现代企业教育,2010,(24):197-198.
[18] 许丹丹,莫志贤.钩藤与绒毛钩藤的化学成分及药理作用[J].中药新药与临床药理,2005,6(4):311-314.
[19] Gu W,Song J,Cao Y,et al.Application of the ITS2 region for barcoding medicinal plants of Selaginellaceae in pteridophyta [J].PLoS One,2013,8(6):e67818.
[20] Li DZ,Liu JQ,Chen ZD,et al.Plant DNA barcoding in China [J].J Syst Evol,2011,49(3):165-168.
(收稿日期:2015-12-16 本文编辑:卫 轲)
