褪黑素抑制磷酸钙诱导的大鼠主动脉血管平滑肌细胞凋亡
2016-06-30刘振华李步潆段维勋金振晓俞世强
刘振华,李步潆,段维勋,金振晓,俞世强
褪黑素抑制磷酸钙诱导的大鼠主动脉血管平滑肌细胞凋亡
刘振华,李步潆,段维勋,金振晓,俞世强
[摘要]:目的 观察褪黑素(Mel)对磷酸钙诱导的大鼠主动脉血管平滑肌细胞(SMCs)凋亡的影响。方法 组织贴块法原代培养的血管SMCs随机分为3组:对照组(PBS)、磷酸钙(CaPO4)组、磷酸钙+褪黑素(CaPO4+Mel)组,Mel又按浓度分为0.1 mmol/ L,0.5 mmol/ L,1 mmol/ L,2 mmol/ L四组。CCK8法测定细胞增殖变化,TUNEL检测细胞凋亡,Western blot印迹法测定凋亡相关蛋白caspase3、Bcl-2、Bax表达。结果 CCK8法检测显示褪黑素可以抑制CaPO4诱导的SMCs凋亡,促进其增殖,并具有时间和剂量依赖性。以1 mmol/ L作用6 h显著。褪黑素作用6 h后,TUNEL检测显示CaPO4诱导的SMCs凋亡明显减少(P<0.01),Western blot结果分析显示,与CaPO4组比较,caspase3表达明显下降,同时,Bcl-2蛋白表达上调,Bax蛋白表达下调(P<0.01)。结论 褪黑素可以抑制CaPO4诱导的SMCs凋亡,其机制可能与下调caspase3和Bax蛋白,上调Bcl-2蛋白表达有关。
[关键词]:褪黑素;平滑肌细胞;CaPO4诱导;细胞凋亡
作者单位:710032西安,第四军医大学西京医院心脏外科
主动脉瘤是一种病情相当凶险、死亡率较高的大血管疾病[1],近年来,随着检查手段和诊疗水平的提高,检出率逐年上升。但是,其发病机制还不是很清楚,基本病理生理是:中膜弹性蛋白退化、崩解,胶原溶解和主动脉壁中膜大量平滑肌细胞(smooth muscle cells,SMCs)凋亡。许多学者[2]为了研究主动脉瘤的发病机制和治疗方法,以氯化钙(CaCl2)诱导啮齿动物腹主动脉瘤模型,达到与人主动脉瘤类似的病理改变:主动脉钙化、炎症反应、氧化应激、新生血管形成、弹性蛋白降解和血管SMCs凋亡等。Yamanouchi D等[3]比较CaCl2和磷酸钙(CaPO4)诱导的SMCs模型,发现CaPO4诱导的SMCs模型更符合主动脉瘤发生时中膜SMCs的凋亡变化。褪黑素(melatonin,Mel)是松果体分泌的一种神经内分泌激素,化学名称为5-甲氧基-N-乙酰色胺,具有广泛的生物学活性,其中,它的抗炎、抗氧化、降血压、抑制血小板凝集和血中胆固醇合成等活性与心血管疾病密切相关[4],Mel的上述生物学活性可能对主动脉瘤的发生发展具有重要的作用。本文采用Ca⁃PO4诱导的SMCs凋亡模型,探讨Mel对主动脉瘤SMCs凋亡的影响。
1 材料与方法
1.1材料 清洁级SD大鼠,雄性,180~200 g,由第四军医大学动物中心提供,DMEM培养基(Hyclone公司),胎牛血清(Gibco公司),Mel(Sigma公司),称取Mel 0.0232 g,用1 ml无水乙醇完全溶解,再用0.22 μm过滤器过滤除菌,即配成0.1 mol/ L Mel母液。CaCl2(Sigma公司),CCK8检测试剂盒(同仁化学研究所,日本),原位缺口末端标记法(TUNEL)检测试剂盒(Roche公司),二氧化碳细胞培养箱(Thermo,美国),倒置相差显微镜(Nikon,日本),流式细胞仪(BD公司),RIPA裂解液(碧云天,上海)SDS-PAGE凝胶配制试剂盒(碧云天,北京),An⁃nexin V-FITC凋亡检测试剂盒(sigma公司),兔抗大鼠caspase3、兔抗大鼠Bcl-2、兔抗大鼠Bax抗体(abcam公司)。
1.2方法
1.2.1大鼠胸主动脉SMCs原代培养 SD大鼠脱颈处死后浸泡在75%酒精中5 min,在超净工作台上迅速分离胸主动脉,在含DMEM培养基的培养皿中仔细剥除血管外组织和外膜,更换眼科剪纵行剪开,用无菌棉签轻刮3~5遍,去除内膜,将血管中膜剪成1 mm×1 mm大小,再用吸管从培养皿中吸出小组织块贴于培养瓶底,加入适量(3~5滴)含10%胎牛血清的DMEM培养基,37℃,5%CO2湿润培养箱中孵育5 h,使组织块干涸并与瓶底黏附,轻轻翻转培养瓶,3 d换1次培养液,约1 w有细胞从组织块周边爬出。待细胞融合以后消化传代培养。
1.2.2CaPO4损伤大鼠胸主动脉SMCs模型建立和流式细胞仪检测 取上述原代培养的第5代SMCs,用无血清的DMEM培养24 h,SMCs随机分为两组:①对照组(PBS):n= 6,细胞用无菌PBS洗2遍,再加入适量PBS培养在37℃,5%CO2湿润培养箱中15 min,吸弃PBS,加入10%胎牛血清的DMEM培养基培养6 h;②CaPO4组:n= 6,细胞用无菌PBS洗2遍,加入用PBS稀释的CaCl2(称取55.49 mg CaCl2溶于100 ml PBS充分溶解后,用0.22 μm过滤器过滤除菌,即配成0.5 mol/ L CaPO4母液。再用无菌PBS稀释10倍,终浓度0.05 mol/ L)在37℃,5%CO2湿润培养箱中培养15 min,吸弃含CaCl2的PBS,用含10%胎牛血清的DMEM培养基洗2遍,加入适量含10%胎牛血清的DMEM培养基培养6 h,模型建立。之后用PBS洗涤2遍,0.25%胰酶消化后,收集各组细胞,加100 μl结合缓冲液(binding buffer)和异硫氰酸荧光素(FITC)标记的磷脂结合蛋白(An⁃nexin-V 20 mg/ L)10 μl,室温避光30 min,再加20 mg/ L PI 10 μl,避光反应5 min后,加入400 μl结合缓冲液,立即上机检测。
1.2.3不同浓度Mel对CaPO4损伤大鼠胸主动脉SMCs模型增殖能力的影响 选取对数生长期的SMCs,以4×104/孔接种于96孔板,每孔加入100 μl培养基,置于37℃,5%CO2湿润培养箱中培养至80%融合后进行实验,实验分三组,分别为①对照组(PBS):n=6。方法同1.2.2中的对照组,在培养6 h后再分别培养2 h、4 h、6 h、8 h;②CaPO4组:n = 6。方法与1.2.2中的CaPO4组相同,在培养6 h后再分别培养2 h、4 h、6 h、8 h;③CaPO4+Mel组:在1.2.2中的CaPO4组模型的基础上,再加入不同浓度的Mel(浓度分别为0.1 mmol/ L,0.5 mmol/ L,1 mmol/ L,2 mmol/ L,各组分别在37℃,5%CO2湿润培养箱中继续培养2 h、4 h、6 h、8 h。上述所有细胞培养结束后,吸弃培养基,PBS洗2遍,每孔加入CCK8溶液(与DMEM 1∶10稀释)100 μl,细胞培养箱继续孵育2 h,450 nm测定吸光度,以增殖率和药物浓度为纵横坐标绘制曲线。实验重复3次。
1.2.4Mel对CaPO4损伤大鼠胸主动脉SMCs凋亡的影响 选取对数生长期的SMCs,以1×105/孔接种于24孔板,行细胞爬片,实验分三组,分别为①对照组(PBS):n= 6。方法同1.2.2对照组模型建立,仅为培养12 h;②CaPO4组:n = 6。方法同CaPO4组的模型建立,培养时间为12 h;③CaPO4+Mel组:n= 6。按CaPO4组模型建立后,再加入Mel(浓度为1 mmol/ L)继续培养6 h。按TUNEL原位细胞凋亡检测试剂盒的说明书进行染色TUNEL染凋亡细胞核(绿色荧光),DAPI染整个细胞核(蓝色荧光)。每张爬片在凋亡区随机选取5个高倍视野,计数每个视野内凋亡细胞核数,计算SMCs凋亡率。
1.2.5Western blot检测凋亡相关蛋白caspase3、Bcl -2和Bax表达 选取对数生长期的SMCs,以6× 105/孔接种于6孔板,实验分组与各组细胞处理方法与1.2.4部分相同,处理完毕后收集细胞,加入预冷的RIPA裂解液,于冰上充分溶解,提取细胞蛋白,加入样本缓冲液后在沸水中煮7 min,进行聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳结束后,将凝胶中的蛋白转移到聚氟乙烯膜上,在5%的脱脂牛奶(1×TBST配置)中封闭2 h。分别使用加入1∶500兔抗caspase3抗体、1∶500兔抗Bcl-2抗体、1∶500兔抗Bax抗体和鼠抗GAPDH抗体,4℃孵育过夜后,TBST洗3遍,每遍10 min,加入辣根过氧化物酶标记二抗,室温下结合2 h;TBST洗3遍,每遍10 min,标准ECL法底物发光并显影,检测caspase3、Bcl-2、Bax蛋白表达。
2 结果
2.1CaPO4可以诱导主动脉血管SMCs凋亡 原代培养的主动脉血管SMCs经过CaPO4处理15 min,再培养6 h后,用流式细胞术检测SMCs凋亡,结果(如图1),右上象限为早期凋亡,右下象限为晚期凋亡。对照组细胞早期凋亡率为(0.3±0.5)%,晚期凋亡率为(1.4±2.1)%,CaPO4处理组细胞早期凋亡率为(17.8±1.6)%,晚期凋亡率为(9.7±2.4)%,两者之间细胞总凋亡率具有统计学差异(P<0.01)。
2.2Mel可以抑制CaPO4诱导的主动脉血管SMCs凋亡 按照实验分组,不同浓度的Mel分别作用于CaPO4诱导的SMCs凋亡模型后2 h、4 h、6 h、8 h,CCK8结果显示(如图2),Mel对CaPO4诱导的主动脉血管SMCs凋亡具有抑制作用,但是具有时间和剂量的依赖性,以1 mmol/ L作用6 h效果最为明显,具有统计学意义(P<0.05)。后面的实验研究采用1 mmol/ L的Mel进行。

图1 CaPO4诱导SMCs凋亡
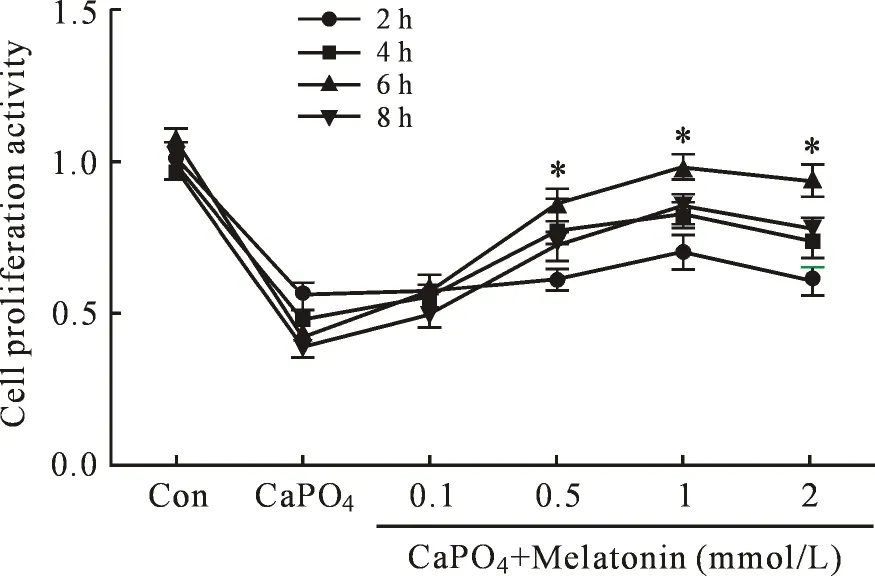
图2 不同浓度Mel对CaPO4诱导的SMCs增殖的影响
2.3Mel对SMCs凋亡率的影响 细胞爬片后,按实验分组,CaPO4+Mel素组(Mel以1 mmol/ L浓度作用6 h),TUNEL检测各组SMCs凋亡率显示(如图3),与对照组比较,CaPO4组SMCs凋亡率明显增加(P<0.01),与CaPO4组比较,CaPO4+ Mel组SMCs凋亡率明显减少(P<0.01)。
2.4Mel对SMCs上凋亡相关蛋白caspase3、Bcl-2 和Bax表达的影响 按实验分组,CaPO4+Mel组(Mel以1 mmol/ L浓度作用6 h),提取细胞蛋白,Western blot检测显示(如图4),与对照组比较,Ca⁃PO4组SMCs上凋亡相关蛋白caspase3、Bax表达明显增加,Bcl-2表达明显减少(P<0.01);与CaPO4组比较,CaPO4+ Mel组SMCs凋亡相关蛋白caspase3、Bax表达明显减少,Bcl-2表达明显增加(P<0.01)。
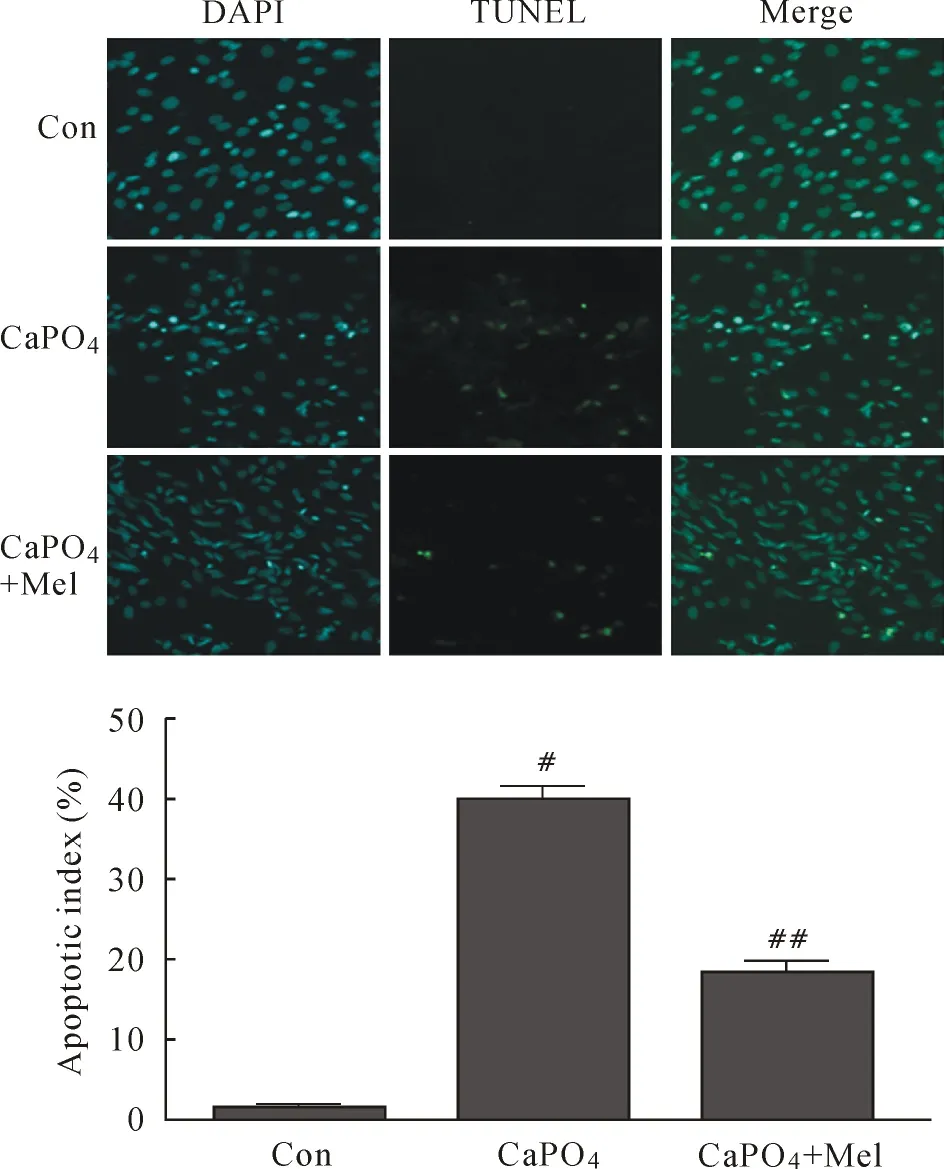
图3 各组SMCs凋亡率的比较
3 讨论
主动脉瘤中膜SMCs凋亡是主动脉瘤发生的一个重要病理生理基础,对于研究主动脉瘤的发生具有重要意义。许多学者为了研究主动脉瘤的发病机制和治疗方法,采用CaCl2诱导啮齿动物腹主动脉瘤模型,达到了与人主动脉瘤类似的病理改变。Ya⁃manouchi D等[3]报道,CaPO4诱导啮齿动物腹主动脉瘤模型效果优于CaCl2,诱导的主动脉瘤直径更大,弹力纤维断裂更彻底,中膜SMCs凋亡更多,引起上述变化的主要原因可能是CaPO4晶体的形成。与Ewence AE等[5]报道的磷酸钙晶体可以诱导人血管SMCs死亡结果相一致。本研究同样采用CaCl2和PBS混合产生CaPO4晶体,达到了诱导SMCs凋亡的效果。
Mel是一种松果体分泌的吲哚类神经内分泌激素,在生物钟、生殖、免疫、消化、中枢神经系统、抗氧化以及抗肿瘤方面具有广泛的生物学活性,在催眠、抗衰老、抗肿瘤和抗心血管疾病方面已经应用[6],高血压和动脉粥样硬化是主动脉瘤发生的两个主要危险因素,Mel在高血压和动脉粥样硬化发生发展中具有重要的保护作用[7-10],Shi DB等[11]研究发现,Mel可以抑制脂多糖(LPS)诱导的SMCs的炎症反应。
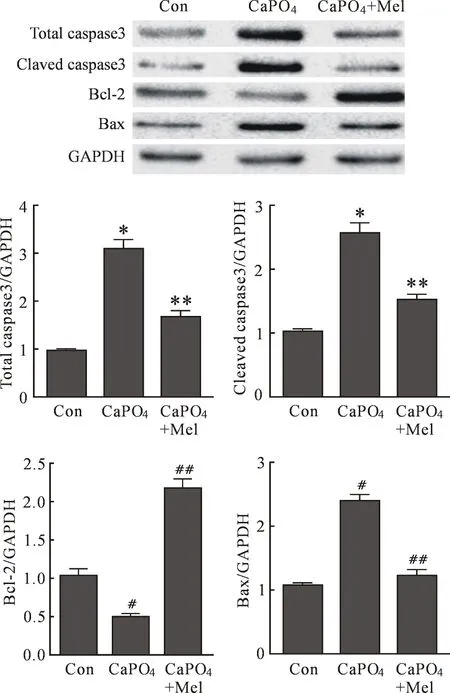
图4 Mel对各组SMCs凋亡相关蛋白caspase3、Bax和Bcl-2的影响
本研究通过观察Mel对CaPO4诱导主动脉血管SMCs的凋亡的影响,发现Mel可以抑制SMCs的凋亡,且具有时间和剂量的依赖性。通过检测SMCs上凋亡相关蛋白caspase3、Bcl-2和Bax表达,证实Mel作用后,上调Bcl-2表达,下调caspase3、Bax表达,从而达到抑制SMCs凋亡的效果。本研究仅仅是发现Mel可以抑制CaPO4诱导主动脉血管SMCs的凋亡,其具体机制还需要深入研究。Mel是否对主动脉瘤的发生发展有影响,还需要进一步进行动物模型和临床研究。
参考文献:
[1]景华.胸主动脉瘤的外科治疗进展[J].中国体外循环杂志,2006,4(4):241-244.
[2]Wang Y,Krishna S,Golledge J.The calcium chloride-induced rodent model of abdominal aortic aneurysm[J].Atherosclerosis,2013,226(1):29-39.
[3]Yamanouchi D,Morgan S,Stair C,et al.Accelerated aneurys⁃mal dilation associated with apoptosis and inflammation in a newly developed calcium phosphate rodent abdominal aortic aneurysm model[J].J Vasc Surg,2012,56(2):455-461.
[4]Dominguez-Rodriguez A,Abreu-Gonzalez P,Sanchez-Sanchez JJ,et al.Melatonin and circadian biology in human cardiovascu⁃lar disease[J].J Pineal Res,2010,49(1):14-22.
[5]Ewence AE,Bootman M,Roderick HL,et al.Calcium phos⁃phate crystals induce cell death in human vascular smooth muscle cells:a potential mechanism in atherosclerotic plaque destabiliza⁃tion[J].Circ Res,2008,103(5):e28-34.
[6]肖建辉,刘作易,粱宗琦.褪黑激素的研究开发现状[J].生命的化学,2001,21(1):69-70.
[7]Benova T,Viczenczova C,Radosinska J,et al.Melatonin attenu⁃ates hypertension-related proarrhythmic myocardial maladaptation of connexin-43 and propensity of the heart to lethal arrhythmias [J].Can J Physiol Pharmacol,2013,91(8):633-639.
[8]Hung MW,Kravtsov GM,Lau CF,et al.Melatonin ameliorates endothelial dysfunction,vascular inflammation,and systemic hy⁃pertension in rats with chronic intermittent hypoxia[J].J Pineal Res,2013,55(3):247-256.
[9]Hu ZP,Fang XL,Fang N,et al.Melatonin ameliorates vascular endothelial dysfunction,inflammation,and atherosclerosis by suppressing the TLR4/ NF-kβsystem in highfat-fed rabbits[J].J Pineal Res,2013,55(4):388-398.
[10]Favero G,Rodella LF,Reiter RJ,et al.Melatonin and its ather⁃oprotective effects:a review[J].Mol Cell Endocrinol,2014,382(2):926-937.
[11]Shi D,Xiao X,Wang J,et al.Melatonin suppresses proinflam⁃matory mediators in lipopolysaccharide-stimulated CRL1999 cells via targeting MAPK,NF-kβ,c/ EBPβ,and p300 signaling[J].J Pineal Res,2012,53(2):154-165.
Melatonin inhibits apoptosis of rat aortic vascular smooth muscle cells induced by CaPO4
Liu Zhen-hua,Li Bu-ying,Yu Li-ming,Duan Wei-xun,Jin Zhen-xiao,Yu Shi-qiang
Department of Cardiovascular Surgery,Xijing Hospital,the Fourth Military University,Shaanxi Xi'an 710032,China Corresponding author:Yu Shi-qiang,Email:E-mail:shiqiangyu210@126.com
[Abstract]:Objective To investigate the effect of melatonin(Mel)on apoptosis of rat aortic vascular smooth muscle cells in⁃duced by CaPO4.Methods VSMCs were primarily cultured by tissue-sticking method and randomly divided into 3 groups:control group,CaPO4group and CaPO4+Mel group.According to the concentration of Mel,the CaPO4+Mel groups were divided into 0.1 mmol/ L,0.5 mmol/ L,1 mmol/ L,2 mmol/ L four groups.SMCs proliferation was determined by CCK8.Cells apoptosis were detected by TUNEL.The expressions of caspase 3、Bcl-2 and Bax protein were investigated by Western blot.Results CCK8 method showed that Mel could inhibit SMCs apoptosis induced by CaPO4 and promoted SMCs proliferation,dependentof time and dose.Treatment with 1mmol/ L Mel for 6h had the most significant inhibitive effect.After SMCs were treated with 1mmol/ L Mel for 6h,TUNEL demonstrated that the apoptosis rate of the SMCs significantly decreased(P<0.01).Western blot demonstrated caspase3 expression significantly de⁃creased and Bcl-2 expression was up-regulated and Bax expression was down-regulated to compare to CaPO4group(P<0.01).Con⁃clusion Mel can inhibit SMCs apoptosis induced by CaPO4,Its mechanisms may be relate to down-regulated the caspase3 and Bax protein expression and up-regulated the Bcl-2 protein expression.
[Key words]:Mel;Smooth muscle cells;CaPO4induced;Cell apoptosis
DOI:10.13498/ j.cnki.chin.j.ecc.2016.02.13
基金项目:“十二五”国家科技支撑计划(2011BAI11B20);国家自然科学基金(81570231,81570230,81570232,81470415,81270170,81200151,81470411);陕西省国际科技合作与交流计划项目(2015KW - 047);陕西省社会发展公关计划(2015SF104);陕西省科技统筹创新工程计划项目(2013KTCL03-01);陕西省自然科学基金(2014JM4106);西京医院学科助推计划(XJZT14203,XJGX13LC15,XJGX12C11)
通讯作者:俞世强,E-mail:shiqiangyu210@126.com
收稿日期:(2016⁃02⁃29)
修订日期:(2016⁃03⁃10)
