新型无血预充大鼠深低温停循环模型的建立
2016-06-30曾庆东李勇男周玉姣孙燕华刘铭月吉冰洋
曾庆东,李勇男,周玉姣,孙燕华,刘铭月,刘 刚,吉冰洋
新型无血预充大鼠深低温停循环模型的建立
曾庆东,李勇男,周玉姣,孙燕华,刘铭月,刘 刚,吉冰洋
[摘要]:目的 在于建立温度可控的大鼠深低温停循环(DHCA)模型,为研究DHCA相关器官损伤及保护机制奠定基础。方法 共15只SD雄性大鼠,分为两组:DHCA组(18℃~20℃,n=8),常温体外循环组(n=7)。七氟烷诱导麻醉,颈静脉置入自制多孔静脉引流管为静脉引流端,左侧股动脉体表分支24 G套管针穿刺监测血压,鼠尾动脉20 G套管针穿刺为动脉灌注端。DHCA组体外循环开始后常温维持5 min后开始降温,30 min降至目标温度后停循环30 min,复温30 min至35℃以上停机,停机后呼吸机维持20 min。常温体外循环组大鼠维持常温体外循环。各组均分别于术前,术中15 min,复温后20 min,停机前,术后48 h,术后14 d,术后30 d七个时间点抽取血气分析,记录各时间点血气值,并于术中实时监测记录动脉压及心率。结果 DHCA组有1只大鼠死亡,其余14只大鼠均顺利完成实验过程,并于术后30 d麻醉状态下处死取材。术中血糖随时间的推延逐渐上升,且在复温至停机期间DHCA组升高较常温体外循环组更明显(P<0.05)。术中及术后两组乳酸水平均明显上升,且在停循环后DHCA组较常温体外循环组上升更为明显(P<0.05),术后15 d时两组乳酸水平均明显回落。结论 本实验成功采用将大鼠全身血液引出的方法,诱导心脏停跳,模型温度及麻醉深度精确可控,成功建立了DHCA模型,成功率高,术后存活率高,简便易行,可用于研究DHCA对大脑及其他脏器的影响,同时使DHCA后对大鼠神经功能评价的研究成为可能。
[关键词]:大鼠;深低温停循环;体外循环;动物模型
作者单位:100037北京,北京市中国医学科学院,北京协和医学院,国家心血管病中心,阜外医院,心血管疾病国家重点实验室,体外循环中心(曾庆东、李勇男、周玉姣、孙燕华、刘铭月、刘 刚、吉冰洋);730000兰州,兰州大学第二临床医学院兰州大学第二医院(李勇男)
深低温停循环(Deep hypothermic circulatory ar⁃rest,DHCA)技术的应用已有60多年的历史,目前常用于成人大血管外科以及部分小儿复杂先天性心脏病的畸形矫治,在临床上发挥着重要作用,然而DHCA技术可引起诸多并发症,尤其是神经系统并发症,长久以来困扰着临床工作者。
目前针对DHCA的实验研究,仍然缺乏一个成熟的动物模型。传统的大动物模型费用昂贵,需要耗费较大的人力物力,不适合大样本实验的开展。近年来,各种国内外针对DHCA研究的动物模型层出不穷[1-2],而大鼠因其价格低廉,与人类相似的心血管系统解剖以及丰富的蛋白、基因水平的检测手段等优点更加受到广大学者的青睐[3]。尽管目前针对大鼠体外循环模型及DHCA模型的报道较多,但在插管方式,设备的选用,麻醉方式以及温度的控制等方面都存在争议。笔者在对近年来国内外大鼠DHCA模型建立的相关经验进行总结后,对之前成功建立的大鼠体外循环模型进行改进[1,4],建立了大鼠DHCA模型,同时就模型建立中的一些关键问题展开讨论。
1 资料与方法
1.1实验动物与分组 本实验经由中国医学科学院阜外医院动物实验伦理委员会批准(2014-5-30-GZR)。选取成年健康雄性SD大鼠15只,体重400 ~480 g(由本院动物中心提供),随机分为2组:DH⁃CA组(18~20℃,n=8);常温体外循环组(n=7)。
1.2麻醉及术前准备 随机选取实验大鼠,术前禁食水6 h。称重后七氟烷吸入诱导麻醉,四肢固定于操作台,16 G麻醉套管针(美国Becton Dickinson公司)经口气管内插管,接小动物呼吸机(美国Har⁃vard Apparatus)行机械通气,吸入100%纯氧混合3%七氟烷维持麻醉,DHCA期间停止机械通气,停循环结束后恢复机械通气,呼吸频率初始设定为60~70次/ min,潮气量8~10 ml/ kg,根据动脉血气值进行调节。电子温度计经石蜡油润滑后置于肛门内5 cm监测体温。
1.3外科准备 手术部位备皮、消毒,在外科显微镜下(Carl Zeiss Jena,Oberkochen)进行三根血管游离及穿刺置管:左侧股动脉体表分支、尾动脉、右侧颈静脉。左侧股动脉体表分支24 G套管针(美国Becton Dickinson公司)穿刺置管后,经其给予250 IU/ ml肝素0.5 ml,连接多导生理监护仪(新西兰,Powerlab)行持续血流动力学监测;20 G套管穿刺针(美国Becton Dickinson公司)穿刺置入尾动脉,接体外循环动脉灌注端;精细外科剪刀剪开颈静脉,在动脉鞘管导丝引导下,经切口送入自制静脉引流管(长50 cm,外径2.0 mm,内径1.6 mm尖端带有侧孔硅胶管),尖端至下腔静脉入右心房水平。所有置管血管远心端丝线结扎,近心端丝线固定置管,防止滑脱。
1.4体外循环管路及设备 体外循环系统组成(如图1)包括:大鼠体外循环配套回流室及管路(东莞科威医疗用品公司);特制动物膜肺(东莞科威医疗用品公司,预充<4 ml);双泵头滚压泵(德国Stock⁃ert公司);小动物体外循环变温器(西安西京医疗用品公司,预充<3 ml);变温水箱(Jostra HCU20 -600)。回流室距大鼠心脏的高度约为35 cm。体外循环管道预充排气,采用无血预充,预充液组成为:13 ml 6%羟乙基淀粉(HES)130/0.4,1 ml肝素(150 IU/ ml),维持回流室3 ml初始液面高度。
1.5转流过程 所有靶血管置管完毕后,将静脉引流管置于回流室,开始静脉引流,体外循环开始,根据引流速度调整合适泵速,维持回流室液面平衡,膜肺中以纯氧和二氧化碳混合气体进行氧合,二氧化碳流量的大小根据实际血气值进行调节,尽可能维持pH值和二氧化碳分压(PCO2)的相对稳定。实验过程中实时监测记录动脉压及心率,若出现血压明显下降,则予以少量去甲肾上腺素持续泵入维持血压。转中流量达到100~150 ml/(kg·min)。
整体转流过程共分为6个阶段:①常温体外循环阶段,维持5 min;②降温阶段,大鼠体温利用变温水箱降至目标温度18~20℃,降温时间限定为30 min;③停循环阶段,降温完毕后停机,静脉端继续引流,直至血压为零且成一条直线时,夹闭静脉端,停循环维持30 min,期间给予体表均匀孵碎冰维持温度;④复温阶段:静脉引流打开,开始体外循环,待心脏复跳后开始变温水箱复温,水温与大鼠体温之间温差不超过8℃直至温度达到35℃以上,复温阶段为30 min;⑤停机阶段:体温达到目标温度后缓慢还血停机,所有实验大鼠均无需鱼精蛋白中和;⑥麻醉苏醒阶段:呼吸机维持20 min,缝合伤口,待大鼠苏醒后拔管,保暖,分笼饲养。
1.6实验数据采集 各组均分别于术前,术中15 min,复温后20 min,停机前,术后48 h,术后14 d,术后30 d七个时间点抽取血气分析,记录各时间点血气值,并于术中实时监测记录动脉压及心率。
1.7统计处理 应用SPSS 17.0软件进行处理和统计分析,对术中各时间点血气分析的组间差异采用t检验方法进行分析,数据用均数±标准差(±s)表示,当组间方差不齐(P<0.1)时,应用校正t检验,P<0.05表明组间存在统计学差异。
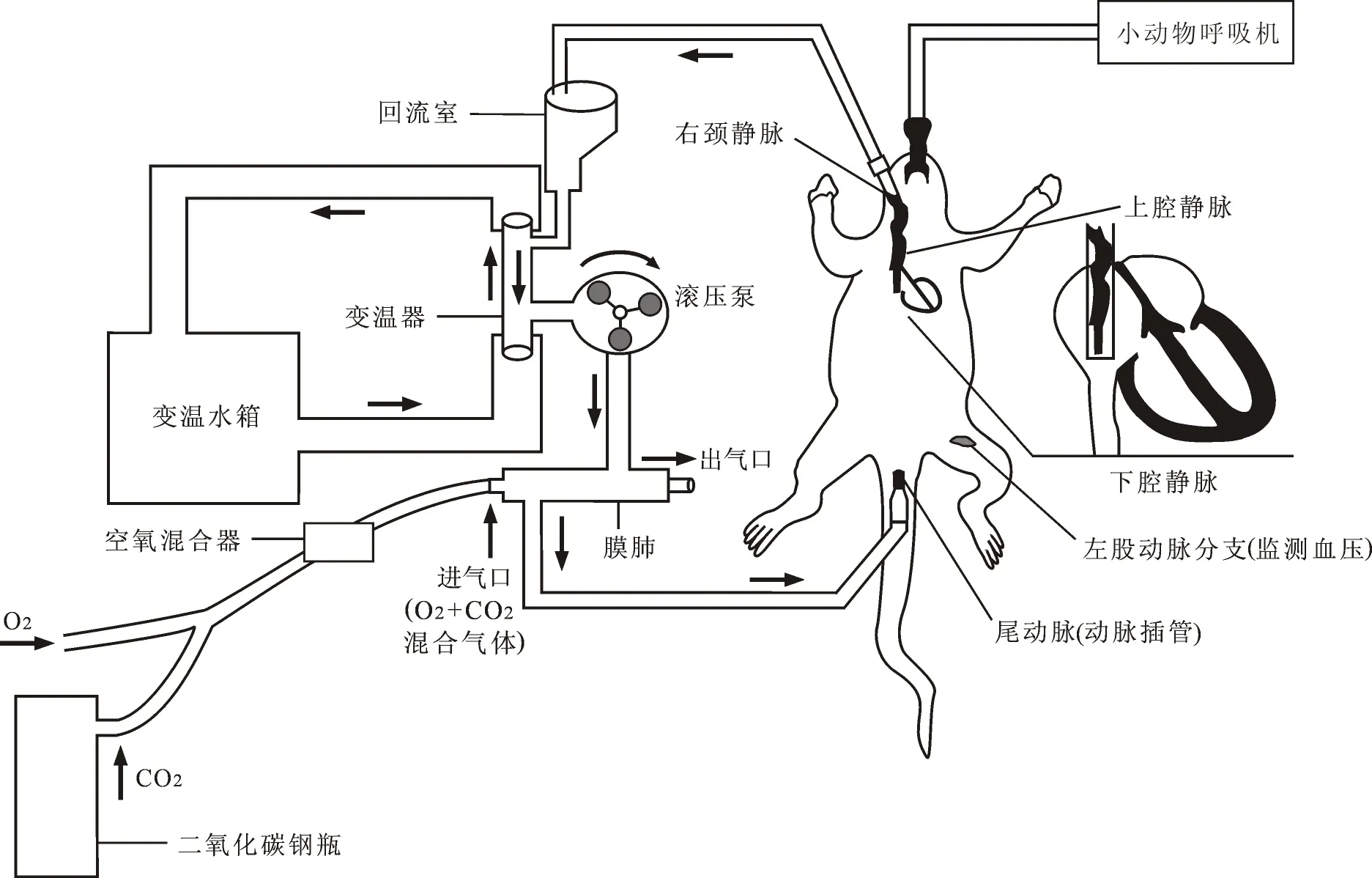
图1 大鼠体外循环模型示意图
2 结果
DHCA组中1只大鼠因静脉引流不畅,流量过低,术后麻醉未苏醒状态直接死亡,未计入统计。其余14只大鼠均于术后成功苏醒,并分笼饲养30 d。两组大鼠基本资料及血流动力学与血气分析数据见表1和表2。转中流量达到100~150 ml/(kg·min)。
表1为两组大鼠体重及血流动力学数据的比较,两组大鼠体重无统计学差异。降温前各组平均动脉压(MAP)无明显差异,降温复温期间,DHCA组低于常温体外循环组(P<0.05)。温度对心率的影响较大,复温期间DHCA组比较于常温体外循环组有所减慢(P<0.05),其他时间点组间未见有明显统计学差异。
表2为两组大鼠动脉血气分析数值,从数据中可以看出,体外循环开始后,血液稀释导致红细胞比容(Hct)下降至0.20左右,于术后30 d时恢复至正常范围内。术中血糖随时间的推延逐渐上升,且在复温至停机期间DHCA组升高较常温体外循环组更明显(P<0.05)这可能与体外循环带来的应激反应有关。术中及术后两组乳酸水平均明显上升,且在停循环后DHCA组较常温体外循环组上升更为明显(P<0.05),术后15 d时两组乳酸水平均明显回落。其他数值均可维持在正常范围。
3 讨论
神经系统功能障碍是患者DHCA术后最常见的并发症之一,有数据表明,DHCA术后,短暂的神经功能障碍发生率为5.8%~28.1%,而不可逆的神经功能损伤达到1.8%~13.6%[5]。建立简便易行的大鼠模型对DHCA过程进行研究一直是研究人员关注的热点。近年来,国内外均有建立大鼠DHCA模型的报道,本课题组此前已经成功建立不同温度下大鼠DHCA模型,模拟不同温度下临床停循环过程,但是该模型中仅少部分实验大鼠术后成功存活,基于此模型研究DHCA对大鼠神经系统及其他器官损伤时只能术毕取材,存在一定局限性。因此,本课题组基于之前已建立的无血预充大鼠体外循环模型及国内外已发表的对大鼠DHCA模型报道,进行了一定程度的改进,并取得了良好的效果,保证了DHCA后大鼠存活率,使DHCA术后评价大鼠神经系统功能与不同时间器官损伤的研究成为可能。
3.1模型建立方法
3.1.1采用新型自制静脉引流管并调整静脉插管位置 目前各类文献中所用的静脉引流管大致有两种,一种是多孔套管[6],另一种为16 G的麻醉套管针[7]。然而,大鼠静脉壁较薄,套管针管壁较硬,存在穿破静脉壁的风险,从而导致实验的失败。之前试验中,笔者观察到静脉引流量并不稳定,当引流不足时严重限制体外循环流量,造成灌注不足,降温复温缓慢,停循环时无法完全引空心脏内血液等问题。因此增加了原有静脉引流管侧孔数量及长度,并调整静脉插管位置至下腔静脉入右心房水平,该做法明显改善了引流量同时使得静脉引流变得更加稳定,保证了体外循环灌注流量同时提高了降温复温速率,提高了实验的成功率。
表1 体重及血流动力学数据的比较(n=7,±s)
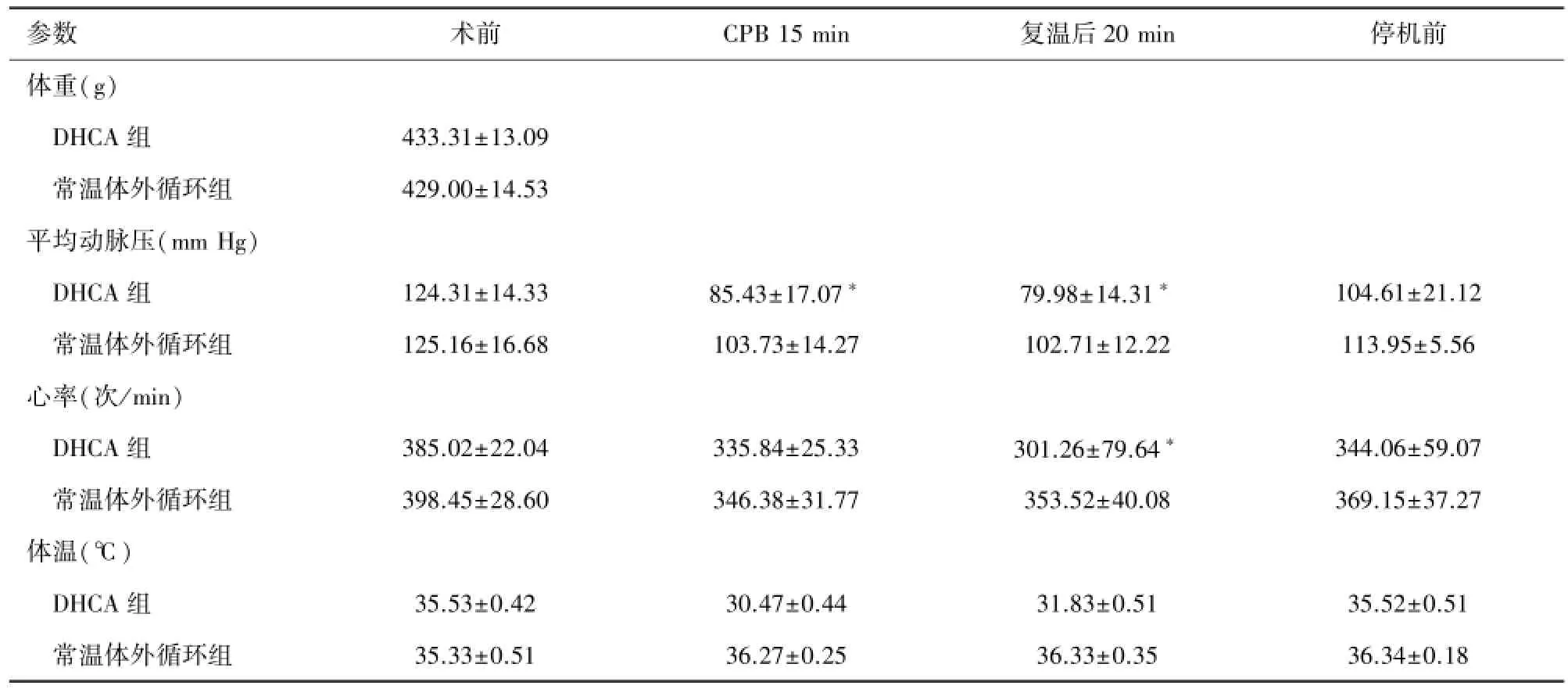
表1 体重及血流动力学数据的比较(n=7,±s)
参数 术前 CPB 15 min 复温后20 min 停机前体重(g)DHCA组 433.31±13.09常温体外循环组 429.00±14.53平均动脉压(mm Hg)DHCA组 124.31±14.33 85.43±17.07∗ 79.98±14.31∗ 104.61±21.12常温体外循环组 125.16±16.68 103.73±14.27 102.71±12.22 113.95±5.56心率(次/ min)DHCA组 385.02±22.04 335.84±25.33 301.26±79.64∗ 344.06±59.07常温体外循环组 398.45±28.60 346.38±31.77 353.52±40.08 369.15±37.27体温(℃)DHCA组 35.53±0.42 30.47±0.44 31.83±0.51 35.52±0.51常温体外循环组 35.33±0.51 36.27±0.25 36.33±0.35 36.34±0.18
表2 各时间点血气分析指标分析比较(n=7,±s)
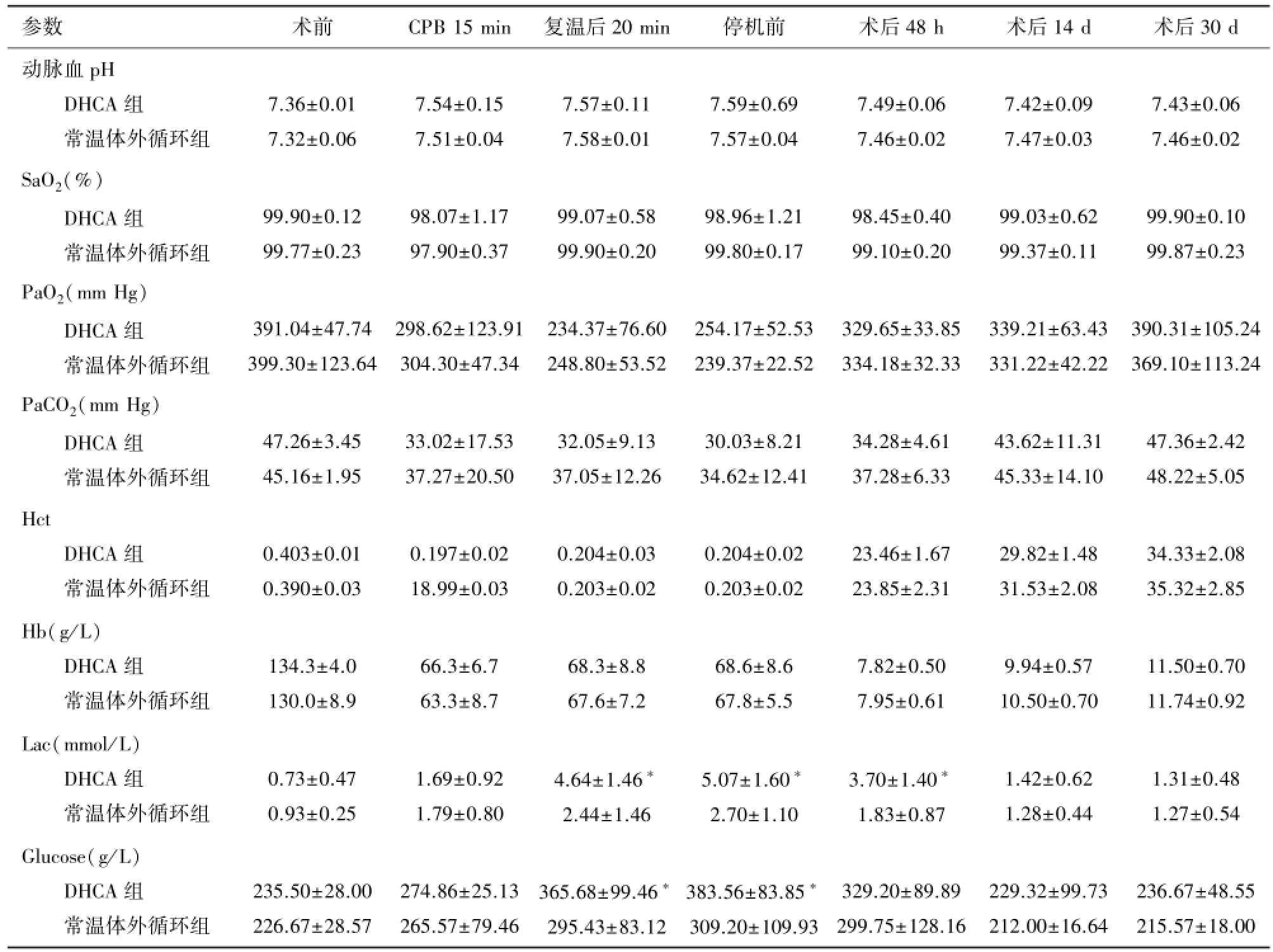
表2 各时间点血气分析指标分析比较(n=7,±s)
注:SaO2:动脉氧饱和度;PaO2:动脉血氧分压;PaCO2:动脉血二氧化碳分压;Hb:血红蛋白;Lac:乳酸;Glucose:血糖;∗P<0.05。
参数 术前 CPB 15 min 复温后20 min 停机前 术后48 h 术后14 d 术后30 d动脉血pH DHCA组常温体外循环组7.36±0.01 7.32±0.06 7.54±0.15 7.51±0.04 7.57±0.11 7.58±0.01 SaO2(%)DHCA组常温体外循环组99.90±0.12 99.77±0.23 98.07±1.17 97.90±0.37 7.59±0.69 7.57±0.04 7.49±0.06 7.46±0.02 7.42±0.09 7.47±0.03 7.43±0.06 7.46±0.02 99.07±0.58 99.90±0.20 PaO2(mm Hg)DHCA组常温体外循环组391.04±47.74 399.30±123.64 298.62±123.91 304.30±47.34 98.96±1.21 99.80±0.17 98.45±0.40 99.10±0.20 99.03±0.62 99.37±0.11 99.90±0.10 99.87±0.23 234.37±76.60 248.80±53.52 PaCO2(mm Hg)DHCA组常温体外循环组47.26±3.45 45.16±1.95 33.02±17.53 37.27±20.50 254.17±52.53 239.37±22.52 329.65±33.85 334.18±32.33 339.21±63.43 331.22±42.22 390.31±105.24 369.10±113.24 32.05±9.13 37.05±12.26 Hct DHCA组常温体外循环组0.403±0.01 0.390±0.03 0.197±0.02 18.99±0.03 30.03±8.21 34.62±12.41 34.28±4.61 37.28±6.33 43.62±11.31 45.33±14.10 47.36±2.42 48.22±5.05 0.204±0.03 0.203±0.02 Hb(g/ L)DHCA组常温体外循环组134.3±4.0 130.0±8.9 66.3±6.7 63.3±8.7 0.204±0.02 0.203±0.02 23.46±1.67 23.85±2.31 29.82±1.48 31.53±2.08 34.33±2.08 35.32±2.85 68.3±8.8 67.6±7.2 Lac(mmol/ L)DHCA组常温体外循环组0.73±0.47 0.93±0.25 1.69±0.92 1.79±0.80 68.6±8.6 67.8±5.5 7.82±0.50 7.95±0.61 9.94±0.57 10.50±0.70 11.50±0.70 11.74±0.92 4.64±1.46∗2.44±1.46 Glucose(g/ L)DHCA组常温体外循环组235.50±28.00 226.67±28.57 274.86±25.13 265.57±79.46 5.07±1.60∗2.70±1.10 3.70±1.40∗1.83±0.87 1.42±0.62 1.28±0.44 1.31±0.48 1.27±0.54 365.68±99.46∗295.43±83.12 383.56±83.85∗309.20±109.93 329.20±89.89 299.75±128.16 229.32±99.73 212.00±16.64 236.67±48.55 215.57±18.00
3.1.2 采用股动脉体表分支穿刺置管监测大鼠血流动力学变化 目前文献报道动脉血压监测均采用股动脉插管方式[8],股动脉位置表浅且相对粗大,易于分离并置管,但是同时存在以下缺点:①股动脉血液含量丰富,穿刺时失血较多;②由于分离股动脉切口过大及结扎远端血管等因素影响大鼠术后活动,无法进行术后神经功能评价方面研究。因此,本研究经过多次试验,选择在左侧股动脉体表分支置管监测大鼠血流动力学变化,该方法避免了以上缺点。但该方法穿刺难度较大,需多次练习后才能熟练掌握。
3.1.3温度调控方式目前大多文献中报道的降温复温方式各不相同,然而大部分实验均存在温度控制不精确、效率不高等缺点。笔者在实验中应用临床变温水箱,并在体外循环管路中加装变温器(预充<3 ml),结合变温毯,取得了较好的效果。一方面增加的预充液量并不会对实验产生较大的影响,另一方面可以模拟临床精确的控制大鼠体温,使实验模型更加贴近临床,可以对术中的体温进行随意调节,并且可以保证升降温的时间。
3.2实验结果分析 实验中DHCA组1只大鼠死亡,该大鼠转流过程中显著存在静脉引流量不足,灌注流量低的特点。术毕对死亡大鼠进行解剖,发现静脉插管尖端位于上腔静脉入右心房水平,这可能是静脉引流不足的重要原因。这一现象也从反面证明了静脉插管应该更深的重要性。其余大鼠均于术后苏醒,并成功存活30 d,术后存活过程中大鼠饮食及运动正常。
从数据结果来看,相较于常温体外循环组,30 min的停循环过程造成了DHCA组大鼠体内大量无氧代谢产物乳酸的堆积。术中血糖随时间的推延逐渐上升,且在复温至停机期间DHCA组升高较常温体外循环组更明显(P<0.05)这与可能体外循环带来的应激反应有关。
3.3实验中存在的不足 本模型的建立采用血管的穿刺插管,在静脉引流方面可能难以实现全流量引流,且与临床体外循环插管方式有较大区别,有文献报道采用开胸的方式进行体外循环建立,最大程度上模拟了临床的过程[9],但是由于对大鼠的损伤较大,不利于大鼠的长期存活。本模型的停循环方式是采用低温加心肌缺血的方式使心脏完全停跳,和临床上停搏液灌注的方式仍存有不同,可能不适合心肌研究的相关实验,如何更好的让模型的建立过程与临床手术吻合,将是一个值得探讨的话题。
4 结论
本实验成功采用将大鼠全身血液引出的方法,诱导心脏停跳,模型温度及麻醉深度精确可控,成功建立了DHCA模型,成功率高,术后存活率高,整体实验过程安全可行,可用于研究DHCA对大脑及其他脏器的影响,同时使DHCA后对大鼠神经功能评价的研究成为可能。对于以后研究不同温度以及其他干预因素下DHCA对各脏器的影响有着积极的意义。
参考文献:
[1]Jungwirth B,Mackensen GB,Blobner M,et al.Neurologic out⁃come after cardiopulmonary bypass with deep hypothermic circula⁃tory arrest in rats:descriptionof a new model[J].J Thorac Card⁃iovasc Surg,2006,131(4):805-812.
[2]Zhu X1,Ji B,Liu J,et al.Establishment of a novel rat model without blood priming during normothermic cardiopulmonary bypass [J].Perfusion,2014,29(1):63-69.
[3]Proctor E.An oxygenator for cardiopulmonary bypass in the rat [J].J Surg Res,1977,22(2):124-127.
[4]朱贤,陆龙,赵向东,等.不同温度大鼠无血预充深低温停循环模型的建立[J].中国体外循环杂志,2013,11(2):110-115.
[5]Franke A,LanteW,Fackeldey V,et al.Pro-inflammatory cyto⁃kines after different kinds of cardiothoracic surgical procedures:iswhat we see what we know[J]?Eur J Cardiothorac Surg,2005,28(4):569-575.
[6]Yoshitani K,de Lange F,Ma Q,et al.Reduction in air bubble size using perfluorocarbons during cardiopulmonary bypass in the rat[J].Anesth Analg,2006,103(5):1089-1093.
[7]Jungwirth B,deLange F.Animal models of cardiopulmonary by⁃pass:development,applications,and impact[J].Semin Cardio⁃thorac Vasc Anesth,2010,14(2):136-140.
[8]Dong GH,Xu B,Wang CT,et al.A rat model of cardiopulmo⁃nary bypass with excellent survival[J].J Surg Res,2005,123 (2):171-175.
[9]Qing M,Shim JK,Grocott H P,et al.The effect of blood pres⁃sure on cerebral outcome in a rat model of cerebral air embolism during cardiopulmonary bypass[J].J Thorac Cardiovasc Surg,2011,142(2):424-429.
·综述·
Establishment of a new deep hypothermic circulatory arrest model without blood priming in rats
Zeng Qing-dong,Li Yong-nan,Zhou Yu-jiao,Sun Yan-hua,Liu Ming-yue,Liu Gang,Ji Bing-yang
Department of Cardiopulmonary Bypass,State keylaboratory of Cardiovascular Medicine,Fuwai Hospital,National center for Cardiovascular disease,Chinese Academy of Medical science and Peking Union Medical College,Beijing,100037,China Corresponding author:Ji Bing-yang,Email:jibingyang@fuwai.com
[Abstract]:Objective Deep hypothermic circulatory arrest(DHCA)could induce many postoperative complications,especial⁃ly neurological dysfunction,whose underlying mechanisms are unclear.Our aim is to establish a temperature-controlled DHCA model in rats that could contribute to the research of organ injury mechanism related to DHCA.Methods Fifteen Sprague-Dawley rats were divided into 2 groups:group A(DHCA(n= 8),group B(normthermic CPB(n= 7)).After sevoflurane inhalation anesthesia,home⁃made multiorificed catheter was cannulated in the right jugular vein for venous drainage.A 24G catheter was cannulated in the branch of the left femoral artery for arterial blood pressure monitoring,A 20G catheter was cannulated in the tail artery for arterial inflow.In DHCA group,after the beginning of the experiment,the experimental process included normthermic CPB 5min,cooling to a rectal tem⁃perature of 18°C to 20°C within 30 minutes,deep hypothermic circulatory arrest 30 min,rewarming 30 min,and maintaining ventila⁃tionafter weaning from CPB 20 min.Blood gas analysis,homodynamic parameters,interval of cardiac recovery were measured at nine time points(pre-operative,peri-operative 15 min,85 min,120 min,post-operative48hours,post-operative 14days,post-operative 30 days).Results One rat(in group A)died and the rest survived.The survived rats were killed under anesthesia at day30 post-op⁃eratively.Conclusions Cardiac arrest can be induced by the drainage of blood from jugular vein to reservoir successfully.The success⁃ful DHCA model in rats is characterized by convenient,safe and precise control of temperature and anesthesia depth.This model could be used instudy of pathophysiology of brain and other organs dysfunction caused by DHCA.
[Key words]:Rats;Deep hypothermic circulatory arrest;Cardiopulmonary bypass;Animal Models
DOI:10.13498/ j.cnki.chin.j.ecc.2016.02.15
基金项目:国家自然科学基金面上项目(项目批号:81270384)
通讯作者:吉冰洋,Email:jibingyang@fuwai.com
收稿日期:(2016⁃03⁃15)
修订日期:(2016⁃03⁃21)
