失血性休克后深低温救治-复苏小型猪模型的建立
2016-06-30韩劲松尹宗涛王辉山
刘 宇,张 永,韩劲松,尹宗涛,王辉山
失血性休克后深低温救治-复苏小型猪模型的建立
刘 宇,张 永,韩劲松,尹宗涛,王辉山
[摘要]:目的 为探讨建立猪失血性休克后深低温停循环救治和延迟复苏动物模型的可行性。方法 对10只小型巴马香猪行颈总动脉和颈内静脉插管,通过颈总动脉插管放出实验动物40%血量建立休克模型,30 min后开始体外膜肺氧合(EC⁃MO),转流降低直肠温至15℃时,暂停循环60 min后转流复温,直肠温恢复到术前水平后脱离ECMO,呼吸机辅助呼吸直至脱离呼吸机,观察实验猪血流动力学指标及存活情况。结果 8只实验猪在钾离子浓度(17.2±6.31)mmol/ L时心脏停搏;在钾离子浓度(8.3±1.82)mmol/ L,直肠温(23.19±2.82)℃时心脏自动复跳并能够脱离呼吸机,脱机后2 h内血流动力学稳定。2只实验猪脱离ECMO后死于循环障碍。结论 失血性休克后深低温救治-复苏小型猪动物模型可成功建立,为探讨外伤或战伤后心脏和大血管损伤后救治提供了实验基础。
[关键词]:深低温诱导;失血性休克;动物模型
作者单位:110016沈阳沈阳军区总医院心血管外科
战伤及创伤所致的严重心脏、大血管损伤救治难度大、死亡率高,由于战场环境或医疗条件的限制很多伤员无法接受及时、合理的治疗而导致死亡。回顾性研究发现,心肺复苏等院前急救措施的普及显著提高了院前心跳骤停患者的抢救成功率[1],但抢救成功率也仅有30%。研究表明[2],低温可以延长脏器存活时间,为伤员的后送和救治赢得时间。国外已有相关技术应用于战场伤员救治并取得较好的效果。因此,建立战伤或外伤后失血性休克的低温救治模型是十分必要的。
1 实验方法
1.1实验动物 清洁级健康成年巴马香猪(沈阳军区总医院实验动物中心提供)10只,体重19~24(21.80±1.48)kg,雌雄各半,术前12 h禁食,4 h禁饮。
1.2主要仪器及材料 体外膜肺氧合(extracorpo⁃real membrane oxygenation,ECMO)系统采用Maquet公司离心泵及配套ECMO套包,Sorin公司变温水箱,Terumo公司CDI 500连续动脉血气监测仪。体外管道:Edward公司16 F股动脉插管、18 F股静脉插管;Datex-Ohmeda公司S/5多功能监护仪,预充液总量约为600 ml(复方乳酸钠注射液600 ml,肝素4 000 U)。
1.3实验药品与试剂 3%戊巴比妥钠、琥珀酰明胶、复方乳酸钠注射液、甘露醇注射液、碳酸氢钠注射液、肝素钠注射液、硫酸鱼精蛋白、10%氯化钾、10%葡萄糖酸钙、25%硫酸镁、利多卡因、阿托品、盐酸多巴胺注射液、盐酸肾上腺素注射液、异丙肾上腺素注射液、地塞米松注射液、艾司洛尔注射液、呋塞米注射液等。
1.4实验方法
1.4.1动物麻醉 实验猪采用氯胺酮20 mg/ kg及阿托品0.5 mg肌内注射诱导麻醉,1.5%~2.0%异氟烷面罩吸入5 min后行气管内插管,呼吸机辅助呼吸,吸入氧浓度40%,潮气量10 ml/ kg,呼吸频率15~20次/ min。右颈部、胸部、下腹部、双侧腹股沟备皮,胸部贴电极片行心电监护,猪舌中部夹氧饱和度探头监测末梢血氧饱和度,肛门置温度探头监测直肠温度。术区以安尔碘消毒,铺无菌单。双侧腹股沟穿刺左侧股静脉及右侧股动静脉,分别置入7 F中心静脉导管、20 G动脉穿刺针、18 G动脉穿刺针作为中心静脉压、动脉监测及静脉输液通路。
1.4.2休克模型及ECMO建立 右颈部气管旁行约4 cm长纵切口,切开皮肤、皮下组织,胸锁乳突肌中点内侧肌间沟内分离出右侧颈总动脉及颈内静脉,以5-0 Prolene缝线于颈总动脉及颈内静脉预置荷包缝线,切开血管后分别置入16 F股动脉插管及18 F股静脉插管(股静脉插管需置入右心房内),股静脉注射肝素钠300 U/ kg全身肝素化,检测ACT大于400 s时进行休克模型建立及ECMO建立。参照本院既往巴马香猪休克模型建立方法[3],采用定容性失血性休克模型,通过股动脉插管侧孔迅速放出40%血量(按30 ml/ kg体重计算),血压下降30%、心率迅速上升至150次/分以上提示休克模型建立成功。休克模型建立完成后观察30 min后开始ECMO,依次采用下述三种方法迅速降温:①ECMO开始后通过变温水箱持续迅速降温;②水箱降温同时,通过ECMO静脉端迅速加入冰高钾脏器保护液(脏器保护液采用Rheed等[4]实验中应用的Hypothermosol脏器保护液配方并加以改良,见表1。)1 000 ml(K+浓度55 mmol/ L),诱导心脏停搏及促进降温;③通过ECMO静脉端或股静脉侧孔放血1 000 ml后并用1 000 ml冰低钾脏器保护液(K+浓度5 mmol/ L)置换高钾液体降低K+浓度并促进降温。待直肠温降低到15℃时,停循环并通过股静脉侧孔放血约1 000 ml。停循环60 min后,重新启动离心泵,将回收血液通过离心泵前回输恢复循环,缓慢复温,复温过程中通过超滤器滤出液体,并继续补充之前放出血液,心脏复跳后继续复温到37℃,复温过程中根据血气结果纠正水电解质和酸碱失衡,待循环稳定,逐渐减低流量并停机。拔除颈总动脉及颈内静脉插管,收紧荷包线打结止血,鱼精蛋白中和肝素。

表1 脏器保护液成份表
1.5观察指标 实验过程中准确记录麻醉、动、静脉插管、ECMO开始、停止及降、复温时间。记录心率、平均动脉压、末梢氧饱和度、体温等。
2 结果
全组10只动物ECMO前无恶性心律失常发生,高钾脏器保护液加入后快速诱导心脏停搏。全组2只动物停机后死亡,其余8只动物存活,复温后心脏均自动复跳、有3只动物复跳后出现室上性心动过速,给予艾司洛尔等药物治疗后好转,其余7只动物恢复窦性心律。自主呼吸全部恢复,平均10~14次/ min。停机后存活2 h以上。通过高钾脏器保护液(K+浓度55 mmol/ L)诱导心脏停搏时血清钾离子浓度为(17.2±6.31)mmol/ L,提示血清钾离子浓度在此范围即可诱导心脏停搏。而所有实验猪在钾离子浓度(8.3±1.82)mmol/ L,直肠温(23.19± 2.82)℃时即可恢复自主心律。通过脏器保护液置换的方法调节钾离子浓度并降温后血液稀释较严重,最低红细胞比容(Hct)为(0.09±0.02),见表2。
3 讨论
深低温停循环(deep hypothermic circulatory ar⁃rest,DHCA)技术本是应用于部分婴幼儿先天性心脏病及成人复杂大血管疾病外科治疗中的重要手段。战场及外伤后心脏及大血管损伤可以迅速导致失血性休克救治难度较大,将ECMO及DHCA技术应用于心脏及大血管损伤后的救治,可以通过便携式体外生命支持系统在院前或基层医疗机构迅速降低全身温度诱导“假死”状态以降低代谢为后续转运及治疗赢得宝贵时间,该技术已初步应用于美军伊拉克战场,国内尚无类似救治经验及报道。因此,建立方便而科学的失血性休克后深低温诱导假死的动物模型对研究深低温停循环时的病理生理变化以及积累这方面救治经验至关重要。
既往关于DHCA动物模型的对象主要包括犬、兔、大鼠、乳猪等[5-9],这些模型具有经济、方便、可比性强等优点,但上述模型均为开胸动、静脉插管建立ECMO并需阻断主动脉灌注心脏停搏液诱导心脏停搏,不适于战、创伤的紧急救治。本研究采用颈动脉与颈内静脉插管建立ECMO,通过体外循环灌注高钾液诱导心脏停搏以模拟战场环境通过诱导深低温提供脏器保护为患者后送接受后续治疗赢得宝贵时间。模型建立中的注意事项:①实验猪股动静脉较细,行动静脉插管难度较大且流量难以满足全流量要求。因此,需采用颈总动脉及颈内静脉插管,而股动静脉可用于动静脉测压或作为静脉通路;②停循环后需缓慢复温(0.5℃/ min),以减少神经系统并发症的发生[10];③由于动物模型不切开心脏及主动脉,冠状动脉不存在气体栓塞风险,实验猪复温后于20.8~24.3℃之间均可自动复跳并且K+浓度对心脏复跳影响有限,本研究中心脏复跳时K+浓度在6.9~10.1 mmol/ L之间;④ECMO期间由于反复通过冰脏器保护液置换血液导致血液严重稀释,Hct严重降低,血浆胶体渗透压降低,复温过程中需持续超滤滤除液体并随温度升高逐渐补充血液及胶体;⑤停循环后需通过ECMO静脉端或股静脉侧孔放血以降低体循环内容量负荷,降低血管内静水压,避免体液向组织及间隙渗出。本实验中死亡的2只实验猪即是由于停循环后未放血导致静水压过高造成体液大量渗出引起心包腔及腹腔大量积液,进而导致停ECMO后由于心包填塞、循环难以维持致死亡。
表2 不同时间点温度、平均动脉压、心率、K+浓度及Hct变化表(n=10,±s)
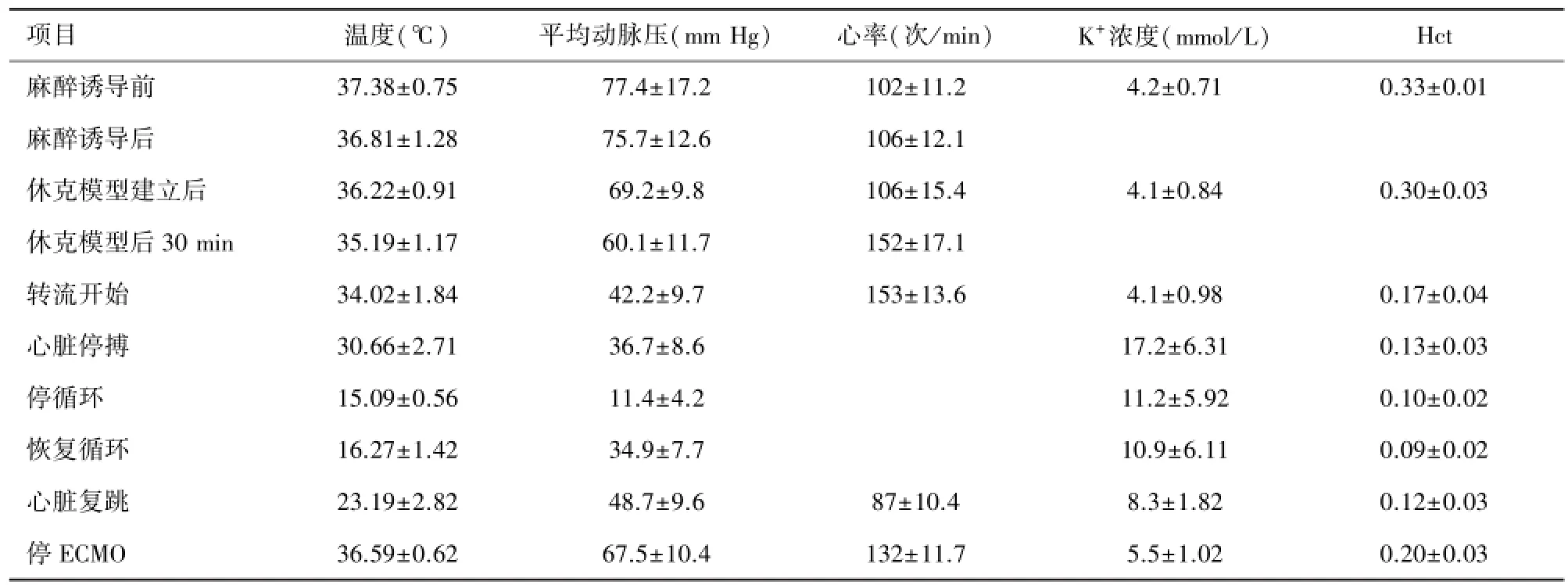
表2 不同时间点温度、平均动脉压、心率、K+浓度及Hct变化表(n=10,±s)
项目 温度(℃) 平均动脉压(mm Hg) 心率(次/ min) K+浓度(mmol/ L) Hct麻醉诱导前 37.38±0.75 77.4±17.2 102±11.2 4.2±0.71 0.33±0.01麻醉诱导后 36.81±1.28 75.7±12.6 106±12.1休克模型建立后 36.22±0.91 69.2±9.8 106±15.4 4.1±0.84 0.30±0.03休克模型后30 min 35.19±1.17 60.1±11.7 152±17.1转流开始 34.02±1.84 42.2±9.7 153±13.6 4.1±0.98 0.17±0.04心脏停搏 30.66±2.71 36.7±8.6 17.2±6.31 0.13±0.03停循环 15.09±0.56 11.4±4.2 11.2±5.92 0.10±0.02恢复循环 16.27±1.42 34.9±7.7 10.9±6.11 0.09±0.02心脏复跳 23.19±2.82 48.7±9.6 87±10.4 8.3±1.82 0.12±0.03 停ECMO 36.59±0.62 67.5±10.4 132±11.7 5.5±1.02 0.20±0.03
本研究的不足之处:①由于既往缺乏ECMO下长时间停循环经验,所以停循环期间忽视了通过放血降低血管内静水压的重要性。这直接引起了2只实验动物术后出现全身体液大量渗出,进而导致实验动物死亡;②由于仪器设备的不足,术中监测指标不够全面:如缺少静脉压、胶体渗透压等指标。一方面导致术中的某些问题(如停循环时静水压较高)不能及时发现,另一方面使得实验结果的可信程度及对后续实验的指导作用显著降低。上述问题均需要在后续实验中进行补充和改进。
综上所述,通过ECMO可以建立失血性休克后深低温救治-复苏小型猪动物模型,操作简便,脱离呼吸机后能短期存活,为探讨深低温救治-复苏导致的病理生理变化及其治疗策略提供了一种新型的动物模型,对探讨通过深低温救治-复苏心脏及大血管严重损伤提供了良好的实验基础。
参考文献:
[1]Daya MR,Schmicker RH,Zive DM,et al.Out-of-hospital car⁃diac arrest survival improving over time:Results from the Resusci⁃tation Outcomes Consortium(ROC)[J].Resuscitation,2015,91 (1):108-115.
[2]Kutcher ME,Forsythe RM,Tisherman SA.Emergency preserva⁃tion and resuscitation for cardiac arrest from trauma[J].Int J Surg,2015.
[3]尚蔚,刘楠,闫晓蕾,等.A型主动脉夹层手术后发生呼吸功能不全的危险因素分析[J].中华胸心血管外科杂志,2011,27 (6):349-352.
[4]Rhee P,Talon E,Eifert S,et al.Induced hypothermia during e⁃mergency department thoracotomy:an animal model[J].J Trau⁃ma,2000,48(3):439-447.
[5]邹小明,刘鑫,王武军,等.改良犬深低温停循环动物模型的建立[J].中国现代医学杂志,2009,19(14):2138-2140.
[6]唐跃,吴爱丽,慎慧,等.兔深低温停循环体外循环模型的建立[J].实验动物科学,2009,26(6):76-77.
[7]杨波,苏肇伉,陈惠文.大鼠深低温停循环模型的建立[J].临床儿科杂志,2003,21(6):368-370.
[8]蒋祖明,李玮浩,俞晓青,等.乳猪深低温停循环对肺保护作用的观察[J].中国体外循环杂志,2009,7(4):238-240.
[9]朱贤,陆龙,赵向东,等.不同温度大鼠无血预充深低温停循环模型的建立[J].中国体外循环杂志,2013(02):107-110.
[10]Alam HB,Rhee P,Honma K,et al.Does the rate of rewarming from profound hypothermic arrest influence the outcome in a swine model of lethal hemorrhage[J]?J Trauma,2006,60(1):134-146.
Establishment of swine model with deep hypothermia induced rescue and anabi⁃osis after hemorrhagic shock
Liu Yu,Zhang Yong,Han Jin-song,Yin Zong-tao,Wang Hui-shan
Department of Cardiovascular Surgery,General Hospital of Shenyang Military Area Command,Shenyang 110016,China Corresponding author:Wang Hui-shan,Email:huishanwang@hotmail.com
[Abstract]:Objective To explore the feasibility of the Establishment of swine model with deep hypothermia induced rescue and anabiosis after hemorrhagic shock.Methods Cannulation of the right common carotid artery and internal jugular vein were performed.Hemorrhagic shock model was reproduced by right common carotid artery bleeding(40%of total blood volume).After 30 min,extra⁃corporeal circulation was established inten pigs,which was terminated till the rectal temperature dropped to 15℃.After sixty minutes,ECMO was restarted and weaned when rectal temperature reached 37℃.Ventilation support was continued until pigs restored spontane⁃ous breath.The index of hemodynamic and survival were observed.Results Eight swine hadcardic arrest at(17.2±6.31)mmol/ L of potassium,the heart restarted beating at serum potassium concentration of(8.3±1.82)mmol/ L of and the rectal temperature of(23.19 ±2.82)℃.Hemodynamic was stable 2 hours after weaning from mechanical ventilation.Two pigs died of circulatory failure.Conclusion
The swine model with deep hypothermia induced rescue and anabiosis after hemorrhagic shock can be successfully established for the future study ofthe heart and large vessel traumain war.
[Key words]:Hypothermia induced;hemorrhagic shock;animal model
DOI:10.13498/ j.cnki.chin.j.ecc.2016.02.14
基金项目:2013年军队装备研制项目重大项目(ASY135001);国家高技术研究发展计划(863计划)项目(2015AA020312);2014年辽宁省建设产业技术创新体系示范工程医疗器械临床研究平台(2014305006)
通讯作者:王辉山,Email:huishanwang@hotmail.com
收稿日期:(2016⁃02⁃29)
修订日期:(2016⁃03⁃07)
