冻融周期移植不同时间囊胚的新生儿结局比较
2016-06-28王雪甄璟然孙正怡郁琦邓成艳周远征王含必何方方
王雪,甄璟然,孙正怡,郁琦,邓成艳,周远征,王含必,何方方
(中国医学科学院 北京协和医学院 北京协和医院妇产科生殖中心 北京 100730)
冻融周期移植不同时间囊胚的新生儿结局比较
王雪,甄璟然,孙正怡*,郁琦,邓成艳,周远征,王含必,何方方
(中国医学科学院 北京协和医学院 北京协和医院妇产科生殖中心 北京100730)
【摘要】目的比较D5和D6的冻融囊胚移植后的新生儿结局,进一步为复苏囊胚的选择提供指导。方法回顾性分析2005年1月至2012年12月在北京协和医院辅助生育中心进行复苏囊胚移植并已分娩的515例患者资料。按照冷冻前形成囊胚的时间D5或D6进行分组,比较两组的新生儿出生结局;并根据分娩胎数将患者分为单胎组和双胎组,分别比较单胎组和双胎组的新生儿结局。结果(1)单胎组:D5组的孕龄、出生体重和出生身长分别为(266.5±14.5)d、(3 387.4±584.8)g和(50.1±2.7)cm,与D6组[分别为(268.5±12.6)d、(3 379.7±540.8)g和(50.1±2.1)cm]相比均无统计学差异(P>0.05);D5组男女性别比略高于D6组(1.21 vs. 1.08),但无统计学差异(P>0.05)。(2)双胎组:D5组新生儿的孕龄、出生体重和出生身长与D6组相比亦均无统计学差异(P>0.05),但D5组新生儿的出生体重[(2 531.0±505.4) g]略低于D6组[(2 601.8±503.0) g];D5组的低体重新生儿发生率(42.3%)高于D6组(31.4%),但无统计学差异(P>0.05);D5组的男女性别比(1.20)高于D6组(0.92),但无统计学差异(P>0.05)。结论在单胎组或双胎组,D5与D6的囊胚冻融移植后出生的新生儿孕周、出生体重和体长均无统计学差异,但是呈现出D6组新生儿体重偏大的趋势;D5组的男女性别比高于D6组,但由于例数所限,未出现统计学差异,还有待于进一步研究。
【关键词】冻融胚胎移植;囊胚;发育速度;出生结局
Methods: The data of 515 patients with frozen-thawed blastocysts transfer cycles and delivered in our reproductive center from January 2005 to December 2012 were retrospectively analyzed. The patients were grouped by the day of blastocyst formation (Day 5 or Day 6). Furthermore,the patients were divided into the single-and twins-birth groups according to the numbers of fetus.
Results: In the single birth group,there were no differences in gestational age [(266.5±14.5) days vs. (268.5±12.6) days],birth weight [(3 387.4±584.8) g vs. (3 379.7±540.8) g] and birth length [(50.1±2.7) cm vs. (50.1±2.1) cm] between Day 5 and Day 6 blastocyst transfer groups (P>0.05,respectively). The ratio between male and female baby in Day 5 group was slightly higher than that in Day 6 group,but not significant (P>0.05). In the twins-birth group,there were also no differences in gestational age,birth weight and birth length between the Day 5 and Day 6 blastocyst transfer groups (P>0.05,respectively). The birth weight in Day 5 group was slightly lower than that in Day 6 group [ (2 531.0±505.4) g vs. (2 601.8±503.0) g]. The rate of low birth weight was lower (42.3% vs. 31.4%) and ratio between male and female baby (1.20 vs. 0.92) was higher in Day 5 group than those in Day 6 group,but not significant (P>0.05).
Conclusions: No matter single-birth or twins-birth,there were no differences in gestational age,birth weight and birth length between Day 5 and Day 6 blastocyst transfer group. But the birth weight in Day 6 group trend to be heavier,and the sex ratio in the Day 5 group was slightly higher than that in Day 6 group. However,it does not appear significant difference due to the limited number of cases,which needs further investigation.
(JReprodMed2016,25(6):511-516)
辅助生育技术已经成为治疗不孕症的重要手段,经典的IVF治疗是将体外受精后第3天(D3)形成的卵裂期胚胎移植入患者宫腔内。近年来随着胚胎体外培养系统的不断完善,囊胚培养得到广泛应用。理论上囊胚移植有很多优点,囊胚经过了一个再筛选的过程,囊胚移植后的种植率更高,从而活产率增加。另外有研究显示,移植囊胚阶段胚胎可以避免多胎妊娠及相关并发症,也可以提高每周期的妊娠率[1]。
在人早期胚胎的体外发育过程中,囊胚的发育速度并不一致,多数会在体外受精后第5天(D5)或第6天(D6)形成。目前在评估囊胚质量时,多数采用Gardner评分系统对囊胚进行形态学评价[2]。目前认为囊胚的发育速度也是一个重要参考因素,通常认为囊胚的发育速度越快,发育潜能越高。但目前关于囊胚复苏移植后的临床结局的研究结论并不一致,有报道认为D5囊胚冻融移植后临床妊娠率、种植率和出生率都显著高于D6囊胚[3],但也有研究发现D5和D6囊胚冻融移植的临床结局无明显差异[4]。在我们之前的研究中也发现D5组的囊胚种植率要明显高于D6囊胚[5],但是仅仅种植率的差异并不能全面代表D5或D6囊胚的发育潜能,还要考虑到着床后的流产率和新生儿的出生结局。有研究显示囊胚移植后新生儿发生早产和低体重的机率增加[6-8],也有研究显示冷冻复苏的囊胚移植后发生巨大儿的比例增加[9],还有研究显示延长培养至囊胚阶段并不影响新生儿结局[10-11]。然而这些都是将囊胚与卵裂期胚胎进行的比较,目前尚无研究来比较D5和D6的囊胚冻融移植后的新生儿出生结局。
因此,本研究按照冷冻前形成囊胚的时间(D5或D6)进行分组,比较D5或D6两组的新生儿出生结局。为了避免多胎对结果的影响,我们根据分娩胎数分为单胎组和双胎组,分别在单胎组和双胎组分别比较D5和D6两组新生儿的出生结局。进一步为复苏日囊胚的选择提供指导。
对象与方法
一、研究对象及分组
收集2005年1月至2012年12月在我院生殖中心进行囊胚复苏移植并已分娩的患者资料,共纳入515例,进行回顾性分析。所有囊胚均采用玻璃化法进行冷冻和复苏。
根据冷冻前形成囊胚的时间(D5或D6)分组:在受精后第5天形成囊胚者,定义为D5组;在受精后第6天形成囊胚者,定义为D6组。剔除在一个复苏周期中同时行D5和D6冻融囊胚移植的患者。并根据分娩胎数将患者分为单胎组和双胎组。
二、研究方法
1.囊胚培养:获卵后常规体外受精或卵胞浆内单精子注射(ICSI)授精。获卵后第1天观察卵母细胞受精情况,获卵后第3天挑选优质胚胎进行卵裂期胚胎移植;移植后的剩余胚胎经患者知情同意全部进行囊胚培养,在受精后第5天或第6天分别观察囊胚形成情况及形态,采用Gardner评分系统对囊胚进行评分[2]。
2. 胚胎冷冻和复苏:本中心全部采用玻璃化冷冻方法进行胚胎冷冻。囊胚冷冻方法参照以前文献所述[5,12-13]。囊胚冷冻之前进行人工皱缩,然后将囊胚放入预平衡液中平衡2 min,之后将胚胎转移入玻璃化冷冻液中平衡30 s,将胚胎转移至冷冻环(cryoloop环)上,直接浸入液氮保存。囊胚复苏在移植当天进行:将含有囊胚的冷冻环从液氮中取出后将胚胎浸入复苏液中,复苏后的囊胚全部进行激光辅助孵化;将复苏囊胚移入提前准备好的囊胚培养液(G2,Vitrolife,瑞典)中,放入37℃、6% CO2和5% O2的培养箱内培养2 h。移植前评估胚胎的存活情况,囊胚腔重新扩张判断为囊胚存活。
3.子宫内膜准备及胚胎移植:子宫内膜准备方法如之前文章所述[5,12]:(1)自然周期法:排卵前注射HCG(艾泽,雪兰诺,瑞士)2 000 U,之后超声监测到卵泡破裂后开始给予黄体支持(肌注黄体酮20~40 mg/d),在排卵后第6天移植胚胎;(2)人工周期法:月经第2~4天常规B超检查,口服戊酸雌二醇(补佳乐,先灵,德国)。B超监测内膜,当内膜厚度达到8 mm时肌注黄体酮(20 mg×2 d、40 mg×2 d、20~40 mg×1 d),第6天进行囊胚复苏移植。胚胎移植均在B超引导下进行,每周期移植1~2个胚胎。移植后常规采用肌注黄体酮进行黄体支持。
4. 随访:所有产妇于分娩后1~3个月进行电话随访。内容包括产科并发症、新生儿的出生日期、分娩方式、孕龄、新生儿性别、出生体重、体长、出生时的Apar评分、出生缺陷等。
三、分析指标及判定标准
移植后第7日测血清HCG>5 U/L则判断为生化妊娠,若移植后4周超声检查见胎心和胎囊则判断为临床妊娠。
孕龄是指末次月经第1天起至分娩时为止的一段时间;足月儿是指孕龄满37周(259 d)而未满42周(294 d)的新生儿;早产儿是指孕龄满28周(196 d)而未满37周(259 d)的新生儿;正常出生体重是指出生体重在2 500~4 000 g之间者;低出生体重儿(LBW)是指出生体重<2 500 g者,其中体重不足1 500 g者称为极低体重儿(VLBW);巨大儿是指出生体重≥4 000 g者。Apar评分满10分者为正常新生儿,评分7分以下的新生儿考虑患有轻度窒息,评分在4分以下考虑患有重度窒息。
四、统计学分析
采用SPSS 19.0软件进行统计学分析,对计量资料进行t检验,对分类变量资料采用卡方检验,以P<0.05为差异有统计学意义。
结果
一、D5和D6囊胚复苏移植的出生结局比较
D5组的孕龄为(258.8±17.2)d,显著低于D6组(262.6±14.7)d,差异有统计学意义(P<0.05)。但是D5的双胎发生率也显著高于D6组(P<0.05),因此孕龄的差异与D5组和D6组的双胎发生率差异有关(表1)。
尽管D5组新生儿的出生体重[(2 976.2±695.2)g]和出生身长[(48.8±3.2)cm],均低于D6组,但无统计学差异(P>0.05)。两组的剖宫产率都非常高(91.9% vs. 92.8%),但组间无统计学差异(P>0.05)。D5组低出生体重的发生率(23.2%)高于D6组(15.1%),而D5组巨大儿的发生率(6.4%)略低于D6组(7.8%),但均无统计学差异(P>0.05)(表1)。
D5组共出生406个新生儿,其中男孩222个,女孩184个,男女性别比为1.21;而D6组分娩258个新生儿,男女性别比为1.01(130∶128),组间无统计学差异(P>0.05)(表1)。
二、单胎新生儿出生结局比较
为了排除D5组和D6组双胎发生率对出生结局的影响,我们将单胎和双胎分娩的出生结局分别加以统计分析。
所有单胎分娩的患者平均年龄为(31.7±4.0)岁,共分娩新生儿366个,孕龄、出生体重和出生身长分别为(267.3±13.7)d、(3 384.1±565.7)g和(50.1±2.5)cm。其中D5组分娩210个新生儿,孕龄、出生体重和出生身长分别为(266.5±14.5)d、(3 387.4±584.8)g和(50.1±2.7)cm,与D6组[分别为(268.5±12.6)d、(3 379.7±540.8)g和(50.1±2.1)cm)]相比无统计学差异(P>0.05)(表2)。
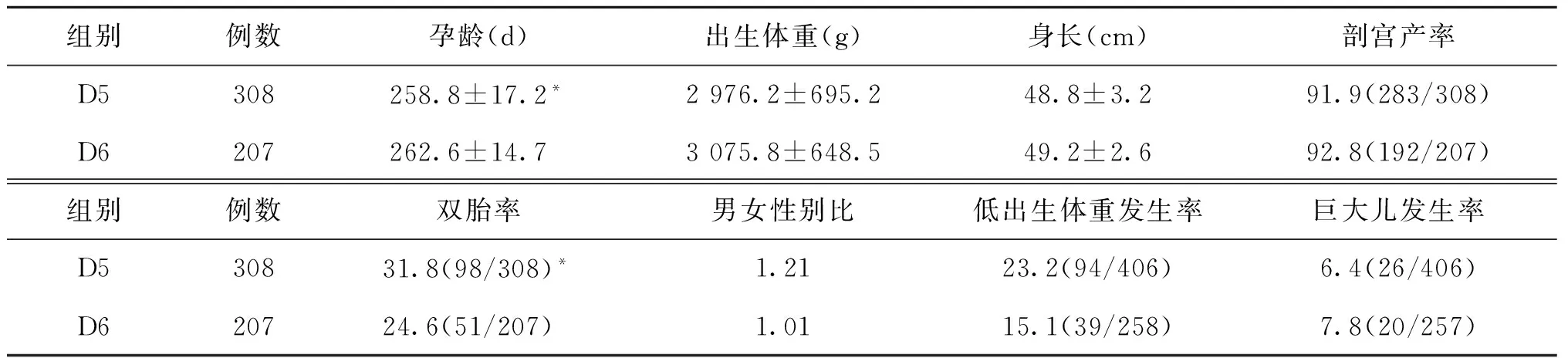
表1 D5与D6组新生儿情况比较[(x-±s),%]
注:与D6组比较,*P<0.05
D6组未出生极低出生体重儿,D5组的低出生体重率略高于D6组,D5组的巨大儿发生率略低于D6组,但两组相比均无统计学差异(P>0.05)(表2)。
D5组的男女性别比(1.21)略高于D6组(1.08),但无统计学差异(P>0.05)。另外,在D5组发生1例出生缺陷为动脉导管未闭合并脑积水,发生2例轻度新生儿窒息(Apar评分为7分),1例新生儿死亡;在D6组发生1例新生儿窒息(表2)。

表2 D5与D6组单胎新生儿情况比较[(x-±s),%]
三、双胎新生儿出生结局比较
双胎分娩的患者平均年龄为(31.8±4.1)岁,149例患者共分娩298个新生儿,孕龄、出生体重和出生身长分别为(251.6±15.3)d、(2 555.1±504.9)g和(47.3±2.9)cm。其中D5组分娩196个新生儿,新生儿的孕龄、出生体重和出生身长与D6组相比均无统计学差异(P>0.05),但是D5组新生儿的出生体重(2 531.0±505.4)g略低于D6组的(2 601.8±503.0)g(表3)。
两组均未出生巨大儿,D5组的低出生体重儿发生率(42.3%)高于D6组(31.4%),但无统计学差异(P>0.05)。D5组的男女性别比(1.20)高于D6组(0.92),但无统计学差异(P>0.05)。另外,在D5组发生2例轻度新生儿窒息(Apar评分为7分),D6组发生1例出生缺陷为双侧睾丸未降(表3)。

表3 D5和D6组双胎新生儿情况比较[(x-±s),%]
讨论
在胚胎的体外发育过程中,卵裂期胚胎发育至囊胚阶段时,经过再选择,发育潜能差的胚胎会被淘汰,因此认为进行囊胚移植更符合自然形态,更有利于胚胎着床,从而获得更好的临床结局。多数胚胎会在受精后D5或D6形成囊胚。我们将形成的囊胚进行玻璃化冷冻保存,之后再进行复苏移植。在前面的研究中我们发现D5的囊胚移植后的种植率、临床妊娠率和活产率均高于D6组囊胚[5],这与很多学者的研究结论相似[14-16]。但是,关于D5和D6的囊胚复苏移植后的新生儿出生结局分析的研究极少。因此本文对两组胚胎的出生结局进行了比较。
在本研究中,我们发现D5组的孕龄为(258.8±17.2)d,显著低于D6组的(262.6±14.7)d,而且D5组新生儿的出生体重(2 976.2±695.2)g和出生身长(48.8±3.2)cm也均低于D6组的(3 075.8±648.5)g和(49.2±2.6)cm,但无统计学差异。分析原因可能与D5组的双胎发生率较高有关。因此,为了避免胎儿数对我们的结果产生混杂影响,我们根据患者分娩的胎数分为单胎和双胎分别分析。我们发现,在单胎患者中,D5组的孕龄(266.5±14.5)d略低于D6组的(268.5±12.6)d,而且在D5组低出生体重的比例略高于D6组;在双胎分娩的患者,D5的孕龄(250.6±16.1)d略低于D6组的(253.6±13.4)d,D5组低出生体重儿的比例高于D6组,而且我们发现D5组出生体重略低于D6组。虽然这些差异均无统计学意义,但是我们看到似乎存在这样一个趋势:在体外培养时间越长,移植怀孕后的孕周越长,而且出生体重越重。这与Mäkinen等[9]的研究结论相似,他们发现移植D5或D6的胚胎后发生大于孕龄儿(LGA)的OR值明显高于移植D2的胚胎,因此认为体外培养时间越长,越容易发生大于孕龄儿。另外,在瑞典最近的两项研究中,也发现随着胚胎在体外培养时间的延长,发生小于孕龄儿(SGA)的比例降低(从3.2%下降至2.5%),尽管无统计学差异[17-18]。但是也有不同的研究结论。最近一项大型研究发现,不论胚胎在体外培养3 d、5 d或6 d,出生LGA或SGA婴儿的比例无明显差别[10]。这与Hiraoka等[4]的研究结论相似,他们比较了D5、D6和D7三组囊胚冻融移植后的出生结局,发现三组的孕周、早产率和平均出生体重没有显著差异,认为不论哪天形成的囊胚移植后都有相似的发育潜能。
胎儿的孕周、身长和出生体重受多种因素的影响,具体原因尚不清楚。有动物研究发现,在囊胚形成时,滋养外胚层和内细胞团细胞分布的改变会影响胎儿的大小,当滋养层细胞多时,胎盘体积会增加,反之,当内细胞团细胞数增加时,胎儿会增大[19-20]。也有动物研究显示体外培养方法和体外培养基的成分会诱导发生大胎儿综合征[21]。最近有关于人类胚胎的随机研究发现,新生儿的出生体重会受不同胚胎培养基的影响,但是孕周不受培养基的影响[21-22]。总之,影响新生儿出生体重的因素众多,如父母的遗传因素、母亲的年龄和母亲的营养等,因此D5和D6的囊胚冻融移植后新生儿的出生体重是否有差异还有待于进一步研究。
在我们的研究中,D5组囊胚冻融移植后出生的新生儿的男女性别比高于D6组,但是差异无统计学意义。在分为单胎组和双胎组后,D5组男女性别比仍然高于D6组,且双胎组差异更明显。在小鼠、牛和猪等动物中的研究提示,雄性胚胎比雌性胚胎发育更快[23-24]。在人类胚胎的体外培养中,也认为细胞分裂速度越快、细胞数越多的胚胎其遗传物质为男性的可能性越大,适当延长体外培养时间更容易选择出男性胚胎,囊胚阶段胚胎移植时的男女性别比要高于卵裂期胚胎,而且冻融囊胚移植后的男女性别比高于新鲜囊胚移植[25-27]。有研究发现,与同发育时期的女性胚胎相比,男性胚胎的形态学评分会更好,如72%的5期或6期囊胚是男性胚胎,而60%的3期囊胚为女性胚胎[25]。我们在胚胎培养至D5时,优先挑选内细胞团和滋养细胞数目多而且排列紧密的优质囊胚进行冷冻保存,在复苏移植时优先挑选冷冻的优质囊胚复苏移植,因此D5的囊胚中男性比例大一些。虽然在男性胚胎和女性胚胎之间存在的胚胎评分差异不能反映胚胎的活性差异,但是研究提示,与女性胚胎相比,男性胚胎能够趋于以最快的速度达到最终囊胚阶段[24]。其具体作用机制尚不清楚,但越来越多的证据显示,Y染色体上的某些生长因子对胚胎的发育有提速作用,而存在于女性而非男性胚胎的第二条X染色体有阻挡卵裂期胚胎向桑葚胚阶段发育的作用,所以男性胚胎和女性胚胎对体外培养条件的应答不同[28]。这只是一些初步猜测,还有待于进一步研究。
本研究结果提示,在单胎组或双胎组,D5与D6的囊胚冻融移植后出生的新生儿的孕周、出生体重和体长均无统计学差异,D5组的男女性别比高于D6组,但由于例数所限,未出现统计学差异。因此,D5和D6冻融囊胚的出生结局是否有差异还有待于进一步大样本量的随访研究。
【参考文献】
[1]Glujovsky D,Blake D,Farquhar C,et al. Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology[J/CD]. Cochrane Database Syst Rev,2012,7:CD002118.
[2]Gardner DK,Lane M,Stevens J,et al. Blastocyst score affects implantation and pregnancy outcome:towards a single blastocyst transfer[J]. Fertil Steril,2000,73:1155-1158.
[3]Kovalevsky G,Carney SM,Morrison LS,et al. Should embryos developing to blastocysts on day 7 be cryopreserved and transferred:an analysis of pregnancy and implantation rates[J]. Fertil Steril,2013,100:1008-1012.
[4]Hiraoka K,Hiraoka K,Miyazaki M,et al. Perinatal outcomes following transfer of human blastocysts vitrified at day 5,6 and 7[J]. J Exp Clin Assist Reprod,2009,6:4.
[5]王雪,甄璟然,孙正怡,等. 囊胚发育速度对冻融移植结局的影响[J]. 生殖医学杂志,2014,23:356-360.
[6]Kalra SK,Ratcliffe SJ,Barnhart KT,et al. Extended embryo culture and an increased risk of preterm delivery[J]. Obstet Gynecol,2012,120:69-75.
[7]Dar S,Joanne G,Librach CL. Reply:Extended culture and the risk of preterm delivery in singletons:confounding by indication?[J]. Hum Reprod,2013,28:2021-2022.
[8]Dar S,Librach CL,Gunby J,et al. Increased risk of preterm birth in singleton pregnancies after blastocyst versus Day 3 embryo transfer:Canadian ART Register (CARTR) analysis[J]. Hum Reprod,2013,28:924-928.
[9]Mäkinen S,Söderström-Anttila V,Vainio J,et al. Does long in vitro culture promote large for gestational age babies?[J]. Hum Reprod,2013,28:828-834.
[10]Fernando D,Halliday JL,Breheny S,et al. Outcomes of singleton births after blastocyst versus nonblastocyst transfer in assisted reproductive technology[J]. Fertil Steril,2012,97:579-584.
[11]Oron G,Sokal-Arnon T,Son WY,et al. Extended embryo culture is not associated with increased adverse obstetric or perinatal outcome[J]. Am J Obstet Gynecol,2014,211:165.e1-7.
[12]王雪,甄璟然,孙正怡,等. 囊胚滋养层细胞评分与移植后第7日血β-HCG和妊娠结局的关系[J]. 生殖医学杂志,2015,24:707-712.
[13]甄璟然,孙正怡,邓成艳,等. 玻璃化冷冻囊胚复苏移植与新鲜胚胎移植的围产期状况比较[J]. 生殖医学杂志,2009,18:86-89.
[14]Levens ED,Whitcomb BW,Hennessy S,et al. Blastocyst development rate impacts outcome in cryopreserved blastocyst transfer cycles[J]. Fertil Steril,2008,90:2138-2143.
[15]Liebermann J. Vitrification of human blastocysts:an update[J/OL]. Reprod Biomed Online,2009,19(Suppl 4):4328.
[16]Kato K,Ueno S,Yabuuchi A,et al. Women’s age and embryo developmental speed accurately predict clinical pregnancy after single vitrified-warmed blastocyst transfer[J/OL]. Reprod Biomed Online,2014,29:411-416.
[17]Källén B,Finnström O,Lindam A,et al. Blastocyst versus cleavage stage transfer in in vitro fertilization:differences in neonatal outcome?[J]. Fertil Steril,2010,94:1680-1683.
[18]Sazonova A,Källen K,Thurin-Kjellberg A,et al. Obstetric outcome after in vitro fertilization with single or double embryo transfer[J]. Hum Reprod,2011,26:442-450.
[19]Leese HJ,Donnay I,Thompson JG. Human assisted conception:a cautionary tale. Lessons from domestic animals[J]. Hum Reprod,1998,13(Suppl 4):184-202.
[20]Walker SK,Hartwich KM,Robinson JS. Long-term effects on offspring of exposure of oocytes and embryos to chemical and physical agents[J]. Hum Reprod Update,2000,6:564-577.
[21]Young LE,Sinclair KD,Wilmut I. Large offspring syndrome in cattle and sheep[J]. Rev Reprod,1998,3:155-163.
[22]Nelissen EC,Van Montfoort AP,Coonen E,et al. Further evidence that culture media affect perinatal outcome:findings after transfer of fresh and cryopreserved embryos[J]. Hum Reprod,2012,27:1966-1976.
[23]Burgoyne PS. A Y-chromosomal effect on blastocyst cell number in mice[J]. Development,1993,117:341-345.
[24]Mittwoch U. Blastocysts prepare for the race to be male[J]. Hum Reprod,1993,8:1550-1555.
[25]Alfarawati S,Fragouli E,Colls P,et al. The relationship between blastocyst morphology,chromosomal abnormality,and embryo gender[J]. Fertil Steril,2011,95:520-524.
[26]Bu Z,Chen ZJ,Huang G,et al. Live birth sex ratio after in vitro fertilization and embryo transfer in China--an analysis of 121,247 babies from 18 centers[J/OL]. PLoS One,2014,9:e113522.
[27]Maalouf WE,Mincheva MN,Campbell BK,et al. Effects of assisted reproductive technologies on human sex ratio at birth[J]. Fertil Steril,2014,101:1321-1325.
[28]Gutiérrez-Adán A,Oter M,Martínez-Madrid B,et al. Differential expression of two genes located on the X chromosome between male and female in vitro-produced bovine embryos at the blastocyst stage[J]. Mol Reprod Dev,2000,55:146-151.
[编辑:罗宏志]
Effect of blastocyst formation time on neonatal outcomes in frozen-thawed blastocyst transfer cycles
WANG Xue,ZHEN Jing-ran,SUN Zheng-yi*,YU Qi,DENG Cheng-yan,ZHOU Yuan-zheng,WANG Han-bi,HE Fang-fang
DepartmentofObstetrics&Gynecology,PekingUnionMedicalCollegeHospital,PekingUnionMedicalCollege/ChineseAcademyofMedicalSciences,Beijing100730
【Abstract】Objective: To compare the neonatal outcomes of transplantation of frozen-thawed blastocyst on Day 5 or Day 6.
Key words:Frozen-thawed embryo transfer;Blastocyst;Development rate;Birth outcome
DOI:10.3969/j.issn.1004-3845.2016.06.006
【收稿日期】2016-02-24;【修回日期】2016-03-30
【作者简介】王雪,女,山东潍坊人,博士,实习研究员,妇科内分泌专业.(*通讯作者)
