化疗药物致卵巢损伤的表型分析及可能机制
2016-06-28吕晓丹李莹张璐王学芹马旭夏红飞
吕晓丹,李莹,张璐,王学芹,马旭*,夏红飞*
(1.国家卫生计生委科学技术研究所遗传优生中心,北京 100081;2.北京协和医学院研究生院,北京 100730)
化疗药物致卵巢损伤的表型分析及可能机制
吕晓丹1,2,李莹1,张璐1,王学芹1,马旭1*,夏红飞1*
(1.国家卫生计生委科学技术研究所遗传优生中心,北京100081;2.北京协和医学院研究生院,北京100730)
【摘要】目的探索化疗药物对小鼠卵巢的影响及可能的机制。方法将60只ICR小鼠平均分为给药组和对照组。给药组小鼠一次性腹腔注射环磷酰胺120 mg/kg+白消安20 mg/kg,对照组小鼠注射同等体积的DMSO;通过观察小鼠动情周期的变化、性激素水平、卵巢组织形态及卵泡计数分析化疗药物对卵巢的影响;通过检测抗苗勒管激素(AMH)、Ki67表达水平等分析卵巢储备能力和细胞增殖能力的变化。结果给药组雌激素水平(203.00±24.91 pmol/L)比对照组(379.00±36.13 pmol/L)显著降低(P<0.01);给药组脏器系数(0.0318)比对照组(0.0487)显著下降(P<0.01);给药组可见卵巢萎缩、各级卵泡数目明显减少、卵泡闭锁增多;给药组颗粒细胞分泌的AMH明显减少、增殖细胞数目显著降低(P<0.01)。结论化疗药物能导致小鼠卵巢损伤,卵巢储备能力和卵巢细胞的增殖能力明显下降。
【关键词】化疗药物;卵巢损伤;表型分析;抗苗勒管激素;增殖
Methods: Sixty ICR mice were equally divided into two groups:the mice were administrated with 120 mg/kg cyclophosphamide and 20 mg/kg busulfan by intraperitoneal injection in CTX+BUS group;and the mice were given with the same quantity of DMSO in the control group. The function of ovary were checked by analyzing estrous cycle,serum gonadal hormone levels,morphology of ovarian tissues,changes of numbers of follicles.Ovarian reserve capacity and cell proliferation were verified by detecting the expression of anti-mullerian hormone and Ki67.
Results: Compared with the control group,the estrogen levels [(203.00±24.91) pmol/L vs. (379.00±36.13) pmol/L] were significantly decreased (P<0.01);organ coefficient (0.0318 vs. 0.0487) was significantly decreased (P<0.01);the numbers of follicles reduced and the numbers of atretic follicles increased;AMH levels secreted by granulosa cells significantly reduced and the numbers of proliferating cells were significantly decreased in mice injected with chemotherapy drugs of CTX+BUS group (P<0.01).
Conclusions: Chemotherapy drugs can lead to ovarian damage in mice,and the ovarian reserve capacity and ovarian cell proliferation significantly decreased.
(JReprodMed2016,25(6):540-544)
化疗药物在抑制肿瘤的同时会产生一定的毒副作用。长期的化疗通常会对女性性腺造成损伤,出现原始卵泡减少等一系列卵巢功能过早衰竭的现象[1-2]。通常卵巢早衰(POF)是指妇女在40岁之前出现闭经、雌激素缺乏(E2<92 pmol/L)、卵泡刺激素(FSH)和黄体生成素(LH)水平升高(FSH>40 U/L,LH>30 U/L)为特征的一种疾病[3-4]。一般人群中发病率为1%~3%,在继发性闭经妇女中占4%~18%,在20岁以前的发病率约为0.01%[5]。目前,如何在化疗的同时保护妇女的卵巢功能、改善其生活质量成为妇产科学及生殖医学研究的重要内容。因此,本实验旨在研究对卵巢毒性较强的化疗药物环磷酰胺(cyclophosphamide,CTX)和白消安(Busulfan,BUS)对小鼠卵巢功能的损伤,为深入探索POF的发病机制和治疗方法提供动物模型和实验依据。
材料与方法
一、材料来源
1. 实验动物:健康ICR(Institute of Cancer Research)雌性小鼠,6周龄,SPF级,体重约27 g,购于北京华阜康生物科技股份有限公司,合格证编号为SCXK(京)2014-0004。所有小鼠在恒温恒湿环境下饲养,提供12 h光照/12 h黑暗环境。
2. 主要试剂:CTX (Baxter,德国),BUS和DMSO (Sigma,美国),E2和FSH试剂盒 (Bio-Swamp,中国),孕马血清促性腺激素(Pregnant Mare Serum Gonadotropin,PMSG;宁波第二激素厂),苏木精-伊红染液(hematoxylin-eosin,HE;中杉金桥),AMH抗体 (R&D Systems,美国),Ki67抗体(Abcam,英国)。
实验经国家卫生计生委科学技术研究所伦理委员会批准。
二、方法
1. 实验动物给药方案:经阴道涂片,将有正常动情周期的小鼠纳入实验。ICR雌性小鼠分为2组,卵巢损伤给药组(CTX+BUS)30只和空白对照组(Control)30只。给药组采用一次性腹腔注射CTX 120 mg/kg+BUS 20 mg/kg[6],CTX用生理盐水配制成20 mg/ml的水溶性注射液,BUS用DMSO配制成66.7 mg/ml的脂溶性注射液。对照组腹腔注射相同体积的DMSO。
2. 动物的一般状态及动情周期:观察处理后各组小鼠的饮食、活动及皮毛变化等情况。每日8﹕00行阴道脱落细胞涂片,用95%乙醇固定5 min,显微镜观察细胞的形态和种类。
3. 动物处理和取材:取材前2 d对各组小鼠进行PMSG注射,使各组小鼠的动情周期处于相同时期。处死小鼠前,准确称取小鼠体重,摘眼球取血,4℃放置过夜后,4 000 rpm离心5 min,分离血清保存于-20℃。处死小鼠,迅速从卵囊内取出卵巢,准确称重(精确至0.001 g),计算脏器系数:脏器系数=卵巢组织质量/体质量×100%。一侧卵巢组织置于4%多聚甲醛中固定,包埋蜡块用于制备组织切片,一侧卵巢冻于-80℃冰箱用于提取RNA或蛋白。
4. 酶联免疫吸附测定(ELISA):操作步骤严格按照FSH和E2试剂盒说明书进行,在酶标包被板上加入待测血清样品与相应抗体37℃温育30 min,加酶标试剂37℃温育30 min,显色液显色,经终止液终止后迅速将样品放入酶标仪中测定吸光度。使用标准品绘制标准曲线。
5. HE染色法:将石蜡切片脱蜡、水化。苏木精染色1 min,伊红染色10 min,梯度酒精脱水,二甲苯透明,中性树脂封片。TE2000-U倒置相差显微镜(Nikon,日本)下观察卵巢组织形态学变化,并对切片中的原始卵泡、初级卵泡、次级卵泡、成熟卵泡进行计数。根据Tilly JL[7]报道的计算卵泡数目方法计算各级卵泡的最终数目。
6. 免疫组化检测:取5 μm的石蜡切片,采用超敏二步免疫组织化学方法检测小鼠卵巢组织颗粒细胞AMH分泌及Ki67的分布。AMH按照1∶40的比例稀释,Ki67按照1∶100的比例稀释。为了检测一抗的特异性,我们用羊血清代替一抗作为阴性对照。TE2000-U倒置相差显微镜(Nikon,日本)下观察并拍照。
三、统计学处理
结果
一、小鼠的一般情况及动情周期的变化
给药组小鼠注射CTX和BUS后活动减少,精神萎靡,体毛光泽度下降。对照组小鼠活动、体毛光泽度等一般情况正常,对外界刺激的反应性好,灵活性强。
动情周期变化明显,给药组小鼠动情间期占动情周期的比例显著高于对照组 (P<0.001),动情期占动情周期的比例显著低于对照组 (P<0.001)(图1)。

两组比较,*P<0.001图1 对照组和给药组小鼠的动情周期构成
二、化疗药物对血清E2和FSH水平的影响
用ELISA法检测小鼠血清中E2和FSH的水平。结果显示,与对照组相比,给药组小鼠血清中E2浓度明显降低 (P<0.001),给药组小鼠血清FSH浓度有所升高,但差异无统计学意义(P>0.05)(表1)。

表1 小鼠血清E2、FSH水平(x-±s)
注:与对照组比较,*P<0.001
三、化疗药物对卵巢脏器系数的影响
脏器系数是药物安全性评价中一种必要的检测指标。观察卵巢肉眼可见给药组卵巢体积明显小于对照组 (图2A),卵巢的脏器系数在给药组显著低于对照组(P<0.01) (图2B)。
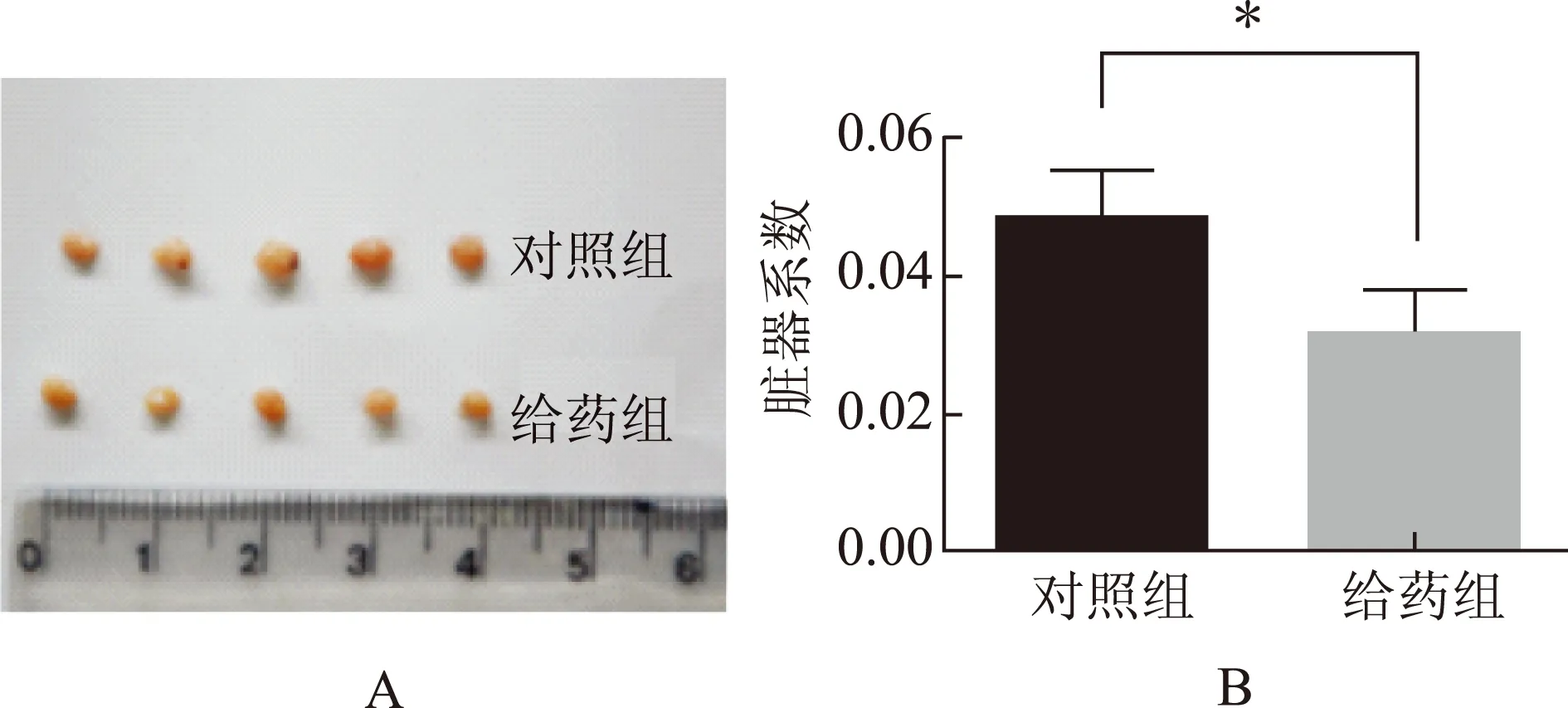
A. 卵巢外观;B. 卵巢脏器系数。两组比较,*P<0.01图2 对照组和给药组小鼠卵巢的外观体积
四、化疗药物对卵巢组织形态和各级卵泡数量的影响
卵巢组织结构的变化是评价化疗药物危害性的重要指标。HE染色显示对照组小鼠卵巢体积较大,可见生长活跃、发育良好的原始卵泡、初级卵泡、次级卵泡、成熟卵泡,且有很多排卵前的窦状卵泡,卵母细胞周边颗粒细胞排列紧密、整齐,亦可见发育良好的黄体,卵巢组织中未见炎细胞浸润(图3ⅠA);给药组小鼠卵巢萎缩明显,结构混乱,各阶段生长卵泡数目明显减少,仅有少数原始卵泡,卵巢卵母细胞周边颗粒细胞明显减少、排列紊乱、细胞间隙增大,大部分间质组织为无功能白体(图3ⅠB)。
与对照组小鼠相比,给药组小鼠原始卵泡、初级卵泡、次级卵泡和成熟卵泡数均显著降低,差异有统计学意义(P<0.05)(图3Ⅱ)。

Ⅰ. 卵巢组织形态(A. 对照组;B. 给药组);Ⅱ.各级卵泡数目(a.始基卵泡;b. 初级卵泡;c. 次级卵泡;d. 成熟卵泡;e.黄体;f. 闭锁卵泡)。两组比较,*P<0.05,**P<0.01图3 对照组和给药组小鼠卵巢卵泡的病理学改变(HE染色 ×50)
五、化疗药物对卵巢储备能力的影响
AMH是发育的卵泡细胞分泌的激素,女性卵巢中AMH的水平是其卵巢储备能力的一个好的指示剂[8-9]。免疫组化检测显示对照组小鼠窦前卵泡颗粒细胞高表达AMH,小窦卵泡颗粒细胞亦表达AHM,窦状卵泡不表达AMH;给药组小鼠卵巢几乎检测不到AMH的阳性信号,提示化疗药物降低了卵巢的储备能力(图4)。
六、化疗药物对小鼠卵巢细胞增殖的影响
Ki67是一种增殖细胞相关的核抗原[10],在细胞增殖中是不可缺少,可作为标记细胞增殖状态的抗原。免疫组化检测显示对照组小鼠各级卵泡染色均较深,均处于增殖期,给药组小鼠各级卵泡几乎不着色,少有处于增殖期的细胞(图5)。

A. 对照组;B. 给药组;C. 阴性对照组(a. 始基卵泡;b. 初级卵泡;c. 次级卵泡;d. 成熟卵泡;e.黄体)图4 对照组和给药组小鼠卵巢组织颗粒细胞中AMH分泌情况(免疫组化染色 ×100)

A. 对照组;B. 给药组;C. 阴性对照组;A~C(×100)标出区域相应放大(×200)图为A1~C1(a. 始基卵泡;b. 初级卵泡;c. 次级卵泡;d. 成熟卵泡;e.黄体;f. 闭锁卵泡)图5 对照组和给药组小鼠卵巢组织中Ki67的表达分布(免疫组化染色)
讨论
研究表明化疗药物可能诱发卵巢早衰,导致女性雌激素水平降低,降低生育能力,从而使女性生活质量下降[11]。本研究显示化疗药物环磷酰胺和白消安能够扰乱性成熟的雌性小鼠的动情周期,降低雌激素的水平,并使小鼠卵巢组织中闭锁卵泡数目增多和各级卵泡数目明显减少,这些结果提示了化疗药物能够引起小鼠的卵巢早衰。
小鼠的动情周期分为动情前期、动情期、动情后期、动情间期。我们的研究发现,与正常小鼠相比,化疗药物能显著延长小鼠的动情间期,降低小鼠的动情期。这显示了小鼠的动情周期被化疗药物扰乱,也提示了小鼠的卵巢功能被破坏。
雌性动物体内的E2主要由卵巢合成、分泌,能增进和调节雌性器官及副性征的正常发育。E2的含量降低意味着卵巢分泌雌激素的功能降低。卵泡刺激素是由垂体前叶分泌的一种促性腺激素,能促进卵泡的成熟、雌性激素的合成与分泌,促进排卵,它的升高意味着卵巢功能的减退[12]。本研究发现给药组小鼠血清E2的值显著低于对照组,这与临床卵巢早衰患者的表现类似。
卵巢组织形态观察及卵泡计数结果显示,与对照组相比,给药组小鼠卵巢组织中闭锁卵泡数目显著增多,各级卵泡数目明显减少,少有成熟卵泡,卵泡颗粒细胞结构松散。这与卵巢早衰患者的卵巢有卵泡丢失、闭锁、不排卵等表现相符。
AMH是由睾丸未成熟支持细胞和卵巢生长卵泡的颗粒细胞分泌的一类单糖蛋白,具有抑制雄性苗勒管发育、调节两性生殖细胞和性腺发育的重要功能[13]。研究发现AMH具有抑制原始卵泡募集和通过降低卵泡对FSH的敏感性影响优势卵泡选择的作用,是评价雌性动物卵巢储备功能的敏感指标[8-9]。我们研究显示,AMH的水平在给药组显著低于对照组,提示化疗药物能够降低卵巢的储备能力。
环磷酰胺在体内可经一系列生物化学反应产生磷酰胺氮芥,磷酰胺氮芥可与细胞内的DNA发生烷化反应,交叉联结,干扰DNA的正常代谢,从而抑制细胞的生长繁殖[14]。白消安可作用于分裂细胞的G0/G1期,抑制细胞分裂增殖[15]。为此,我们研究了它们对卵巢细胞增殖能力的影响。研究发现在正常的卵巢组织中,始基卵泡、初级卵泡、次级卵泡和成熟卵泡均有明显的细胞增殖,而在化疗药物处理的小鼠卵巢组织中几乎检测不到发生细胞增殖的卵泡。这些结果表明化疗药物可以显著抑制卵巢细胞增殖,与其临床作用机理相符。
此外,本研究选择小鼠作为实验动物是由于小鼠具有适应性强、性情温顺、生长发育快、繁殖力强、实验重复性好、自发性排卵、动情周期规律且易于观察的特点[16]。雌性小鼠性成熟后,生殖器官发生周期性变化。为了取材时实验小鼠处于同一周期,在取材前2 d给所有小鼠注射PMSG[17],48 h后小鼠处于同一发情周期再处死小鼠进行后续实验,得到的数据更加可信、具有说服力。
综上所述,本研究结果表明,化疗药物能够通过抑制雌激素分泌、降低卵巢储备能力和抑制卵巢细胞增殖等诱导卵巢早衰的发生。实验结果不仅能为探讨卵巢早衰的病理表现和发病机制提供实验性模型,也能为卵巢早衰的治疗提供动物模型。
【参考文献】
[1]王方圆,谢超,程蔚蔚,等. 环磷酰胺化疗导致小鼠卵巢功能损伤模型的建立[J]. 上海交通大学学报,2011,10:1398-1402.
[2]刘超英,王哲海,陈黎. 肿瘤患者性腺机能的损伤与防治[J]. 生殖医学杂志,2001,10:242-246.
[3]Goswami D,Conway GS. Premature ovarian failure[J]. Hum Reprod Update,2005,11:196-202.
[4]付莉,赵怡璇,李守柔. 卵巢早衰实验动物模型的建立[J]. 生殖医学杂志,2006,15:179-183.
[5]Zargar AH,Salahuddin M,Wani AI,et al. Pregnancy in premature ovarian failure:a possible role of estrogen plus progesterone treatment[J]. J Assoc Physicians India,2000,48:213-215.
[6]Wang F,Wang L,Yao X,et al. Human amniotic epithelial cells can differentiate into granulosa cells and restore folliculogenesis in a mouse model of chemotherapy-induced premature ovarian failure[J]. Stem Cell Res Ther,2013,4:124. doi:10.1186/scrt335.
[7]Tilly JL. Ovarian follicle counts-not as simple as 1,2,3[J]. Reprod Bio Endocrinol,2003,1:1-11.
[8]Visser JA,Durlinger AL,Peters IJ,et al. Increased oocyte degeneration and follicular atresia during the estrous cycle in anti-mullerrian hormone null mice[J]. Endorinology,2007,148:2301-2308.
[9]Sowers MR,Eyvazzadeh AD,Mcconnell D,et al. Anti-mullerian hormone and inhibin B in the definition of ovarianaging and the menopause transition[J]. J Clin Endocrinol Metab,2008,93:3478-3483.
[10]Gerdes J,Schwab U,Lemke H,et al. Production of a mouse monoclonal antibody reactive with a human nuclear antigen associated with cell proliferation[J]. Int J Cancer,1983,31:13-20.
[11]Hemminiki K,Xu G,Angelini S,et al. XPD exon 10 and 23 polymorphisms and DNA repair in human skin in situ[J]. Carcinogenesis,2001,22:1185-1188.
[12]Luisi S,Florio P,Reis FM,et al. Inhibins in female and male reproductive physiology:role in gametogenesis,conception,implantation and early pregnancy[J]. Hum Reprod Update,2005,11:123-135.
[13]钱警语,陈秀娟. 抗苗勒管激素与女性生育功能关系研究进展[J]. 生殖与避孕,2013,33:473-478.
[14]王新禹,梁前进. 环磷酰胺的毒副作用机制及应对措施[J]. 药学进展,2006,30:452-456.
[15]Shiraishi A,Sakumi K,Sekiguchi M. Increased susceptibility to chemotherapeutic alkylating agents of mice deficient in DNA repair methyltransferase[J]. Carcinogenesis,2000,21:1879-1883.
[16]孙德明,李根平,陈振文,等. 实验动物从业人员上岗培训教材[M]. 北京:中国农业大学出版社,2011:136-141.
[17]俞凌. 人脐带间充质干细胞治疗卵巢早衰的初步实验研究[D]. 北京:解放军总医院军事进修学院,2012:1-87.
[编辑:辛玲]
Phenotypic analysis and possible mechanism of chemotherapy drugs induced ovarian damage
LU Xiao-dan1,2,LI Ying1,ZHANG Lu1,WANG Xue-qin1,MA Xu1*,XIA Hong-fei1*
1.Reproductive&GeneticCenterofNationalResearchInstituteforFamilyPlanning,Beijing100081 2.GraduateSchool,PekingUnionMedicalCollege,Beijing100730
【Abstract】Objective: To investigate the effect and possible mechanism of chemotherapy drugs induced ovarian damage in mice.
Key words:Chemotherapy drugs;Ovarian damage;Phenotype analysis;Anti-Mullerian hormone;Proliferation
DOI:10.3969/j.issn.1004-3845.2016.06.010
【收稿日期】2015-12-16;【修回日期】2016-01-21
【基金项目】国家自然科学基金(No. 30800396)和中央级公益性科研院所基本科研业务费专项(2015GJZ01)
【作者简介】吕晓丹,女,硕士研究生,生殖遗传专业. (*通讯作者,Email:hongfeixia@126.com)
