建立不同类型干细胞并比较其分泌细胞因子的水平
2016-06-28张琴静陈爱琴宁松高超蒋春艳崔毓桂陈娟覃莲菊刘嘉茵
张琴静,陈爱琴,宁松,高超,蒋春艳,崔毓桂,陈娟,覃莲菊,刘嘉茵
(南京医科大学第一附属医院生殖医学科,南京 210029)
·实验研究·
建立不同类型干细胞并比较其分泌细胞因子的水平
张琴静,陈爱琴,宁松,高超,蒋春艳,崔毓桂,陈娟,覃莲菊*,刘嘉茵*
(南京医科大学第一附属医院生殖医学科,南京210029)
【摘要】目的比较不同类型干细胞分泌细胞因子的水平,探讨其潜在的临床意义。方法建立人类胚胎干细胞(hESCs)、脐带间充质干细胞(UMSCs)、羊膜间充质干细胞(AMSCs)株系;实时荧光定量聚合酶链反应(RT-qPCR)分析干细胞分泌细胞因子水平:(1)促炎因子,包括白细胞介素-6(IL-6)、白细胞介素-8(IL-8)和肿瘤坏死因子(TNF-α);(2)抑炎因子白细胞介素-10(IL-10);(3)生长因子,包括肝细胞生长因子(HGF)、脑源性神经营养因子(BDNF)、干细胞因子(SCF)和血管内皮生长因子(VEGF);(4)基质金属蛋白酶MMP-1及其抑制剂TIMP-1;(5)血管形成因子(Angiogenin),白血病抑制因子(LIF)以及骨形成蛋白(BMP4)。结果女性UMSCs分泌生长因子、血管生成因子、造血因子、抑炎因子等的能力显著强于hESCs、AMSCs(P<0.05);女性hESCs、男性UMSCs分泌金属蛋白酶的水平显著高于其它干细胞(P<0.05)。结论女性UMSCs可能具有更好的促进细胞生长、改善血供的能力;而女性hESCs、男性UMSCs则可能具有更强的降解结缔组织的能力。
【关键词】人胚胎干细胞;人羊膜间充质干细胞;人脐带间充质干细胞;细胞分泌因子
Methods: The cell lines of human embryonic stem cells (hESCs),umbilical cord mesenchymal stem cells (UMSCs) and amniotic mesenchymal stem cells (AMSCs) were established and identified. The expressions of secretory cytokines,such as:(1) pro-inflammatory factors of IL-6,IL-8 and TNF-α;(2) anti-inflammatory factor of IL-10;(3) Growth factors (HGF,BDNF,SCF and VEGF);(4) matrix metalloprotein (MMP-1) and its inhibitor TIMP-1;(5) angiogenic factor,LIF and BMP4 were determined by real-time fluorescent quantitative polymerase chain reaction (RT-qPCR).
Results: The expresses of growth factors,angiogenic factor,LIF and IL-10 in female UMSCs were significantly higher than those in hESCs and AMSCs(P<0.05). The expressions of MMP-1 in female hESCs and male UMSCs were significantly higher than those in other stem cell lines (P<0.05).
Conclusions: Female UMSCs may have stronger capacity to promote cell growth and improve blood supply. Female hESCs and male UMSCs may be more powerful in degradation of connective tissue.
(JReprodMed2016,25(6):528-539)
干细胞是一种具有自我更新、增殖能力的特殊细胞,且具有多向分化潜能,在特定培养条件下能分化为特定类型的细胞[1]。最近几年,认为干细胞治疗是能够修复和恢复受伤组织正常功能,具有潜力的替代治疗方法[2]。卵巢功能早衰(POF)是引起女性不孕的常见原因,同时也增加了女性退行性疾病的发生率,如心血管疾病、骨质疏松、认知障碍[3-5]。针对POF的治疗,目前广泛接受的是激素替代疗法(HRT)[6],但该疗法大大增加了静脉血栓、卵巢癌和乳腺癌发生的风险[7-8]。另一类治疗方法是将卵巢组织、卵母细胞或胚胎进行冷冻保存[9],但依旧不能根治POF。研究显示,移植间充质干细胞可恢复雌性POF模型小鼠的卵巢功能[10-13]。
研究显示,移植的间充质干细胞是通过分泌细胞因子,而不是通过分化为新的卵母细胞改善受损卵巢的功能[14]。此外,直接注射细胞培养上清可改善受损器官的功能[15-16]。目前认为,干细胞分泌的细胞因子中,促炎因子可促进炎症反应和组织损伤;而机体释放的抗炎因子,如白细胞介素-10(IL-10),具有抗炎和免疫调节的作用[17];细胞生长因子则主要促进细胞增殖与分化,但不同的细胞因子也具有其特异的生物学功能,如血管内皮生长因子(VEGF)具有促进血管内皮细胞分裂、诱发血管形成及增加血管通透性的功能[18],而肝细胞生长因子(HGF)则在细胞运动、侵袭转移、上皮间质转化中发挥重要作用[19];金属蛋白酶及其抑制剂主要维持机体结缔组织的平衡[20]。另外,骨形成蛋白4(BMP4)主要参与骨的形成与胚胎发育[21];白血病抑制因子(LIF)在不同细胞的作用不同,包括刺激或抑制细胞的增殖、分化或存活,同时也可促进胚胎发育[22];血管生成素(Angiogenin)则可促进新生血管形成,同时通过调节细胞增殖、存活、迁移、侵袭、分化,在各种生理病理过程中发挥重要作用[23]。预测,将来干细胞培养上清提取物可直接作为注射剂治疗包括POF在内的相关疾病。
然而,不同类型干细胞分泌细胞因子的种类、质量可能具有较大差异,因此适应证及疗效也具有差异性。另外,推测不同性别的同类型干细胞分泌的细胞因子种类、质量可能也存在差异,对症治疗时应精准选择。本研究为探明不同类型干细胞分泌细胞因子的质量,为将来干细胞治疗生殖相关疾病提供依据,将比较不同种类、不同性别干细胞中细胞分泌因子的表达水平。
材料与方法
一、材料
人胚胎干细胞(hESC)系CCRM22由本实验室构建[24];α-MEM、DMEM F/12、Knockout血清替代物(knockout serum replacement,KSR)、1% L-谷氨酰胺(LG)、1%青霉素-链霉素(PS)、1%非必需氨基酸(NEAA)、胶原酶Ⅵ、Trizol、DPBS、CTSTMTrypLETMSelect Enzyme(Gibco,美国);丝裂霉素C、α-二巯基乙醇、β-甘油磷酸钠、地塞米松、抗坏血酸(VitC)、吲哚美辛、3-异丁基-1-甲基黄嘌呤(Sigma,美国);间充质干细胞成软骨分化培养基(Promo cell,德国);碱性成纤维细胞生长因子(bFGF)(Peprotech,美国),血小板裂解物(Helios,中国);胰岛素、肝素钠、反转录(PCR)试剂盒(Takara,日本);PCR引物由南京瑞真生物技术有限公司合成。
兔多克隆抗体OCT4、NONAG、小鼠单克隆抗体SSEA-4羊抗兔二抗(红色)、羊抗鼠二抗(绿色)(Abcam,美国);流式抗体PE Mouse-Anti-Hman CD44、CD73、CD90、CD105、CD11b/Mac-1、CD19、CD34、CD45,FITC-Mouse-Anti-Human HLA-DR,DP,DQ、PE-Mouse-IgG2b、FITC-Mouse-IgG2a(BD,美国);Mount封片剂(SBA,美国)。
二、方法
hESC细胞系CCRM15和CCRM22来源于不孕不育夫妇向本院生殖中心捐赠的废弃胚胎。羊膜间充质干细胞来源的羊膜、脐带间充质干细胞来源的脐带,均由足月剖宫产产妇捐赠。实验方案取得医院伦理委员会批准,捐献志愿者均签署了书面知情同意书。
(一)人胚胎干细胞的建系及鉴定
1.胚胎干细胞的建系及培养:参照本实验既往建立hESC的方法[24-25]建立胚胎干细胞系CCRM15。简要步骤如下:提前准备滋养层小鼠成纤维细胞(MEF),在胚胎第6天,将去除透明带的囊胚种植于MEF上,每天更换ES培养基(DMEM/F12+20% KO-SR+1% LG+1% PS+1% NEAA+0.1 mmol/L α-二巯基乙醇+10 ng/ml bFGF),待出现克隆样生长的细胞团,机械法传代(5代后用1 mg/ml 胶原酶Ⅵ消化后传代)。
2.人胚胎干细胞表面标志物表达鉴定:4%多聚甲醛室温固定hESCs,杜氏磷酸盐缓冲液(DPBS)洗涤,0.4% Triton X-100/PBS破膜,然后依次用5%BSA封闭、加一抗OCT4(1∶200)、NANOG(1∶200)、SSEA-4(1∶500),过夜;洗涤后加二抗,室温避光孵育,DPBS洗涤,Mount封片,荧光显微镜拍照。
3.拟胚状体分化:hESCs克隆用1 mg/ml胶原酶Ⅳ不完全消化,使其保持团块状;接种至不贴壁培养皿内,加入不含bFGF的hESCs培养基;隔天换液,培养7 d。
4.基因组测序鉴定核型:收集培养至第6天的hESCs,应用美国Life TECH公司的Ion Torrent PGM测序系统,对人类全基因组进行较低深度(0.07X覆盖度)的高通量全基因组测序。
(二)间充质干细胞的建系及鉴定
1.羊膜间充质干细胞的建系及培养:本实验室改进了Marongiu等[26]的方法进行人类羊膜间充质干细胞(AMSC)的分离,建立AMSC株系AMSC1.2.2 (46,XY)、AMSC2.2.2 (46,XX)。简述如下:DPBS清洗羊膜去除血细胞,加入Tryple,37℃水浴30 min;再次洗涤剩余组织,加入新鲜Tryple,37℃水浴45 min;加入PLT培养液(α-MEM+5%血小板裂解物+1%LG+2000u/ml肝素钠)中和,离心弃上清;PLT培养液重悬细胞,种于培养皿,每3 d换液;当细胞融合度达80%~90%时,1∶4传代。
2.脐带间充质干细胞的建系及培养:本实验按以下方法分离人类脐带间充质干细胞(UMSC),建立UMSC株系UMSC2.2.2(46,XX)、AMSC4.2.2(46,XY):脐带用DPBS清洗后剪成2 cm的小块,抽除动、静脉;将脐带小块剪碎成2 mm左右碎片,移至培养皿中均匀铺开;加入少量PLT培养液湿润组织,培养皿倒置放入培养箱培养24 h;加入足量血小板裂解物(PLT)培养基,继续培养1~2周,加入Tryple消化组织块周围爬出的细胞,1∶3传代。
3.流式细胞技术检测AMSCs和UMSCs细胞表面标志物:AMSCs和UMSCs 均在第三代(P3)进行检测。检测基因包括血管细胞相关标志(CD11b、CD19、CD34、CD45)、间充质干细胞表面标志(CD44、CD73、CD90、CDl05)和免疫排斥相关的表面标志(HLA-DP/DQ/DR)。DPBS洗涤细胞,Tryple消化,等量PLT培养液中和后离心、重悬、分装;分别加入鼠抗人流式抗体及相对应的同型对照,4℃避光放置20 min;离心、洗涤,加入DPBS重悬细胞,上机检测(型号Gallios,Beckman,美国)。
4.AMSCs和UMSCs分化潜能检测:AMSCs和UMSCs分别均在P3代进行中胚层分化诱导实验。①成骨分化:细胞用DPBS洗涤后加入成骨分化培养基(DMEM+10% FBS+1% PS+10 mmol/L β-甘油磷酸钠+0.1 μmol/L地塞米松+50 mg/L抗坏血酸),每3 d换液,培养至21 d;茜素红染色。②成脂分化:细胞用DPBS洗涤后加入成脂分化培养基(DMEM+10% FBS+1 μmol/L地塞米松+200 μmol/L吲哚美辛+0.5 mmol/L 3-异丁基-1-甲基黄嘌呤+10 mg/L胰岛素),每3 d换液,培养至14 d;油红O染色。③成软骨分化:将细胞种于U型96孔板内(1×105cells/孔),PLT培养,细胞成球后,培养液更换为商品化成软骨分化培养基,每3 d换液,培养21 d;阿辛蓝染色。
5.遗传标志检测-STR图谱鉴定AMSCs和UMSCs:利用遗传标志检测-STR图谱鉴定AMSCs和UMSCs的纯合性以及核型,该实验由南京医科大学医学检验学院完成。
(三)实时荧光定量聚合酶链反应(RT-qPCR)
在CCRM15 (46,XX)、CCRM22 (46,XY)培养的第6天,加入胶原酶IV、Dispase消化为细胞克隆并收集、洗涤,然后加入tryple消化成单细胞;在AMSC1.2.2 (46,XY)、AMSC2.2.2 (46,XX)、UMSC2.2.2 (46,XX)、UMSC4.2.2 (46,XY)培养的第3天、细胞呈90%融合度时,加入tryple消化成单细胞。在以上细胞中加入适量的Trizol 试剂,按照Trizol试剂操作说明书提取总RNA;根据 Takara公司的逆转录试剂盒进行逆转录,获得cDNA为模板分别以下述引物(表1),在RT-PCR仪(Life Technologies,美国)进行RT-qPCR检测。反应过程如下:94℃预变性1 min;94℃变性45 s,55℃退火45 s,72℃延伸45 s,以上过程进行30个循环;最后72℃延伸5 min。每个样品以其β-actin的表达量进行定量,实验重复3次,结果以倍数改变±SD表示。

表1 各细胞因子引物序列
三、统计学方法
结果
一、建立、鉴定hESC细胞系
我们之前的研究证实CCRM22(46,XY)具有hESC的典型特征[24]。本次实验建立的CCRM15特性与CCRM22一致:细胞呈克隆状生长(图1A),能形成拟胚体(图1B),表达多能性标志物OCT4、NONAG、SSEA-4(图1C);另外,测序结果显示其染色体核型为46,XX (图1D)。
二、建立、鉴定AMSC、UMSC株系
成功建立AMSCs细胞系两株,命名为AMSC1.2.2及AMSC2.2.2。P0时细胞混有少量羊膜上皮细胞,纯化至P3时细胞呈典型的间充质细胞形态,呈放射状或漩涡状分布(图2A)。
建立UMSCs细胞系两株,命名为UMSC2.2.2和UMSC4.2.2。在组织块贴壁培养约7 d左右组织块周围有细胞爬出,至贴壁培养14 d左右第一次传代,其后每3~4 d可传代,细胞形态为梭形,为间充质细胞形态(图2B)。
细胞系遗传标志检测-STR图谱结果显示:UMSC2.2.2为46,XX;AMSC1.2.2和UMSC4.2.2来自同一胎盘,为46,XY;AMSC2.2.2已知胎儿性别为女性,即为46,XX。
流式细胞检测结果表明:新建立的AMSC、UMSC系均符合间充质干细胞的质量鉴定标准[27],其中CD44、CD73、CD90和CD105阳性率均超过95%,而CD11b、CD19、CD34、CD45以及HLA-DR/DP/DQ的阳性率均<2%(图3A~D)。
新建立的AMSCs、UMSCs均具有向中胚层分化潜能。在诱导分化条件下,4种间充质干细胞均可被诱导分化为成脂细胞(油红阳性)、成骨细胞(茜素红染色阳性)和成软骨细胞(阿辛蓝染色阳性)(图4)。
三、hESC、AMSC和UMSC细胞分泌因子基因表达水平的比较
选取生殖细胞发育相关的高分泌的细胞因子进行分析。选取细胞因子种类包括:(1)促炎因子IL-6、IL-8和TNF-α;(2)抑炎因子IL-10;(3)生长因子HGF、BDNF、SCF和VEGF;(4)基质金属蛋白酶MMP-1及其抑制剂TIMP-1;(5)血管形成因子Angiogenin,造血因子LIF和骨形成蛋白BMP4。
(一)同种类型、不同性别干细胞中细胞分泌因子表达水平的比较
1.不同性别hESC中细胞分泌因子表达水平的比较:比较女性胚胎干细胞株系CCRM15(46,XX)、男性胚胎干细胞株系CCRM22(46,XY)中细胞分泌因子的相对表达水平(图5)。发现:(a)促炎因子IL-6、IL-8低水平表达,TNF-α极低水平表达,且在CCRM15中的表达水平分别为CCRM22的4.3倍(P<0.01)、10.3倍(P<0.001)、13.9倍(P<0.001)。(b)抑炎因子IL-10在两种hESCs中表达水平极低,在CCRM22中的表达水平约为CCRM15的2.1倍(P<0.01)。(c)生长因子在hESCs中表达水平较高,其中SCF、BDNF及HGF在CCRM22中的表达均显著高于CCRM15,分别为1.3倍(P<0.01)、3.4倍(P<0.01)、3.8倍(P<0.001);VEGF的表达水平无显著的性别差异(P>0.05)。(d)金属蛋白酶MMP-1及其抑制剂TIMP-1在hESCs中高水平表达,且在CCRM15中的表达水平均显著高于CCRM22,分别为6.1倍(P<0.001)、1.1倍(P<0.001)。(e)BMP4在hESCs中高水平表达,但无显著的性别差异(P>0.05);LIF在hESCs中低水平表达,且在CCRM22中的表达量显著高于CCRM15(1.9倍,P<0.01);Angiogenin的表达水平与LIF相当,但在CCRM15中较高,为CCRM22中表达量的1.6倍(P<0.01)。

A:CCRM15和CCRM27均呈克隆状生长,核质比高,边界清晰(×4);B:CCRM15能形成拟胚状体,图为拟胚状体培养Day 4和Day 7时形态(×10);C:免疫荧光检测CCRM15多能性基因,其中OCT4、NANOG红色信号为阳性,SSEA-4绿色信号为阳性,蓝色为PAPI染核(×10);D:基因组测序结果表明CCRM的核型为46,XX。标尺=50 μm图1 CCRM15的细胞形态及多能性鉴定

图2 间充质干细胞的细胞形态

A:AMSC2.2.2;B:AMSC1.2.2;C:UMSC2.2.2;D:UMSC4.2.2。图中横坐标均表示荧光强度,纵坐标均表示细胞计数。 CD44、CD73、CD90以及CD105阳性率>95%,CD11b、CD19、CD34、CD45以及HLA-DR/DP/DQ阳性率<2%图3 AMSCs和UMSCs表面标志物流式检测
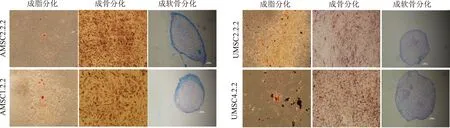
AMSC2.2.2、AMSC1.2.2、UMSC2.2.2、UMSC4.2.2在体外诱导条件下向中胚层分化:成脂、成骨、成软骨分化。成脂分化为油红O染色阳性,成骨分化为茜素红染色阳性,成软骨分化为阿辛蓝染色阳性(均为×10)图4 AMSCs和UMSCs具有向中胚层组织细胞分化潜能

以CCRM15为基数,比较各因子的相对表达倍数。*P<0.01;#P<0.001图5 hESC株系CCRM15、CCRM22中细胞分泌因子相对表达水平比较
2.不同性别AMSC中细胞分泌因子表达水平的比较:比较羊膜间充质干细胞女性株系AMSC2.2.2 (46,XX)和男性株系AMSC1.2.2(46,XY)中细胞分泌因子的相对表达水平(图6)。结果表明:(a)促炎因子IL-6、IL-8高表达,且AMSC2.2.2中的表达水平显著高于AMSC1.2.2,分别为3.4倍(P<0.01)、8.6倍(P<0.01);而TNF-α表达水平极低,且无显著的性别差异(P>0.05)。(b)抑炎因子IL-10表达水平极低,且无显著的性别差异(P>0.05)。(c)生长因子在AMSCs中高表达,其中BDNF、HGF在AMSC2.2.2中的表达量显著高于AMSC1.2.2,分别为1.2倍(P<0.05)、3.9倍(P<0.001);与此相反,VEGF在AMSC1.2.2的表达水平则为AMSC2.2.2中的3.1倍(P<0.01);SCF的表达量无显著的性别差异(P>0.05)。(d)金属蛋白酶MMP-1低水平表达,其抑制剂TIMP-1以极高水平表达,但两种分泌因子的表达水平均无显著的性别差异(P>0.05)。(e)BMP4高水平表达,Angiogenin、LIF低水平表达,且在AMSC1.2.2中的表达水平均显著高于AMSC2.2.2,分别为5.4倍(P<0.001)、3.3倍(P<0.001)、1.8倍(P<0.01)。
3.不同性别UMSC中细胞分泌因子表达水平的比较:比较脐带间充质干细胞女性株系UMSC2.2.2(46,XX)和男性株系UMSC4.2.2(46,XY)中细胞分泌因子的表达水平(图7)。结果显示:(a)促炎因子IL-6、IL-8高表达,TNF-α极低表达,且IL-6、IL-8在UMSC2.2.2中的表达水平显著高于UMSC4.2.2,分别为3.9倍(P<0.001)、6.1倍(P<0.001);而TNF-α在UMSC4.2.2中的表达水平显著高于UMSC4.2.2(10.3倍,P<0.01)。(b)抑炎因子IL-10在以极低水平表达,但UMSC4.2.2中的表达水平显著高于UMSC2.2.2(1.9倍,P<0.01)。(c)生长因子在两种性别细胞中均高表达,其中BDNF、HGF在UMSC2.2.2中的表达水平显著高于UMSC4.2.2,分别为2.6倍(P<0.001)、5.5倍(P<0.001),而VEGF在UMSC4.2.2中的表达水平较高,为UMSC2.2.2的1.4倍(P<0.05);SCF的表达水平无显著的性别差异(P>0.05)。(d)金属蛋白酶MMP-1在UMSCs中低水平表达,且UMSC4.2.2中的表达水平显著高于UMSC2.2.2(9.6倍,P<0.001);而其抑制剂TIMP-1在UMSCs中高表达,且在UMSC2.2.2中的表达水平为UMSC4.2.2中的3.8倍(P<0.05)。(e)BMP4、Angiogenin在UMSC2.2.2低水平表达,BMP4表达水平在UMSC4.2.2中显著高于UMSC2.2.2(1.8倍,P<0.05);而Angiogenin、LIF的表达水平无显著的性别差异(P>0.05)。

以AMSC2.2.2为基数,比较各因子的相对表达倍数。*P<0.05;**P<0.01;#P<0.001图6 AMSC株系AMSC2.2.2、AMSC1.2.2中细胞分泌因子相对表达水平比较

以UMSC2.2.2为基数,比较各因子的相对表达倍数。*P<0.05;**P<0.01;#P<0.001图7 UMSC株系UMSC2.2.2、UMSC4.2.2中细胞分泌因子相对表达水平比较
(二)不同类型、同性别干细胞中细胞分泌因子表达水平的比较
1.不同类型女性干细胞中细胞分泌因子表达水平的比较:两两比较女性干细胞系CCRM15、AMSC2.2.2、UMSC2.2.2中细胞分泌因子的相对表达水平(图8)。发现:(a)促炎因子IL-6、IL-8表达水平在三种细胞间存在显著差异,其中IL-6的相对表达量排序为AMSC2.2.2(4.9倍,P<0.001)>UMSC2.2.2(3.0倍,P<0.001)>CCRM15,IL-8为UMSC2.2.2(2.0倍,P<0.001)>AMSC2.2.2(3.0倍,P<0.001)>CCRM15;而TNF-α在CCRM15的相对表达量显著高于AMSC2.2.2(16.0倍,P<0.001)和UMSC2.2.2(47.1倍,P<0.001),但AMSC2.2.2和UMSC2.2.2间并无显著差异(P>0.05)。(b)抑炎因子IL-10在CCRM15的相对表达量显著高于AMSC2.2.2(2.0倍,P<0.05)和UMSC2.2.2(3.1倍,P<0.01),但AMSC2.2.2和UMSC2.2.2间无显著差异(P>0.05)。(c)生长因子VEGF、HGF的表达量在CCRM15、AMSC2.2.2、UMSC2.2.2三者间均存在显著差异性,VEGF表达量排列顺序为UMSC2.2.2(5.6倍,P<0.01)>AMSC2.2.2(2.5倍,P<0.05)>CCRM15,HGF为UMSC2.2.2(3.6倍,P<0.01)>AMSC2.2.2(3.9倍,P<0.01)>CCRM15;BDNF在AMSC2.2.2、UMSC2.2.2中的表达水平均显著高于CCRM15,分别为2.1倍(P<0.01)、2.0倍(P<0.01),但AMSC2.2.2、UMSC2,2.2之间无显著差异(P>0.05);SCF在三种细胞系间的表达水平无显著差异性(P>0.05)。(d)金属蛋白酶MMP-1及其抑制剂TIMP-1的相对表达水平在CCRM15、AMSC2.2.2和UMSC2.2.2三者间均存在显著差异,MMP-1的表达水平排列顺序为CCRM15(5.4倍,P<0.001)>AMSC2.2.2(5.0倍,P<0.01)>UMSC2.2.2,TIMP-1则为AMSC2.2.2(1.1倍,P<0.001)>UMSC2.2.2(37.2倍,P<0.001)>CCRM15。(e)BMP4表达水平在CCRM15中显著高于AMSC2.2.2(18.5倍,P<0.001)和UMSC2.2.2(7.2倍,P<0.001),但AMSC2.2.2、UMSC2.2.2间无显著差异(P>0.05);LIF的表达水平在UMSC2.2.2中显著高于CCRM15(1.4倍,P<0.05),但UMSC2.2.2与AMSC2.2.2间、AMSC2.2.2与CCRM15间无显著差异(P>0.05);Angiogenin在三种细胞系中的表达水平均存在显著差异,排列顺序为UMSC2.2.2(1.2倍,P<0.05)>CCRM15(1.5倍,P<0.01)>AMSC2.2.2。
2.不同类型男性干细胞中细胞分泌因子表达水平的比较:两两比较男性干细胞系CCRM22、AMSC1.2.2和UMSC4.2.2中细胞分泌因子的相对表达水平(图9)。发现:(a)促炎因子中,IL-6在UMSC4.2.2中的表达水平显著高于CCRM22(3.3倍,P<0.01),其它细胞系之间无显著差异(P>0.05);IL-8、TNF-α在三种细胞中的表达水平无显著差异(P>0.05)。(b)抑炎因子IL-10在CCRM22中的表达水平显著高于AMSC1.2.2(3.5倍,P<0.001)、UMSC4.2.2(3.4倍,P<0.01),但AMSC1.2.2和UMSC4.2.2之间无显著差异(P>0.05)。(c)生长因子SCF、VEGF、BDNF以及HGF在三种细胞中的相对表达量均存在显著差异性:SCF表达水平排列顺序为CCRM22(1.2倍,P<0.05)>AMSC1.2.2(1.3倍,P<0.05)>UMSC4.2.2,BDNF为CCRM22(2.2倍,P<0.001)>AMSC1.2.2(2.0倍,P<0.01)>UMSC4.2.2,VEGF为UMSC4.2.2(2.6倍,P<0.001)>AMSC1.2.2(21.0倍,P<0.001)>CCRM22,HGF为CCRM22(1.4倍,P<0.05)>UMSC4.2.2(2.6倍,P<0.01)>AMSC1.2.2。(d)金属蛋白酶MMP-1在UMSC4.2.2中的表达水平显著高于CCRM22(2.1倍,P<0.01)、AMSC1.2.2(1.8倍,P<0.01),而在CCRM22、AMSC1.2.2间无显著差异性(P>0.05);金属蛋白酶抑制剂TIMP-1的表达水平在AMSC1.2.2中显著高于CCRM22(20.7倍,P<0.001)和UMSC4.2.2(1.9倍,P<0.01),但CCRM22和UMSC4.2.2间无显著差异性(P>0.05)。(e)BMP4在CCRM22中的表达水平显著高于AMSC1.2.2(3.2倍,P<0.001)、UMSC4.2.2(3.8倍,P<0.001),而在AMSC1.2.2、UMSC4.2.2之间无显著差异(P>0.05);Angiogenin在三者间均有显著差异,且AMSC1.2.2(2.0倍,P<0.001)>UMSC4.2.2(1.7倍,P<0.001)>CCRM22;LIF的相对表达量在三者之间无显著差异(P>0.05)。

以CCRM15为基数,比较相同性别不同种类干细胞细胞分泌因子的相对表达倍数。*P<0.05;**P<0.01;#P<0.001图8 女性株系CCRM15、AMSC2.2.2以及UMSC2.2.2中细胞分泌因子相对表达水平比较

以CCRM22为基数,比较相同性别不同种类干细胞细胞分泌因子的相对表达倍数。*P<0.05;**P<0.01;#P<0.001图9 男性株系CCRM22、AMSC1.2.2以及UMSC4.2.2中细胞分泌因子相对表达水平比较
讨论
干细胞分为胚胎干细胞(ES)和间充质干细胞(MSCs),根据其来源又可以具体分为胚胎干细胞(ESCs)、新生儿附属物干细胞(NDSCs)、成体间充质干细胞(ASCs)、组织干细胞(TSCs)、诱导多能干细胞(iPSCs)等,其中NDSCs、ASCs和TSCs同属于MSCs类型。
不同来源的干细胞临床应用范围、价值也各不相同。因为ES具有致瘤性,且存在伦理问题,因此hES更多的是用于机制研究而很少用于临床治疗,例如用来研究生殖细胞发育的调控机制[28-29]。MSCs来源较广,具有低免疫原性的特性,因而具有较高的临床应用潜能。目前,MSCs已广泛用于改善化疗后所致卵巢功能减退的研究[12-13],而进入体内的MSCs并不能进一步分化为生殖细胞。我们推测,进入小鼠体内的MSCs通过分泌细胞因子来改善卵巢功能,其作用机制与脂肪间充质干细胞分泌的细胞因子可以改善小鼠阿尔兹海默症症状[30]、羊膜间充质干细胞分泌的细胞因子可减少小鼠心肌梗死面积[15]类似。
细胞因子种类繁多,具体是哪一类或哪几类细胞因子在其中发挥关键作用,目前尚无定论。另外,干细胞种类不同,分泌的细胞因子数量、质量存在差异;而对于改善生殖功能,可能不同性别干细胞具有不同的疗效。为给基于干细胞的临床治疗提供依据,本研究比较包括了2种性别的3种干细胞类型、共6个细胞株中干细胞分泌因子表达水平的差异。
同类型、不同性别细胞进行比较时:(1)促炎因子IL-8、金属蛋白酶及其抑制剂、Angiogenin在女性hESC系中的表达水平显著高于男性hESC;而抑炎因子IL-10、生长因子HGF、BDNF、SCF及LIF则在男性hESC中的表达水平较高;(2)促炎因子IL-6、IL-8、生长因子BDNF及HGF的表达量在女性AMSC系中显著高于男性AMSC系;VEGF、Angiogenin、LIF和BMP4则在男性AMSC系中的表达水平较高;(3)促炎因子IL-6、TNF-α,生长因子BDNF、HGF及金属蛋白酶抑制剂TIMP-1均在女性UMSC系中具有较高表达水平;而促炎因子IL-8,抑炎因子IL-10,生长因子VEGF,金属蛋白酶MMP-1及BMP4均在男性UMSC系中表达水平较高。
同性别、不同类型细胞进行比较时,实验结果显示:(1)在女性细胞中,促炎因子IL-8,生长因子VEGF、HGF,LIF以及Angiogenin在UMSC中相对表达水平显著高于其他细胞系;促炎因子IL-6及金属蛋白酶抑制剂TIMP-1则在AMSC中的相对表达量较高;而促炎因子TNF-α、抑炎因子、金属蛋白酶MMP-1、BMP4在hESC中表达水平显著高于成体干细胞;(2)男性细胞系中,促炎因子、金属蛋白酶的表达水平在UMSCs中显著高于其他两种细胞类型;而抑炎因子、BMP4的表达水平在hESCs中较高;金属蛋白酶抑制剂、Angiogenin的表达水平在成体干细胞中较高;生长因子的表达水平在三种细胞系中存在显著差异、互有高低。
总之,女性hESCs、男性UMSCs可分泌较多的金属蛋白酶,具有更强的降解纤维的能力,临床上可考虑用于促进伤口愈合、抑制或消除疤痕;而女性UMSCs分泌生长因子、血管生成因子、造血因子、抑炎因子的能力要强于hESCs、AMSCs,可能具有更好的改善血供、提高生殖功能的疗效。以上推测尚需动物实验进一步验证。
本实验通过比较不同性别、不同类型干细胞中细胞分泌因子的表达水平差异,为研究干细胞治疗、特别是POF治疗机制提供了基础,同时也为选择合适类型的干细胞来实施POF临床治疗提供理论依据。
【参考文献】
[1]Cherry AB,Daley GQ.Reprogramming cellular identity for regenerative medicine[J].Cell,2012,148:1110-1122.
[2]Liu J,Zhang H,Zhang Y,et al.Homing and restorative effects of bone marrow-derived mesenchymal cells on cisplatin injured ovaries in rats[J].Mol Cells,2014,37:865-872.
[3]Shelling AN.Premature ovarian failure[J].Reproduction,2010,140:633-641.
[4]Bachelot A,Rouxel A,Massin N,et al.Phenotyping and genetic studies of 357 consecutive patients presenting with premature ovarian failure[J].Eur J Endocrinol,2009,161:179-187.
[5]Panay N,Fenton A.Premature ovarian failure:a growing concern[J].Climacteric,2008,11:1-3.
[6]Maclaran K,Panay N. Premature ovarian failure[J]. J Fam Plann Reprod Health Care,2011,37:35-42.
[7]Chen H,Li J,Cui T,et al.Adjuvant gonadotropin-releasing hormone analogues for the prevention of chemotherapy induced premature ovarian failure in premenopausal women[DB].Cochrane Database Syst Rev,2011,(11):CD008018.
[8]Antoine C,Ameye L,Paesmans M.et al. Systematic review about breast cancer incidence in relation to hormone replacement therapy use[J]. Climacteric,2014,17:116-132.
[9]Donnez J,Dolmans MM.Fertility preservation in women[J].Nat Rev Endocrinol,2013,9:736-749.
[10]Ghadami M,El-Demerdash E,Zhang D,et al.Bone marrow transplantation restores follicular maturation and steroid hormones production in a mouse model for primary ovarian failure[J/OL].PLOS One,2012,7:e32462.
[11]Kilic S,Pinarli F,Ozogul C,et al.Protection from cyclophosphamide-induced ovarian damage with bone marrow-derived mesenchymal stem cells during puberty[J].Gynecol Endocrinol,2014,30:135-140.
[12]Takehara Y,Yabuuchi A,Ezoe K,et al.The restorative of adipose-derived mesenchymal stem cells on damaged ovarian function[J].Lab Invest,2013,93:181-193.
[13]Xiao GY,Liu IH,Cheng CC,et al.Amniotic fluid stem cells prevent follicle atresia and rescue fertility of mice with premature ovarian failure induced by chemotherapy[J/OL].PLOS One,2014,9:e106538.
[14]Santiquet N,Vallieres L,Pothier F,et al.Transplanted bone marrow cells do not provide new oocytes but rescue fertility in female mice following treatment with chemotherapeutic agents[J].Cell Reprogram,2012,14:123-129.
[15]Danieli P,Malpasso G,Ciuffreda MC,et al.Conditioned medium from human amniotic mesenchymal stromal cells limits infarct size and enhances angiogenesis[J].Stem Cells Transl Med,2015,4:448-458.
[16]Gao Z,Zhang Q,Han Y,et al.Mesenchymal stromal cell-conditioned medium prevents radiation-induced small intestine injury in mice[J].Cytotherapy,2012,14:267-273.
[17]姚娜,李树德,王文林.IL-6,IL-10在实验性肺部炎症中的研究进展[J].昆明医科大学学报,2014,35:161-163.
[18]吕倩,王昌明,蒋明,等.HIF-1α和VEGF在大鼠COPD中的表达及肺血管重构的关系研究[J].中国药理学通报,2012,28:772-777.
[19]孙燕来,李增军.肝细胞生长因子及其受体c-Met表达与胃癌肝转移的相关性[J].实用医学杂志,2015,31:2635-2637.
[20]Nagase H,Visse R,Murphy G.Structure and function of matrix metalloproteinases and TIMPs[J].Cardiovasc Res,2006,69:562-573.
[21]Guo WT,Dong DL.Bone morphogenetic protein-4:a novel therapeutic target for pathological cardiac hyperrophy/heart failure[J].Heart Fail Rev,2014,19:781-788.
[22]Nicola NA,Babon JJ.Leukemia inhibitory factor (LIF)[J].Cytokine Growth Factor Rev,2015,26:533-544.
[23]Sheng J,Xu Z.Three decades of research on angiogenin:a review and perspective[J/OL].Acta Biochim Biophys Sin (Shanghai),2016,48:399-410.
[24]Jiang C,Cai L,Huang B,et al.Normal human embryonic stem cell lines were derived from microsurgical enucleated tripronuclear zygotes[J].J Cell Biochem,2013,114:2016-2023.
[25]Huang B,Jiang C,Chen A,et al.Establishment of human-embryonic-stem-cell line from mosaic trisomy 9 embryo[J].Taiwan J Obestet Gynecol,2015,54:505-511.
[26]Marongiu F,Gramignoli R,Sun Q,et al.Isolation of amniotic mesenchymal stem cells[J].Curr Protoc Stem Cell Bio,2010,Chapter 1:Unit1E.5-1E.5.11.
[27]Dominici M,Le Blanc K,Mueller I,et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement[J]. Cytotherapy,2006,8:315-317.
[28]Wongtrakoongate P,Jones M,Gokhale PJ,et al. STELLA facilitates differentiation of germ cell and endodermal lineages of human embryonic stem cells[J/OL]. PLoS One,2013,8:e56893.
[29]Gkountela S,Li Z,Vincent JJ,et al. The ontogeny of cKIT+human primordial germ cells proves to be a resource for human germ line reprogramming,imprint erasure and in vitro differentiation[J]. Nat Cell Biol,2013,15:113-122.
[30]Yamazaki H,Jin Y,Tsuchiya A,et al.Adipose-derived stem cell-conditioned medium ameliorates antidepression-related behaviors in the mouse model of Alzheimer’s disease[J].Neurosci Lett,2015,609:53-57.
[编辑:谷炤]
Expressions of secretory factors in different types of stem cells
ZHANG Qin-jing,CHEN Ai-qin,NING Song,GAO Chao,JIANG Chun-yan,CUI Yu-gui,CHEN Juan,QIN Lian-ju*,LIU Jia-yin*
StateKeyLaboratoryofReproductiveMedicine,CenterofClinicalReproductiveMedicine,FirstAffiliatedHospital,NanjingMedicalUniversity,Nanjing210029
【Abstract】Objective: To compare the expression levels of secretory cytokine in different type of stem cell,and explore their clinical significance.
Key words:Human embryonic stem cell;Human amniotic mesenchymal stem cell;Human umbilical cord mesenchymal stem cell;Secretory cytokine
DOI:10.3969/j.issn.1004-3845.2016.06.009
【收稿日期】2016-01-16;【修回日期】2016-02-05
【基金项目】973项目(2012CB944902);国家自然科学基金(81370764,81370754);江苏省科技厅项目(BL2012009、BM201358)、卫生厅项目(ZX201110)
【作者简介】张琴静,女,江苏昆山人,硕士,妇产科生殖医学方向.(*通讯作者,Email:ljqin@njmu.edu.cn;jyliu_nj@126.com)
