microRNA⁃122抑制肝肿瘤细胞HepG2的增殖研究
2016-06-27罗兰云
罗兰云
四川省人民医院肝胆脾胰外科和细胞移植中心,四川成都610072
microRNA⁃122抑制肝肿瘤细胞HepG2的增殖研究
罗兰云
四川省人民医院肝胆脾胰外科和细胞移植中心,四川成都610072
目的 探究microRNA⁃122(miR⁃122)对肝肿瘤细胞HepG2增殖的抑制效应。方法 培养肝肿瘤细胞HepG2并随机分为miR⁃122组、阴性对照组(NC组)、空白对照组,miR⁃122组使用LipofectamineTM2000试剂转染肝癌细胞株HepG2细胞,NC组将阴性对照siRNA转染HepG2细胞,空白对照组只加胎牛血清RPMI⁃1640培养基。转染24 h后,采用MTS试剂盒测定细胞活力,计算细胞增殖抑制率,采用荧光定量PCR测定细胞中凋亡抑制蛋白(XIAP)、细胞周期素D1(CyclinD1)、细胞周期蛋白依赖激酶2(CDK2)、细胞周期蛋白依赖激酶4(CDK4)、血管内皮生长因子(VEGF)、VEGFR1、VEGFR2、肝细胞生长因子(HGF)的mRNA含量。结果 干预后24 h,miR⁃122组细胞的吸光值(OD)明显低于空白对照组、NC组,细胞增殖抑制率明显高于NC组(t=9.43、19.475、P<0.05),miR⁃122组细胞中XIAP、CyclinD1、CDK2、CDK4 mRNA含量明显低于空白对照组、NC组(t=8.135、7.542、11.740、5.937,P<0.05),VEGF、VEGFR1、VEGFR2、HGF mRNA含量明显低于空白对照组、NC组(t=7.741、13.002、6.347、6.662,P<0.05)。结论miR⁃122能够抑制肝肿瘤细胞HepG2的增殖,靶向抑制细胞周期相关分子、血管新生相关分子的表达是miR⁃122发挥增殖抑制效应的可能机制。
肝癌;microRNA⁃122;细胞周期;增殖;血管新生
肝癌是一类恶性程度较高、预后较差的消化系统恶性肿瘤,肝脏组织血供丰富、癌细胞增殖十分活跃,手术切除后复发率高。尽管介入栓塞、射频消融等治疗手段的发展在一定程度上改善了肝癌患者的预后,但肝癌的生存率仍较低。无限增殖是肝癌细胞重要的生物学特征,抑制癌细胞增殖也是临床上治疗肝癌的重要靶点[1]。microRNA是一类长度18~25 bp的小分子非编码RNA,通过抑制基因的表达来调节细胞的生物学行为[2⁃3]。miRNA⁃122(miR⁃122)是一类具有抑癌活性的miRNA,且肝癌组织中miR⁃122的表达量显著降低,miR⁃122预期能够抑制肝癌细胞的增殖[4]。本研究中,我们分析了miR⁃122对肝肿瘤细胞HepG2增殖的抑制效应。
1 材料与方法
1.1 实验材料 肝肿瘤细胞HepG2购自中国科学院上海细胞研究所;miR⁃122购自德国QI AGEN公司;细胞培养所用RPMI 1640、胎牛血清、胰蛋白酶均购自Hyclone公司;Trizol裂解液及转染试剂LipofectamineTM2000购自Invitrogen公司;反转录及荧光定量PCR试剂盒购自Promega公司,PCR所用引物由上海生工公司合成;显微镜购自日本Olympus公司;低温高速离心机购自法国BIO⁃RAD公司;紫外分析仪购自上海天能科技有限公司(UV⁃2000)。
1.2 方法
1.2.1 细胞培养及干预:肝肿瘤细胞HepG2复苏后用含有10%胎牛血清的RPMI 1640进行培养,每2~3 d换液一次,待细胞密度生长至80%~90%后进行消化传代,消化所用胰蛋白酶的浓度为0.25%,消化后的细胞分别接种在培养瓶和培养板中,培养瓶中的细胞用于继续消化传代,培养板中的细胞用于处理,根据处理条件不同分为miR⁃122组、阴性对照组(NC组)、空白对照组。miR⁃122组使用LipofectamineTM2000试剂转染肝癌细胞株HepG2细胞,NC组将阴性对照siRNA转染HepG2细胞(转染时间为24 h);空白对照组只加含10%胎牛血清RPMI⁃1640培养基。
1.2.2 细胞活力检测:用于细胞周期检测的细胞接种在6孔培养板中,处理24 h后在培养体系中加入细胞活力检测液20 μl,继续孵育4 h后,在酶标仪上读取450 nm处的吸光值(OD值),计算细胞增殖抑制率(%)=(空白对照组-处理组)/空白对照组×100%。
1.2.3 分子mRNA含量的检测:用于mRNA含量检测的细胞接种在6孔培养板中,处理24 h和48 h后弃去培养基,用PBS缓冲液洗涤两遍后将细胞培养板放置在-80℃低温冰箱保存。检测时,取出细胞培养板,每孔加入Trizol裂解液1 ml,充分裂解细胞后用三氯甲烷和异丙醇进行萃取、离心,得到RNA斑块后用75%酒精洗涤2遍,最后用适量DEPC水溶解。取RNA样本并进行反转录反应,合成cDNA第一链;取cDNA样本并用荧光定量PCR试剂盒进行扩增,分别扩增凋亡抑制蛋白(XIAP)、细胞周期素D1(CyclinD1)、细胞周期蛋白依赖激酶2(CDK2)、细胞周期蛋白依赖激酶4(CDK4)、血管内皮生长因子(VEGF)、VEGFR1、VEGFR2、肝细胞生长因子(HGF),以甘油醛⁃3⁃磷酸脱氢酶(glyceraldehyde⁃3⁃phosphate dehydrogenase,GAPDH)为内参照,计算上述分子的mRNA含量。
1.3 统计学分析 采用SPSS 20.0软件进行统计学分析,计量资料以x ±s表示,多组间比较采用方差分析,两两比较采用LSD⁃t检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞活力及抑制率 干预后24 h,miR⁃122组细胞的OD值明显低于空白对照组、NC组,细胞增殖抑制率明显高于NC组(P<0.05);空白对照组和NC组OD值比较,差异无统计学意义(P>0.05,见表1)。
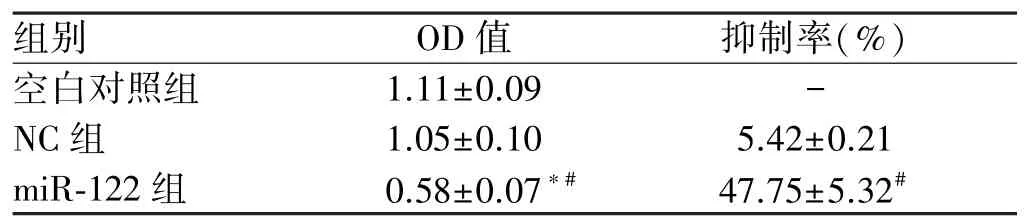
表1 三组细胞的活力及抑制率比较(x±s)Tab 1 Comparison of activity and inhibition rate in 3 groups(x±s)
2.2 细胞周期相关蛋白的mRNA表达量 干预后24 h,miR⁃122组细胞中XIAP、CyclinD1、CDK2、CDK4 mRNA含量明显低于空白对照组、NC组(P<0.05);空白对照组与NC组比较,差异无统计学意义(P>0.05,见表2)。

表2 三组细胞中细胞周期相关蛋白的mRNA表达量比较(x ±s)Tab 2 Expressions of cell cycle related proteins in 3 groups of cells(x ±s)
2.3 血管新生分子的mRNA表达量 干预后24 h,miR⁃122组细胞中VEGF、VEGFR1、VEGFR2、HGF mRNA含量明显低于空白对照组、NC组(P<0.05);空白对照组与NC组比较,差异无统计学意义(P>0.05,见表3)。

表3 三组细胞中血管新生分子的mRNA表达量(x ±s)Tab 3 Expressions of angiogenic molecules in 3 groups of cells(x ±s)
注:与空白对照组比较,t=7.229、11.826、6.636、6.291、∗P<0.05;与NC组比较,t=7.741、13.002、6.347、6.662,#P<0.05。
3 讨论
microRNA是近年来新发现的非编码小分子RNA,通过与mRNA 3’UTR区域互补配对抑制靶基因的翻译[5]。miR⁃122是在肝脏组织中特异性表达的一类miRNA,对肝细胞的增殖、迁移、侵袭等生物学特征均具有调节作用[6]。近年来研究证实,miR⁃122具有抑癌活性,肝癌组织中低表达的miR⁃122与细胞增殖、细胞周期相关[7]。但miR⁃122是否直接调控肝癌细胞的增殖尚不明确,能否通过转染降低癌变细胞的表达或采用miR⁃122替代治疗肝癌还有很多争议[8]。本文通过转染miR⁃122模拟物的方式来增加肝癌细胞中miR⁃122的表达,而后对细胞活力及抑制率进行分析,结果表明,miR⁃122组细胞的OD值明显低于空白对照组、NC组,抑制率明显高于NC组,提示miR⁃122能够降低肝癌细胞的活力,促进肿瘤细胞的凋亡。
细胞周期相关蛋白是调节细胞增殖、细胞周期发展的重要分子。XIAP是体内重要的凋亡抑制分子,能够通过调节下游Cyclin/CDK的活性来促进细胞增殖[9]。已有研究证实,XIAP能够增加细胞周期蛋白CyclinD1及其激酶CDK2、CDK4的表达,进而加速细胞周期进程、促进细胞增殖[10⁃11]。CyclinD1是细胞周期蛋白家族的重要成员,与CDK2、CDK4形成复合体后能够启动E2F2下游通路、缩短细胞周期、促进细胞增殖[12]。通过对上述细胞周期相关蛋白表达量的分析,miR⁃122组细胞中XIAP、CyclinD1、CDK2、CDK4 mRNA含量明显低于空白对照组、NC组。说明miR⁃122能够靶向抑制肝癌细胞中细胞周期相关蛋白XIAP、CyclinD1、CDK2、CDK4表达。
肝癌病灶内新生血管生成是促进肝癌细胞增殖的重要病理环节,新生的血管能够为细胞增殖提供必需的氧气及养分[13]。VEGF是目前已知促血管新生效应最为明确的细胞因子,通过与血管内皮细胞上的受体VEGFR1、VEGFR2结合促进新生血管的形成[14]。HGF是具有促进血管新生作用的多功能细胞因子,在肝细胞增殖、转移及局部组织血管新生的过程中均发挥了重要的调节作用[15]。在肝癌的发生、发展过程中,局部组织中高表达的VEGF、HGF能够促进肝癌的病情进展[16]。本研究同样证实,miR⁃122能够靶向抑制肝癌细胞中促血管新生分子VEGF、VEGFR1、VEG⁃FR2、HGF的表达。
本研究表明,miR⁃122能够抑制肝肿瘤细胞HepG2的增殖,靶向抑制细胞周期相关分子、血管新生相关分子的表达是miR⁃122发挥增殖抑制效应的可能机制。需要指出的是,miR⁃122抑制肝癌生长的途径很多,如抗凋亡蛋白Bcl⁃w的表达等,本研究局限于实验条件的限制,检测指标相对较少,miR⁃122抑制肝肿瘤细胞HepG2增殖的作用机制还有待更多的实验研究去证实。
[1]潘康明,邓量,许峰峰.早期生长反应基因2在肝癌组织的表达及对细胞增殖能力的影响[J].中华实验外科杂志,2016,33(5):1315⁃1317.Pan KM,Deng L,Xu FF.Expression of early growth response 2 in hep⁃atocellular carcinoma and its effect on proliferation of HepG2 cells[J].Chin J Exp Surg,2016,33(5):1315⁃1317.
[2]Spaniel C,Honda M,Selitsky SR,et al.microRNA⁃122 abundance in hepatocellular carcinoma and non⁃tumor liver tissue from Japanese pa⁃tients with persistent HCV versus HBV infection[J].PLoS One,2013,8(10):e76867.
[3]许丽娜,黄东凤,李峰,等.血清miRNA⁃122和miRNA⁃221在原发性肝癌患者的表达及其诊断价值[J].江苏医药,2015,41(11):1285⁃1288.Xu LN,Huang DF,Li F,et al.Expressions and significance of serum miRNA⁃122and miRNA⁃221in diagnosis of primary hepatic carcinoma[J].Jiangsu Medical Journal,2015,41(11):1285⁃1288.
[4]陈素玲,李芳,柴海云,等.微小RNA⁃122在HBV感染慢性肝脏疾病中的表达及其临床意义[J].中华实验和临床感染病杂志(电子版),2015,9(6):68⁃72.Chen SL,Li F,Chai HY,et al.The expression and clinical signifi⁃cance of micro RNA⁃122 in different chronic liver diseases with HBV infection[J].Chin J Exp Clin Infect Dis(Electronic Version),2015,9(6):68⁃72.
[5]Xu Y,Huang J,Ma L,et al.MicroRNA⁃122 confers sorafenib resist⁃ance to hepatocellular carcinoma cells by targeting IGF⁃1R to regulate RAS/RAF/ERK signaling pathways[J].Cancer Lett,2016,371(2):171⁃181.
[6]张缨,贾绍昌,项方,等.miR⁃122在肝癌细胞中的表达及其与细胞周期调控的关系[J].临床肿瘤学杂志,2013,18(8):691⁃694.Zhang Y,Jia SC,Xiang F,et al.Expression of miR⁃122 in hepatocel⁃lular carcinoma and its relationship with cell cycle regulation[J].Chi⁃nese Clinical Oncology,2013,18(8):691⁃694.
[7]张洪亮,杨海霞,吴睿,等.肝癌患者组织中miR⁃122、miR⁃375表达分析[J].医药论坛杂志,2015,36(10):95⁃97.Zhang HL,Yang HX,Wu R,et al.Expression and analysis of miR⁃122 and miR⁃375 in the tissues of patients with hepatocellularcarcinoma[J].J Medical Forum,2015,36(10):95⁃97.
[8]王雨晴.microRNA在肝癌组织中的表达及其潜在临床价值分析[J].临床和实验医学杂志,2015,14(1):27⁃29.Wang YQ.Expression of microRNA in hepatocellular carcinoma tissue and its potential clinical value analysis[J].Journal of Clinical and Ex⁃perimental Medicine,2015,14(1):27⁃29.
[9]周伟,王兴远,周崑.吉西他滨热化疗灌注联合卡铂化疗栓塞对血清恶性生物学指标以及肝癌组织中凋亡调控基因表达的影响[J].海南医学院学报,2015,21(8):112⁃1115.Zhou W,Wang XY,Zhou K.Effect of gemcitabine heat perfusion chemotherapy combined with carboplatin chemotherapy embolization on serum indexes in patients with hepatocellular carcinoma[J].Journal of Hainan Medical University,2015,21(8):112⁃1115.
[10]邝少松,郑佳琳,杨林,等.CyclinE及相关基因在人原发性肝癌中的表达及其意义[J].中国肿瘤,2016,25(2):143⁃149.Kuang SS,Zheng JL,Yang L,et al.Expression and Significance of CyclinE and Related Genes in Hepatocellular Carcinoma[J].China Cancer,2016,25(2):143⁃149.
[11]Hongo F,Takaha N,Oishi M,et al.CDK1 and CDK2 activity is a strong predictor of renal cell carcinoma recurrence[J].Urol Oncol,2014,32(8):1240⁃1246.
[12]车宇芳,叶飞,青海涛,等.XIAP通过调节CDK4/CDK6/cyclin D1复合物表达促进肝癌细胞增殖[J].胃肠病学和肝病学杂志,2011,20(10):939⁃944.Che YF,Ye F,Qing HT,et al.XIAP promote cell proliferation of hepatocellular carcinoma through regulating expression of CDK4/CDK6/cyclin D1 complex[J].Chin J Gastroenterol Hepatol,2011,20(10):939⁃944.
[13]代少华.重组人血管内皮抑素介入栓塞治疗对肝癌组织中凋亡相关分子表达及血清中VEGF含量的影响[J].海南医学院学报,2015,21(7):974⁃976,980.Dai SH.Influence of recombinant human endostatin interventional em⁃bolization treatment on apoptosis related molecule expressions in liver cancer tissue and serum VEGF contents[J].Journal of Hainan Medi⁃cal University,2015,21(7):974⁃976,980.
[14]韩珍,孙焕芹,江娜,等.血管新生相关因子在乙型肝炎相关肝细胞癌各临床分期中的表达分析[J].临床肝胆病杂志,2015,31(6):932⁃935.Han Z,Sun HQ,Jiang N,et al.Agiogenesis⁃related factors in various clinical stages of hepatitis B⁃related hepatocellular carcinoma[J].J Clin Hepatol,2015,31(6):932⁃935.
[15]Abdel⁃Rahman O.Vascular endothelial growth factor(VEGF)pathway and neuroendocrine neoplasms(NENs):prognosticandther⁃apeutic considerations[J].TumourBiol,2014,35(11):10615⁃10625.
[16]Ratnasari N,Nurdjanah S,Sadewa AH,et al.The role of vascular endothelial growth factor⁃634 G/C and its soluble receptor on chronic liver disease and hepatocellular carcinoma[J].Arab J Gastroenterol,2016,17(2):61⁃66.
(责任编辑:马 军)
Research on microRNA⁃122 inhibiting the proliferation of hepatocellular carcinoma cells HepG2
LUO Lanyun
Department of Liver,Spleen and Pancreatic Surgery and Cell Transplantation Center,Sichuan Provincial People’s Hos⁃pital,Chengdu 610072,China
Objective To investigate the inhibiting effect of microRNA⁃122(miR⁃122)on the proliferation of hepa⁃tocellular carcinoma cells HepG2.Methods The hepatocellular carcinoma cells HepG2 were cultured and randomly di⁃vided into miR⁃122 group,negative control group(NC group)and blank control group.In miR⁃122 group,the HepG2 cells were transfected by LipofectamineTM2000 reagent.In NC group,the HepG2 cells were transfected by siRNA.In blank control group,only the fetal bovine serum culture medium RPMI⁃1640 was added.Twenty⁃four hours after the transfection,the cell viability was measured by MTS kit,and the cellular proliferation inhibition rate was calculated.Fluorescence quantitative PCR was adopted to measure the mRNA levels of X linked inhibitor of apoptosis protein(XI⁃AP),CyclinD1,cyclin dependent kinase 2(CDK2),cyclin dependent kinase 4(CDK4),vascular endothelial growth factor(VEGF),VEGFR1,VEGFR2 and hepatocyte growth factor(HGF).Results Twenty⁃four hours after the treat⁃ment,the optical density(OD)of cells in miR⁃122 group was significantly lower than that in blank control group and NC group,and the cellular proliferation inhibition rate was significantly higher than that in the NC group(t=9.43,19.475,P<0.05).The mRNA levels of XIAP,CyclinD,CDK2 and CDK 4 in miR⁃122 group were significantly lower than those in blank control group and NC group(t=8.135,7.542,11.740,5.937,P<0.05),and the mRNA levels of VEGF,VEGFR1,VEGFR2 and HGF were significantly lower than those in blank control group and NC group(t=7.741,13.002,6.347,6.662,P<0.05).Conclusion microRNA⁃122 can inhibit the proliferation of hepatocellular car⁃cinoma cell HepG2,and the possible mechanism is targeted inhibition of the expression of cell cycle relevant molecules and angiogenesis relevant molecules.
Hepatocellular carcinoma;MicroRNA⁃122;Cell cycle;Proliferation;Angiogenesis
R735.7
A
1006-5709(2016)12-1467-04
2016⁃02⁃26
10.3969/j.issn.1006⁃5709.2016.12.048
罗兰云,硕士研究生,副主任医师,研究方向:包虫病和细胞移植。E⁃mail:54241107@qq.com
