白蛋白结合型紫杉醇联合吉西他滨治疗局部进展期胰腺癌的疗效观察
2016-06-22唐美月王思亮
唐美月,石 宇,王思亮,吴 荣*
白蛋白结合型紫杉醇联合吉西他滨治疗局部进展期胰腺癌的疗效观察
唐美月1,石宇2,王思亮1,吴荣1*
1.中国医科大学附属盛京医院肿瘤科,沈阳 1100-22;2.中国医科大学情报学教研室,沈阳 110122
[摘要]目的评估白蛋白结合型紫杉醇联合吉西他滨治疗局部进展期胰腺癌的有效性及安全性。方法20例经病理确诊不能手术的局部进展期胰腺癌患者,给予白蛋白结合型紫杉醇+吉西他滨方案化疗:白蛋白结合型紫杉醇125 mg/m2,吉西他滨1 000 mg/m2,d1、d8给药,21 d重复1次。结果所有患者均进行疗效评价,其中完全缓解(CR)2例,部分缓解(PR)6例,疾病稳定(SD)9例,疾病进展(PD)3例。客观有效率(ORR):40%,疾病控制率(DCR):85%。中位无进展生存期(mPFS)和中位生存期(mOS)分别为5.5个月和10.3个月,1年生存率为40%。所有患者均未发生因不能耐受不良反应而停止治疗及治疗相关性死亡。其中主要的不良反应为:骨髓抑制、脱发、恶心呕吐、乏力、周围神经毒性。结论白蛋白结合型紫杉醇联合吉西他滨治疗局部进展期胰腺癌具有良好的有效性及安全性。
[关键词]白蛋白结合型紫杉醇;吉西他滨;局部进展期胰腺癌
0引言
胰腺癌的预后极差,5年生存率低于5%[1]。近年来,胰腺癌的发病率逐渐上升,根据《2014年中国肿瘤登记年报》数据显示,胰腺癌已上升至我国癌症死因的第7位。胰腺癌的病因尚不明确,由于胰腺位置较隐蔽,早期症状以反酸、嗳气、上腹部不适为主,容易被忽略或被误认为胃肠道疾病,待肿瘤侵及或压迫胆道出现黄疸或侵及周围组织出现疼痛症状而明确诊断时,肿瘤往往已发展成晚期,80%~90%以上的胰腺癌就诊时已经无法手术切除,其中50%~60%的为局部进展期胰腺癌[2]。局部进展期胰腺癌的定义为:肿瘤包绕肠系膜上动脉,腹腔干或肠系膜上静脉或门静脉汇合处,同时无远处转移。化疗在局部进展期胰腺癌的治疗中起着非常重要的作用。吉西他滨是NCCN指南推荐的治疗胰腺癌的一线化疗药物,2013年美国FDA批准白蛋白结合型紫杉醇(Nab-paclitaxel,Abraxane)用于晚期胰腺癌的治疗。本研究回顾性分析了中国医科大学附属盛京医院肿瘤科应用白蛋白结合型紫杉醇联合吉西他滨方案治疗局部进展期胰腺癌的有效性和安全性,现将结果报道如下。
1资料和方法
1.1一般资料收集我科2013年6月至2014年6月共20例局部进展期胰腺癌患者,所有患者均经病理证实为胰腺癌,经外科会诊为不可切除的局部进展期胰腺癌。其中,男13例,女7例,年龄最小45岁,最大70岁,中位年龄为56岁,PS评分≤1分,CA199>37 U/mL 14例,CA199正常6例,胰头癌12例,胰体尾部癌8例,预计生存期3个月以上。有1个以上可测量病灶;既往未接受过放化疗;无重要器官功能障碍,血常规、肝肾功、心电图均正常。
1.2治疗方法吉西他滨(法国礼来制药公司)按1 000 mg/m2给药,加入生理盐水100 mL中静点30 min,第1、8天给药;白蛋白结合型紫杉醇(美国Abraxis Bioscience公司)按125 mg/m2给药,按说明书方法加入生理盐水100 mL中静点30 min,第1、8天给药[3],用药前不给予抗过敏处理,用药时给予心电血压血氧监护。每21天重复1次,化疗前常规给予5-HT3受体拮抗剂及地塞米松5 mg止吐,化疗前行血常规、肝肾功、心电图检查,若患者出现Ⅳ度不良反应,下个疗程药物减量20%~25%。
1.3疗效评价所有患者每2个周期行影像学检查,对病灶进行评估。按照美国实体瘤疗效评价RESIST标准进行评估,分为完全缓解(Complete response,CR),部分缓解(Partical response,PR),疾病稳定(Stable disease,SD),疾病进展(Progression disease,PD)。CR+PR为客观有效率,CR+PR+SD为疾病控制率。无进展生存期(Progression free survival,PFS)定义为:从接受治疗开始知道疾病进展或不能耐受不良反应的时间。SD以上的患者继续原方案化疗,最多化疗6周期,PD或不能耐受不良反应的患者换用其他替代方案继续治疗。不良反应按照国立癌症研究所的NCI CT CAE 3.0进行判定。
1.4统计学处理采用SPSS 19.0统计学软件对数据进行统计学分析,所有计量资料以中位数表示,计数资料以百分率表示。中位生存期用Kaplan-Meier 法。
2结果
2.1近期疗效及生存时间20例患者接受吉西他滨联合白蛋白结合型紫杉醇化疗最少2个周期,最多6个周期,没有患者因不能耐受不良反应而终止治疗。全部患者进行疗效评价,CR:2例,PR:6例,SD:9例,PD:3例。客观有效率(ORR objective response rate):40%,疾病控制率(DCR disease control rate):85%。随访至2015年10月,中位无进展生存期(mPFS)和中位生存期(mOS)分别为:5.5、10.3个月,1年生存率为:40%。
2.2不良反应所有患者均未发生因不能耐受不良反应而停止治疗及治疗相关性死亡。其中主要的不良反应为:骨髓抑制、脱发、恶心呕吐、乏力、周围神经毒性。1例患者出现中性粒细胞减少伴发热,积极治疗后好转。见表1。
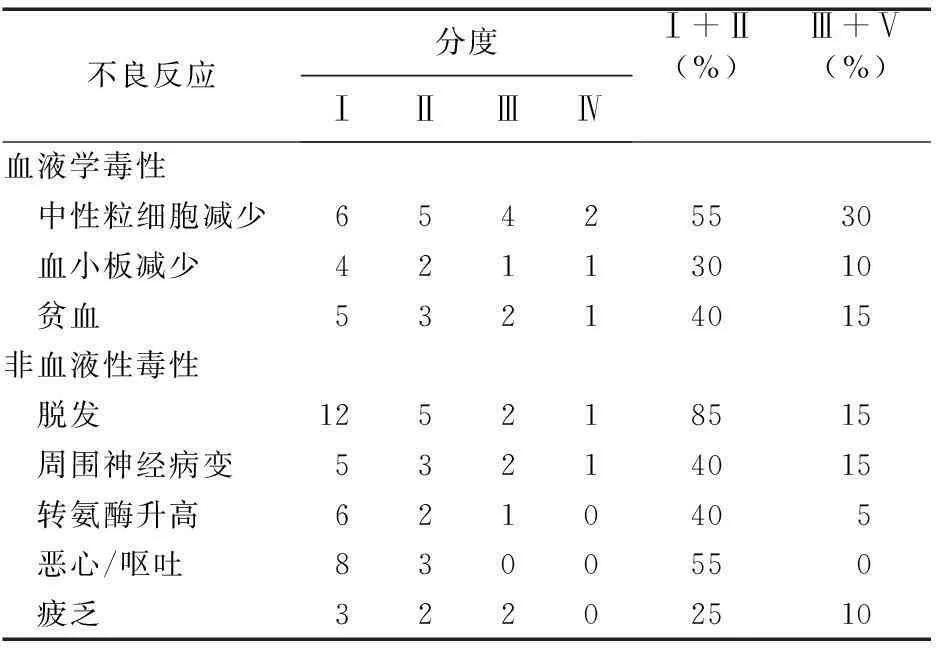
表1 白蛋白结合型紫杉醇联合吉西他滨治疗的不良反应
3讨论
局部进展期胰腺癌的治疗目前尚有争议,放化疗联合还是单纯化疗目前仍无定论。在法国消化肿瘤联盟及肿瘤放射治疗学会(FFCD/SFRO)的研究中[4],一组给予三维适形放疗(总剂量60 Gy)同步化疗(顺铂+ 5-Fu),同步放化疗后再用吉西他滨化疗,另一组单用吉西他滨化疗。联合放化疗与单纯化疗比较:中位生存期13个月vs. 8.6个月(P=0.03),1年生存率53% vs.32%,进一步分析发现,联合放化疗组完成治疗的情况较差,故影响疗效,并且给予高剂量放疗(60 Gy)导致放疗的并发症越多,影响生存期。本研究中的患者因选择两药联合方案化疗,故没有同步给予放疗,客观缓解率及疾病控制率与美国学者Loehrer在ECOG4201实验中报道的对于局部进展期胰腺癌给予吉西他滨联合放疗(50.4 Gy)结果相当[5]。在局部进展期胰腺癌的治疗中,采用白蛋白结合型紫杉醇联合吉西他滨化疗还是两药联合化疗同时给予放疗,联合放化疗中的放疗剂量还需进一步探讨。
吉西他滨是二氟核类抗代谢药,通过抑制核糖核苷酸酶,抑制DNA的合成及修复,达到很好的抗肿瘤作用。吉西他滨在胰腺癌的药物治疗中有着非常重要的地位,1995年Burris等[6]的一项比较吉西他滨与氟尿嘧啶一线治疗局部进展期胰腺癌的Ⅲ期临床研究显示:吉西他滨组MST显著优于氟尿嘧啶组(5.65个月vs.4.41个月,P=0.002 5),奠定了吉西他滨在晚期胰腺癌治疗中的重要地位,之后关于以吉西他滨为基础的联合化疗方案的研究纷纷出现,主要有顺铂、希罗达、S-1等[7-9],但在生存期改善上并没有明显获益。
白蛋白结合型紫杉醇是新一代靶向紫杉醇制剂,是利用纳米技术将紫杉醇与人血白蛋白结合成平均直径约130 nm 的胶状悬浮颗粒,利用白蛋白的独特靶向转运机制,使白蛋白结合型紫杉醇直接分布于肿瘤细胞,增加肿瘤间质中的紫杉醇浓度,并且在实验中大大提高了小鼠的最大耐受剂量[10]。剂型的改良使白蛋白结合型紫杉醇具有良好的水溶性,彻底避免了传统剂型紫杉醇使用助溶剂(聚氧乙烯蓖麻油)而导致的一系列不良反应,尤其是过敏反应、神经脱髓鞘及脂肪代谢紊乱等,并且具有输注时间短、无需临床预处理和使用方便等显著的优点。2013年Von等[11]在新英格兰临床肿瘤学杂志上发表了白蛋白结合型紫杉醇联合吉西他滨方案一线治疗晚期胰腺癌的Ⅲ期临床试验的研究结果,即MPACT研究,该实验入组861例转移性胰腺癌患者,随机分为白蛋白联合紫杉醇化疗组(NG组)和吉西他滨(GEM)单药化疗组。结果显示:NG组的mOS为8.5个月,GEM单药组为6.7个月(HR=0.72,95%CI:0.617~0.835;P<0.001)。1年生存率增加了59%(35% vs.22%,P<0.05),2年生存率增加125%(9% vs.4%,P<0.05)。两组3~4级不良反应中有明显差别的是:中性粒细胞减少(38% vs.27%)、疲劳(17% vs.7%)及神经病变(17% vs.1%),耐受性良好。
国外研究者应用白蛋白紫杉醇联合吉西他滨方案均采用白蛋白结合型紫杉醇125 mg d1、d8、d15给药,吉西他滨1 000 mg d1、d8给药,4周重复1次[11-12]。国内研究者考虑到亚裔人群的耐受性,均采用白蛋白结合型紫杉醇125 mg d1、d8给药,吉西他滨1 000 mg d1、d8给药,3周重复1次[13-14]。本研究采用国内研究者的给药剂量,得到了很好的效果,1年生存率为40%,和国内外其他报道相似,并且有很好的安全性,期待国内大规模的随机对照研究进一步证实。
参考文献:
[1]Siegel R,Naishadham D,Jemal A,et al.Cancer statistics[J].CA Cancer J Clin,2012,62:10-29.
[2]Vincent A,Herman J,Schulick R,et al.Pancreatic cancer[J].Lancet,2011,378(9791):607-620.
[3]Zhang DS,Wang DS,Wang ZQ,et al.Phase Ⅰ/Ⅱ study of albumin-bound nab-paclitaxel plus gemcitabine administered to Chinese patients with advanced pancreatic cancer[J].Cancer Chemother Pharmacol,2013,71(4):1065-1072.
[4]Barhoumi M,Mornex F,Bonnetain F,et al.Locally advanced unresectable pancreatic cancer:induction chemoradiotherapy followed by maintenance gemcitabine versus gemcitabine a-lone,definitive results of the 2000—2001 FFCD/SFRO phase Ⅲ trial[J].Cancer Radiother,2011,15(3):182-191.
[5]Loehrer PJ Sr,Feng Y,Cardenes H,et al.Gemcitabine alone versus gemcitabine plus radiotherapy in patients with locally advanced pancreatic cancer:an Eastern Cooperative Oncology Group trial[J].J Clin Oncol,2011,29(31):4105-4112.
[6]Burris HA,Moore MJ,Andersen J,et al.Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer:a randomized trial[J].J Clin Oncol,1997,15(6):2403-2413.
[7]Humphris JL,Johns AL,Simpson SH,et al.Clinical and pathologic features of familial pancreatic cancer[J].Cancer,2014,120(23):3669-3675.
[8]Herrmann R,Bodoky G,Ruhstaller T,et al.Gemcitabine plus capecitabine compared with gemcitabine alone in advanced pancreatic cancer:a randomized,multicenter,phase Ⅲ trial of the Swiss Group for Clinical Cancer Research and the Central European Cooperative Oncology Group[J].J Clin Oncol,2007,25(16):2212-2217.
[9]Ueno H,Ioka T,Ikeda M,et al.Randomized phase III study of gemcitabine plus S-1,S-1 alone,or gemcitabine alone in patients with locally advanced and metastatic pancreatic cancer in Japan and Taiwan:GEST study[J].J Clin Oncol,2013,31(13):1640-1648.
[10]Desai N,Trieu V,Yao Z,et al.Increased antitumor activity,intratumor paclitaxel concentrations,and endothelial cell transport of cremophor-free,albumin-bound paclitaxel,ABI-007,compared with cremophor-based paclitaxel[J].Clin Cancer Res,2006,12(4):1317-1324.
[11]Von Hoff DD,Ervin T,Arena FP,et al.Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine[J].N Engl J Med,2013,369(18):1691-1703.
[12]Von Hoff DD,Ramanathan RK,Borad MJ,et al.Gemcitabine plus nab-paclitaxel is an active regimen in patients with advanced pancreatic cancer:a phase Ⅰ/Ⅱ trial[J].J Clin Oncol,2011,29(34):4548-4554.
[13]梅静峰,周云,陈嘉,等.白蛋白结合型紫杉醇治疗晚期难治性恶性肿瘤的疗效与安全性观察[J].中国肿瘤外科杂志,2012,4(6):355-357.
[14]彭晓波,颜芳,王斌,等.白蛋白结合紫杉醇联合替吉奥治疗吉西他滨治疗失败进展期胰腺癌的临床观察[J].中国癌症杂志,2015,25(1):63-66.
Clinical efficacy of Nab-paclitaxel with gemcitabine for locally advanced pancreatic cancer
TANG Mei-yue1,SHI Yu2,WANG Si-liang1,WU Rong1*
(1.Department of Oncology,Shengjing Hospital of China Medical University,Shenyang 110004,China;2.Department of Information Science,China Medical University,Shenyang 110122,China)
[Abstract]ObjectiveTo investigate the feasibility and efficacy of Nab-paclitaxel with gemcitabine for locally advanced pancreatic cancer.MethodsTwenty patients with locally advanced pancreatic cancer confirmed by pathology were recruited in the study.All the patients were treated by Nab-paclitaxel with gemcitabine:Nab-paclitaxel 125 mg/m2 andgemabine 1 000 mg/m2 at the first and eighth day,with 21 d as a cycle.ResultsAll the patients completed the scheduled course of chemotherapy.There were 2 cases of complete response (CR),6 cases with partial response (PR) and 9 cases of stable disease (SD).The objective response rate (ORR) and the disease control rate (DCR) were 40% and 85%,and the median progression-free survival (mPFS) and median overall survival (mOS) were 5.5 and 10.3 months.There was no treatment-related death,and the main toxicities included hematological toxicity,alopecia,gastrointestinal reactions,fatigure and sensory neuropathy.ConclusionNab-paclitaxel combined with gemcitabine has good efficacy and safety in the treatment of locally advanced pancreatic cancer.
Key words:Nab-paclitaxel;Gemcitabine;Locally advanced pancreatic cancer
收稿日期:2015-12-30
*通信作者
DOI:10.14053/j.cnki.ppcr.201605010
