精子DNA损伤对IVF/ICSI-ET结局影响的回顾性资料分析
2016-06-08邵淑敏
邵淑敏 李 姣 邹 敏 胡 廉 张 玲
华中科技大学同济医学院计划生育研究所生殖医学中心(武汉,430030)
·临床研究·
精子DNA损伤对IVF/ICSI-ET结局影响的回顾性资料分析
邵淑敏李姣邹敏胡廉张玲*
华中科技大学同济医学院计划生育研究所生殖医学中心(武汉,430030)
摘要目的:探讨精子DNA损伤对体外受精/卵胞浆内单精子注射-胚胎移植(IVF/ICSI-ET)结局的影响。方法:回顾性分析了初次行常规IVF和ICSI治疗的192例不孕夫妇的临床资料。分别比较行IVF和ICSI治疗时,精子DNA碎片指数(DFI)≤15%和DFI>15%的受精率、优质胚胎率、种植率、临床妊娠率和流产率的差异;并比较DFI>15%时,不同受精方式(IVF或ICSI)对受精率、优质胚胎率和临床妊娠率的影响。结果:在IVF或ICSI治疗周期中,精子DNA损伤对受精率、优质胚胎率、种植率、临床妊娠率和流产率均无影响(P>0.05)。在DFI>15%情况下,行IVF治疗的受精率、优质胚胎率、种植率和临床妊娠率与行ICSI治疗比较,无统计学差异(P>0.05)。结论:精子DNA损伤不影响IVF/ICSI-ET的结局。对于DFI>15%的患者ICSI-ET与IVF-ET的治疗结局相似。
关键词体外受精-胚胎移植;精子DNA损伤;流产率
体外受精-胚胎移植技术(IVF-ET)使生育力低或不孕患者获得了生育的可能,尤其是卵胞浆内单精子注射(ICSI)技术使越来越多男性不育症患者获得后代。然而,研究证实男性不育患者的精子核可能存在潜在异常,精子形态完整性也与精子DNA完整性不一致,ICSI时人为选择形态和活力好的精子并不能确保其遗传物质正常[1]。目前精子DNA损伤成为对精子功能评价的一项新指标,有研究表明精子DNA损伤对IVF-ET结局有一定的影响,但目前尚存争议[2]。本研究回顾性分析行IVF/ICSI-ET治疗的不孕夫妇临床资料,探讨精子DNA损伤对IVF/ICSI-ET结局的影响。
1 资料与方法
1.1 临床资料
回顾性分析本中心初次行IVF/ICSI治疗的192对不孕夫妇的临床资料,其中IVF治疗周期114个,ICSI治疗周期78个。纳入条件:①女方年龄≤35岁;②月经规律,卵巢功能正常;③获卵数≥5枚;④确诊为盆腔因素或输卵管因素不孕,排除子宫内膜异位症、多囊卵巢综合征等疾病。
1.2 研究方法
1.2.1 IVF/ICSI方案女方超排卵均采用常规长方案,月经周期第21天开始皮下注射促性腺激素释放激素激动剂(GnRH-α,达菲林) 0.1 mg/d,持续14 d。若卵泡刺激素(FSH)< 5 U/L,黄体生成素(LH)< 3 U/L,雌二醇(E2)< 183 pmol/L,双侧卵巢窦卵泡直径≤5 mm,子宫内膜<5 mm,即可启动促性腺激素(Gn),启动Gn后持续皮下注射GnRH-0.05 mg/d,直至绒毛膜促性腺激素(hCG)注射日。启动Gn后第5天开始B超检测卵泡发育,当主导优势卵泡达18~20 mm,根据血清LH、P水平决定当晚是否肌注hCG 10000 U ,hCG肌注后36~37 h在阴道B超引导下取卵。
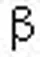
1.2.3 精液DNA完整性检测手淫法取精后1 h内取50 μl精液于EP管中,-80℃冰箱中冷冻保存。将冷冻的精液样品迅速置于37℃水浴中复苏。用冷TNE缓冲液(0.01 mol/L Tris HCl, 0.15 mol/L NaCl, 1 mol/L EDTA, pH 7.4)稀释精子浓度为2×106/ml;取50 μl加入进样管中,加入100 μl酸处理液(0.1% Triton X-100, 0.15mol/L NaCl, 0.08 mol/L HCl, pH 1.2),振荡混匀30 s,加300 μl AO染液染色2 min后,低速流动样品,检查精子流速,控制流速200~300个精子/s,每份精液样本获取10 000个精子的红绿荧光。DNA完整性好,精子DNA碎片指数(DFI)≤15%;DNA完整性中等,15%
1.2.4 分组根据DFI检测值将192对患者夫妇分为DFI≤15%和DFI>15%两个组。
1.3 统计学处理
采用SPSS 12.0 统计软件进行数据分析。计数资料比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况比较
符合纳入条件的192对夫妇,其中IVF-ET 114个周期:DFI≤15% 70个周期(DFI≤15%组),DFI>15% 44个周期(DFI>15%组);ICSI-ET 78个周期:DFI≤15% 27个周期(DFI≤15%组),DFI>15% 51个周期(DFI>15%组)。ICSI周期与IVF周期中DFI≤15%组与DFI>15%组对象一般情况均无统计学差异(P>0.05),见表1。
2.2 不同DFI组IVF-ET和ICSI-ET结局比较
IVF-ET周期中,DFI≤15%组和DFI>15%组的受精率、优质胚胎率、种植率、临床妊娠率和流产率差异均无统计学意义(P>0.05)。ICSI-ET周期中,DFI>15%组与DFI≤15%组的受精率、优质胚胎率、种植率、临床妊娠率和流产率的差异均无统计学意义(P>0.05)。见表2。
2.3 精子DFI>15%患者不同受精方式的结局
精子DFI>15% 患者行IVF和ICSI治疗的女方年龄、男方年龄、女方FSH水平均无统计学差异(P>0.05),IVF组的精子浓度和精子活力明显高于ICSI组(P<0.05)。IVF组与ICSI组受精率、优质胚胎率、种植率和临床妊娠率的差异均无统计学意义(P>0.05)。见表3。

表1 IVF-ET和ICSI-ET周期中不同DFI对象的一般情况比较

表2 不同DFI组IVF-ET和ICSI-ET结局比较

表3 DFI>15%患者不同受精方式治疗情况比较
3 讨论
精子发生是一个复杂而独特的过程,涉及一系列有丝分裂和减数分裂过程,精子形成过程中组蛋白逐渐被过渡蛋白,最终被鱼精蛋白代替。鱼精蛋白能中和DNA电荷,降低DNA分子间静电作用,精子DNA与鱼精蛋白通过二硫键的交联形成致密胞核,抵抗精子DNA在女性生殖道转运过程中的破坏,保证遗传物质的完整性,并将父系遗传信息完整地传递给卵母细胞,并在胚胎发育中正确地表达[3]。某些环境因素、病理性因素和医源性损伤等通过精子染色质组装、氧化应激、精子凋亡等机制造成精子DNA损伤[4]。精子DNA损伤主要有DNA碎片增加,包括精子DNA双链或单链的卵裂、异常染色质包装及鱼精蛋白缺乏等形式[5]。
精子DNA损伤与男性不育有密切关系。男性不育症患者的精子DNA损伤水平显著高于生育力正常男性[6],随着精子DNA碎片的增加,精子顶体酶活性和精子穿透透明带与卵黄膜融合的能力逐渐降低,影响受精率[7]。然而有些使用连续顺序追踪超声检查法检测精子DNA完整性的研究显示,精子DNA完整性与精子受精率无显著相关性[8]。本研究严格筛选单纯输卵管性因素不孕,年龄≤35岁,卵巢功能正常,获卵数≥5枚卵子的患者夫妇为研究对象。精子DNA完整性检测是男方患者病因诊断的精液质量检测项目,本研究中男方患者精液均进行精子DNA损伤检测。本研究结果证实,无论是IVF还是ICSI,精子DNA损伤均不影响卵子的受精率,而且当DFI>15%时,IVF和ICSI受精率仍无统计学差异。可能是因为胚胎发育最初仅受母源基因组调控,受精和胚胎早期发育都依赖于卵子本身的质量[9],而精子DNA是着床前胚胎发育的后期才开始表达,所以精子DNA对卵子受精的影响不大[10]。
本研究结果还显示,在IVF和ICSI周期中,精子DFI与对优质胚胎率、种植率、临床妊娠率和流产率均无显著影响。有研究显示,无论是IVF组还是ICSI组,低DNA损伤组(DFI<30%)和高DNA损伤组(DFI≥50%)的受精率、优质胚胎率及临床妊娠率均无统计学差异[11],虽然在胚胎发育后期,父源基因组逐渐被激活,进而影响胚胎发育,但是胚胎自身可能也对精子DNA进行修复,干预精子DNA完整性对治疗结局的影响。Zhang等[12]研究也认为精子DNA损伤对IVF或ICSI的流产率没有影响,但是有研究则认为精子DNA损伤与囊胚获得率呈负相关,且影响胚胎的继续发育[13]。研究证实射线可使大鼠精子DNA有一定程度的氧化性损伤,卵子受精后,胚胎发育明显受阻,甚至胚胎停止发育,死于子宫内[14]。精子DNA碎片化会使精子在核染色体解凝聚过程中改变表观遗传,从而影响精子的功能,进而对着床后胚胎的发育和妊娠结局产生负面影响[15-16]。不同结论可能与研究过程中精子DNA完整性的检测方法以及临界值的确定、样本的大小等差异有关。
本研究比较了精子DFI>15%患者不同受精方式的结局,结果发现IVF组与ICSI组的受精率、优质胚胎率、种植率和临床妊娠率均无统计学差异,这与Frydman[10]的研究结果一致。对于精子DNA损伤多的患者,ICSI治疗并不能改变其妊娠结局。
由于本研究中精子DFI>15%同时又满足纳入条件的不孕患者较少,故结论有一定的局限性,仍需更多的临床研究进一步验证。
参考文献
[1]Henkel R, Kierspel E, Hajimohammad M, et al. DNA fragmentation of spermatozoa and assisted reproduction technology [J]. Reprod Biomed Online, 2003, 7(4): 477-484.
[2]Seli E, Sakkas D. Spermatozoal nuclear determinants of reproductive outcome: implications for ART [J]. Hum Reprod Update, 2005, 11(4): 337-349.
[3]岳顺利, 李树峰, 严云勤. 乙醇对哺乳动物受精及胚胎发育的影响 [J]. 生殖与避孕, 2004, 24(1): 48-51.
[4]杨译. 精子 DNA 损伤与男性不育的关系 [J]. 中国男科学杂志, 2011, 25(12): 67-69.
[5]Blumer CG, Fariello RM, Restelli AE, et al. Sperm nuclear DNA fragmentation and mitochondrial activity in men with varicocele [J]. Fertil Steril, 2008, 90(5): 1716-1722.
[6]Giwercman A, Lindstedt L, Larsson M, et al. Sperm chromatin structure assay as an independent predictor of fertility in vivo: a case-control study [J]. International Journal of Andrology, 2010, 33(1): 221-227.
[7]Bakos HW, Thompson JG, Feil D, et al. Sperm DNA damage is associated with assisted reproductive technology pregnancy [J]. International Journal of Andrology, 2008, 31: 518-526.
[8]Tomsu M, Sharma V, Miller D. Embryo quality and IVF treatment outcomes may correlate with different sperm comet assay parameters [J]. Human Reproduciton, 2002, 17: 1856-1862.
[9]Meseguer M, Santiso R, Garrido N, et al. Effect of sperm DNA fragmentation on pregnancy outcome depends on oocyte quality [J]. Fertility and Sterility, 2011, 95(1): 124-128.
[10]Frydman N, Prisant N, Hesters L, et al. Adequate ovarian follicular status does not prevent the decrease in pregnancy rates associated with high sperm DNA fragmentation [J]. Fertility and Sterility, 2008, 89(1): 92-97.
[11]蒋欢欢, 贺小进, 宋兵,等.精子染色质完整性对IVF/ICSI临床结局的预测价值[J].中华男科学杂志, 2011,12: 1083-1087.
[12]Zhang Z, Zhu L, Jiang H, et al. Sperm DNA fragmentation index and pregnancy outcome after IVF or ICSI: a meta-analysis [J]. J Assist Reprod Genet, 2015, 32(1): 17-26.
[13]Lourdes M, Nicolas G, Jose F, et al. Value of he sperm deoxyribonucleic acid fragmentation level, as measured by the sperm chromatin dispersion test, in the outcome of in vitro fertilization and intracytoplasmic sperm injection [J]. Fertil Steril, 2006, 85(2): 371-383.
[14]Ahmadi A, Ng SC. Developmental capacity of damaged spermatozoa [J]. Hum Reprod, 1999, 14(9): 2279-2285.
[15]Lin MH, Kuo-Kuang LR, Li SH, et al. Sperm chromatin structure assay parameters are not related to fertilization rates, embryo quality, and pregnancy rates in vitro fertilization and intracytoplasmic sperm injection, but might be related to spontaneous abortion rates [J]. Fertil Steril, 2008, 90: 352-359.
[16]Saxena P, Misro MM, Chaki SP, et al. Is abnormal sperm function an indicator among couples with recurrent pregnancy loss? [J]. Fertil Steril, 2008, 90: 1854-1858.
[责任编辑:张璐]
Study on sperm DNA fragmentation effecting on the outcomes of In Vitro Fertilization and Embryo Transfer
SHAO Shumin, LI Jiao, ZOU Min, HU Lian, ZHANG Ling*
FamilyPlanningResearchInstitute&CenterforReproductiveMedicineofTongJiMedicalCollege,HuangZhongUniversityofScienceandTechnology,Wuhan430030,China
AbstractObjective: To assess sperm DNA fragmentation effecting on the outcomes of In Vitro Fertilization (IVF) and Embryo Transfer (ET). Methods: Retrospective analysis 192 couples who accepted IVF/ Intracytoplasmic sperm injection(ICSI)and ET. According to the DNA fragmentation index (DFI), the cases were divided into DFI≤15% group(low DFI group) and DFI>15% group(high DFI group). When patients were treated by IVF or ICSI, comparisons were made between high DFI group and low DFI group in the fertilization rate, embryo quality, rate of implantation, rate of clinical pregnancy and rate of abortion. In high DFI group, comparisons were also made between IVF and ICSI in the fertilization rate, embryo quality, and rate of clinical pregnancy rate. Results: During patients were treated by IVF or ICSI, no significant correlation of sperm DFI with fertilization rate, embryo quality, rate of clinical pregnancy and rate of implantation and rate of abortion (P>0.05). There was no significant difference when IVF compared to ICSI in the fertilization rate, embryo quality, and rate of clinical pregnancy rate (P>0.05). Conclusion: The sperm DNA fragmentation has no any effect on the outcomes of IVF/ ICSI and ET. As for patients with DFI≤15%, the outcome are similar when treated by IVF or ICSI .
Key wordsIn Vitro Fertilization; Embryo Transfer; Sperm DNA fragmentation; Rate of abortion
收稿日期:2015-07-09修回日期:2016-01-22
*通讯作者:zhling312@163.com
doi:10.3969/j.issn.1004-8189. 2016.03
*Corresponding author:ZHANG Ling, Email: zhling312@163.com
