巨噬细胞极化在大鼠肝硬化发生发展中的作用*
2016-06-06田小霞张慧英陈云霞李旭炯王黎敏来丽娜赵中夫韩德五CHENGJi
田小霞, 张慧英△, 陈云霞, 李旭炯, 王黎敏, 孟 丽, 来丽娜, 赵中夫, 韩德五, CHENG Ji
(长治医学院 1病理生理学教研室, 2微生物学教研室, 3生理学教研室, 4机能综合实验室, 5药理学教研室, 6肝病研究所,山西 长治 046000; 7山西医科大学肝病研究所,山西 太原030001; 8南加州大学Keck医学院肝病中心, 美国 加利福尼亚州 洛杉矶 90089)
巨噬细胞极化在大鼠肝硬化发生发展中的作用*
田小霞1,张慧英1△,陈云霞2,李旭炯3,王黎敏4,孟丽2,来丽娜5,赵中夫6,韩德五7,CHENG Ji8
(长治医学院1病理生理学教研室,2微生物学教研室,3生理学教研室,4机能综合实验室,5药理学教研室,6肝病研究所,山西 长治 046000;7山西医科大学肝病研究所,山西 太原030001;8南加州大学Keck医学院肝病中心, 美国 加利福尼亚州 洛杉矶 90089)
[摘要]目的: 探讨在大鼠肝硬化发病过程中,巨噬细胞的极化状态及其与肠源性内毒素血症-内质网应激反应之间的关系。方法: 36只雄性SD大鼠随机分为正常对照组和肝硬化模型组。各组动物分别于造模第4周末、6周末和8周末处死取材。ELISA法检测大鼠血浆中ALT、内毒素、Hcy的水平和肝组织匀浆中iNOS、TNF-α、IL-6、Arg-1、IL-10的水平;肝组织切片行HE染色和VG染色;实时荧光定量PCR法检测大鼠肝组织中Grp78、NF-κB、IRF5、CD86、CD206和TGF-β1 的mRNA表达。结果: 与相应的正常对照组相比,肝硬化模型组动物血浆中ALT、内毒素、Hcy水平和肝组织中Grp78的mRNA表达在4周、6周和8周均随病程进展逐渐升高(P<0.05);肝组织中NF-κB、IRF5 和CD86的mRNA表达以及iNOS、TNF-α、IL-6的水平均显著升高(P<0.05),且它们的变化趋势为6周水平最高,4周次之,8周最低;肝组织中CD206 和TGF-β1的mRNA表达以及Arg-1、IL-10的水平在4周未见明显变化,在6~8周逐渐升高(P<0.05)。相关性分析结果显示,血浆中内毒素水平与肝组织中Grp78的mRNA表达显著相关(P<0.01);血浆中内毒素水平和肝组织中Grp78的mRNA表达均与肝组织中CD86和CD206 的mRNA表达显著相关(P<0.01)。结论: 肝损伤-肠源性内毒素血症-内质网应激-巨噬细胞极化途径可能是肝纤维化乃至肝硬化发病的重要机制。
[关键词]肝硬化; 肝纤维化; 巨噬细胞; 内质网应激; 内毒素
肝内巨噬细胞包括肝血窦内的枯否细胞和来自血液的单核细胞,它们具有可塑性和多能性,在不同微环境的影响下,可分化为不同表型并表现出功能上的差异,现已明确的2种巨噬细胞极化类型分别为经典活化的M1型巨噬细胞和选择性活化的M2型巨噬细胞,二者是巨噬细胞一系列功能变化的其中2个极端状态。巨噬细胞极化发生在多种生理及病理过程中,对于维持机体健康具有十分重要的意义[1-2]。目前的研究表明,巨噬细胞极化在肝纤维化发生发展过程中具有重要作用[3-5],而在动物模型体内巨噬细胞极化状态的研究却不多。本项研究继续以复合致病因素诱导的肝硬化大鼠模型为研究对象,观察在肝硬化发生发展过程的不同阶段巨噬细胞的极化状态,并初步探讨影响巨噬细胞极化过程的可能机制。
材料和方法
1主要试剂
丙氨酸氨基转移酶(alanine aminotransferase,ALT)、内毒素、同型半胱氨酸(homocysteine,Hcy)的ELISA检测试剂盒购自上海蓝基生物科技有限公司;诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、精氨酸酶-1(arginase-1,Arg-1)和白细胞介素-10(interleukin-10,IL-10)的ELISA检测试剂盒购自上海科鉴生物科技有限公司。总RNA提取试剂RNAiso Plus,反转录试剂盒Prime ScriptTMRT Master Mix,实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)试剂盒SYBR®Premix Ex TaqTMII购自TaKaRa;葡萄糖调节蛋白78(glucose-regulated protein 78,Grp78)、核因子-kappa B(nuclear factor-kappa B,NF-κB)、干扰素调节因子(interferon-regulatory factor,IRF)5、CD86、CD206、转化生长因子-β1(transforming growth factor-β1,TGF-β1)和18S RNA引物由上海生工生物工程股份有限公司合成。
2实验方法
2.1实验动物及标本制备36只清洁级健康雄性SD大鼠购自中国人民解放军军事医学科学院实验动物中心,体重180~220 g。随机将大鼠分为正常对照(normal control,N)组和肝硬化模型(model,M)组,每组18只动物。肝硬化模型组采用复合致病因素法复制[6]:以掺入胆固醇(饲料重量0.5%)的玉米面做饲料,前2周掺入猪油(饲料重量20%),首次皮下注射CCl4原液(每100g体重0.5mL),之后每隔3 d皮下注射40% CCl4油溶液(每100 g体重0.3 mL),以4%(体积比)乙醇作为饮用水。正常对照组动物饲以标准饲料和饮用水。将每一组动物随机分为3批,每批6只,分别于造模第4周末、6周末和8周末,全麻、无菌、无内毒素条件下取材。腹主动脉采集血液,3 000 r/min离心15 min后,吸取血浆,置-80 ℃保存备用;每次取肝脏同一区域组织用10% 中性甲醛固定,石蜡包埋,组织切片用于HE染色和VG染色;取部分肝组织立即置于液氮,后转移至-80 ℃冻存,用于相关基因的检测。
2.2肝组织HE染色和VG染色以石蜡包埋的组织标本制备5 μm厚连续切片,行HE染色和VG染色。
2.3血浆和肝组织匀浆中指标检测严格按照ELISA试剂盒操作说明,分别测定血浆中ALT、内毒素、Hcy的水平和肝组织匀浆中iNOS、TNF-α、IL-6、Arg-1、IL-10的水平。
2.4实时荧光定量PCR用TaKaRa的RNAiso Plus试剂提取肝组织总RNA。用酶标仪检测RNA样品纯度(A260/A280值在1.7~2.1)。按照TaKaRa逆转录试剂盒说明,利用逆转录-聚合酶链反应合成cDNA,反转录条件为37 ℃ 15 min,85 ℃ 5 s,产物保存于-20 ℃。以cDNA为模板,Primer Express 2.0和Beacon Designer软件设计引物,具体序列见表1。采用SYBR®Green I 荧光染料实时定量PCR法对目的基因进行检测。反应条件:95 ℃ 30 s,Grp78 62 ℃ 20 s/NF-κB 57 ℃ 15 s/IRF5 58 ℃ 15 s/CD86 58.5 ℃ 20 s/CD206 59.5 ℃ 20 s/TGF-β1 57.5 ℃ 15 s/18S RNA 61.5 ℃ 20 s,72 ℃ 1 min,共35个循环。以18S RNA为内参照,结果采用2-ΔΔCt值表示[7]。

表 1 RT-qPCR引物序列
3统计学处理
数据用均数±标准差(mean±SD)表示,采用SPSS 19.0统计分析软件对数据进行单因素方差分析和组间LSD-t检验,采用Pearson相关分析做相关性检验,以P<0.05为差异有统计学意义。
结果
1肝组织HE染色和VG染色
各正常对照组:肝细胞索排列整齐,肝小叶结构完整清晰。肝硬化模型4周组,可见肝细胞脂肪变性,肝细胞索排列紊乱,未见明显的胶原纤维沉积;模型6周组,炎性反应进一步加重,部分肝小叶结构消失,可见增生的条索状纤维间隔;模型8周组,纤维组织增生形成纤维间隔,分割正常的小叶结构形成假小叶,见图1、2。

Figure 1. Pathological changes of liver tissues (HE staining). N: normal control group; M: liver cirrhosis model group.
图1肝组织HE染色

Figure 2.Pathological changes of liver tissues (VG staining). N: normal control group; M: liver cirrhosis model group.
图2肝组织VG染色
2血浆中ALT、内毒素和Hcy水平变化
与相应的正常对照组相比,随着病程的进展,肝硬化模型组动物血浆中ALT、内毒素和Hcy的水平逐渐显著增高(P<0.05),见表2。

表2 血浆中ALT、内毒素和Hcy水平变化
*P<0.05 vs N group.
3肝组织中iNOS、TNF-α、IL-6、Arg-1和IL-10水平变化
肝硬化模型组各个时点肝组织中iNOS、TNF-α 和IL-6的水平均显著高于其相应的正常对照组(P<0.05),以6周组最高,4周组次之,8周组最低;而肝组织中Arg-1和IL-10的水平在肝硬化4周未见明显变化,在6周和8周显著升高(P<0.05),见表3、4。
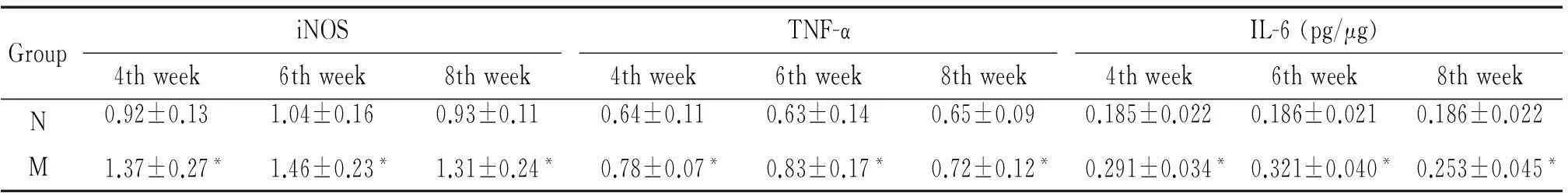
表3 肝组织中iNOS、TNF-α和IL-6水平变化
*P<0.05 vs N group.

表4 肝组织中Arg-1和IL-10水平变化
*P<0.05 vs N group.
4肝组织中Grp78、NF-κB、IRF5、CD86、CD206和TGF-β1 mRNA的表达
与相应的正常对照组相比,肝硬化模型组动物肝组织中Grp78的mRNA表达随病程进展逐渐升高(P<0.05);NF-κB、IRF5和CD86的 mRNA表达均显著升高(P<0.05),其中6周最高,4周次之,8周最低;CD206和TGF-β1的mRNA的表达在4周组未见明显变化,在6周和8周组逐渐显著升高(P<0.05),见图3。
5相关性分析
大鼠血浆中内毒素水平与肝组织中Grp78的mRNA表达显著相关(P<0.01);血浆中内毒素水平和肝组织中Grp78的mRNA表达分别与肝组织中CD86 和CD206的mRNA表达显著相关(P<0.01),见表5。
讨论
研究表明巨噬细胞极化在维持机体自稳态,非酒精性脂肪肝、肿瘤等多种疾病的发病,以及炎症的发生、发展和消解过程中起关键的作用[8]。M1型巨噬细胞的主要功能是清除细胞外病原体,促进炎症反应,合成和分泌TNF-α、IL-1、IL-6等促炎细胞因子,通过iNOS将精氨酸代谢成NO来杀灭病原体;M2型巨噬细胞的主要功能是抑制炎症反应,参与组织修复、合成和分泌抗炎细胞因子IL-10以及通过Arg-1将精氨酸分解成聚胺,参与合成和稳定细胞外基质[9-10]。本研究中复合致病因素诱导肝硬化模型4周,巨噬细胞主要分化为M1型,肝脏的变化以炎性反应为主;6周,M1和M2型巨噬细胞的数量都显著增多,以M1型为更多,肝脏炎性反应加剧,同时有少量纤维生成;8周,巨噬细胞主要分化为M2型,M2型巨噬细胞通过释放大量的促纤维化细胞因子,引起肝星状细胞过度活化,肝脏发生细胞外基质过度沉积的纤维修复反应。因此,慢性肝损伤后,肝内巨噬细胞极化的动态变化与肝硬化的发生发展过程密切相关。
我们前期的研究证实肠源性内毒素血症(intestinal endotoxemia,IETM)引起的肝组织氧化应激和高同型半胱氨酸血症可以引发肝脏发生内质网应激反应(endoplasmic reticulum stress,ERS),进而导致Grp78表达升高,在肝硬化发生发展过程中起重要作用[11]。本项研究中肝硬化模型动物血浆中内毒素、同型半胱氨酸的水平和肝组织中Grp78的mRNA表达均随病程进展逐渐显著升高,而且血浆中内毒素水平和肝组织中Grp78的mRNA表达存在显著相关性,与之前的研究结果一致。另外血浆中内毒素水平和肝组织中Grp78的mRNA表达与M1型巨噬细胞标志物CD86的mRNA和M2型巨噬细胞标志物CD206的mRNA表达均存在显著相关性,提示肝内巨噬细胞极化的转化机制可能与肠源性内毒素血症-内质网应激反应有关。另外,NF-κB信号通路在炎症反应中发挥重要功能[12],而IRF5对M1型巨噬细胞极化起关键作用[13],本项研究还检测了这2个调控巨噬细胞极化的转录因子的表达,结果NF-κBmRNA和IRF5 mRNA表达与M1型巨噬细胞的变化趋势一致,6周最高,4周次之,8周最低,也呈现动态变化过程。
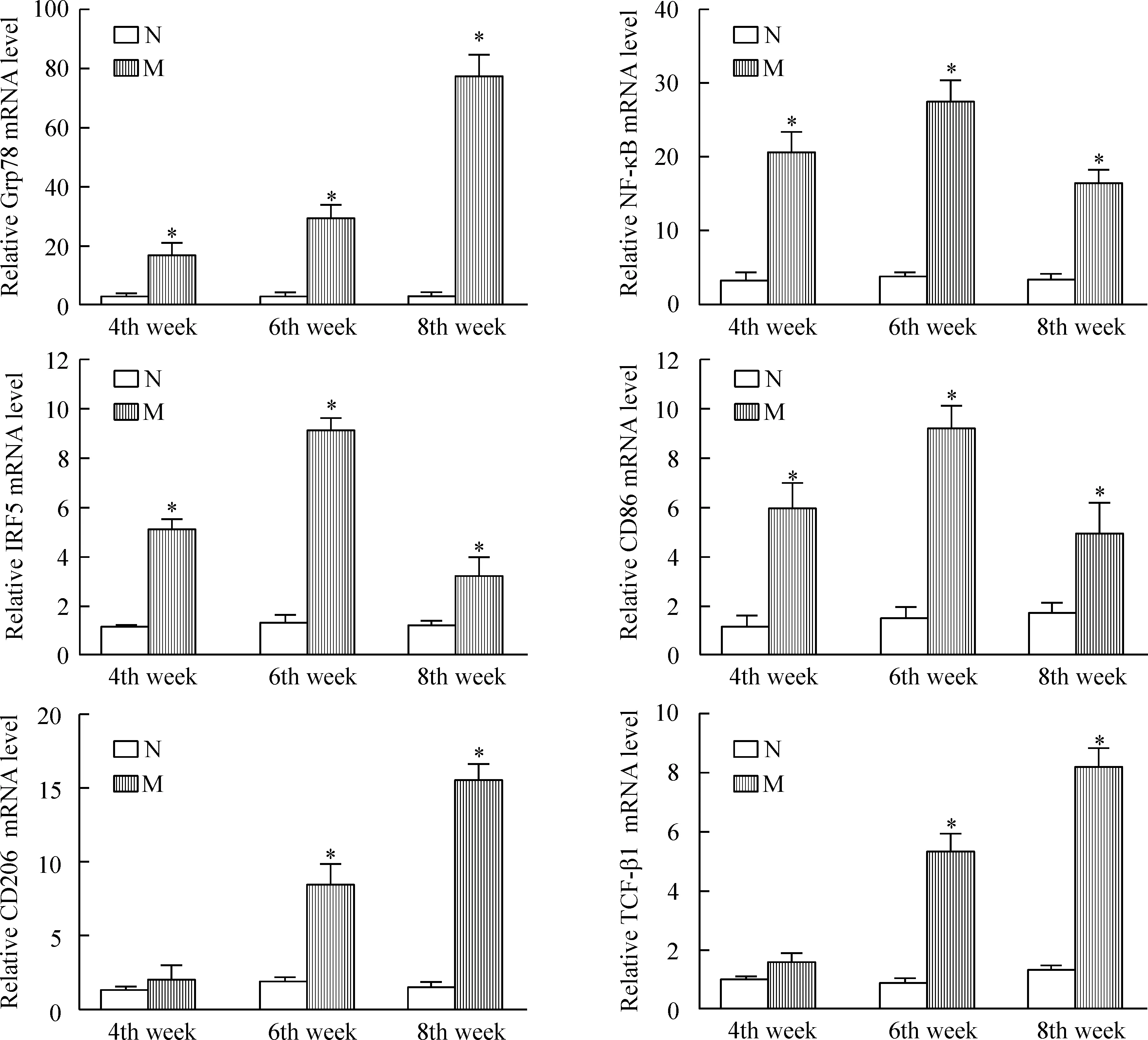
Figure 3. The mRNA levels of Grp78, NF-κB, IRF5, CD86, CD206 and TGF-β1 in the liver tissues. N: normal control group; M: liver cirrhosis model group. Mean±SD.n=6.*P<0.05 vs N group.
图3肝组织中Grp78、NF-κB、IRF5、CD86、CD206和TGF-β1的mRNA表达

表5 各指标间相关性分析
衣霉素(tunicamycin,TM)或毒胡萝卜素(thapsigargin,TG)诱导人肝癌细胞HepG2发生内质网应激反应之后,收集其培养上清液,作用于佛波酯诱导人单核细胞THP-1分化成的巨噬细胞,结果巨噬细胞Toll样受体4的表达减少,NF-κB信号途径被抑制,同时促炎细胞因子TNF-α、IL-6、IL-1β等表达减少,巨噬细胞发生内质网应激反应,巨噬细胞向M2型分化[14]。这提示从损伤因素作用于肝脏开始至肝硬化4周,IETM逐渐形成,通过高同型半胱氨酸血症等因素引发肝脏发生内质网应激反应,NF-κB、IRF5等信号途径被激活,促进巨噬细胞向M1型转化,肝硬化4周以后,在IETM的作用下,肝脏内质网应激反应到达一定强度,可能通过某种机制抑制NF-κB 和IRF5的信号途径,同时促进巨噬细胞向M2型分化可能是肝纤维化乃至硬化发生发展的一个非常重要的机制。
在各种实验性肝损伤模型中,巨噬细胞的活化总是先于肝星状细胞的激活,其分泌的生长因子、细胞因子等与肝脏其它细胞相互作用,影响肝纤维化乃至硬化的发生发展过程[15]。在肝硬化发生发展过程中,随着肠源性内毒素血症-内质网应激反应程度的不断增强,巨噬细胞先分化为M1型,参与肝脏的炎性反应,肝硬化4周之后又分化为M2型,参与肝纤维化乃至硬化的发生发展,因此减轻肠源性内毒素血症,抑制肝脏内质网应激反应可以抑制肝脏炎性反应,减少巨噬细胞向M2型巨噬细胞分化,减缓肝硬化进程。本项研究所获结果仅涉猎冰山一角,深入开展肝脏疾病-肠源性内毒素血症-内质网应激-巨噬细胞极化途径在肝纤维化乃至肝硬化中所起作用机制的研究,将有望对临床防治产生积极影响。
[参考文献]
[1]Biswas SK, Chittezhath M, Shalova IN, et al. Macrophage polarization and plasticity in health and disease[J]. Immunol Res, 2012, 53(1-3):11-24.
[2]Wolfs IM, Donners MM, de Winther MP. Differentiation factors and cytokines in the atherosclerotic plaque micro-environment as a trigger for macrophage polarisation[J]. Thromb Haemost, 2011, 106(5):763-771.
[3]Karlmark KR, Weiskirchen R, Zimmermann HW, et al. Hepatic recruitment of the inflammatory Gr1+monocyte subset upon liver injury promotes hepatic fibrosis[J]. Hepatology, 2009, 50(1):261-274.
[4]Heymann F, Trautwein C,Tacke F. Monocytes and macrophages as cellular targets in liver fibrosis[J]. Inflamm Allergy Drug Targets, 2009, 8(4): 307-318.
[5]Wynn TA, Barron L. Macrophages: master regulators of inflammation and fibrosis[J]. Semin Liver Dis, 2010, 30(3):245-257.
[6]Zhang HY, Han DW, Zhao ZF, et al. Mutiple pathogenic factor-induced complications of cirrhosis in rats: a new model of hepatopulmonary syndrome with intestinal endotoxemia[J]. World J Gastroenterol, 2007, 13(25):3500-3507.
[7]Lee EJ, Schmittgen TD. Comparison of RNA assay me-thods used to normalize cDNA for quantitative real-time PCR[J]. Anal Biochem, 2006, 357(2):299-301.
[8]Martinez FO, Sica A, Mantovani A, et al. Macrophage activation and polarization[J]. Front Biosci, 2008, 13:453-461.
[9]陈芳艳, 贺福初, 姜颖. 肝纤维化发生发展及逆转过程中肝巨噬细胞亚群分类[J]. 中国生物化学与分子生物学报, 2012, 28(10):879-887.
[10]Ohashi W, Hattori K, Hattori Y. Control of macrophage dynamics as a potential therapeutic approach for clinical disorders involving chronic inflammation[J]. J Pharmacol Exp Ther, 2015, 354(3):240-250.
[11]冀菁荃, 张慧英, 贾建桃, 等. 糖调节蛋白78在大鼠肠源性内毒素血症促进肝硬化形成中的作用[J]. 中国病理生理杂志, 2010, 26(12):2447-2452.
[12]Perkins ND. Integrating cell-signalling pathways with NF-κB and IKK function[J]. Nat Rev Mol Cell Biol, 2007, 8(1):49-62.
[13]Krausgruber T, Blazek K, Smallie T, et al. IRF5 promotes inflammatory macrophage polarization and TH1-TH17 responses[J]. Nat Immunol, 2011, 12(3):231-238.
[14]Xiu F, Catapano M, Diao L, et al. Prolonged endoplasmic reticulum-stressed hepatocytes drivean alternative macrophage polarization[J]. Shock, 2015, 44(1): 44-51.
[15]Wijesundera KK, Izawa T, Tennakoon AH. M1- and M2-macrophage polarization in rat liver Cirrhosis induced by thioacetamide (TAA), focusing on Iba1 and galectin-3[J]. Exp Mol Pathol, 2014, 96(3):382-392.
(责任编辑: 林白霜, 罗森)
Effects of macrophage polarization during development of liver cirrhosis in rats
TIAN Xiao-xia1, ZHANG Hui-ying1, CHEN Yun-xia2, LI Xu-jiong3, WANG Li-min4, MENG Li2, LAI Li-na5, ZHAO Zhong-fu6, HAN De-wu7, CHENG Ji8
(1Department of Pathophysiology,2Department of Microbiology,3Department of Physiology,4Functional Integrative Laboratory,5Department of Pharmacology,6Institute of Hepatology, Changzhi Medical College, Changzhi 046000, China;7Institute of Hepatology, Shanxi Medical University, Taiyuan 030001, China;8Research Center for Liver Disease, Keck School of Medicine, University of Southern California, Los Angeles, CA 90089, USA. E-mail: zhanghy2001@163.com
[ABSTRACT]AIM: To explore the state of macrophage polarization and its relation with intestinal endotoxemia-endoplasmic reticulum stress in the development of liver cirrhosis induced by multiple pathogenic factors in rats. METHODS: The male SD rats (n=36) were randomly divided into normal control group and liver cirrhosis model group, and sacrificed at the end of the 4th, 6th and 8th weeks. The rat model of liver cirrhosis was induced by multiple pathogenic factors. The levels of alanine aminotransferase (ALT), endotoxin, homocysteine (Hcy) in the plasma, and inducible nitric oxide synthase (iNOS), tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), arginase-1 (Arg-1) and interleukin-10 (IL-10) in the liver tissues were detected by ELISA. Histopathological change of the liver was observed under microscope with the staining of hematoxylin and eosin (HE) and van Gieson (VG). The expression of glucose-regulated protein 78 (Grp78), nuclear factor-kappa B (NF-κB), interferon-regulatory factor 5 (IRF5), CD86, CD206 and transforming growth factor-β1 (TGF-β1) at mRNA levels in the liver tissues were detected by the method of real-time fluorescence quantitative PCR.RESULTS: Compared with the corresponding normal control group, the levels of ALT, endotoxin, Hcy in the plasma and Grp78 mRNA in the liver tissues in liver cirrhosis model group were significantly and gradually increased (P<0.05). The mRNA expression of NF-κB, IRF5 and CD86, and the protein levels of iNOS, TNF-α and IL-6 in the liver tissues were significantly increased (P<0.05), and they successively increased from the 4th week to the 6th week and decreased reversely at the 8th week. The mRNA expression of CD206, TGF-β1, Arg-1 and IL-10 in the liver tissues were significantly increased from the 6th week to the 8th week (P<0.05), and no significant difference at the 4th week was observed. The level of endotoxin in the plasma was correlated with the mRNA expression of Grp78 in the liver tissues (P<0.01). Both endotoxin in the plasma and Grp78 mRNA in the liver tissues were correlated with the mRNA expression of CD86 and CD206 in the liver tissues (P<0.01).CONCLUSION: The pathway of liver damage-intestinal endotoxemia-endoplasmic reticulum stress-macrophage polarization may be critical in the pathogenesis of liver cirrhosis induced by multiple pathogenic factors.
[KEY WORDS]Liver cirrhosis; Liver fibrosis; Macrophage; Endoplasmic reticulum stress; Endotoxin
[文章编号]1000- 4718(2016)05- 0880- 06
[收稿日期]2015- 12- 23[修回日期] 2016- 02- 19
*[基金项目]国家自然科学基金资助项目(No. 81070339);山西省国际科技合作计划(No. 2010081068);山西省回国留学人员科研基金资助项目(No. 211-091);山西医科大学细胞生理学省部共建教育部重点实验室主任基金资助项目(No. 2010-09);长治医学院博士科研启动经费项目(No.2010-01)
通讯作者△Tel: 0355-3151441; E-mail: zhanghy2001@163.com
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.019
杂志网址: http://www.cjpp.net
