Rab7蛋白参与了BLP耐受巨噬细胞对细菌清除能力增强的过程*
2016-06-06赵舒祺蔡军伟罗海华刘靖华
赵舒祺, 蔡军伟, 李 雪, 杨 勤, 黄 林,罗海华, 项 静, 乔 敏, 姜 勇, 刘靖华△
(1贵州医科大学病理生理学教研室,贵州 贵阳 550004; 2南方医科大学基础医学院病理生理学教研室,广东省蛋白质组学重点实验室,广东 广州 510515)
Rab7蛋白参与了BLP耐受巨噬细胞对细菌清除能力增强的过程*
赵舒祺1,2,蔡军伟2,李雪2,杨勤1△,黄林2,罗海华2,项静2,乔敏2,姜勇2,刘靖华2△
(1贵州医科大学病理生理学教研室,贵州 贵阳 550004;2南方医科大学基础医学院病理生理学教研室,广东省蛋白质组学重点实验室,广东 广州 510515)
[摘要]目的: 探讨Rab GTP酶是否参与了对细菌脂蛋白(BLP)耐受的骨髓诱导分化巨噬细胞(BMDMs)杀菌能力增强的过程。方法: 首先利用real-time PCR比较BLP耐受巨噬细胞和非耐受细胞中Rab5a、Rab5b、Rab7、Rab9、Rab9b、Rab11a、Rab11b、Rab12、Rab32和Rab34的表达变化,筛选出水平升高的Rab7分子;进一步用real-time PCR和Western blot实验证实Rab7的mRNA和蛋白表达是否在BLP耐受细胞感染大肠杆菌后继续升高;接下来用RNAi技术下调BLP耐受巨噬细胞Rab7表达,观察细胞对细菌的吞噬能力及杀灭能力的影响。结果: 在检测的10个Rab GTP酶中, Rab7在BLP耐受BMDMs的mRNA水平升高,是非耐受细胞的1.4倍;进一步用real-time PCR和Western blot实验证实Rab7的mRNA和蛋白表达在BLP耐受细胞感染大肠杆菌后,随着时间延长均明显升高;下调Rab7表达不影响BLP耐受巨噬细胞对细菌的吞噬能力,但是显著降低其对细菌的杀灭能力。结论: BLP耐受通过上调巨噬细胞Rab7的表达,在增强巨噬细胞对细菌的杀灭过程中发挥重要作用。
[关键词]细菌脂蛋白; 耐受; 细菌清除; Rab GTP酶; Rab7蛋白
细菌脂蛋白(bacterial lipoprotein,BLP)是革兰氏阳性和革兰氏阴性细菌外膜中最丰富的蛋白,主要由生长或裂解的细菌释放。BLP作为病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)的一种,主要是通过Toll样受体2(Toll-like receptor 2,TLR2)启动天然免疫反应。人们发现动物或体外培养的单核/巨噬细胞等在给予小剂量的BLP预处理后,对BLP再次刺激时无反应或反应性明显降低,表现为炎症因子分泌减少,机体炎症损伤减轻,动物在致死剂量内毒素再次刺激后的存活率提高,这一现象被称为BLP耐受(BLP tolerance)[1]。BLP耐受是生物在长期进化过程中形成的一种保护性调节机制,是机体防御反应的重要组成部分,目前对其机制尚不完全清楚。
在机体(细胞)对BLP的耐受过程中,突出的表现是机体(细胞)对细菌的清除能力增强[2]。机体清除细菌主要是通过包括巨噬细胞在内的专职吞噬细胞完成的。吞噬细胞吞噬细菌后首先形成吞噬体,然后吞噬体与溶酶体融合形成吞噬溶酶体,溶酶体内的多种杀菌物质和水解酶将细菌杀死并消化,这个过程被称为吞噬体的成熟。从吞噬体形成到吞噬体与溶酶体融合需要有多种蛋白分子共同参与完成[3]。现已知Rab GTP酶家族(Rab GTPase family)中的多个Rab分子在吞噬体等膜性细胞器的转运过程中发挥了重要作用,它们相互协作共同完成从吞噬起始至细菌清除的整个过程[4]。
为了探讨Rab分子是否参与了BLP耐受巨噬细胞对细菌清除能力增强的过程,本研究首先利用定量PCR筛选出在BLP耐受巨噬细胞中表达量高的Rab7,接下来用RNA干扰技术下调Rab7分子的表达,观察对BLP耐受巨噬细胞吞噬和杀灭细菌能力的影响。
材料和方法
1动物与细胞
雄性SPF级C57BL/6小鼠,8~10周龄,18~20 g,由南方医科大学实验动物中心提供,许可证号为SCXK(粤)2011-0015。大肠杆菌(E. coli)菌株和转染了pET-14b-GFP(green fluorescent protein)质粒的大肠杆菌(GFP- E. coli)由本室保存;小鼠成纤维细胞L929(NCTC clone 929)购自中国科学院细胞库。
2主要试剂
DMEM培养基、胎牛血清(fetal bovine serum,FBS)和OPTI-MEM培养基购自Gibco;TRIzol总RNA提取试剂、LB培养基购自Invitrogen;FastStart Universal SYBR Green Master购自TOYOBO;Rab7抗体和RIPA Buffer购自CST;羊抗兔IgG-HRP和β-actin抗体购自北京中杉金桥生物技术有限公司;Super Signal West Pico化学发光底物购自Thermo;引物合成由广州纽克利公司完成;siRNA合成由GenePharma完成。
3主要方法
3.1骨髓来源巨噬细胞(bone marrow-derived macrophages, BMDMs)的分离、培养及鉴定将L929细胞用含10% FBS的DMEM培养基于37 ℃、5% CO2培养箱中培养,收集细胞培养上清,用0.22 μm滤器过滤后与含有20% FBS的DMEM按体积比1∶4比例混匀,配制成BMDMs完全培养基,备用。将8~10周龄、SPF级C57BL/6小鼠处死并置于75%乙醇中浸泡2~3 min后,暴露并分离股骨和胫骨,在超净台内去除肌肉组织并暴露骨髓腔,用装有DMEM的注射器冲洗骨髓腔,300×g离心10 min后收集沉淀;用BMDMs完全培养基充分吹打使其分散成单细胞悬液,将上述悬液平铺至培养瓶中,放于37 ℃、 5% CO2培养箱中培养,在培养的第3天、第5天分别更换新的BMDMs完全培养基,培养至第7天即可获得分化成熟的BMDMs[5]。
3.2BLP耐受细胞的制备取分化成熟的BMDMs,给予 0.1 μg/L BLP预处理24 h,DPBS洗3遍,该部分细胞为BLP耐受的BMDMs;未经BLP预处理的即为非耐受或者naive BMDMs。
3.3细胞吞噬细菌实验将BMDMs 按每孔 2×105接种至 24 孔细胞培养板中,将GFP-E. coli按一定比例(细胞∶细菌=1∶30)加入 24 孔细胞培养板,37 ℃、5% CO2共同孵育15、30 min后,冰DPBS洗5遍,用 0.25%胰蛋白酶消化,800 r/min离心4 min,弃去上清,用冰DPBS充分重悬制成单细胞悬液,流式细胞仪(BD FACSVerse)检测,以GFP阳性细胞百分数表示BMDMs吞噬细菌的能力。
3.4杀菌实验将BMDMs按每孔2×105分别接种至3块24孔板中,标记为1、2、3号,将活的大肠杆菌按一定比例(细胞∶细菌=1∶30)加入24孔细胞培养板中。37 ℃共孵育30 min后,弃去培养上清并用冰DPBS充分洗涤细胞3次,在1号板中加入含0.1% Triton X-100的无菌水(每孔500 μL)于冰上裂解细胞,在2、3号板中加入含10% FBS的DMEM并放入培养箱中分别继续培养30 min和60 min,与此同时加入庆大霉素(0.1 mg/L),以杀灭细胞外的细菌。培养结束时同上用含0.1% Triton X-100的无菌水(每孔500 μL)于冰上裂解细胞,并将裂解液转移至1.5 mL EP管中。分别取100 μL以上所得裂解液按10的倍数梯度稀释,再取不同层次稀释液(10-1、10-2、10-3)各100 μL分别均匀涂布于LB平板上,放于37 ℃培养12 h,取出后选取菌落数量合适(30~300个)的平板计数并计算出该实验组细胞内所剩余的细菌数。1号板中所得值即为BMDMs在30 min吞噬的细菌总数,2号板中所得值为BMDMs发挥胞内杀菌作用30 min后所剩余的细菌数,3号板中所得值为BMDMs发挥胞内杀菌作用60 min后所剩余的细菌数,细胞杀菌能力使用细胞内杀菌百分比表示,细胞内杀菌百分比=2号板中所得值或3号板中所得值-1号板中所得值/1号板中所得值×100%。
3.5Real-time PCR实验将BMDMs以每孔5×108接种于6孔板, 按上述方法制备naive和BLP耐受的BMDMs。用TRIzol收集并提取细胞总RNA,逆转录获得cDNA,以此为模板,用real-time PCR(SYBR-Green法)扩增以下10种与吞噬体成熟相关的Rab GTPases的mRNA水平:Rab5a(NM_025887.4)、Rab5b(NM_177411.4)、Rab7 (NM_001293652.1)、Rab9(NM_019773.2)、Rab9b(NM_176971.2)、Rab11a(NM_017382.5)、Rab11b(NM_008997.3)、Rab12(NM_024448.2)、Rab32(NM_026405.3)和Rab34(NM_001159482.1)。引物序列见表1。Real-time PCR循环在ABI 7500荧光定量PCR仪中进行,所得数据用2-ΔΔCt方法分析,实验重复3次。
3.6Western blot实验用RIPA裂解液裂解细胞并收集细胞总蛋白,用BCA法进行定量蛋白。取等量蛋白行12%的SDS-PAGE分离蛋白,电泳结束后将蛋白电转移至PVDF膜上。经5% BSA-TBST溶液室温封闭2 h后, 1∶1 000稀释anti-Rab7抗体并4 ℃孵育过夜,然后与1∶5 000稀释的羊抗兔IgG-HRP室温孵育1 h,加入化学发光底物,利用Kodak IS4000R 图像工作站(Carestream)进行化学发光检测。
3.7BMDMs电转染与干扰实验取BLP耐受的BMDMs于15 mL离心管,加入4 mL OPTI-MEM培养基,吹打并重悬细胞团,重复以上洗涤过程3次后,将BMDMs重悬于OPTI-MEM培养基中计数后备用。取90 μL BMDMs(1×106)与 10 μL(2 μg) 靶向Rab7的siRNA(siRab7)或者无序siRNA(scrambled siRNA, ScrRNA)混合液转移至电转杯中,按电转染仪(NEPA21)操作要求设置相关参数,执行相关电转染程序,结束后取出电转杯将细胞悬液轻轻吸出均匀铺于含10% FBS的DMEM(已预热)培养板中;重复以上步骤依次完成所有实验组的转染。siRab7有3对,序列分别如下: siRab7-1上游序列为 5’-CUCUCAUGAACCAGUAUGUTT-3’,下游序列为 5’-ACAUACUGGUUCAUGAGAGTT-3’; siRab7-2上游序列为 5’-GUGGACGACAGACUUGUUATT-3’,下游序列为 5’-UAACAAGUCUGUCGUCCACTT-3’; siRab7-3上游序列为 5’-CCAGACAAUUGCUCGGAAUTT-3’,下游序列为5’-AUUCCGAGCAAUUGUCUGGTT -3’。 Rab7的干扰效率分别用real-time PCR及Western blot实验检测,具体方法同前。选取3条siRNA中干扰效率最高的做后续实验。

表1 引物序列
4统计学处理
应用SPSS 13.0进行统计学分析。数据均采用均数±标准差(mean±SD)表示,两独立样本间均数比较采用两独立样本t检验(independent-sample t test)分析;多个样本均数的比较采用单因素方差分析(one-way ANOVA),不同处理组间的两两比较行 SNK-q 检验;以P<0.05为差异有统计学显著性。
结果
1Naive和BLP耐受BMDMs对细菌吞噬能力和杀灭能力的比较
实验发现,naive组细胞在感染细菌后15 min和30 min GFP阳性细胞百分数分别为(13.8±1.7)%和(39.8±5.4)%;而BLP耐受组GFP阳性细胞百分数分别是(25.7±1.7)%和(75.1±0.1)%,与naive组相比BLP耐受组的GFP阳性细胞百分数显著增加(P<0.05);杀菌实验显示,30 min 时,BLP 耐受的BMDMs杀灭大肠杆菌的百分比为naive的1.7倍,60 min时为naive的1.6倍(P<0.05),见图1。
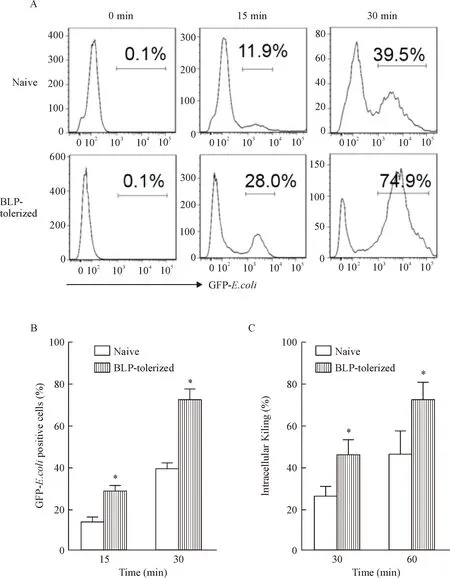
Figure 1.Enhanced bacterial uptake and intracellular bacterial killing in BLP-tolerized BMDMs. Mean±SD. n=3.*P<0.05 vs naive.
图1Naive和BLP耐受BMDMs对细菌吞噬能力和杀灭能力的比较
2Rab分子在BLP耐受BMDMs中的表达
Real-time PCR结果显示,与naive组相比,BLP耐受的BMDMs中Rab7表达上调,是非耐受细胞的1.4倍(P<0.05),其余Rab分子,包括Rab5a、Rab5b、Rab9、Rab9b、Rab11a、Rab11b、Rab12、Rab32和Rab34的表达减少(P<0.05),见图2。
3E.coli刺激对Rab7 mRNA与蛋白表达的影响
结果显示,无论是naive细胞还是BLP耐受的细胞在受到E. coli感染后Rab7的mRNA水平均升高,但是BLP耐受BMDMs Rab7的mRNA水平显著高于naive的BMDMs(P<0.05);BLP 耐受后 Rab7的蛋白水平相对于naive的BMDMs 明显增加;随着大肠杆菌刺激时间的延长,naive BMDMs 内 Rab7 的表达水平增加,而 BLP 耐受的 BMDMs 内 Rab7 的表达则一直处于较高水平,见图3。
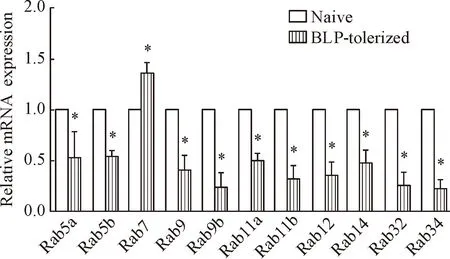
Figure 2.The mRNA levels of Rab GTPases in BLP-tolerized BMDMs compared with naive. Mean±SD. n=3.*P<0.05 vs naive.
图2Rab GTP酶在BLP耐受BMDMs中的表达
4下调Rab7的表达对BLP耐受细胞细菌吞噬能力的影响
电转染Rab7特异性siRNA下调Rab7的表达,real-time PCR结果显示siRab7-1、siRab7-2和siRab7-3的mRNA水平干扰效率达70%~90%(P<0.05);Western blot结果显示Rab7蛋白水平明显下调。吞菌实验表明,下调BMDMs中Rab7的表达后,干扰组与对照组相比GFP阳性细胞百分数无明显差异,提示干扰Rab7蛋白对细菌的吞噬没有明显影响,见图4。
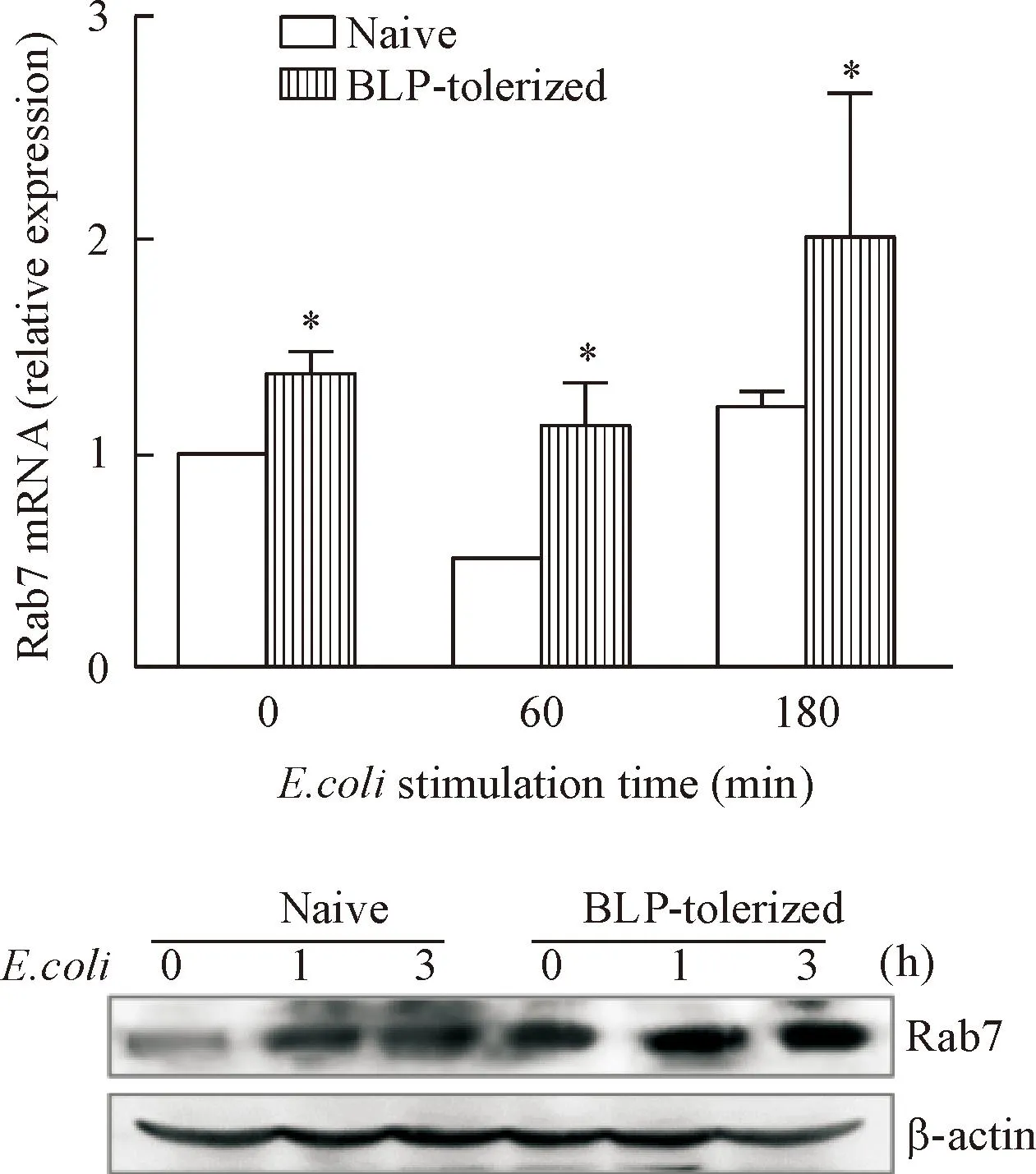
Figure 3.The expression of Rab7 in naive or BLP-tolerized BMDMs treated with heat-killed E. coli at different time points detected by real-time PCR and Western blot. Mean±SD. n=3.*P<0.05 vs naive.
图3大肠杆菌刺激naive和BLP耐受BMDMs中Rab7的mRNA与蛋白表达水平变化
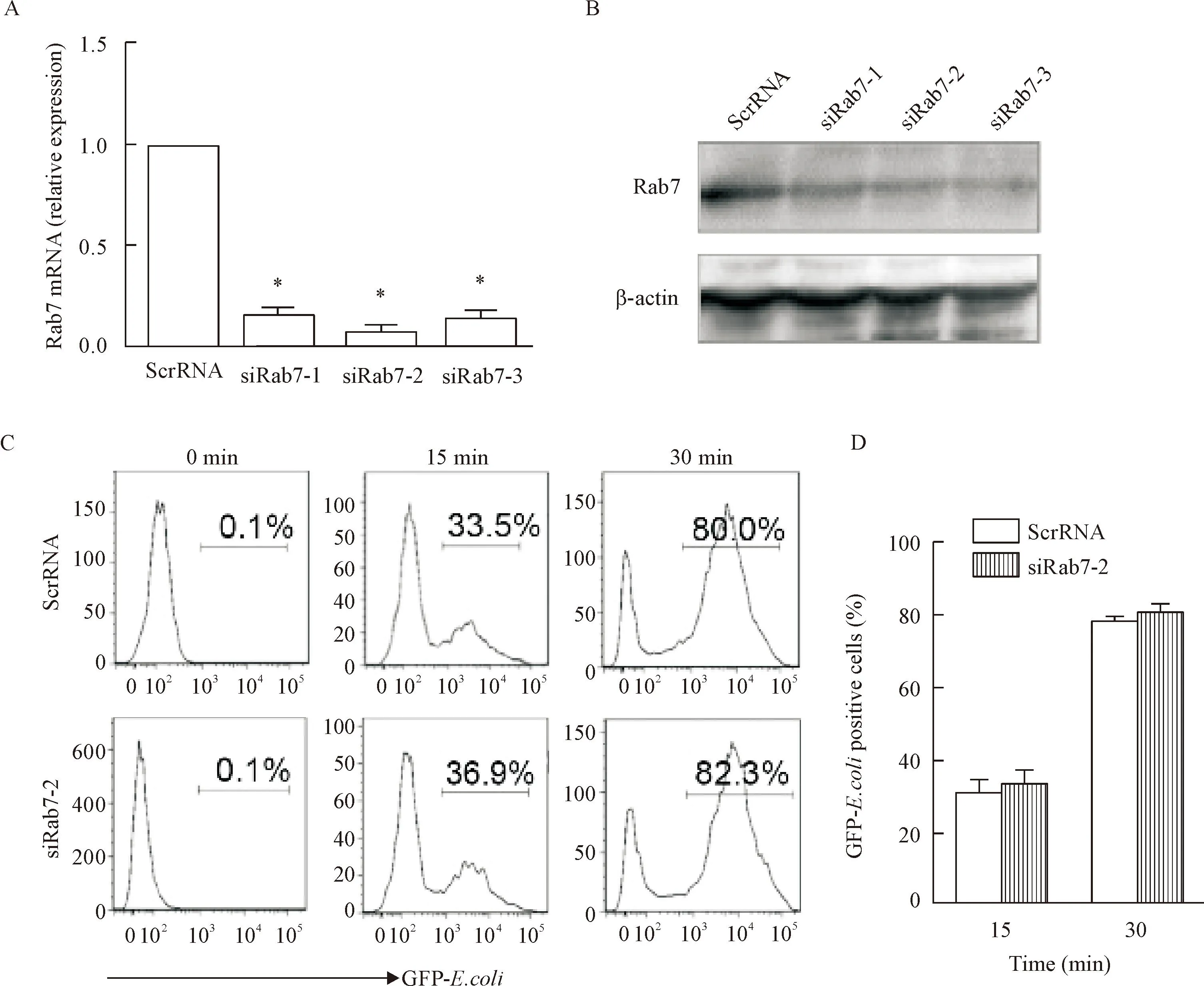
Figure 4.Rab7 down-regulation had no influence on bacterial engulfment in BLP-tolerized BMDMs. A: detection ofRab7 interference efficiency by real-time PCR; B: detection of efficiency ofRab7 interference by Western blot; C: detection of bacterial engulfment by flow cytometry; D: positive cells of bacterial engulfment.
图4下调Rab7的表达对BLP耐受细胞细菌吞噬能力的影响
5下调Rab7的表达对BLP耐受细胞细菌杀灭能力的影响
下调Rab7蛋白的表达后,杀菌实验显示,30 min 时对照组BMDMs杀灭大肠杆菌的百分比为干扰组的1.6倍,60 min时为干扰组的1.3倍,表明干扰Rab7后,BMDMs对细菌的杀灭能力均明显降低(P<0.05),见图5。

Figure 5.Rab7 down-regulation led to the inhibition of intracellular bacterial killing in BLP-tolerized BMDMs. Mean±SD. n=3.*P<0.05 vs ScrRNA.
图5下调Rab7的表达对BLP耐受细胞细菌杀灭能力的影响
讨论
机体对病原微生物的毒性成分如BLP、脂多糖(lipopolysaccharide,LPS)等的耐受现象是在探索脓毒性休克的发生机制与治疗策略过程中发现的,是生物在长期进化过程中形成的一种保护性调节机制[6]。研究发现BLP耐受不仅可以防止BLP刺激而且还可以通过交叉耐受防止LPS刺激引起的内毒素休克。更重要的是,BLP耐受还能降低动物再次感染大剂量细菌或者盲肠结扎穿孔(cecal ligation and puncture,CLP)所引起的死亡率,而内毒素耐受对细菌感染或盲肠结扎穿刺所致的脓毒症并不具有保护作用[7]。显然,BLP耐受与LPS耐受既有相同之处,也有很大不同。探讨BLP耐受的机制不仅有助于了解机体在抗感染过程中的适应性应答机制,加深我们对脓毒性休克发生机制的认识,而且有可能为脓毒性休克的防治提供新的思路。
目前,有关BLP耐受机制的探讨主要集中在BLP介导的细胞信号转导通路改变方面。研究发现,当细胞再次受到BLP攻击时,介导BLP信号转导通路中的多个信号分子发生了改变,如TLR2表达水平下调、MyD88结合IRAK1的能力下降、MAPK磷酸化程度降低、NF-κB的活性受抑制等,提示上述信号事件的改变可能是BLP耐受时细胞(机体)炎症介质释放减少的主要原因[8]。进一步研究发现,当给予小鼠或巨噬细胞(Raw264.7或THP1)小剂量BLP预处理后,再给予细菌感染,发现机体或细胞促炎介质如TNF-α、IL-6和IL-1β释放减少的同时,机体(细胞)对细菌的清除能力增加[9]。这一研究结果解释了BLP耐受能保护动物抵抗引起的脓毒性休克的机制,但BLP所引起的机体(细胞)对细菌清除能力增加的具体机制还有待进一步阐明。目前关于BLP耐受巨噬细胞对细菌清除能力增强的机制研究还不多。巨噬细胞对细菌清除能力主要包括2个部分:对细菌的吞噬能力以及对细菌的杀灭能力。Wang等[10]发现BLP耐受的中性粒细胞和腹腔巨噬细胞中补体受体3(complement receptor type 3,CR3)与Fc段γ受体III/II(FcγIII/IIR)表达上调,推测这些与抗菌能力相关受体的增加可能是BLP耐受机体(细胞)对细菌清除能力增强的主要原因。但是,由于上述受体主要参与细胞对细菌的吞噬过程,所以不能解释为什么BLP耐受巨噬细胞杀菌能力也同时增强的机制。那么细菌进入机体(细胞)是如何被杀灭的呢?吞噬过程开始的时候,首先是吞噬细胞胞膜内陷包裹吞噬物而形成吞噬体,但它并不具备杀灭和降解病原微生物的能力,必须经过一系列的生物学过程实现与溶酶体的融合,成为含有高活性氧化酶、酸化酶和水解酶的吞噬溶酶体,才具备了对吞噬物的清除能力[11-12]。在吞噬体与溶酶体融合为吞噬溶酶体的过程中,需要Rab GTP酶参与完成。研究表明,Rab GTP酶家族中的Rab5、Rab7、Rab10、Rab34等多个成员在吞噬体的转运和与溶酶体的融合过程中发挥了重要作用,并且它们分工明确、顺序出现完成对吞噬体转运全过程的调控[13]。
为了明确Rab GTP酶是否参与了BLP耐受过程中细胞(机体)对细菌清除能力的增强,本研究首先检测了10种与吞噬体成熟转运相关的Rab分子,筛选出在BLP耐受后mRNA水平增加的Rab7,并得到了进一步的实验验证。以往的研究发现,当巨噬细胞吞噬细菌成为包含有病原体的囊泡吞噬溶酶体时,Rab7会被募集到这些囊泡上,并与溶酶体有较好的共定位,提示Rab7是调控吞噬体成熟的关键分子;进一步实验证明,当缺失或突变Rab7时巨噬细胞吞噬体的成熟过程延迟,清除细菌能力降低[14-15]。Rab7在BLP耐受后表达上调,提示其可能参与了BLP耐受过程中BMDMs对细菌清除能力的增强。为了证明这个推测,接下来我们用RNAi技术下调了Rab7的表达。结果发现Rab7的表达水平降低后,并不影响BLP耐受细胞对细菌的吞噬能力,但是明显降低耐受细胞对细菌的杀灭能力,提示BLP耐受BMDMs清除细菌能力增强可能与Rab7分子表达水平上调有关,机体(细胞)通过上调Rab7分子,加速吞噬体与溶酶体的融合,增强对细菌的杀灭。BLP耐受后其它几个Rab分子的mRNA表达下调可能是机体的一种适应性调控机制,目的可能是确保相关分子如Rab7的表达。本研究结果不仅有助于了解机体在抗感染过程中的适应性应答机制,而且为脓毒性休克的防治提供新的思路。
[参考文献]
[1]Wang JH, Doyle M, Manning BJ, et al. Induction of bacterial lipoprotein tolerance is associated with suppression of Toll-like receptor 2 expression[J]. J Biol Chem, 2002, 277(39):36068-36075.
[2]O’Brien GC, Wang JH, Redmond HP. Bacterial lipoprotein induces resistance to Gram-negative sepsis in TLR4-deficient mice via enhanced bacterial clearance[J]. J Immunol, 2005, 174(2):1020-1026.
[3]Flannagan RS, Jaumouillé V, Grinstein S. The cell biology of phagocytosis[J]. Annu Rev Pathol, 2012, 7:61-98.
[4]Blander JM, Medzhitov R. On regulation of phagosome maturation and antigen presentation[J]. Nat Immunol, 2006, 7(10):1029-1035.
[5]Weischenfeldt J, Porse B. Bone marrow-derived macrophages (BMM): isolation and applications[J]. CSH Protoc, 2008, 2008: pdb.prot5080.
[6]Medzhitov R, Schneider DS, Soares MP. Disease tole-rance as a defense strategy[J]. Science, 2012, 335(6071):936-941.
[7]Sato S, Nomura F, Kawai T, et al. Synergy and cross-to-lerance between Toll-like receptor (TLR) 2- and TLR4-mediated signaling pathways[J]. J Immunol, 2000, 165(12):7096-7101.
[8]Li CH, Wang JH, Redmond HP. Bacterial lipoprotein-induced self-tolerance and cross-tolerance to LPS are asso-ciated with reduced IRAK-1 expression and MyD88-IRAK complex formation[J]. J Leukoc Biol, 2006, 79(4):867-875.
[9]Buckley JM, Liu JH, Li CH, et al. Increased susceptibi-lity of ST2-deficient mice to polymicrobial sepsis is asso-ciated with an impaired bactericidal function[J]. J Immunol, 2011, 187(8):4293-4299.
[10]Wang JH, Doyle M, Manning BJ, et al. Cutting edge: bacterial lipoprotein induces endotoxin-independent tole-rance to septic shock[J]. J Immunol, 2003, 170(1):14-18.
[11]Fairn GD, Grinstein S. How nascent phagosomes mature to become phagolysosomes[J]. Trends Immunol, 2012, 33(8):397-405.
[12]Kinchen JM, Ravichandran KS. Phagosome maturation: going through the acid test[J]. Nat Rev Mol Cell Biol, 2008, 9(10):781-795.
[13]Guo P, Wang X. Rab GTPases act in sequential steps to regulate phagolysosome formation[J]. Small GTPases, 2010, 1(3):170-173.
[14]Huynh KK, Plumb JD, Downey GP, et al. Inactivation of macrophage Rab7 byBurkholderiacenocepacia[J]. J Innate Immunity, 2010, 2(6):522-533.
[15]Mottola G, Boucherit N, Trouplin V. Tropheryma whipplei, the agent of Whipple’s disease, affects the early to late phagosome transition and survives in a Rab5- and Rab7-positive compartment[J]. PLoS One, 2014, 9(2):e89367.
(责任编辑: 陈妙玲, 罗森)
Rab7 is involved in enhanced bacterial clearance by BLP-tolerized macrophages
ZHAO Shu-qi1, 2, CAI Jun-wei2, LI Xue2, YANG Qin1, HUANG Lin2, LUO Hai-hua2, XIANG Jing2, QIAO Min2, JIANG Yong2, LIU Jing-hua2
(1DepartmentofPathophysiology,GuizhouMedicalUniversity,Guiyang550004,China;2DepartmentofPathophysiology,SchoolofBasicMedicalScience,SouthernMedicalUniversity,KeyLaboratoryforFunctionalProteomicsofGuangdongProvince,Guangzhou510515, China. E-mail: liujhua@fimmu.com; qinyang@gmc.edu.an)
[ABSTRACT]AIM: To explore whether Rab GTPases are involved in enhanced bacterial clearance by bacterial lipoprotein (BLP)-tolerized macrophages (bone marrow-derived macrophages, BMDMs).METHODS: Real-time PCR was used to compare the mRNA levels of Rab5a, Rab5b, Rab7, Rab9, Rab9b, Rab11a, Rab11b, Rab12, Rab32 and Rab34 between the naive BMDMs and the BLP-tolerized BMDMs. The up-regulation of Rab7 was further confirmed in BLP-tolerized BMDMs infected with E. coli by real-time PCR and Western blot. Following down-regulating the expression of Rab7 using RNA interference (RNAi), the bacterial uptake and intracellular bacterial killing of BLP-tolerized BMDMs treated with E. coli were detected.RESULTS: The mRNA level of Rab7 was significantly increased in BLP-tolerized BMDMs, which was 1.4 folds as high as that in the naive BMDMs, and the mRNA and protein levels of Rab7 in BLP-tolerized BMDMs stimulated with bacteria were further confirmed to be increased. Down-regulating the expression of Rab7 had no effect on phagocytosis of BLP-tolerized BMDMs for bacteria, but the intracellular bacterial killing ability was significantly attenuated. CONCLUSION: BLP tolerance plays an important role during intracellular bacterial killing in macrophages through up-regulating the expression of Rab7.
[KEY WORDS]Bacterial lipoprotein; Tolerance; Bacterial clearance; Rab GTPases; Rab7 protein
[文章编号]1000- 4718(2016)05- 0900- 07
[收稿日期]2016- 01- 29[修回日期] 2016- 03- 03
*[基金项目]国家自然科学基金资助项目(No. 81272149; No. 81471901)
通讯作者△刘靖华 Tel: 020-61648172-810; E-mail: liujhua@fimmu.com; 杨勤 Tel: 0851-6908489; E-mail: qinyang@gmc.edu.cn
[中图分类号]R392.12
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.022
杂志网址: http://www.cjpp.net
