应用微阵列芯片分析糖尿病大鼠下肢动脉硬化miRNAs差异表达谱*
2016-06-06龚昆梅王昆华
孙 平, 肖 乐, 龚昆梅△, 王昆华
(1昆明理工大学医学院, 2云南省第一人民医院, 3昆明医科大学第一附属医院,云南 昆明 650034)
应用微阵列芯片分析糖尿病大鼠下肢动脉硬化miRNAs差异表达谱*
孙平1,肖乐2,龚昆梅2△,王昆华3
(1昆明理工大学医学院,2云南省第一人民医院,3昆明医科大学第一附属医院,云南 昆明 650034)
[摘要]目的: 通过建立糖尿病大鼠模型,检测糖尿病大鼠动脉硬化下肢与糖尿病大鼠无动脉硬化下肢的动脉组织中微小RNAs(miRNAs)的差异表达情况,探究异常表达的miRNAs参与糖尿病大鼠下肢动脉硬化可能的分子机制。方法: 选取建模成功的患有糖尿病下肢动脉硬化和患有糖尿病但无下肢动脉硬化的大鼠,取出下肢动脉组织,分别提取总的miRNAs,用miRNAs微阵列芯片进行杂交检测,经过芯片扫描和数据分析,再用RT-qPCR验证芯片的扫描分析结果,最终获得糖尿病大鼠下肢动脉硬化的miRNAs差异表达谱。结果: 筛选出10个与糖尿病大鼠下肢动脉硬化有关的miRNAs,即 rno-miR-206-3p、rno-miR-133a-5p、rno-miR-133b-3p、rno-miR-133a-3p、rno-miR-325-5p、rno-miR-675-3p、rno-miR-411-5p、rno-miR-329-3p、rno-miR-335和rno-miR-126a-3p,这10个异常表达的mi-RNAs都上调。RT-qPCR证实,其中9个miRNAs与芯片检查结果一致,仅仅rno-miR-335的PCR检测结果与基因芯片检测结果相反,表达下调。结论: 有一群miRNAs在糖尿病大鼠下肢动脉硬化中起着重要作用,其表达过程很可能影响着动脉硬化的进程。
[关键词]微小RNAs; 微阵列; 糖尿病; 下肢动脉硬化
微小RNAs(microRNAs,miRNAs)是一类21~25 个核苷酸组成的,不编码蛋白质的,多物种高度保守性、时序性和组织特异性表达的,通过抑制靶mRNA翻译或促其降解而参与控制基因表达的非编码小RNA,作为生物体正常生长发育的重要基因调控分子备受关注。现在许多研究证实,糖尿病、多种肿瘤、心血管疾病、动脉粥样硬化等都存在miRNAs的异常表达或缺失[1-7],miRNAs很可能参与了这些疾病发生的基因调控。临床中发现许多糖尿病下肢动脉硬化病人,表现为间隙性跛行、休息痛和缺血性坏疽,与单纯的仅患有下肢动脉硬化的病人比较,病情严重,更加不易治疗,治疗效果差,容易反复。为了准确了解其发病机制,做好对糖尿病下肢动脉硬化的有效预防和治疗,我们搜索了相关文献,可是迄今为止尚未见到有关miRNAs表达谱在糖尿病下肢动脉硬化中被研究及临床应用的报道。因此为了补充这方面研究,我们首先建立动物模型,选取建模成功的患有糖尿病下肢动脉硬化(diabetic rats with lower limb arteriosclerosis,DAS)和患有糖尿病但无下肢动脉硬化(diabetic rats with normal lower limb,DN)的大鼠,利用微阵列技术平台[8-10],在髂动脉组织中筛查miRNAs异常表达谱,为进一步研究miRNAs与人患有糖尿病下肢动脉硬化的发病关系提供动物实验基础。
材料和方法
1材料
SD大鼠购自常州卡文斯实验动物有限公司。微阵列芯片选取建模成功后的DN大鼠3只和DAS大鼠3只,DN为对照组,DAS为实验组。根据用于RNA抽提的组织样品采集规范流程分别采取其下肢动脉组织,迅速置于液氮中(-196 ℃),用于以后分子实验。miRNAs微阵列芯片和质控探针由Affymetrix提供,采用的芯片型号为Affymetrix GeneChip miRNA 4.0 Array,其miRNA探针序列信息来源于最新Sanger miRBase 20.0数据库(http://microrna.sanger.ac.uk/sequences/),数据库收录了来自约40篇新文献报道的3 355条新的发夹前体序列和5 393条新的成熟体miRNA,其中大鼠miRNA增至728条。
2方法
2.1样本总miRNA的抽提根据Invitrogen TRIzol说明书分别提取DN大鼠和DAS大鼠的总RNA,然后用QIAGEN RNeasy Mini Kit进行纯化,将总RNA通过微离心过滤柱得到miRNA,样品量至少2 μg。
2.2样本总miRNA质量检测(1) NanoDrop 2000紫外分光光度计检测样品总miRNA在260 nm和280 nm下的吸光度(A)值,检测miRNA浓度和纯度,按以下公式计算总 RNA 的浓度,即总 RNA 浓度(mg/L)=A260×稀释倍数×40 mg/L,以A260/A280值来检测总RNA 的纯度,A260/A280值在 1.9~2.1之间时,可认为 RNA 的纯度较好。(2) 琼脂糖凝胶电泳检测miRNA的完整性,1.5%琼脂糖凝胶电泳检测,28S和18S核糖体RNA条带非常亮而浓,上面一条带(28S)的密度大约是下面一条带(18S)的2倍。
2.3样品miRNA荧光标记进行Poly (A) 加尾,FlashTag Biotin HSR 连接,生物素标记。
2.4微阵列芯片杂交、芯片扫描及数据分析把生物素标记好的样品加入到配置好的杂交液中(2×hybridization, 27.5% formamide, DMSO, 20× eukaryotic hybridization controls, control oligonucleotide B2),离心PCR孵育后再离心,将杂交液注入芯片中,把芯片放在杂交炉架子上后放在杂交炉里杂交,每个样品单独杂交一张芯片。经过一番洗涤操作后,把芯片放在 Affymetrix 的扫描仪中,点击Affymetrix Launcher 中的 AGCCScan Control,点击工具栏中的 Start进行芯片扫描生成CEL原始数据文件数据,然后运用Array-Pro(MediaCyber-netics)软件对杂交图像进行数字化转换,获得实验组与对照组检测信号的比值(log2)和t检验的P值,筛选出有意义的差异表达miRNAs。其中为了得到芯片合理准确的质量评估,对每种类型的样本进行不少于3次重复,同时为了保证芯片在探针集水平的评估结果,芯片内每个探针杂交布置5个重复,所得数据用SAM法进行分析[11]。
2.5RT-qPCR验证查阅相关文献[12]根据miRNA基因芯片检测结果,对筛选出的差异表达的10个miRNA进行进一步验证,内参照选择snRNA U6(表1)。cDNA序列的翻译、酶切位点分析、引物设计以及扩增产物、熔解曲线都是运用生物分析软件DNAMAN(5.0版)所得。反转录程序: 25 ℃ 5 min; 50 ℃ 60 min; 70 ℃ 15 min。PCR反应程序(扩增和熔解曲线): 95 ℃ 10 s; 60 ℃ 30 s, 70 ℃ 45 s,重复40个循环。在PCR反应体系中加入过量SYBR染料,按Ct值来计算各基因的相对表达水平。
3统计学处理
用统计软件包SPSS 10.0进行统计学分析。多组间比较采用单因素方差分析,两两比较采用q检验,以P<0.05为差异有统计学意义。
结果
1总RNA提取质量分析
琼脂糖凝胶电泳后有清晰的28S和18S两条条带,上面一条带(28S)的密度大约是下面一条带(18S)的2倍,低分子量RNA(tRNA和5S核糖体RNA等)条带微弱。由表2可知,所测RNA总量和浓度满足仪器上样(miRNA芯片要求:浓度不低于50 mg/L,总量不低于1 μg),A260/A280值介于1.9~2.1之间,质检综合评定合格,可以继续进行miRNA芯片检测。

表1 用于RT-qPCR验证的引物序列
R: reverse; F: forward.
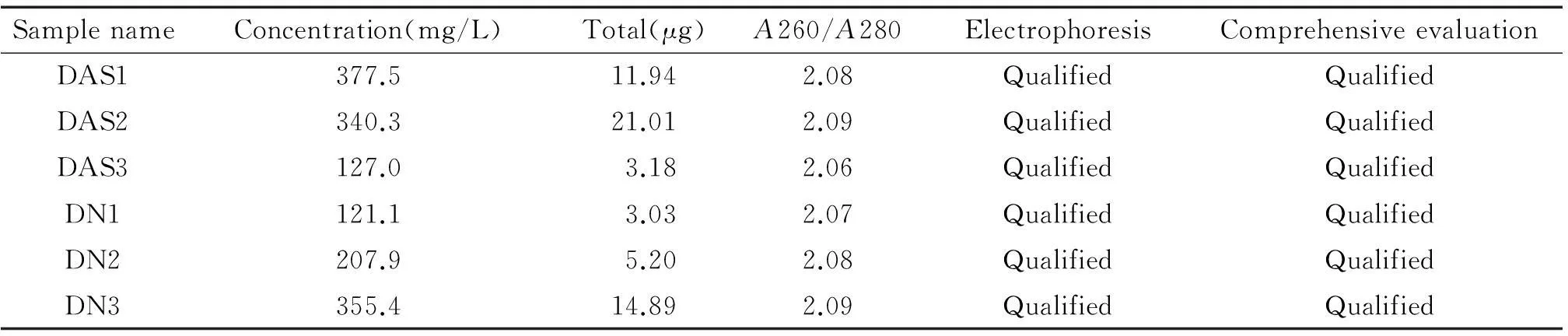
表2 总RNA样本质检报告
2miRNA微阵列芯片表达谱分析结果
微阵列芯片杂交结果分析显示,与患有糖尿病但无下肢动脉硬化的大鼠相比,患有糖尿病下肢动脉硬化的大鼠下肢动脉组织中异常表达的miRNA有10个,分别是rno-miR-206-3p、rno-miR-133a-5p、rno-miR-133b-3p、rno-miR-133a-3p、rno-miR-325-5p、rno-miR-675-3p、rno-miR-411-5p、rno-miR-329-3p、rno-miR-335和rno-miR-126a-3p,均为表达上调,其中上调明显的是rno-miR-206-3p、rno-miR-133a-5p和rno-miR-675-3p,见图1、表3。
3RT-qPCR验证miRNA基因芯片差异表达谱结果
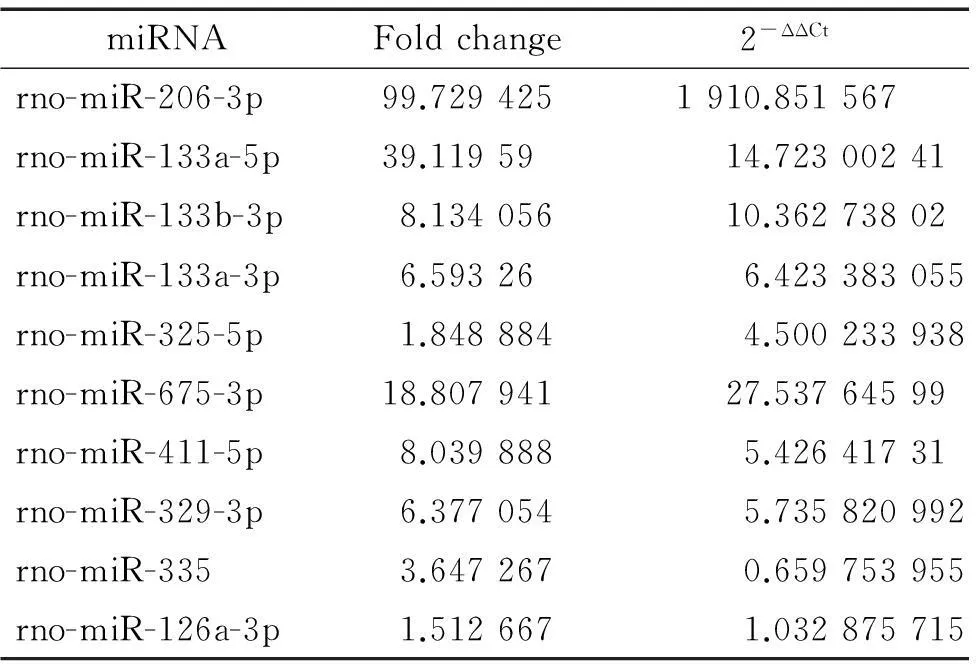
miRNA基因芯片中这10种miRNA在组织中表达差异较大,相比DN,都在DAS组织中表达上调。运用RT-qPCR技术对miRNA基因芯片筛选出差异表达的10个miRNAs进行验证工作,设定miRNA在DN组织中表达量为对照,计算miRNA在DAS组织内相对表达水平(图2)。对比DAS与DN miRNA的RT-qPCR结果与基因芯片结果,这10种miRNA的PCR检测结果与基因芯片结果虽然在数值上有些差异,但是趋势基本一致,仅仅rno-miR-335的PCR检测结果与基因芯片检测结果相反,为表达下调,见图3、表4,所以miRNA芯片结果基本可靠。RT-qPCR验证也显示rno-miR-206-3p、rno-miR-133a-5p和rno-miR-675-3p在DAS下肢动脉组织高表达。
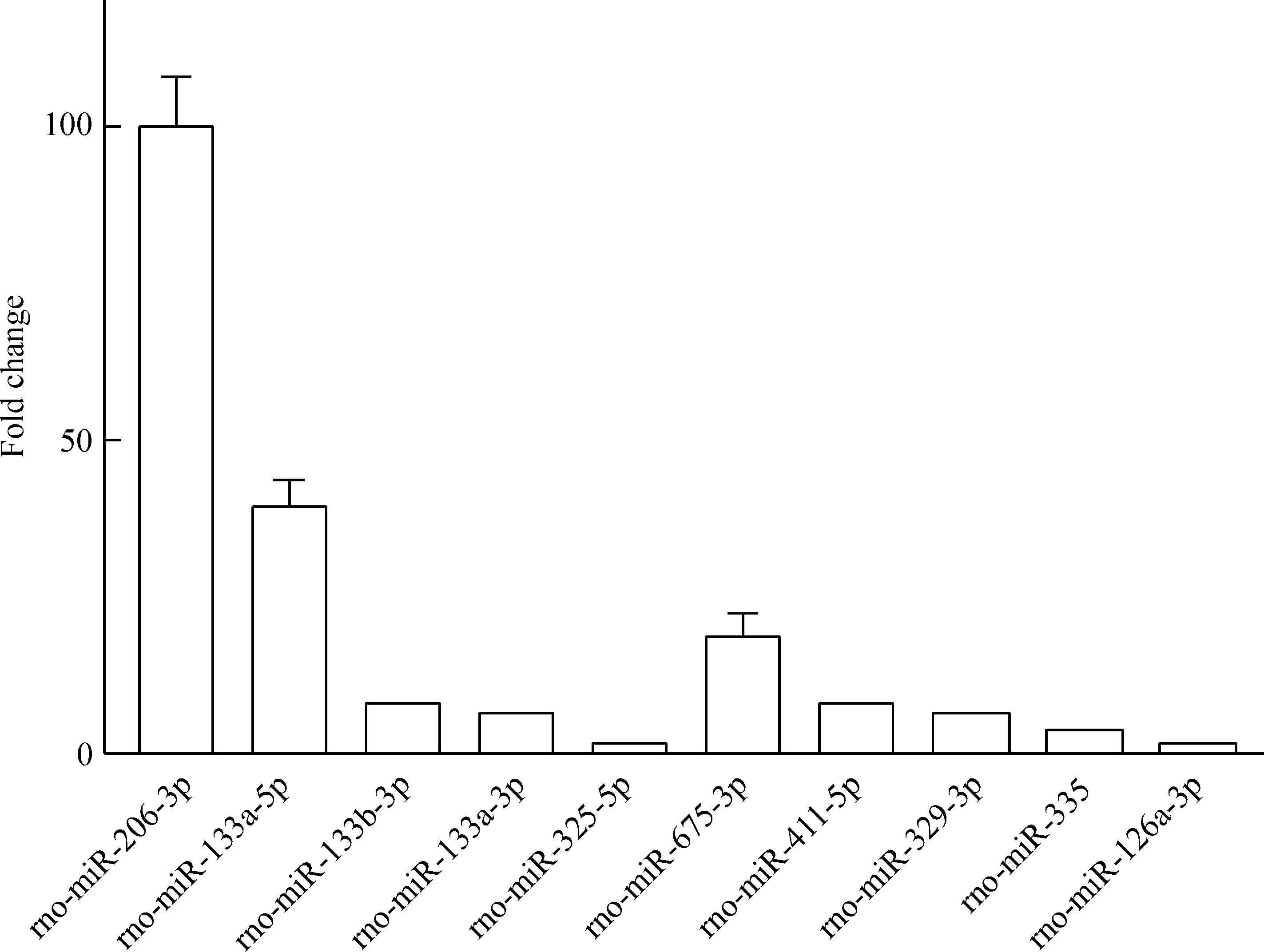
Figure 1. Differentially expressed miRNAs detected by microRNA chips. Mean±SD.n=3.
图1芯片中miRNA的差异表达
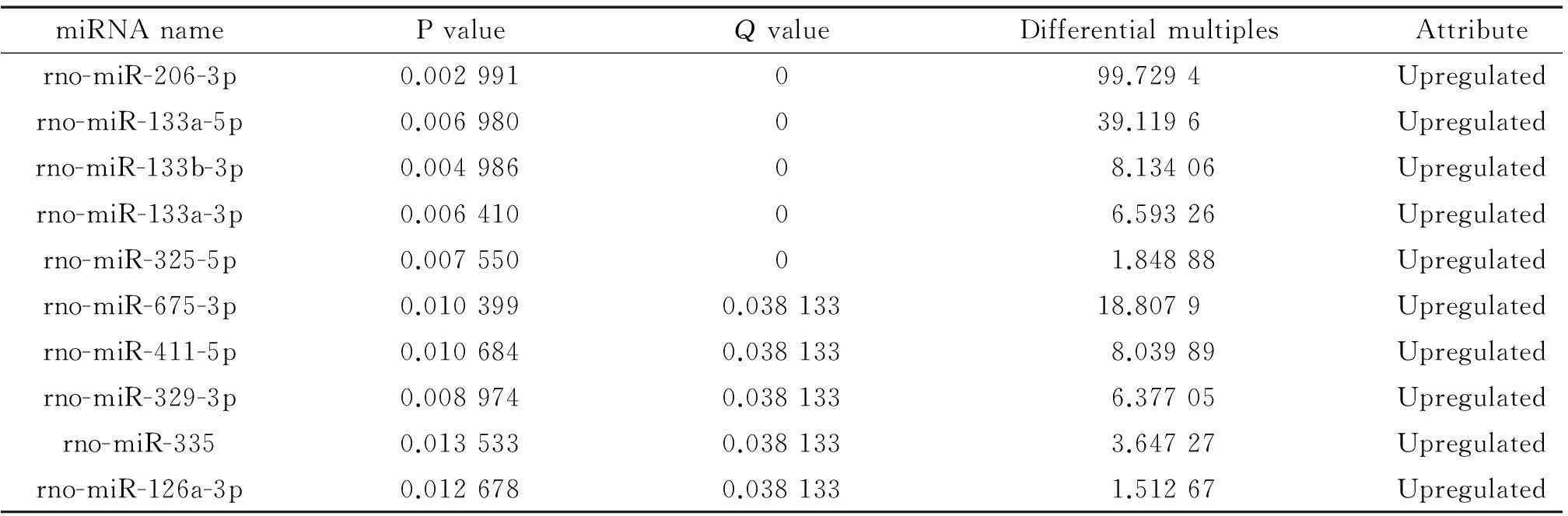
表3 DAS中异常miRNA表达谱
讨论
查阅相关文献,报道克隆技术和Northern blot分析技术也经常运用于miRNAs的确认[13],且费用相对来说比较低,可是对大量miRNA的差异表达谱筛选,二者存在着工作量大,灵敏度低的缺点,难以在单一一次实验中分析出数百个miRNA的差异表达情况,非常不便于对差异基因的筛选。随着能同时检测成百上千差异基因的高通量基因芯片技术的普及与推广,我们选择Affymetrix提供的miRNA基因芯片技术,采用的芯片型号为Affymetrix GeneChip miRNA 4.0 Array,其miRNA探针序列信息来源于最新Sanger miRBase 20.0数据库(http://microrna.sanger.ac.uk/sequences/),能够检测约28 700个注释完好基因的约31 000个转录本。其中为了得到芯片合理准确的质量评估,每种类型的样本不少于3次重复,同时为了保证芯片在探针集水平的评估结果,芯片内每个探针杂交布置5个重复,运用了μParaflo®技术,芯片内和不同芯片间阵列点的一致性都非常好,所以miRNA芯片是研究大量样本和样本中大量miRNA最常用的高通量方法[14-15]。
虽然高通量技术检测出来的信息稳定性差,错误率高,且费用也比较昂贵,但是随着近几年基因芯片技术的发展,数据库的增强,芯片数据准确率逐年攀升。因为芯片存在较大错误率,所以还需RT-qPCR和Northern blot实验的验证,对后续功能检测确定,这个步骤也是非常关键和必要的。
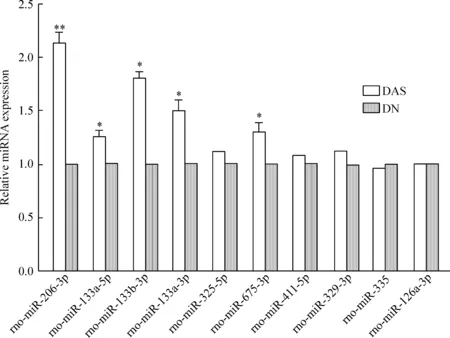
Figure 2. The expression levels of miRNAs determined by RT-qPCR detection. Mean±SD.n=3.*P<0.05,**P<0.01 vs DN.
图2RT-qPCR检测 miRNA相对表达水平

Figure 3. Comparison of the microarray and RT-qPCR results. Mean±SD.n=3.*P<0.05,**P<0.01 vs microarray.
图3芯片和RT-qPCR结果的对比
由于动脉硬化具体详细的发病机制还未阐明,同时鲜有关于糖尿病下肢动脉硬化的miRNA差异表达报道,本实验率先将miRNA芯片技术应用到糖尿病下肢动脉硬化发病机制的研究中去,做出差异表达谱,筛选出差异表达的miRNAs,为研究糖尿病下肢动脉硬化发病机制提供了重要实验补充。本次实验数据来自动物模型不同的病例样本,选自所有芯片表达趋势一致的差异miRNA,差异具有统计学显著性。基因芯片显示有10个明显差异表达的miRNA,RT-qPCR验证与芯片趋势一致,只是rno-miR-335在实时定量PCR中表达为下调,与芯片结果相反。进行RT-qPCR数据与基因芯片对比,DAS相对DN miRNA差异表达最为明显的是rno-miR-206-3p、 rno-miR-133a-5p和rno-miR-675-3,为表达明显上调。基于筛选出的关键miRNA,利用网上共享数据库Gene Ontology(GO)分析(http://www.geneontology.org)进行GO分类,包括GO分析、Passway分析、基因网络分析、GSEA分析和KEGG Pathway分析和了解相关的信号通路和基因功能,后期将针对关键miRNA构建miRNA拟似物和miRNA抑制物寡核苷酸,进行过表达和抑制实验。根据现有实验数据显示,有一群miRNAs在糖尿病大鼠患有下肢动脉硬化中起着重要作用,其表达过程很可能影响着血管动脉硬化的进程。本次实验数据为以后进行miRNA靶向调节基因表达研究,阐明糖尿病下肢动脉硬化发病基因调控机制提供了重要实验数据和理论依据。
表4RT-qPCR检测结果与miRNA芯片结果比较
Table 4.The results of RT-qPCR detection (2-ΔΔCt) for validating the results of microarray
miRNAFoldchange2-ΔΔCtrno-miR-206-3p99.7294251910.851567rno-miR-133a-5p39.1195914.72300241rno-miR-133b-3p8.13405610.36273802rno-miR-133a-3p6.593266.423383055rno-miR-325-5p1.8488844.500233938rno-miR-675-3p18.80794127.53764599rno-miR-411-5p8.0398885.42641731rno-miR-329-3p6.3770545.735820992rno-miR-3353.6472670.659753955rno-miR-126a-3p1.5126671.032875715
[参考文献]
[1]Ye S, Yang L, Zhao X, et al. Bioinformatics method to predict two regulation mechanism: TF-miRNA-mRNA and lncRNA-miRNA-mRNA in pancreatic cancer[J]. Cell Biochem Biophys, 2014, 70(3):1849-1858.
[2]Bommer GT, Gerin I, Feng Y, et al. p53-mediated activation of miRNA34 candidate tumor-suppressor genes[J]. Curr Biol, 2007, 17(15):1298-1307.
[3]Baranwal S, Alahari SK. miRNA control of tumor cell invasion and metastasis[J]. Int J Cancer, 2010, 26(6):1283-1290.
[4]Cha YH, Kim NH, Park C, et al. MiRNA-34 intrinsically links p53 tumor suppressor and Wnt signaling[J]. Cell Cycle, 2012,11(7):1273-1281.
[5]王霞,杜杰, 李汇华. miRNA-155在心血管疾病中的作用[J].生理科学进展, 2013, 44(5):377-380.
[6]Figueira MF, Monnerat-Cahli G, Medei E, et al. MicroRNAs: potential therapeutic targets in diabetic complications of the cardiovascular and renal systems[J]. Acta Physiol (Oxf), 2014, 211(3):491-500.
[7]Li T, Yang GM, Zhu Y, et al. Diabetes and hyperlipidemia induce dysfunction of VSMCs: contribution of the metabolic inflammation/miRNA pathway[J]. Am J Phy-siol Endocrinol Metab, 2015, 308(4):E257-E269.
[8]Ramírez-Gordillo D, Powers TR, van Velkinburgh JC, et al. RNA-Seq and microarray analysis of theXenopusinner ear transcriptome discloses orthologous OMIM® genes for hereditary disorders of hearing and balance[J]. BMC Res Notes, 2015, 8:691.
[9]Ashaari NS, Ramarad S, Khairuddin D, et al. Development of repeatable arrays of proteins using immobilized DNA microplate (RAPID-M) technology[J]. BMC Res Notes, 2015, 8:669.
[10]Fraiture MA, Herman P, Taverniers I, et al. Current and new approaches in GMO detection: challenges and solutions[J]. Biomed Res Int, 2015,2015:392872.
[11]Tusher V, Tibshirani R, Chu G. Significance analysis of microarrays applied to the ionizing radiation response[J]. Proc Natl Acad Sci U S A, 2001, 98(9):5116-5121.
[12]Sempere LF, Freemantle S, Pitha-Rowe I, et al. Expression profiling of mammalian microRNAs uncovers a subset of brain-expressed microRNAs with possible roles in murine and human neuronal differentiation[J]. Genome Biol, 2004, 5(3):R13.
[13]Kim VN. MicroRNA biogenesis: coordinated cropping and dicing[J]. Nat Rev Mol Cell Biol, 2005, 6:376-385.
[14]Connon SA, Giovannoni SJ. High-throughput methods for culturing microorganisms in very-low-nutrient media yield diverse new marine isolates[J] Appl Environ Microbiol, 2002, 68(8):3878-3885.
[15]Persson KE, Lee CT, Marsh K, et al. Development and optimization of high-through put methods to measure plasmodium falciparum-specific growth inhibitory antibodies[J]. J Clin Microbiol, 2006, 44(5):1665-1673.
(责任编辑: 陈妙玲, 罗森)
Microarray-based miRNAs profiling in lower limb arteriosclerosis of diabetic rats
SUN Ping1, XIAO Le2, GONG Kun-mei2,
(1MedicalFacultyofKunmingUniversityofScienceandTechnology,2FirstPeople′sHospitalofYunnanProvince,3FirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming650034,China.E-mail:kunhuagongkunmei@163.com)
[ABSTRACT]AIM: To establish the profiling of microRNAs (miRNAs) in the lower extremity arterial tissue between diabetic rats with lower limb arteriosclerosis (DAS) and diabetic rats with normal lower limb (DN), and to explore the possible molecular mechanisms involved in aberrant miRNA expression in DAS. METHODS: The rat models of DAS and DN were successfully established. The respective lower extremity arterial tissue was isolated. The total miRNAs were purified for a hybridization detection by miRNA microarray. The results of chip scanning and data were analyzed and verified by RT-qPCR. RESULTS: Ten miRNAs related to DAS, including rno-miR-206-3p, rno-miR-133a-5p, rno-miR-133b-3p, rno-miR-133a-3p, rno-miR-325-5p, rno-miR-675-3p, rno-miR-411-5p, rno-miR-329-3p, rno-miR-335 and rno-miR-126a-3p, were determined. All 10 abnormally expressed miRNAs were up-regulated. The validating results of RT-qPCR confirmed 9 of the miRNAs in line with chip expression. Just rno-miR-335 showed the opposite between PCR detection and microarray result. CONCLUSION: A group of miRNAs in diabetic rats suffering from lower limb arteriosclerosis plays an important role in the vascular atherosclerosis process. The abnormal expression of miRNAs is likely to affect the vascular atherosclerosis process.
[KEY WORDS]MicroRNAs; Microarray; Diabetes mellitus; Lower limb arteriosclerosis
[文章编号]1000- 4718(2016)05- 0917- 06
[收稿日期]2015- 11- 27[修回日期] 2016- 02- 16
*[基金项目]国家自然科学基金资助项目(No. 81260066; No. 81360069); 云南省科技厅-昆明医科大学联合专项基金资助项目(No. 2012FB089; No. 2013FB199)
通讯作者△Tel: 0871-63638564; E-mail: kunhuagongkunmei@163.com
[中图分类号]R587.1; R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.025
杂志网址: http://www.cjpp.net
·短篇论著·
