植物蔗糖转运蛋白研究进展
2016-05-30张清胡伟长张积森
张清 胡伟长 张积森


摘 要 蔗糖转运蛋白(SUT)在植物的生长代谢中调控蔗糖的运输和分配,并通过蔗糖信号影响其它代谢途径。植物蔗糖转运蛋白结构较为保守,属于12次跨膜的膜蛋白基因家族。对已完成基因组测序的10个单子叶和8个双子叶植物的蔗糖转运蛋白聚类分析表明,该基因家族可以分为5个亚族,SUT1、SUT2、SUT3、SUT4、SUT5,其中SUT2和SUT4为单、双子叶所共有的基因,SUT1为双子叶特异,而SUT3、SUT5为单子叶特异。单、双子叶蔗糖转运蛋白是由2个祖先基因进化而来。SUT的组织分布和遗传转化研究表明,SUT参与植物蔗糖运输与贮存、非生物胁迫响应、胚乳发育等,且SUT家族成员之间存在功能差异。SUT2的表达受SnRKs调控,而SUT4表达则调控部分生物钟相关基因,同时筛部移动信号等也调节SUT的表达。本文综述了植物蔗糖转运蛋白基因分类、生理功能及其在不同水平上的调控等方面的研究进展,为更好的理解蔗糖转运蛋白对植物生长发育的影响及其分子机制提供参考。
关键词 蔗糖转运蛋白;单双子叶植物;基因进化;基因功能;基因家族
中图分类号 Q946.1 文献标识码 A
Abstract Sucrose transporters(SUT)regulate the sugar distributions in tissues and influence several plant metabolic pathways by using sucrose as the signal. Plant sucrose transporters are conservative proteins containing 12 transmembrane protein domains. Phylogenetic analysis of the whole sucrose transporter families from 10 monocotyledon and 8 dicotyledon demonstrates that the gene family could be separated into two groups for five subfamilies(SUT1, SUT2, SUT3, SUT4, SUT5). The results suggested that sucrose transporters of monocotyledon and dicotyledonwere originated from two different ancient genes. In addition, the genes in SUT2 and SUT4 subfamilies exist in both monocotyledon and dicotyledon, and SUT1 specifically exists in the dicotyledon, while, the SUT3 and SUT5 are monocotyledon-specific. SUT families play roles in the process of transportation and storage of sucrose, abiotic stress response and the development of endosperm as well, and the gene members of SUT families present diverse functions in plant. In addition,the expression level of SUT families is proved to regulated by the long-range signal;furthermore, the gene network for two of members, SUT2 and SUT4, have been investigated in the families, showing that the expression level of SUT2 is regulated by SnRKs, while, SUT4 regulated some of biological clock related genes. In this paper,we reviewed the progresses on different aspects of SUT genes, such as classification,physiological function and regulation at different levels,providing details about their the effects on plant growth and development.
Key words Sucrose transporters;Monocotyledonous and dicotyledonous plants;Gene evolution; Gene function;Gene families
doi 10.3969/j.issn.1000-2561.2016.01.031
蔗糖作为一种非还原糖,是大多数高等植物的主要光合同化产物。光合作用产生的蔗糖除了部分维持光合组织自身的代谢外,大部分通过韧皮部长距离运输到其他组织进行代谢或储存。在植物中,生产或输出同化产物的组织通常称之为“源”,而接收、利用或储存同化产物的组织称之为“库”[1-2]。蔗糖从源到库的运输和分配过程中,韧皮部的“装载”和“卸载”都涉及到两条途径:第1条为共质体途径,蔗糖分子从叶肉细胞进入到筛管分子-伴胞复合体(sieve element-companion cell,SE/CC),需要经过细胞与细胞间的胞间连丝,不需要经过跨膜运输;第2条为质外体途径,即蔗糖分子从叶肉细胞进入到筛管分子-伴胞复合体,不是通过胞間连丝而是通过锚定在筛管分子-伴胞复合体上的蔗糖转运蛋白进行跨膜转运[3]。质外体途径在大多数植物中占有重要的地位,该途径依赖一种特殊的载体蛋白来介导蔗糖分子的跨膜转运,这个过程需要能量驱动[4]。最近的研究表明,质外体途径中,蔗糖分子从韧皮部薄壁细胞流出,进入到筛管伴胞复合体中的过程需要SWEET(Sugars Will Eventually be Exported Transporters)蛋白和蔗糖转运蛋白共同来完成[5]。蔗糖转运蛋白(sucrose/H+cotransporter或sucrose transporters,SUCs或SUTs)可以依赖H+2ATPase形成的质膜电化学势差耦联进行蔗糖的跨膜转运,所以又称蔗糖-H+共转运蛋白(sucrose/H+co-transporters,SUCs)。蔗糖转运蛋白作为一类具有蔗糖转运活性的载体广泛地存在于高等植物的各种组织中,介导植物体中蔗糖的输入和输出,在多种生理过程中起着非常重要的作用[6]。近年来,基因组领域的研究为SUT基因的分类与基因组演化提供了新的数据资源,不同的研究团队对SUT家族主成员SUT1、SUT2、SUT4表达与分子网络调控方面均有明显进展。为此,本文对蔗糖转运蛋白的生理生化、基因组学、基因功能与分子调控机制进行较为全面的综述。
1 单双叶植物中的蔗糖转运蛋白基因家族分类
蔗糖转运蛋白是配糖体戊糖苷己糖醛(glycoside-pentoside-hexuronide,GPH)阳离子家族的成员,属于主要易化子超家族(major facilitator superfamily,MFS)[7],该家族成员显著的结构特点是具有12个由α-螺旋构成的高疏水性跨膜结构域(图1),其序列高度保守,存在很多保守的氨基酸。水稻OsSUT1中发现了6个对蔗糖转运功能至关重要的氨基酸位点D177、R188、D329、D331、R335和E336[8]。Ricky等在高粱(Sorghum bicolor)中发现了6个蔗糖转运蛋白基因,并克隆出了高粱两个品种(cv.Rio和cv.BTx623)中的蔗糖转运蛋白基因的cDNA,序列比较发现只有SbSUT4的N端结构域中包含一个LXXLL结构,可能是液泡膜的靶位点[9],两个高粱品种中的SbSUT5有9个氨基酸(A32G,G33A,E34G,K35E,G37A,L272V,V355M,T396M,K426R)的差异(图1),SbSUT1有一个氨基酸(I381V)的差异,SbSUT2在Rio中有T41的插入,SbSUT3、SbSUT4、SbSUT6在两个品种中无氨基酸差异。尽管ZmSUT4与ShSUT4在结构上存在差异,但是它们的序列的相似度却达到了88%[10]。在小麦中,研究者通过比较基因组学的方法鉴定了六倍体小麦中的一个新的蔗糖转运蛋白的3个同系成员(TaSUT2),它的3个同系成员TaSUT2A、TaSUT2B、TaSUT2D的开放读码框(Open Reading Frame, ORF)分别为1 518、1 518、1 524 bp,编码的蛋白分别为506、506、508个氨基酸,分子量约为54 ku,这三者之间的3UTR区域存在较大差异[11]。
目前对蔗糖转运蛋白的基因家族的分类先后有两种,第1种是把植物蔗糖转运蛋白基因分成3个类型[13],其中第1类型的蔗糖转运蛋白基因只在双子叶植物中存在,与菠菜SoSUT1和拟南芥AtSUT2的同源性较高[14],第2、3类型为单双子叶植物蔗糖转运蛋白基因共有,第2类型的植物蔗糖转运蛋白基因与拟南芥中的AtSUT2较为同源,第3类型则与拟南芥中的AtSUT4较为同源,为此推测,第2、3类型的植物蔗糖转运蛋白可能是蔗糖转运蛋白的祖先形式,在进化的过程中,它们共同祖先的进化早于单双子叶植物的分歧[13]。另一种是根据对更多植物SUT基因序列同源性分析,将植物蔗糖转运蛋白共分为5个亚族:SUT1、SUT2、SUT3、SUT4和SUT5亚族[6],其中,SUT2和SUT4亚族是单双子叶植物共有的,而SUT3和SUT5亚族是单子叶植物特有的,SUT1亚族是双子叶植物特有的,这说明单子叶植物的蔗糖转运蛋白与双子叶植物的蔗糖转运蛋白在进化上可能存在着某种先后进化关系。
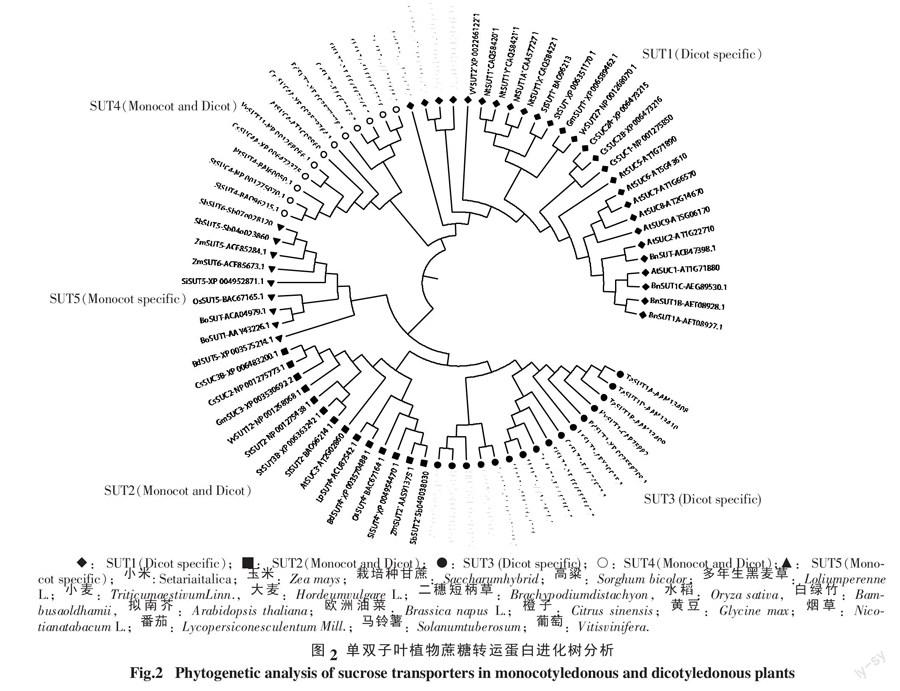
在基因演化研究中,对来源于更多有代表性物种的基因家族成员进行聚类分析,更有利于得到可靠的结论。近年来,多种植物的基因组被解析,这为研究植物糖转运蛋白基因的演化提供了可靠的数据。到目前为止,已经至少在11种单子叶植物和30多种双子叶植物中发现了蔗糖转运蛋白基因,除了在拟南芥、水稻中的研究较为深入外,其他物种的蔗糖转运蛋白基因有待深入研究[6, 12]。为进一步考查上述两种分类方法的合理性,我们将10种单子叶植物和8种双子叶植物中找到的78种蔗糖转运蛋白基因的氨基酸序列进行聚类分析发现,其聚类结果可以将植物蔗糖转运蛋白共分为5个亚族,这与Kühn等[6]的主张是一致的(图2)。SUT1和SUT4共存一族,而SUT2、SUT3和SUT5共存一族,这预示单双子叶植物的蔗糖转运蛋白起源于2个祖先基因,支持Reinders等[13]认为SUT2和SUT4是单双子叶植物的蔗糖转运蛋白共同祖先的假说(见图2),但这结果进一步推测SUT4的祖先基因在单双子叶分化后产生双子叶特异性的SUT1,而SUT2的祖先基因则在单双子叶分化后产生单子叶特异的SUT3和SUT5。
2 蔗糖转运蛋白基因的生理功能研究
2.1 单子叶植物蔗糖转运蛋白基因的生理功能研究
在单子叶的模式植物水稻中,在叶片、叶鞘、圆锥花序和萌发的种子中都检测到了OsSUT1的表达[15-16]。在水稻的灌浆阶段,OsSUT1在叶片的韧皮部、第一节间、花茎中表达,为灌浆过程转运所需要的蔗糖,而抑制OsSUT1的表达会影响谷粒的充实程度[17],此外,OsSUT1的表达水平可以调控响应水稻盐胁迫的基因[18],在萌发的胚中,OsSUT1、OsSUT2、OsSUT4的表达量比OsSUT3和OsSUT5高,而且差异显著[16],用GUS染色分析OsSUT4的启动子的结果发现该基因在水稻种子的糊粉层和胚中特异表达,可以推测OsSUT4在介导蔗糖从胚乳到达萌发的胚中起着非常关键的作用[19]。通过反义抑制水稻蔗糖转运蛋白基因OsSUT5的表达,可以显著降低其愈伤组织诱导植株再生率,这表明OsSUT5基因影响水稻组织培养过程中外植体对蔗糖的吸收和转运[20]。
小麦中,研究表明非叶组织包括颖片、外稃对小麦种子光合同化物的贡献率为10%~44%,抽穗前期与后期都在麦穗的颖片中检测到了TaSUT1的表达,这说明TaSUT1可能在介导蔗糖从穗状花序到韧皮部装载过程中起着非常重要的作用[21-22]。据最新的研究发现,把大麦的SUT基因遗传转化到冬小麦中可以增加产量和微量营养素的含量[23]。而在酵母中表达TaSUT2,结果显示TaSUT2可以被错误定位在细胞质膜上,这种错误定位可以功能互补酵母SUSY7/ura3的突变表型[11]。
高粱族(Trib. Andropogoneae)的代表性作物有高粱和糖料作物甘蔗。在高粱中,SbSUT1在“源”和“庫”中都被检测到,SbSUT2存在于所有的组织中,SbSUT4存在于成熟的叶子中,SbSUT5在茎中表达,SbSUT6在植株生长时期的叶片的“源”和“库”中表达,但具体的功能还有待进一步研究[12]。在糖料作物甘蔗中,从澳大利亚栽培种中克隆出来的一个蔗糖转运蛋白基因命名为ShSUT1[24],后来将从夏威夷栽培种中克隆出来的一个比SbSUT1多7个氨基酸残基的蔗糖转运蛋白命名为ShSUT2A[24]。用双极电压钳技术对在非洲爪蟾蜍卵母细胞中表达的ShSUT1进行研究发现,ShSUT1对蔗糖具有高选择性,但是在膜电势为-137 mV、pH=5.6、K0.5=8.26 mmol/L的条件下ShSUT1对蔗糖的亲和性较低,同时发现蔗糖的类似物三氯蔗糖能竞争性抑制ShSUT1的酶活性[13]。ShSUT2被发现在维管束鞘周围的细胞层中表达,ShSUT1和ShSUT1A可能在回收从茎的薄壁细胞渗出蔗糖分子的过程中起到重要作用[3,25]。目前对单子叶植物的SUT5亚族的蔗糖转运蛋白的功能特征还不是很清楚[26]。
2.2 双子叶植物中的蔗糖转运蛋白基因的生理功能研究
编码基因表达特征和亚细胞定位是研究植物蔗糖转运蛋白运输性质的重要手段,而YFP(yellow fluorescent protein,黄色荧光蛋白)、GFP(green fluorescent protein,绿色荧光蛋白)融合表达定位和免疫定位经常被用来研究蔗糖转运蛋白在植物组织中的定位。茄科植物SUT蛋白主要定位在木质部的薄壁组织细胞和韧皮部的伴胞中[27];马铃薯StSUT4-GFP融合蛋白定位在质膜上,StSUT4的mRNA稳定性的调控发生在转录后水平上,在远红光照射的条件下,其稳定性增强[28-29];马铃薯、番茄和烟草的SUT1存在于无核的筛管细胞质膜中[30];烟草的NtSUT4在质膜中表达[29];胡萝卜(Daucuscarota)DoSUT1在叶片中表达,在韧皮部中起到装载的作用,DoSUT2主要在库组织韧皮部中表达[31];荷花LjSUT4定位在液泡膜上[32]。有些转运蛋白在库器官中特异表达,如葡萄中的VvSUC11、VvSUC12,利用基因工程技术把这两个基因导入到甜菜的块根中能有效提高转基因甜菜的含糖量[33-34];芭蕉(Musa basjooSiebold)的PmSUC1在花粉管和花粉粒中表达[35];在蓖麻种子发芽的过程中,蓖麻RCSUT1在子叶的表皮细胞以及相邻的胚乳和韧皮部中表达[5,35-36];拟南芥AtSUT2在叶片的伴细胞和韧皮部中表达,主要在韧皮部起到装载蔗糖的作用[37]。在拟南芥种子早期萌发过程中,AtSUT5被认为在胚乳中特异表达,为胚乳提供生物素,从而影响三酰甘油的积累[38-39]。AtSUT3、AtSUT4主要在成熟植株的源叶片的细脉中表达,而AtSUT4还在液泡中表达,可能参与调控蔗糖的运输和存储过程[40-41]。桃子PpSUT1在源细胞的质膜中表达,在韧皮部中行使装载的功能;PpSUT4在液泡中表达,参与调控液泡中蔗糖的流入流出,从而维持细胞代谢[42]。欧洲白蜡树FeSUT1在叶片细脉的筛管细胞中表达,异源表达FeSUT1发现该蔗糖转运蛋白可以回收渗漏到筛管外的蔗糖分子,过表达FeSUT1使欧洲白蜡树叶片的碳的代谢在春天和深秋发生异常[43]。SWEET家族基因与蔗糖转运蛋白家族基因同属于MFS超家族,研究表明,SWEET也行使介导蔗糖运输的功能,在植物的韧皮部薄壁组织中表达,可以将叶脉中的蔗糖传递给SUT1,为植物中的病原微生物和共生体提供营养[5,44-46]。SWEET9在拟南芥、烟草等植物的花的蜜腺中高度表达,该位置蔗糖的输出需要大量招募SWEET9[47]。
植物中不同的蔗糖转运蛋白分布的组织细胞部位不同,行使的功能也不同,如拟南芥AtSUT1在花粉中高度表达,主要在花粉萌发过程中介导蔗糖的摄取,敲除AtSUT1的突变会导致植株花青素合成减少,而且一些与花青素合成相关的基因的表达也相应会减少[48],AtSUT9几乎在所有组织中都有表达,AtSUT9基因的缺失会导致植株由于非生物胁迫诱导产生的ABA合成受阻,从而使植株适应胁迫的能力下降[49]。茄属植物的SUT4在质膜、液泡、内质网中表达,可能参与调控茄科植物的生理节律,SUT4发生突变会导致植物中乙烯的合成不再遵守白昼的节律[29]。但在拟南芥的研究中,AtSUT4和AtSUT2与一些非生物胁迫的耐受性相关,这两者可以通过蔗糖信号来调控ABA-依赖的途径,进而来响应非生物胁迫[11,50]。烟草蔗糖转运蛋白NtSUT1的过表达可以提高烟草细胞对铝离子的耐受性[51]。蔗糖转运蛋白除了转运蔗糖外还具备其他的功能,拟南芥AtSUT2可以转运麦芽糖和配糖物,如熊果苷、水杨苷等[52]。AtSUT9可以转运蜗牛素、水杨苷、麦芽糖等[52]。
3 植物蔗糖转运蛋白的调控
3.1 蔗糖转运蛋白的转录水平调节
植物蔗糖轉运蛋白受不同的代谢产物和相关基因的调控,是植物能够适应外界刺激(温度、光照、光周期、病虫害等胁迫)的应答机制之一[6]。研究发现,蔗糖能通过一些特异的启动子对蔗糖转运蛋白的转录水平进行调节,如受蔗糖诱导的patatin启动子和韧皮部特异表达的rolC启动子[53]。SnRKs(Sucrose nonfermenting-1(SNF1)-related protein kinases)家族基因被认为与调控代谢和响应胁迫相关,其中SnRK1主要作用于调控碳代谢和能量状态的过程[54-55],而SnRK2、SnRK3受胁迫调节,参与ABA介导的信号途径[56]。SnRK2激酶的负调控因子磷酸酶PP2C在ABA的调控下可以使PYR/PYL/RCAR蛋白结合并抑制PP2C,使SnRK2能自激活,磷酸化下游的转录因子(ABF/AREB),促进ABA应答基因的转录[57-59]。拟南芥中SnRKs基因的表达受AtSUT2、AtSUT4和AtSUT9的调控[40,49],而SnRKs基因在小麦中参与蔗糖信号调控途径[60]。AtSUT2和AtSUT4基因在拟南芥中被证明是受胁迫诱导,同时蔗糖转运蛋白基因家族成员AtSUT3调控AtSUT2和AtSUT4基因的表达[40]。SUT4的表达影响一些生物钟调控相关的基因(如StFT、StSOC1、StCO)的表达,这些生物钟相关基因参与调控光周期依赖的块茎组织器官发育[29](图3)。在种子的萌发和生长过程中,AtSUT9基因受低浓度的蔗糖诱导,该基因的缺失还会抑制一些响应低蔗糖信号相关基因的表达,同时还会抑制一些受ABA诱导的基因(如SnRk2.2/3/6, ABF2/3/4, ABI1/3/4, RD29A, KIN1和KIN2)的表达[49]。黑麦草的LpSUT2被认为是在亚细胞水平上参与调控蔗糖和果糖的信号途径,影响植物落叶[61]。双分子荧光互补实验证明,蕃茄中的SlSUT2参与调控油菜素类固醇信号,影响灌木菌根的形成[62]。
蔗糖转运蛋白基因的表达除了受相关基因的调节外,还受某些筛部移动信号的调节,如蔗糖分子、赤霉素、細胞分裂素、miRNA以及其他的一些小分子存在于韧皮部汁液中,构成了筛部长距离运输的信号[63],欧洲油菜的导管渗出液中可以检测到18个不同家族的32个miRNA[64],其中miR172在许多植物中被认为与调控开花有关[65-66],在马铃薯中过表达miR172可以促进开花、加速诱导块茎形成[67],这与StSUT4在RNAi作用下下调表达产生的结果一样,可能是因为miRNA参与调控光敏色素B的下游途径,从而影响GA信号途径中的BEL5的表达[68]。通过共注射南瓜中的RNA-binding 韧皮部蛋白CmPP16发现StSUT1 mRNA 可以通过胞间连丝结构在细胞间移动[69]。南瓜的CmSUT1 mRNA可以在菟丝子与其宿主植物南瓜之间进行移动[70]。菠菜SoSUT1、番茄SlSUT1的mRNA都被证实在韧皮部中可以流动[28]。用35S融合表达SoSUT2使其带有c-myc标签但不含UTR区域,仍然能在韧皮部汁液中检测到SoSUT2的mRNA,说明3′和5′UTR不是SoSUT1 mRNA通过胞间连丝所必须的[28]。迄今为此,人们在用3种不同的方法证明蔗糖转运蛋白的mRNA至少可以在拟南芥、南瓜、马铃薯、番茄、烟草5种植物的韧皮部流动[28,70-71],但韧皮部中蔗糖转运蛋白mRNA的作用机理到现在为止还不是很清楚,这些mRNA是否会被运回伴细胞中翻译需要进一步探究。
3.2 蔗糖转运蛋白的转录后调节
蔗糖转运蛋白的mRNA半衰期比较短,通常为60~130 min[28,72],受生物钟节律和白昼节律的调控[31,73]。研究认为可以通过调控蔗糖转运蛋白的mRNA稳定性来调节其表达水平,环己酰亚胺是一种基因翻译抑制剂,也可以影响SUT mRNA的稳定性,当SUT1的翻译被抑制而导致其mRNA变得不稳定时,SUT2和SUT4 mRNA的积累增加到了原来的四倍,而同时加入放线菌素D和环己酰亚胺可以增加SUT2和SUT4转录本的稳定性[28]。SUT4和SUT2的RNA结合蛋白可能在转录后水平上参与调控StSUT4 mRNA的稳定性(图4),这可能会影响转录本在细胞间或者长距离的运输[74];在红光/远红光照射减弱或者遮阴的条件下,StSUT4的mRNA在源叶中大量积累,下调StSUT4的表达可以缓解避荫综合征[73](这种综合症是指在高密度光照条件下,增加红光/远红光比率会促进植株茎的伸长并诱导植株提前开花),而增加远红光照射和用放线菌素D处理都会导致StSUT4 mRNA大量积累,这可能是由于增加了转录本的稳定性,但没有增加转录活性[73]。StSUT4可能参与了光敏色素B依赖的途径,启动了避荫响应机制以至于远红光照射可以增加StSUT4转录本的半衰期,SUT4的mRNA 在乙烯和赤霉素处理的条件下积累,这说明SUT4可能参与连接光照信号途径和激素信号途径[73]。
3.3 蔗糖转运蛋白的翻译后调节
在高等植物中,蛋白质互作在蔗糖转运蛋白的翻译后水平调控中起到了决定性的作用[75],比如形成同源寡聚化和异源寡聚化的蛋白[6]。Renders等[76-77]利用分裂泛素化酵母双杂交系统对SUT1蛋白进行研究发现,SUT1之间可以形成有功能的同源二聚体,并进一步在植物中用分裂的YFP证实了该结论[78]。此外,通过分裂泛素化酵母双杂交系统、免疫共沉淀和双分子荧光互补测定发现,苹果(Maluspumila)蔗糖转运蛋白MdSUT1与山梨醇转运蛋白MdSOT6在细胞色素b5(Cyb5)的参与下能发生特殊的反应,增加蔗糖浓度会抑制MdSUT1与Cyb5的相互作用,但不受葡萄糖浓度变化的影响[79]。拟南芥中AtSUT4/Cyb5-2复合物可能参与蔗糖和葡萄糖的信号途径[80]。核苷二磷酸葡萄糖焦磷酸化酶是淀粉合成中重要的酶,以变构的四聚体形式存在,其活性受糖和光的调节,主要是通过小亚基氧化还原所依赖的二聚化作用来实现[81-82],用免疫共沉淀的方法鉴定与StSUT1作用的蛋白发现StSUT1可以与核苷二磷酸葡萄糖焦磷酸化酶四聚体的大亚基--1-磷酸葡萄糖转乙酰酶相互作用[83],因此,淀粉的合成不仅受可利用的糖和核苷二磷酸葡萄糖焦磷酸化酶小亚基的二聚化作用的调节,同时还受StSUT1与核苷二磷酸葡萄糖焦磷酸化酶大亚基之间互作的调节。StSUT1可以与具有抗菌功能的细胞壁蛋白SN1相互作用,这种SN1蛋白富含脯氨酸,在马铃薯中,SN1抑制的表型与蛋白质二硫键异构酶被干扰的表型相似,这种蛋白质二硫键异构酶也可以与SUT发生互作[83]。
蛋白质的磷酸化与去磷酸化是调节蔗糖转运蛋白的重要形式。14-3-3蛋白被认为是通过结合磷酸化的蛋白来调控许多胞内的代谢过程,在拟南芥中,AtSUC6可以直接作用14-3-3x蛋白,这说明AtSUC6在行使功能的过程中也被磷酸化[84]。蛋白磷酸化抑制剂冈田酸影响甜菜(Beta vulgaris)BvSUT1的mRNA的表达量、转录速率以及转运蛋白的活性[85],然而,蛋白激酶抑制剂却不影响BvSUT1的转录和活性[86]。AtSUT5被首次直接证明其N端出现了磷酸化现象[87]。此外,质谱分析发现,拟南芥AtSUT1蛋白的第20位点的丝氨酸和第393位点的苏氨酸是该蛋白的主要磷酸化位点[88-89]。
4 研究展望
蔗糖转运蛋白作为植物中重要的功能基因家族,人们对单双子叶植物进行了系统的基因组学研究,对模式植物拟南芥,研究人员主要集中在亚细胞定位、结构、功能方面,有较为系统的研究。尽管如此,在植物蔗糖转运蛋白领域的研究依然还存在广泛的空白,如模式植物的拟南芥,对其AtSUT6、AtSUT7、AtSUT8的基因功能还不清楚;在主要的作物中,蔗糖转运蛋白基因家族的功能研究均还处于起步阶段,蔗糖转运蛋白领域还有许多科学问题值得我们去探索:(1)蔗糖转运蛋白在植物的生长代谢中处于什么样的位置?它又是如何影响其他代谢途径和如何受调控? (2)单双子叶植物的蔗糖转运蛋白家族基因在进化上存在着先后顺序,这家族基因的主要成员功能有何分工,单双子叶植物特异的蔗糖转运蛋白基因使单双子叶植物在蔗糖转运过程中存在哪些差异?(3)蔗糖转运蛋白在糖料作物的功能和调控是否存在特殊机制?其中典型的例子是甘蔗,蔗糖是甘蔗中最重要的光合同化产物,研究其蔗糖转运蛋白的分子机制具有实践意义,但甘蔗遗传背景高度复杂,这给甘蔗蔗糖转运蛋白的基因组学和分子生物学研究带来了巨大的挑战。笔者课题组正在从事甘蔗蔗糖转运蛋白基因家族成员之间的基因组学工作,并同步研究它们的功能。
參考文献
[1] Kuhn C, Franceschi V R, Schulz A, et al. Macromolecular trafficking indicated by localization and turnover of sucrose transporters in enucleate sieve elements[J]. Science, 1997, 275: 1 298-1 300.
[2] Lalonde S, Boles E, Hellmann H, et al. The dual function of sugar carriers. Transport and sugar sensing[J]. Plant Cell, 1999, 11: 707-726.
[3] Rae A L, Grof C P L, Casu R E, et al. Sucrose accumulation in the sugarcane stem: pathways and control points for transport and compartmentation[J]. Field Crops Research, 2005, 92: 159-168.
[4] Sauer N. Molecular physiology of higher plant sucrose transporters[J]. FEBS Lett, 2007, 581: 2 309-2 317.
[5] Chen L Q, Qu X Q, Hou B H, et al. Sucrose Efflux Mediated by SWEET Proteins as a Key Step for Phloem Transport[J]. Science, 2012, 335: 207-211.
[6] Kuhn C, Grof C P L. Sucrose transporters of higher plants[J]. Current Opinion in Plant Biology, 2010, 13: 287-298.
[7] Chang A B, Lin R, Studley W K, et al. Phylogeny as a guide to structure and function of membrane transport proteins (Review)[J]. Molecular Membrane Biology, 2004, 21: 171-181.
[8] Sun Y, Lin Z, Reinders A, et al. Functionally important amino acids in rice sucrose transporter OsSUT1[J]. Biochemistry,2012, 51: 3 284-3 291.
[9] Yamada K, Osakabe Y, Mizoi J, et al. Functional Analysis of an Arabidopsis thaliana Abiotic Stress-inducible Facilitated Diffusion Transporter for Monosaccharides[J]. Journal of Biological Chemistry, 2010, 285: 1 138-1 146.
[10] ElSayed A I, Boulila M, Rafudeen M S. Investigation into the Expression of Sucrose Transporters and Sucrose Phosphate Synthase mRNA in Different Plant Species[J]. AgriculturalResearch,2013(2): 31-42.
[11] Deol K K, Mukherjee S, Gao F, et al. Identification and characterization of the three homeologues of a new sucrose transporter in hexaploid wheat(Triticum aestivum L.)[J]. BMC Plant Biol, 2013, 13: 181.
[12] Milne R J, Byrt C S, Patrick J W, et al. Are sucrose transporter expression profiles linked with patterns of biomass partitioning in Sorghum phenotypes[J]. Frontiers in Plant Science, 2013(4).
[13] Reinders A, Sivitz A B, Hsi A, et al. Sugarcane ShSUT1: analysis of sucrose transport activity and inhibition by sucralose[J]. Plant Cell and Environment, 2006, 29: 1 871-1 880.
[14] Aoki N, Hirose T, Scofield G N, et al. The sucrose transporter gene family in rice[J]. Plant Cell Physiol, 2003, 44:223-232.
[15] Scofield G N, Aoki N, Hirose T, et al. The role of the sucrose transporter, OsSUT1, in germination and early seedling growth and development of rice plants[J]. J Exp Bot, 2007, 58: 483-495.
[16] Chen J Y, Liu S L, Siao W, et al. Hormone and sugar effects on rice sucrose transporter OsSUT1 expression in germinating embryos[J]. Acta Physiologiae Plantarum, 2010, 32: 749-756.
[17] Scofield G N, Hirose T, Gaudron J A, et al. Antisense suppression of the rice sucrose transporter gene, OsSUT1, leads to impaired grain filling and germination but does not affect photosynthesis[J]. Functional Plant Biology, 2002, 29: 815-826.
[18] Siahpoosh M R, Sanchez D H, Schlereth A, et al. Modification of OsSUT1 gene expression modulates the salt response of rice Oryza sativa cv. Taipei 309[J]. Plant Science, 2012, 182: 101-111.
[19] Chung P, Hsiao H H, Chen H J, et al. Influence of temperature on the expression of the rice sucrose transporter 4 gene, OsSUT4, in germinating embryos and maturing pollen[J]. Acta Physiologiae Plantarum, 2014, 36: 217-229.
[20] 张武君, 管其龙, 付艳萍, 等. 反义抑制水稻蔗糖转运蛋白基因(OsSUT5)的表达降低其愈伤组织诱导和植株再生频率[J]. 农业生物技术学报, 2014: 825-831.
[21] Wang Z M, Wei A L, Zheng D M. Photosynthetic characteristics of non-leaf organs of winter wheat cultivars differing in ear type and their relationship with grain mass per ear[J]. Photosynthetica, 2001, 39: 239-244.
[22] Aoki N, Whitfeld P, Hoeren F, et al. Three sucrose transporter genes are expressed in the developing grain of hexaploid wheat[J]. Plant Mol Biol,2002, 50: 453-462.
[23] Saalbach I, Mora-Ramirez I, Weichert N, et al. Increased grain yield and micronutrient concentration in transgenic winter wheat by ectopic expression of a barley sucrose transporter[J]. Journal of Cereal Science, 2014, 60: 75-81.
[24] Casu R E, Grof C P L, Rae A L, et al. Identification of a novel sugar transporter homologue strongly expressed in maturing stem vascular tissues of sugarcane by expressed sequence tag and microarray analysis[J]. Plant Molecular Biology, 2003, 52: 371-386.
[25] ElSayed A I, Ramadan M F, Komor E. Expression of sucrose transporter(ShSUT1) in a Hawaiian sugarcane cultivar infected with Sugarcane yellow leaf virus (SCYLV)[J]. Physiological and
Molecular Plant Pathology, 2013, 75: 56-63.
[26] 王利芬, 張虎平, 张绍铃. 植物蔗糖转运蛋白及其功能调节研究进展[J]. 植物研究, 2012(4): 501-507.
[27] Schmitt B, Stadler R, Sauer N. Immunolocalization of solanaceous SUT1 proteins in companion cells and xylem parenchyma: new perspectives for phloem loading and transport[J]. Plant Physiol,
2008, 148: 187-199.
[28] He H, Chincinska I, Hackel A, et al. Phloem mobility and stability of sucrose transporter transcripts[J]. The Open Plant Science Journal, 2008(2): 15-26.
[29] Chincinska I, Gier K, Krugel U, et al. Photoperiodic regulation of the sucrose transporter StSUT4 affects the expression of circadian-regulated genes and ethylene production[J]. Front Plant Sci, 2013(4): 26.
[30] Stadler R, Wright K M, Lauterbach C, et al. Expression of GFP-fusions in Arabidopsis companion cells reveals non-specific protein trafficking into sieve elements and identifies a
novel post-phloem domain in roots[J]. Plant J, 2005, 41: 319-331.
[31] Shakya R, Sturm A. Characterization of source-and sink-specific sucrose/H+ symporters from carrot[J]. Plant physiology, 1998, 118: 1 473-1 480.
[32] Reinders A, Sivitz A B, Starker C G, et al. Functional analysis of LjSUT4, a vacuolar sucrose transporter from Lotus japonicus[J]. Plant Mol Biol, 2008, 68: 289-299.
[33] Davies C, Wolf T, Robinson S P. Three putative sucrose transporters are differentially expressed in grapevine tissues[J]. Plant Science, 1999, 147: 93-100.
[34] 閆甜甜, 郭新勇, 向本春, 等. 蔗糖转运蛋白VvSUC11和VvSUC12累加作用对提高转基因甜菜含糖量的影响[J]. 中国农业科学, 2014: 2 455-2 464.
[35] Williams L E, Lemoine R, Sauer N. Sugar transporters in higher plants--a diversity of roles and complex regulation[J]. Trends Plant Sci, 2000(5): 283-290.
[36] Rae A L, Perroux J M, Grof C P. Sucrose partitioning between vascular bundles and storage parenchyma in the sugarcane stem: a potential role for the ShSUT1 sucrose transporter[J]. Planta, 2005, 220: 817-825.
[37] Srivastava A C, Ganesan S, Ismail I O, et al. Functional characterization of the Arabidopsis AtSUC2 Sucrose/H+ symporter by tissue-specific complementation reveals an essential role in phloem loading but not in long-distance transport[J]. Plant Physiol, 2008, 148: 200-211.
[38] Baud S, Wuilleme S, Lemoine R, et al. The AtSUC5 sucrose transporter specifically expressed in the endosperm is involved in early seed development in Arabidopsis[J]. Plant Journal, 2005, 43: 824-836.
[39] Pommerrenig B, Popko J, Heilmann M, et al. SUCROSE TRANSPORTER 5 supplies Arabidopsis embryos with biotin and affects triacylglycerol accumulation[J]. Plant Journal, 2013, 73: 392-404.
[40] Gong X, Liu M, Zhang L, et al. Arabidopsis AtSUC2 and AtSUC4, encoding sucrose transporters, are required for abiotic stress tolerance in an ABA-dependent pathway[J]. Physiologia Plantarm, 2015(1): 119-136
[41] Endler A, Meyer S, Schelbert S, et al. Identification of a vacuolar sucrose transporter in barley and Arabidopsis mesophyll cells by a tonoplast proteomic approach[J]. Plant Physiol, 2006, 141: 196-207.
[42] Zanon L, Falchi R, Hackel A, et al. Expression of peach sucrose transporters in heterologous systems points out their different physiological role[J]. Plant Science, 2015, 238: 262-272.
[43] Oner-Sieben S, Rappl C, Sauer N, et al. Characterization, localization, and seasonal changes of the sucrose transporter FeSUT1 in the phloem of Fraxinus excelsior[J]. Journal of Experimental Botany, 2015(255): erv255.
[44] Chen L Q, Hou B H, Lalonde S, et al. Sugar transporters for intercellular exchange and nutrition of pathogens[J]. Nature 2010, 468: 527-U199.
[45]Xuan Y H, Hu Y B, Chen L Q, et al. Functional role of oligomerization for bacterial and plant SWEET sugar transporter family[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110: E3 685-E3 694.
[46] Schroeder J I, Delhaize E, Frommer W B, et al. Using membrane transporters to improve crops for sustainable food production[J]. Nature, 2013, 497: 60-66.
[47] Lin I W, Sosso D, Chen L Q, et al. Nectar secretion requires sucrose phosphate synthases and the sugar transporter SWEET9[J]. Nature, 2014, 508: 1.
[48] Sivitz A B, Reinders A, Ward J M. Arabidopsis sucrose transporter AtSUC1 is important for pollen germination and sucrose-induced anthocyanin accumulation[J]. Plant Physiol 2008, 147: 92-100.
[49] Jia W, Zhang L, Wu D, Liu S, et al. Sucrose transporter AtSUC9 mediated by low Suc level is involved in Arabidopsis abiotic stress resistance by regulating Suc distribution and ABA accumulation[J]. Plant and Cell Physiology, 2015, 56(8): 1 574-1 587.
[50] Barker L, Kuhn C, Weise A, et al. SUT2, a putative sucrose sensor in sieve elements[J]. Plant Cell, 2000(12): 1 153-1 164.
[51] Sameeullah M, Sasaki T, Yamamoto Y. Sucrose transporter NtSUT1 confers aluminum tolerance on cultured cells of tobacco(Nicotiana tabacum L.)[J]. Soil Science and Plant Nutrition, 2013, 59: 756-770.
[52] Chandran D, Reinders A, Ward J M. Substrate specificity of the Arabidopsis thaliana sucrose transporter AtSUC2[J]. Journal of Biological Chemistry, 2003, 278: 44 320-44 325.
[53] Smeekens S. Sugar-Induced Signal Transduction in Plants[J]. Annu Rev Plant Physiol Plant Mol Biol, 2000, 51: 49-81.
[54] Halford N G, Hey S J. Snf1-related protein kinases(SnRKs) act within an intricate network that links metabolic and stress signalling in plants[J]. Biochemical Journal, 2009, 419: 247-259.
[55] Smeekens S, Ma J K, Hanson J, et al. Sugar signals and molecular networks controlling plant growth[J]. Current Opinion in Plant Biology, 2000, 13: 274-279.
[56] Hey S J, Byrne E, Halford N G. The interface between metabolic and stress signalling[J]. Annals of Botany, 2010, 105: 197-203.
[57] Furihata T, Maruyama K, Fujita Y, et al. Abscisic acid-dependent multisite phosphorylation regulates the activity of a transcription activator AREB1[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103: 1 988-1 993.
[58] Fujii H, Chinnusamy V, Rodrigues A, et al. In vitro reconstitution of an abscisic acid signalling pathway[J]. Nature, 2009, 462: 660-U138.
[59] Park S Y, Fung P, Nishimura N, et al. Abscisic Acid Inhibits Type 2C Protein Phosphatases via the PYR/PYL Family of START Proteins[J]. Science, 2009, 324: 1 068-1 071.
[60] Coello P, Hirano E, Hey S J, et al. Evidence that abscisic acid promotes degradation of SNF1-related protein kinase (SnRK)1 in wheat and activation of a putative calcium-dependent SnRK2[J]. Journal of Experimental Botany, 2012, 63: 913-924.
[61] Berthier A, Meuriot F, Dedaldechamp F, et al. Identification of a new sucrose transporter in rye-grass(LpSUT2): effect of defoliation and putative fructose sensing[J]. Plant Physiol Biochem,2014, 84: 32-44.
[62] Bitterlich M, Krugel U, Boldt-Burisch K, et al. The sucrose transporter SlSUT2 from tomato interacts with brassinosteroid functioning and affects arbuscular mycorrhiza ormation[J]. Plant J, 2014, 78: 877-889.
[63] Suarez-Lopez P Long-range signalling in plant reproductive development[J]. Int J Dev Biol, 2015, 49(5-6): 761-771.
[64] Buhtz A, Springer F, Chappell L, et al. Identification and characterization of small RNAs from the phloem of Brassica napus[J]. Plant Journal, 2008, 53: 739-749.
[65] Aukerman M J, Sakai H. Regulation of flowering time and floral organ identity by a MicroRNA and its APETALA2-like target genes[J]. Plant Cell, 2003, 15: 2 730-2 741.
[66] Jung J H, Seo Y H, Seo P J, et al. The GIGANTEA-regulated microRNA172 mediates photoperiodic flowering independent of CONSTANS in Arabidopsis[J]. Plant Cell, 2007, 19: 2 736-2 748.
[67] Martin A, Adam H, Diaz-Mendoza M, et al. Graft-transmissible induction of potato tuberization by the microRNA miR172[J]. Development, 2009, 136: 2 873-2 881.
[68] Chen H, Banerjee A K, Hannapel D J. The tandem complex of BEL and KNOX partners is required for transcriptional repression of ga20ox1[J]. The Plant Journal, 2004, 38: 276-284.
[69] Xoconostle-Cazares B, Xiang Y, Ruiz-Medrano R, et al. Plant paralog to viral movement protein that potentiates transport of mRNA into the phloem[J]. Science, 1999, 283: 94-98.
[70] Roney J K, Khatibi P A, Westwood J H. Cross-species translocation of mRNA from host plants into the parasitic plant dodder[J]. Plant Physiol, 2007, 143: 1 037-1 043.
[71] Deeken R, Ache P, Kajahn I, et al. Identification of Arabidopsis thaliana phloem RNAs provides a search criterion for phloem-based transcripts hidden in complex datasets of microarray experiments[J]. Plant J, 2008, 55: 746-759.
[72] Vaughn M W, Harrington G N, Bush D R. Sucrose-mediated transcriptional regulation of sucrose symporter activity in the phloem[J]. Proceedings of the National Academy of Sciences,2002, 99: 10 876-10 880.
[73] Chincinska I A, Liesche J, Krugel U, et al. Sucrose transporter StSUT4 from potato affects flowering, tuberization, and shade avoidance response[J]. Plant Physiol, 2008, 146: 515-528.
[74] Liesche J, Krugel U, He H X, et al. Sucrose transporter, 2011. regulation at the transcriptional, post-transcriptional and post-translational level[J]. Journal of Plant Physiology, 168: 1 426-1 433.
[75] Krugel U, Kuhn C. Post-translational regulation of sucrose transporters by direct protein-protein interactions[J]. Front Plant Sci, 2013(4): 237.
[76] Liesche J, Schulz A, Krugel U, et al. Dimerization and endocytosis of the sucrose transporter StSUT1 in mature sieve elements[J]. Plant Signal Behav, 2008(3): 1 136-1 137.
[77] Reinders A, Schulze W, Kuhn C, et al. Protein-protein interactions between sucrose transporters of different affinities colocalized in the same enucleate sieve element[J]. Plant Cell, 2002, 14: 1 567-1 577.
[78] Krugel U, Veenhoff L M, Langbein J, et al. Transport and Sorting of the Solanum tuberosum Sucrose Transporter SUT1 Is Affected by Posttranslational Modification[J]. Plant Cell, 2008,
20: 2 497-2 513.
[79] Fan R C, Peng C C, Xu Y H, et al. Apple sucrose transporter SUT1 and sorbitol transporter SOT6 interact with cytochrome b5 to regulate their affinity for substrate sugars[J]. Plant Physiol, 2009, 150: 1 880-1 901.
[80] Li Y, Li L L, Fan R C, et al. Arabidopsis sucrose transporter SUT4 interacts with cytochrome b5-2 to regulate seed germination in response to sucrose and glucose[J]. Mol Plant,2012(5): 1 029-1 041.
[81] Hendriks J H, Kolbe A, Gibon Y, et al. ADP-glucose pyrophosphorylase is activated by posttranslational redox-modification in response to light and to sugars in leaves of Arabidopsis and other plant species[J]. Plant Physiol, 2003, 133: 838-849.
[82] Geigenberger P, Kolbe A, Tiessen A. Redox regulation of carbon storage and partitioning in response to light and sugars[J]. J Exp Bot, 2005, 56: 1 469-1 479.
[83] Krugel U, He H X, Gier K, et al. The potato sucrose transporter StSUT1 interacts with a DRM-associated protein disulfide isomerase[J]. Mol Plant, 2012(5): 43-62.
[84] Shin R, Jez J M, Basra A, et al. 14-3-3 proteins fine-tune plant nutrient metabolism[J]. FEBS Lett,2011,585: 143-147.
[85] Roblin G, Sakr S, Bonmort J, et al. Regulation of a plant plasma membrane sucrose transporter by phosphorylation[J]. FEBS Lett, 1998, 424: 165-168.
[86] Ransom-Hodgkins W D, Vaughn M W, Bush D R. Protein phosphorylation plays a key role in sucrose-mediated transcriptional regulation of a phloem-specific proton-sucrose symporter[J]. Planta, 2003, 217: 483-489.
[87] Nuhse T S, Stensballe A, Jensen O N, et al. Phosphoproteomics of the Arabidopsis plasma membrane and a new phosphorylation site database[J]. Plant Cell, 2004, 16: 2 394-2 405.
[88] Niittyla T, Fuglsang A T, Palmgren M G, et al. Temporal analysis of sucrose-induced phosphorylation changes in plasma membrane proteins of Arabidopsis[J]. Mol Cell Proteomics, 2007(6): 1 711-1 726.
[89] Durek P, Schmidt R, Heazlewood J L, et al. PhosPhAt: the Arabidopsis thaliana phosphorylation site database[J]. An update. Nucleic Acids Res, 2010, 38: D828-834.
責任编辑:凌青根
