2012年云南省会泽县马铃薯晚疫病菌小种结构分析
2016-05-30杨丽娜段国华覃雁瑜祝雯潘哲超隋启君詹家绥
杨丽娜 段国华 覃雁瑜 祝雯 潘哲超 隋启君 詹家绥

摘 要 利用11个含有不同单显性(R1、R2、R3、R4、R5、R6、R7、R8、R9、R10、R11)抗马铃薯晚疫病的鉴别寄主,对云南省会泽县村同一发病田块前、中、后期3个群体的马铃薯晚疫病菌59、158和75个菌株进行毒性频率和小种鉴定,分别鉴定出31、60和30个小种,大部分小种只检测到一次,其中优势小种为超级小种(含有11个毒性基因的晚疫病菌),占整个群体的53.33%;随着发病时间的推移,优势小种频率、小种复杂度呈上升趋势,但小种多样性呈降低趋势,在马铃薯生育期间除了avr4外,其它毒性基因的频率未发生显著变化。实验结果表明云南省马铃薯晚疫病菌小种演化速度快,小种结构复杂,在该地区种植起源于Solanum demission的R1~R11抗性基因存在较高的失效风险。
关键词 马铃薯晚疫病菌;毒性基因;小种;进化;鉴别品种;病害防治
中图分类号 S435.32 文献标识码 A
Abstract Race and virulence factor of 59, 158 and 75 Phytophthora infestans isolates sampled from early, middle and late stages of late blight epidemics respectively in a potato field located in Huize,Yunnan in 2012 evaluated on 11 potato differentials each carrying one of R1-R11 resistance genes. A total of 31, 60 and 31 races were found in the early-, middle-and late-epidemic season, respectively. Super-race able to induce the late blight disease on all 11 differentials dominated in all three collections, accounting for 53.33% of combined population, while most of other races were detected only once. Over the potato growing season, the frequency of the super-race and race complexity gradually increased while the race diversity decreased directionaly. Except avr4, no significant change in the frequency of virulence factors was detected over the single growing season. These results suggest a quick evolution of race structure and an increasing risk of major resistance breakdown in Yunnan.
Key words Phytophthora infestans;Virulence factor;Race complexity;Evolution;Differential cultivar;Disease management
doi 10.3969/j.issn.1000-2561.2016.01.026
随着种植面积的不断扩大,马铃薯已经成为仅次于水稻、小麦和玉米的第四大粮食作物[1],因此其病害防治工作也越来越受到人们的重视。由致病疫霉Phytophthora infestans(Mont.)de Bary引起的晚疫病是马铃薯的最主要病害,据文献记载该病害曾导致爱尔兰大饥荒,造成数百万人口死亡和流离失所,影响着世界人口分布[2]。目前,晚疫病仍然是马铃薯的毁灭性病害[3],每年全球由该病害引起的直接经济损失高达上百亿美元[4-5]。
喷施化学农药和种植抗性品种是防治马铃薯晚疫病的主要措施。喷施化学农药虽然可以在短期内获得良好的防治效果,但存在使用成本高、污染环境及农药残留等问题。与之相比,使用抗性品种可以避免以上问题,是防治马铃薯晚疫病的经济环保措施。到目前为止,已经有11个起源于马铃薯野生亲缘种地霉松(Solanum Demmissum)的抗晚疫病主效抗性基因被克隆和利用[6]。当具有主效抗性基因的马铃薯品种被种植时,对晚疫病的防治效果非常明显,但是这种垂直抗性往往会在种植几年后消失。这和现在农业一年多茬及单一品种大规模的密集种植模式有关[7],此类种植模式人为加大了对病原菌的选择压力,使病原菌的进化速度加快,能使晚疫病菌在短期内形成新的毒性基因或小种克服寄主的抗性。所以马铃薯晚疫病菌小种的演化及时空间分布直接决定了马铃薯抗性品种的有效性及其使用寿命。
中国马铃薯晚疫病菌小种的分布在不同地区及同一地区不同时间都存在着一定的差异[8-17]。这些差异一方面是由中国幅员辽阔、从南到北跨越不同气候带、各地海拔高低不等且地势复杂的自然因素导致的[18-20];另一方面是由品種的选用[21-25]、杀菌剂的使用[26]、及不同的种植模式导致;除此之外还和晚疫病菌本身变异及繁殖速度较快有关系[27-29]。这导致了中国马铃薯晚疫病菌小种的种类越来越多、复杂度也越来越高[30-32]。同时能侵染起源于马铃薯野生亲缘种地霉松的全部11个主效抗性基因的超级小种近年在全国各地不断被检测出来,并且在晚疫病菌群体中所占的比例越来越大[33-35]。在云南省,赵志坚等[36]于2003年检测到1株超级小种,但到了2005年,超级小种在晚疫病菌群体中的比例已达到21.05%[37]。超级小种出现最直接的危害是使现有的具有马铃薯野生亲缘种地霉松血缘的垂直抗性失去使用价值,意味着无论使用的品种是单抗还是多个抗性组合都对晚疫病菌几乎没有抵抗能力,所以必须重视新抗源的筛选、鉴定和利用。超级小种在群体中所占比例越来越高的发展趋势已对马铃薯生产构成了极大的威胁,因此对病原群体小种结构的继续监测具有极大的应用价值。本研究于2012年对来自同一田块同一季节不同马铃薯生长期晚疫病菌小种的鉴定和比较,了解晚疫病菌小种和毒性基因在短时间内的变化,为马铃薯抗性品种的选用、部署及晚疫病菌的防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株及植株 试验所用的马铃薯晚疫病菌均采集于云南省会泽县同一块马铃薯试验田,共293株,其中59株采自2012年7月11日(前期),158株采自2012年7月31日(中期), 75株采自2012年8月14日(后期)。鉴别寄主由11个含有单个主效抗性基因(R1~R11) 的抗病品种和1个不含抗病基因的感病材料(r)组成,由福建省农业科学院植物保护研究所陈庆河研究员提供。
1.1.2 培养基 晚疫病菌用黑麦培养基培养。晚疫病菌分离纯化及小种鉴定过程中所用的培养基为水琼脂。鉴别寄主培养所用的培养基为MS培养基。
1.2 方法
1.2.1 样本的采集及纯化 采集具有单个典型病斑的马铃薯叶片(发病前期田间只有少量病斑,田间平均发病率<1.0%;发病中期田间病斑数目较多,平均发病率25%~40%;发病后期病斑数量非常多,平均发病率约>75%)。采集的2病叶之间的间隔至少是2 m。为了防止采集过程中样本的交叉感染,每片病叶都用卫生纸包好并放在独立的牛皮紙信封(或硫酸纸袋)中。样本采集后立即放入已放有冰袋的保温箱中低温存放,并在24 h之内带回实验室进行分离纯化。
分离纯化前先用清水对叶片进行清洗,去除叶片表面所带有的杂菌。清洗后的叶片稍微晾干,叶片背面朝上放在2%的水琼脂上进行保湿培养,待20~30 h后病斑形成气生菌丝,用灭菌过的解剖针挑取单根菌丝,置添加有氨苄(100 mg/L)和利福平(10 mg/L)的黑麦选择性培养基上进行培养。待晚疫病菌丝从选择性培养基上长出后,再进行一次单菌丝挑取和选择性培养以确保分离的纯度。晚疫病菌分离纯化的步骤参见祝雯等[38]的研究方法。
1.2.2 培养基的制备 黑麦培养基制作方法为:50 g黑麦浸泡2~3 h后用大功率料理机磨成匀浆,65 ℃水浴2 h后用双层纱布过滤,取上清液用纯净水定容至1 L,加琼脂粉12 g搅拌均匀后分装,用121 ℃高压灭菌20 min。分离纯化后的晚疫病菌接种在黑麦培养基上于18 ℃培养箱黑暗培养,14 d后用于小种的鉴定。
水琼脂的制作方法为:10 g琼脂粉加到1 L无菌水中煮沸,待冷却到40 ℃,在培养皿中倒入薄薄一层即可使用。
MS培养基制作方法为:4.74 g MS,30 g蔗糖,5 g琼脂粉加无菌水定容至1 L后分装到组培瓶或三角瓶中,用121 ℃高压灭菌20 min。
1.2.3 鉴别寄主的培养 选取长势较好且无污染的鉴别寄主组培苗进行无性扩繁,于20 ℃条件下培养并用白炽灯管进行每天18 h的辅助光照。待组培苗长到株高15~20 cm、叶片直径1.5 cm时进行小种测定。
1.2.4 毒性基因和小种的鉴定 晚疫病菌的毒性组成和小种采用叶蝶法[39]:即取18 ℃培养14 d的晚疫病菌平板,加5 mL无菌水用无菌玻璃棒轻轻刮培养基表面洗脱晚疫病菌孢子囊,所得悬浮液在2 750 r/min 15 min离心后弃上清液,重新加入无菌水将孢子囊浓度调至5x10-4 mL并放于4 ℃冰箱中备用。
在无菌环境下,将新摘取的鉴别寄主叶片背面朝上放在1%的水琼脂上,用移液枪吸取10 μL孢子囊悬浮液,轻轻滴在叶片上,放置于18 ℃、16 h/d辅助光照培养7 d后观测并记录结果。重复3次,空白为对照。
1.3 数据处理
如果晚疫病菌株能在特定的鉴别寄主离体叶片上形成病斑,并在显微镜下观测到晚疫病菌孢子囊,则该菌株携带和鉴别寄主对应的毒性基因。菌株小种类型由其所含的毒性基因界定。小种复杂度是指每个晚疫病菌携带毒性基因的个数,当小种复杂度为11时该菌株可以同时侵染11个抗性寄主,反之小种复杂度为0的菌株只能使感病寄主发病。小种多样性[40]由POPGENE[41]计算得出,发病前、中、后期毒性基因频率的差异用列表卡方检测[42]。
2 结果与分析
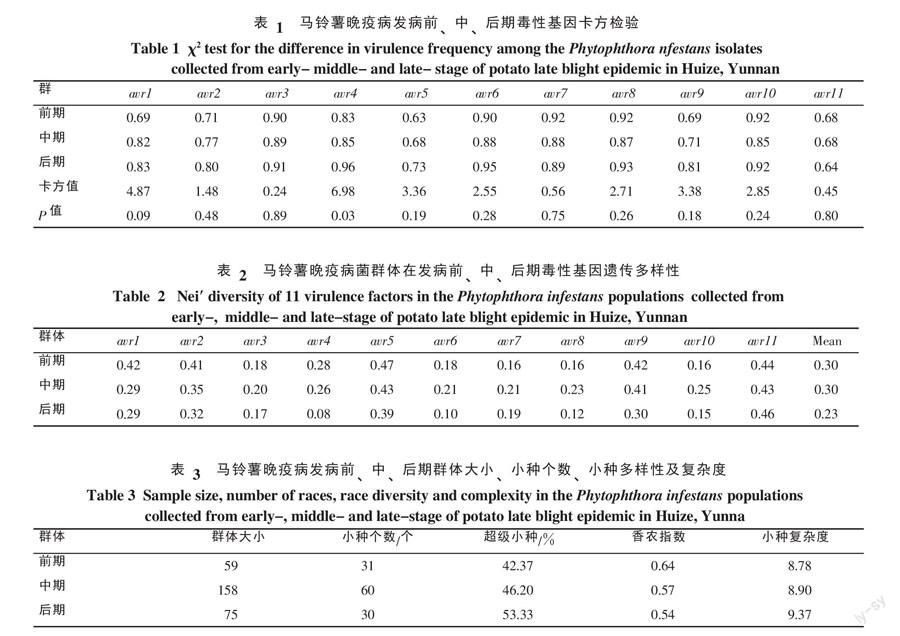
由表1可知,所有的毒性基因都能在晚疫病菌中检测到;在发病前、中、后期80%之上的晚疫病菌都能使带有R3、R4、R6、R7、R8和R10抗性基因的鉴别寄主发病;晚疫病菌对R5和R11的较为敏感,平均分别只有68%和67%的菌株能侵染这2个鉴别寄主;除了avr7和avr11,大部分毒性基因的频率随着流行季节而提高,但卡方检验结果表明,除avr4之外其余的10个毒性基因在流行季节的频率没有发生显著变化(表1)。
由表2可知,在晚疫病发病的前、中、后期3个群体中,遗传多样性最低的是发病后期的avr4,最高的是前期的avr5;从群体角度出发,前、中、后期11个毒性基因的平均遗传多样性分别为0.30、0.30和0.23,呈降低趋势。
由表3可知,发病中期的小种个数多达60个,发病前期和后期小种个数几乎一样,分别为31和30个;其中每一生育期优势小种均为超级小种,即同时携带11个毒性基因,能同时侵染所有的鉴别寄主,且其在群体中的比例随流行时间呈上升趋势,分别占前、中、后期群体个数的42.37%、46.20%和53.33%。除超级小种之外其他小种出现的频率较低,为1.33%~5.33%(图1,表3)。小种的种类在不同时期的变化很大,只有6个小种同时出现在晚疫病发病的前、中、后期,其余小种大部分只在1个发病时期出现1次(图1)
发病前期香农指数为0.64,随着发病时间的推移,小种遗传多样性逐渐降低,后期为0.54,但小种复杂度呈上升趋势,发病前、中、后期分别是8.87、8.90和9.37(表3)。说明本试验检测的晚疫病菌小种复杂度很高,只在发病中期和后期各检测到1株不携带毒性基因马铃薯晚疫病菌,90%以上的小种都含有3个以上的毒性基因。
3 讨论与结论
中国是马铃薯的种植大国[43-44],面积和产量分别占世界的26.3%和22.2%[45]。同时云南省又是中国马铃薯的种植大省,所以云南省晚疫病菌小种的研究对马铃薯抗性品种的使用和晚疫病的防治都有重要的意义。与之前云南晚疫病菌小种的研究相比[9],本研究结果发现,2012年云南会泽县晚疫病菌超级小种的数量明显上升并成为优势小种,在整个发病过程中40%~53%的马铃薯晚疫病菌能攻克现有的起源于马铃薯亲缘种地霉松的所有11个垂直抗性基因。这一结果与前人的研究相似[34],表明在生产中具有地霉松血缘的单抗性及多抗性马铃薯品种可能已经失去了对晚疫病的防治作用。
小种多样性和复杂度是研究小种结构,病原演化趋势和抗性基因利用潜力的重要参数。本研究结果发现,从发病前期到后期小种多样性逐渐降低,说明晚疫病菌群体受到寄主的定向选择[46],在该选择压力下某些适应性较低的小种类型被逐渐淘汰,而另外一些小种类型(如超级小种)则由于适应性较高频率逐渐升高。从小种复杂度结果可以看出,2012年云南省会泽县的晚疫病菌平均每个都含有8个毒性基因,并且随着发病时间的推移小种复杂度可达到9.37,这可能是由超级小种在群体中的比例逐渐提高造成的,这个结果同样也证明复杂小种的晚疫病菌具有较高的生存优势,更容易通过外界选择保留下来。
发病前、中、后期大部分毒性基因频率都逐渐提高,说明晚疫病群体受到寄主的定向选择。除avr4外,卡方检验没有发现其他毒性基因在流行期间发生显著性的频率变化,其原因可能是在发病前期这些基因的频率已经很高(63%~92%),样本采集过程中发病前、中、后期之间的采样间隔较短,约21 d,定向选择的作用很难有效地体现出来。
本研究結果发现,2012年云南省会泽县的晚疫病菌小种复杂度较高,超级小种为优势种,种植具有地霉松血缘的单抗病或多抗品种对晚疫病菌的防治都不会起太大作用,这给马铃薯抗性品种的选育和使用带来了很大的挑战。因此,急切需要发掘新的抗性基因,培育带地霉松以外新血缘的抗性品种;重视马铃薯抗性基因的合理布局及水平抗性[47-48]的利用,把进化理论[7, 49]和先进的育种技术[50-51](如分子辅助育种)应用到品种选育中去,以加快抗性新品种的选育及延长抗性品种的使用寿命;加强对晚疫病的预测预报,降低晚疫病药剂防治的生态和环境成本,为晚疫病的可持续性防治奠定基础。
参考文献
[1] Birch P R, Bryan G, Fenton B, et al. Crops that feed the world 8: potato: are the trends of increased global production sustainable?[J]. Food Security, 2012, 4(4): 477-508.
[2] Ross D. Ireland: History of a Nation[M]. New Lanark(United Kingdom): Geddes & Grosset, 2000: 224-311.
[3] Fry W E. Phytophthora infestans: the plant (and R gene) destroyer[J]. Molecular Plant Pathology, 2008, 9(5): 385-402.
[4] Haverkort A J, Boonekamp P M, Hutten R, et al. Societal costs of late blight in potato and prospects of durable resistance through cisgenic modification[J]. Potato Research, 2008, 51(1): 47-57.
[5] Runno-Paurson E, Hannukkala A O, Kotkas K, et al. Impact of phytosanitary quality of seed potato and temporal epidemic progress on the phenotypic diversity of Phytophthora infestans populations[J]. American Journal of Potato Research, 2013, 90(3): 245-254.
[6] Gebhardt C, Valkonen J P T. Organization of genes controlling disease resistance in the potato genome[J]. Annual Review of Phytopathology, 2001, 39: 79-102.
[7] Zhan J S, Thrall P H, Papaix J, et al. Playing on a pathogens weakness using evolution to guide sustainable plant disease control strategies[J]. Annual Review of Phytopathology,2015, 53: 19-43.
[8] 黄 河, 称汉清, 徐天宇,等. 我国北部马铃薯晚疫病菌生理小种的发生和变化[J]. 植物病理学报, 1981, 11(1): 45-49.
[9] 杨艳丽, 罗文富,国立耘. 云南马铃薯晚疫病菌生理小种的研究[J]. 植物保护, 2001, 27(4): 3-5.
[10] Ryu K Y, 罗文富, 杨艳丽,等. 云南省马铃薯晚疫病菌的交配型、抗药性及生理小种的研究[J]. 植物病理学报, 2003, 33(2): 126-131.
[11] 金光辉, 文景芝, 董传民,等. 黑龙江省马铃薯晚疫病生理小种的类型与分布状况研究[J]. 中国马铃薯, 2003(4): 213-215.
[12] 杨艳丽, 胡先奇, 鲁绍凤,等. 云南省马铃薯晚疫病菌生理小种的组成与分布[J]. 华中农业大学学报, 2007, 26(3): 297-301.
[13] 郭 军, 屈冬玉, 巩秀峰,等. 内蒙古马铃薯晚疫病菌交配型和生理小种研究[J]. 西北农林科技大学学报, 2007, 35(11):120-124.
[14] 刘波微, 彭化贤, 席亚东, 等. 四川马鈴薯晚疫病生理小种鉴定及品种抗性评价[J]. 西南农业学报, 2010, 23(3): 747-751.
[15] 李洪浩, 彭化贤, 席亚东, 等. 四川马铃薯晚疫病菌交配型、生理小种、 甲霜灵敏感性及mtDNA单倍型组成分析[J]. 中国农业科学, 2013, 46(4): 728-736.
[16] 金光辉, 吕文河, 白雅梅,等. 黑龙江省马铃薯晚疫病菌生理小种的鉴定[J]. 东北农业大学学报, 2009, 40(10): 13-17.
[17] 韩彦卿, 秦宇轩, 朱杰华, 等. 2006-2008年中国部分地区马铃薯晚疫病菌生理小种的分布[J]. 中国农业科学, 2010, 43(17): 3 684-3 690.
[18] 腾宗璠, 张 畅,王永智. 我国马铃薯适宜种植区的分析[J]. 中国农业科学, 1989, 22(2): 35-44.
[19] Andrivon D. Race structure and dynamics in populations of Phytophthora infestans[J]. Canadian Journal of Botany, 1994, 72(11): 1 681-1 687.
[20] 杨海鹰, 云 庭, 段 跃,等. 内蒙古马铃薯产业发展的思路与对策[J]. 内蒙古农业科技, 2001(1): 3-7.
[21] 金黎平. 我国马铃薯育种和品种应用[J]. 农业技术与装备,2007(9): 14-15.
[22] Andrivon D, Pilet F, Montarry J, et al. Adaptation of Phytophthora infestans to partial resistance in potato: evidence from french and moroccan populations[J]. Phytopathology, 2007, 97(3): 338-343.
[23] 汤 浩, 翁定河, 杨立明,等. 福建冬种马铃薯生产技术研究[J]. 福建农业学报, 2006, 21(3): 198-202.
[24] 江锡瑜, 杨 力, 杨昌达,等. 贵州马铃薯品种现状及合理布局研究[J]. 种子, 2008(6): 65-68.
[25] 李 瑾, 董淑英, 崔 潇, 等. 马铃薯品种比较试验[J]. 山东农业科学, 2012, 44(6): 29-31.
[26] Gisi U, Cohen Y. Resistance to phenylamide fungicides: a case study with Phytophthora infestans involving mating type and race structure[J]. Annual Review of Phytopathology, 1996, 34: 549-72.
[27] Cooke D E L, Young V, Birch P R J, et al. Phenotypic and genotypic diversity of Phytophthora infestans populations in Scotland[J]. Plant Pathology, 2003, 52(2): 181-192.
[28] Brurberg M B, Elameen A, Le V H, et al. Genetic analysis of Phytophthora infestans populations in the Nordic European countries reveals high genetic variability[J]. Fungal Biology,2010, 115(4-5): 335-342.
[29] Runno-Paurson E, Ronis A, Hansen M, et al. Lithuanian populations of Phytophthora infestans revealed a high phenotypic diversity[J]. Journal of Plant Diseases and Protection, 2015, 122(2): 57-65.
[30] Cohen Y. Populations of Phytophthora infestans in Israel underwent three major genetic changes during 1983 to 2000[J]. Phytopathology, 2002, 92(3): 300-307.
[31] 刘晓鹏, 谢从华,宋伯符. 湖北恩施地区马铃薯晚疫病菌生理小种的组成及分布[J]. 马铃薯杂志, 1995, 9(2): 81-83.
[32] 朱杰华, 杨志辉, 邵铁梅,等. 中国部分地区马铃薯晚疫病菌生理小种的组成及分布[J]. 中国农业科学, 2003, 2(1): 45-48.
[33]Swiezyński K M,Domański L,Zarzycka H. The reaction of potato differentials to Phytophthora infestans isolates collected in nature[J]. Plant Breeding, 2000, 119(2): 119-126.
[34] Corbière R, Rekad F Z, Galfout A, et al. Phenotypic and genotypic characteristics of Algerian isolates of Phytophthora infestans[J]. PPO-Special Report, 2010, 14: 133-146.
[35] 孫洁平, 张 琼, 马丽杰,等. 宁夏陕北地区马铃薯晚疫病菌的毒性分析[C]//郭泽建, 侯明生. 中国植物病理学会2011年学术年会论文集. 北京: 中国农业科学技术出版社, 2011: 99.
[36] 赵志坚, 李灿辉, 曹继芬,等. 云南省马铃薯致病疫霉毒性基因组成及毒力结构研究[J]. 中国农业科学, 2007, 40(3): 505-511.
[37] 杨素祥. 云南马铃薯晚疫病菌群体的遗传多样性研究[D]. 昆明: 云南师范大学, 2006.
[38] Zhu W, Yang L N, Wu E J, et al. Limited sexual reproduction and quick turnover in the population genetic structure of Phytophthora infestans in Fujian, China[J]. Scientific Reports, 2015, 13(5): 10 094.
[39] Zhu S, Vossen J H, Bergervoet M, et al. An updated conventional and a novel GM potato late blight R gene differential set for virulence monitoring of Phytophthora infestans[J]. Euphytica, 2015, 202(2): 219-234.
[40] Nei M. Analysis of gene diversity in subdivided populations[J]. Proceedings of the National Academy of Sciences of the United States of America, 1973, 70(12): 3 321-3 323.
[41] Yeh F C, Yang R, Boyle T J, et al. PopGene 32,Microsoft Windows-based freeware for population genetic analysis. 1.32[J]. Edmonton, Alberta, Canada: Molecular Biology and Biotechnology Centre; University of Alberta, 2000.
[42] Everitt B S. The Analysis of contingency tables[M]. New York: CRC Press, 1992: 1-36.
[43] Wang Q B, Zhang W. Chinas potato industry and potential impacts on the global market[J]. American Journal of Potato Research, 2004, 81(2): 101-109.
[44] Jansky S H, Jin L P, Xie K Y, et al. Potato production and breeding in China[J]. Potato Research, 2009, 52(1): 57-65.
[45] Wang B, Ma Y L, Zhang Z B, et al. Potato viruses in China[J]. Crop Protection, 2011, 30(9): 1 117-1 123.
[46] Susan M R, Michelle M R, Boubacar C, et al. Exceptional diversity, maintenance of polymorphism, and recent directional selection on the APL1 malaria resistance genes of Anopheles gambiae[J]. PLOS Biology, 2011, 9(3): e1 000 600.
[47] Shawn M J W, Barry J S, Terry R A, et al. QTL associated with horizontal resistance to soybean cyst nematode in Glycine soja PI464925B[J]. Theoretical and Applied Genetics, 2007, 114(3): 461-472.
[48] Vanderplank J E. Disease resistance in plants[M]. London:Academic Press, 1984: 57-96.
[49] Zhan J S, Peter H T, Jeremy J B. Achieving sustainable plant disease management through evolutionary principles[J]. Trends in Plant Science, 2014, 19(9): 570-575.
[50] Amalia B. Molecular marker-assisted selection for potato breeding[J]. American Journal of Potato Research, 2004, 81:111-117.
[51] Park T H, Vleeshouwers V G A A, Jacobsen E, et al. Molecular breeding for resistance to Phytophthora infestans (Mont.)de Bary in potato(Solanum tuberosum L.): a perspective of cisgenesis[J]. Plant breeding, 2009, 128(2): 109-117.
责任编辑:古小玲
