染料木素对噪声性聋的保护作用△
2016-05-13肖冰姜明春康颂建孙宪昌
肖冰 姜明春 康颂建 孙宪昌
·基础研究·
染料木素对噪声性聋的保护作用△
肖冰姜明春*康颂建*孙宪昌*
【摘要】目的探讨植物雌激素染料木素是否具有预防噪声性聋的作用。方法将30只健康豚鼠随机分为3组,每组10只。单纯噪声组每日腹腔注射生理盐水1 mL/kg,染料木素保护组每日腹腔注射染料木素10 mg/kg,正常对照组每日腹腔注射生理盐水1 mL/kg,3组动物均持续给药10 d。除正常对照组以外的2组动物于给药的第4天开始给予噪声刺激,连续7 d。噪声模式采用4 kHz纯音,强度为115 dB SPL,噪声持续时间为4 h/d。每组动物在给药前、后均行听性脑干反应(ABR)检测。末次检测完毕后,在麻醉状态下将豚鼠断头取耳蜗,采用耳蜗基底膜铺片技术观察耳蜗毛细胞的形态学改变,同时计算外毛细胞损伤率;观察外毛细胞琥珀酸脱氢酶(SDH)活性的改变;采用DNA末端转移酶介导的缺口末端标记法(TUNEL)检测耳蜗螺旋神经节细胞的凋亡。结果噪声刺激前,3组动物ABR阈值无明显差异(P﹥0.05);接触噪声后,单纯噪声组ABR阈值明显升高(P<0.01),染料木素保护组ABR阈值较单纯噪声组显著降低(P<0.01)。耳蜗铺片及SDH染色结果显示:单纯噪声组动物耳蜗毛细胞排列紊乱并伴有大量缺失,SDH染色明显变浅;给予染料木素后,毛细胞缺失明显减少(P<0.01),排列较规则,SDH染色明显好于单纯噪声组。TUNEL结果显示:动物接触噪声后,螺旋神经节细胞大量凋亡,染料木素能减轻细胞损伤。结论染料木素对噪声性聋有一定的防治作用,该作用可能与其营养神经、保护耳蜗毛细胞SDH的活性及线粒体功能有关。(中国眼耳鼻喉科杂志,2016,16:84-87,95)
【关键词】染料木素;噪声性聋;雌激素;毛细胞;琥珀酸脱氢酶;凋亡
△基金项目:泰山医学院自然科学基金(2011ZR036)
随着我国工业化进程的加快,噪声污染日趋严重。长期接触噪声可造成听觉系统的永久性损害导致噪声性聋(noise-induced hearing loss,NIHL),严重影响人们的生活质量,给个人及社会带来沉重的精神和经济负担。因此,关于NIHL 机制与防治的研究一直是国内外学者研究的热点。雌激素是一类由内分泌系统分泌的类固醇激素,通过与靶细胞内的雌激素受体(estrogen receptor,ER)结合发挥作用。有研究[1]显示,雌激素在体内的作用非常广泛,除能影响女性生殖内分泌功能外,对心血管系统、免疫系统、神经系统、骨骼均有一定的保护作用。近年来有文献[2-3]报道,ER在听觉器官内广泛分布,推测雌激素与听觉功能密切相关;进一步的临床研究与动物实验均证实雌激素对听觉系统有保护作用,这为防治NIHL的研究提供了新的思路。但是长期应用雌激素会产生严重的不良反应,因此,寻找一种更加安全的具有雌激素样作用的替代剂具有重要意义[4]。大豆异黄酮是典型的植物雌激素,染料木素(genistein) 是其主要的活性成分, 结构与雌激素相似。流行病学资料已证实,染料木素具有类雌激素作用,对神经退行性疾病、骨质疏松及心血管疾病具有一定的防治作用[5-6];但染料木素是否能保护听功能,国内外尚罕见报道。因此,本实验拟通过建立NIHL豚鼠模型,观察实验前、后听觉功能和耳蜗毛细胞形态及代谢的变化,研究染料木素对NIHL的保护作用,并探讨可能的机制。
1材料与方法
1.1试剂及仪器设备染料木素购自上海同田生化技术有限公司,白色粉末,使用前先用二甲基亚砜(DMSO)溶解,再用生理盐水将其稀释到所需浓度;DNA末端转移酶介导的缺口末端标记法(terminal deoxynucleotide transferase-mediated deoxyuridine triphosphote-biotin nick end labeling,TUNEL)凋亡检测试剂盒购自美国Roche公司。其他设备:听性脑干反应(auditory brainstem response, ABR)仪(Bio-logic Navigator PRO;美国),SC-1型声刺激器(上海生理研究所),体视显微镜(OLYMPUS SZ61;日本),普通光学显微镜(Leica DM2500;德国)。
1.2实验动物选取耳廓反射灵敏的健康红目白毛豚鼠,体重300~350 g,购自山东省生物制品研究所(动物合格证号为鲁动质字D20120608号)。在恒温(21~24 ℃)、恒湿(40%~55%)、自由进食和饮水、明暗各12 h的环境下饲养,适应环境7 d后进行实验。
1.3动物分组豚鼠30只,随机分为3组,即正常对照组、单纯噪声组、染料木素保护组,每组10只。①染料木素保护组:每天腹腔注射染料木素10 mg/kg,连续10 d,第4天起给药后2 h接触噪声。②单纯噪声组:每天腹腔注射生理盐水1 mL/kg,持续10 d,并于实验第4天开始给予噪声暴露。③正常对照组:每天腹腔注射生理盐水1 mL/kg,持续10 d,不给予噪声处理。
1.4噪声暴露方法将动物分别置于独立分隔的长方形铁丝笼内,笼子置于自制隔音箱(箱壁由双层木板组成,中间填充泡沫隔音材料)中央。隔音箱内背景噪声<40 dB SPL,暴露噪声由SS-1型声刺激器发出经功率放大器放大后传至扬声器,扬声器悬挂于隔音箱上方,声源距动物约25 cm;噪声性质为4 kHz纯音,给声强度为115 dB SPL,暴露时长为4 h,经监测保证隔音箱内各处噪声强度差别<5 dB。
1.5ABR测定所有动物在噪声暴露前和实验结束后各测1次ABR。动物在清醒状态下用固定装置固定后置于隔音屏蔽室内进行测试。将记录电极插入豚鼠颅顶正中,参考电极和接地电极分别插入同侧和对侧乳突部;采用短声(click)刺激,经EDL-903型耳机输出(声源距耳0.5 cm),频率13次/s,滤波带宽为80~3 000 Hz,叠加500次,以Ⅲ波刚出现时的最小刺激强度判断阈值,重复2次,取平均值。
1.6耳蜗基底膜铺片及琥珀酸脱氢酶染色每组各取5只动物,乙醚麻醉后迅速断头取出双侧听泡;打开听泡,用细针在蜗尖钻孔,开放蜗窗(圆窗)和前庭窗(卵圆窗);用吸管吸取新鲜配制的琥珀酸脱氢酶(succinate dehydrogenase, SDH)作用液[0.2 mol/L琥珀酸钠、0.2 mol/L磷酸盐缓冲液(phosphate buffer saline, PBS)、0.1%硝基四氮唑蓝,配置比例为1∶1∶1],从蜗尖小孔缓慢注入,最后经蜗窗(圆窗)和前庭窗(卵圆窗)流出,共灌注2~3次;然后将耳蜗浸入SDH作用液中,37 ℃孵育1~2 h;再用10%多聚甲醛溶液自蜗顶灌流3次,并将标本浸入10%多聚甲醛溶液后固定过夜;10%乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)溶液中脱钙2周后在立体显微镜(解剖显微镜)下剥去蜗壳,分离基底膜置于载玻片上,70%甘油封片,光学显微镜下观察毛细胞内SDH的变化及基底膜各回外毛细胞缺失情况。毛细胞计数参考茅犁春等[7]描述的方法,选取第一、二、三回中下部3个视野内的外毛细胞进行计数,视野周边不完整的毛细胞,只记一边,即计左不计右,计上不计下。统计学比较时以正常对照组均数为基准。
1.7耳蜗石蜡切片标本制备每组取5只动物的耳蜗制作石蜡切片标本。动物麻醉后断头处死,快速取出听泡,暴露耳蜗,蜗尖钻孔,打开前庭窗(卵圆窗)及蜗窗(圆窗),吸管吸取4%多聚甲醛从蜗尖小孔灌入耳蜗,每个标本灌流4~5次,然后将标本浸入固定液中过夜。固定好的听泡浸入10%EDTA溶液中,室温下脱钙2周,脱钙液每日更换1次,以骨质软化为标准。低熔点石蜡包埋,平行于蜗轴方向进行连续切片,片厚8 μm;用于苏木素-伊红(hematoxylin-eosin, HE)染色及细胞凋亡检测。
1.8凋亡细胞的检测采用TUNEL检测凋亡细胞。将切片常规脱蜡入水,0.3%过氧化氢(双氧水)孵育10 min,双蒸水冲洗3次。将玻片浸入盛有0.01 mol/L枸橼酸盐缓冲液(pH=6.0)的烧杯中,750 W微波下加热5 min,自然冷却,PBS冲洗。每张切片加50 μL TUNEL反应液[内含5 μL 10×末端脱氧核糖核酸转移酶(TdT)和45 μL荧光素标记的核苷酸(dUTP),现用现配],37 ℃湿盒内孵育60 min。PBS冲洗3次,加入适量POD转换剂,37 ℃孵育30 min。PBS冲洗后加入适量底物显色液,显微镜下控制显色时间。梯度乙醇脱水,二甲苯透明后中性树胶封片。于400倍光学显微镜下观察耳蜗各回所对应的螺旋神经节内细胞的凋亡情况,阳性细胞的细胞核染成棕黄色并伴有不同程度的形态改变或固缩。

2结果
2.1ABR检测噪声暴露前、后各组动物ABR阈值见表1。正常对照组实验前、后ABR阈值差异无统计学意义(P>0.05),单纯噪声组动物接噪后ABR反应阈值明显高于噪声暴露前(P<0.01)。噪声暴露后,染料木素保护组阈值显著低于单纯噪声组(P<0.05)。

表1 各组动物给药前、后ABR阈值变化情况±s)
注:a示与正常对照组比较P<0.01;b示与染料木素保护组比较P<0.05;C示与正常对照组比较,P<0.05
2.2耳蜗基底膜铺片及SDH染色正常对照组豚鼠耳蜗在光学显微镜下可见排列整齐的3排外毛细胞和1排内毛细胞,毛细胞内有深紫蓝色沉淀,细胞染色均匀、轮廓清晰,SDH活性较强(图1)。单纯噪声组豚鼠耳蜗毛细胞SDH染色明显减弱;细胞排列紊乱、轮廓不清,外毛细胞明显受损,其中以第一、二回损伤较为严重;而内毛细胞基本正常。接噪过程中给予染料木素保护的豚鼠耳蜗毛细胞SDH染色比正常变浅,外毛细胞也有部分损伤缺失;但与单纯噪声组比较,毛细胞SDH染色基本正常,细胞缺失数量明显减少,排列基本规则。
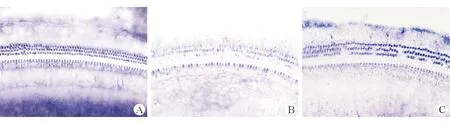
图1. 3组豚鼠耳蜗螺旋神经节细胞TUNEL染色结果(400×)A. 正常对照组;B. 单纯噪声组;C. 染料木素保护组
2.3耳蜗外毛细胞计数400倍显微镜下选取耳蜗基底膜各回连续3个视野,观察外毛细胞缺失率。正常对照组外毛细胞排列整齐,无明显缺失;单纯噪声组豚鼠耳蜗外毛细胞呈片状缺失,损伤严重,缺失率达41.7%,数量明显多于染料木素保护组(25.7%)(P<0.01)(表2)。
2.43组耳蜗螺旋神经节TUNEL染色光学显微镜下观察,正常对照组豚鼠耳螺旋神经节内未发现明显的棕黄色TUNEL染色阳性细胞。单纯噪声组豚鼠耳蜗各回对应的螺旋神经节内均发现胞核固缩、呈棕黄色的TUNEL阳性细胞,并且部分螺旋神经节细胞发生空泡样改变甚至缺失;其中底回对应的螺旋神经节内阳性细胞数量最多并伴有明显的细胞缺失。给予染料木素保护的豚鼠耳螺旋神经节内也有TUNEL阳性细胞出现,并伴有细胞缺失,但数量比单纯噪声组动物明显减少(图2)。
表2 各组动物实验后3个视野外毛细胞计数±s;个)
注:a示与对照组比较,P<0.01;b示与染料木素保护组比较,P<0.01;c示与正常对照组比较,P<0.05
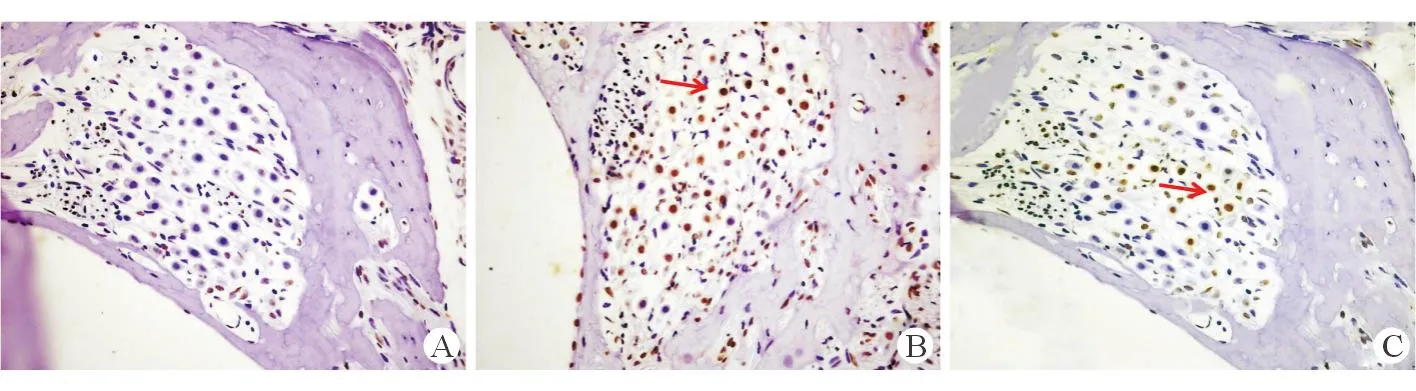
图2.3组豚鼠耳蜗螺旋神经节TUNEL染色结果(400×)
A. 正常对照组豚鼠耳蜗螺旋神经节未见棕黄色阳性凋亡细胞;B. 单纯噪声组,螺旋神经节内可见大量棕黄色、核固缩的阳性细胞(如箭头所示);C. 染料木素保护组,可见少量的TUNEL阳性细胞
3讨论
NIHL是指人们长期遭受噪声或短时接受强噪声而导致的一种感音神经性聋。近年来,其发病率呈现逐年升高的趋势;因此,如何预防NIHL的发生,降低其听觉损害已成为一项亟须解决的课题。
本实验应用115 dB SPL强度的稳态噪声对豚鼠进行持续暴露,NIHL组动物接触噪声后ABR阈值明显升高,阈移平均超过30 dB;耳蜗底回和中回外毛细胞及对应的螺旋神经节内神经元损伤严重。这些损伤特点与文献[7]报道一致,成功建立了NIHL动物模型。关于NIHL的详细发病机制目前尚未明确,但是通过以往的研究可知,NIHL的发生主要与噪声所致的内耳氧自由基增加、微循环障碍及能量代谢紊乱有关[8]。线粒体既是细胞内能量代谢的主要场所,又是细胞自由基生成的主要部位,因此线粒体功能是否正常与NIHL的发生有着密切的联系。SDH是存在于细胞线粒体内膜的一种重要氧化还原酶,参与三羧酸循环的ATP生成过程,因其定位清楚,已成为检测线粒体功能的标志酶[9]。本实验通过SDH染色,观察动物接触噪声后内耳毛细胞线粒体功能及能量代谢的改变。实验结果显示,噪声暴露后,耳蜗毛细胞内SDH染色明显变浅,伴有大片缺失,说明噪声引起毛细胞内线粒体呼吸链显著破坏,进而减少了ATP的生成,加速了能量代谢的衰竭;同时使毛细胞内产生大量的自由基,最终导致了毛细胞的损伤与死亡,引起听觉功能障碍。因此,可以认为线粒体的能量转换在NIHL的发生中起着关键作用。
关于NIHL的防治一直是耳科学研究的热点问题。近几年的研究[1,10-11]发现,雌激素对听觉系统具有保护作用。有研究[12]指出,内耳毛细胞及螺旋神经节上存在大量的ER,雌激素可作用于内耳发挥作用,清除内耳自由基,改善内耳微循环,保护线粒体功能,从而对听觉功能起到保护作用。雌激素的这种作用为研发NIHL的防治药物提供了新的思路;但临床研究发现,长期使用雌激素可增加罹患生殖系统恶性肿瘤的风险,对于患者而言其带来的危害远大于收益,因此大大限制了它的应用[13]。所以寻找一种既能够发挥雌激素样保护作用又没有严重不良反应的替代品是研究重点。染料木素的化学结构与雌二醇相似,可与雌激素受体结合发挥作用,而且能防止雌激素替代治疗出现的严重不良反应,被认为是雌激素的天然替代品,已逐渐受到人们的关注[14]。但染料木素对听功能是否具有保护作用尚罕见报道,因此本实验观察了染料木素对NIHL的作用。结果表明,染料木素能明显减轻动物接触噪声后所致的ABR阈值提高、耳蜗外毛细胞损伤及螺旋神经节内神经元的凋亡,说明染料木素能保护动物的听功能,对NIHL具有一定的防护作用。其作用机制可能与染料木素的雌激素样作用有关,染料木素可与内耳毛细胞及螺旋神经节内神经元上的ER结合,发挥抗氧化、清除自由基、改善微循环的作用,从而保护线粒体的功能,防止毛细胞的大量损伤;而染料木素减轻螺旋神经元凋亡的作用可能与其促进神经营养因子的释放、保护神经元的功能有关[15]。当然,染料木素的详细作用机制还有待进一步的研究。
综上所述,本实验利用NIHL动物模型,首次揭示了植物雌激素染料木素对NIHL的保护作用,这为研究NIHL的防治提供了新的策略及实验依据。
参 考 文 献
[1]王刚,吴玮,韩浩伦,等. 雌激素对模拟失重及噪声条件下豚鼠听功能的影响[J].中华耳科学杂志,2013,11(2):293-295.
[2]Hultcrantz M, Simonoska R, Stenberg AE. Estrogen and hearing: a summary of recent investigations[J]. Acta Otolaryngol, 2006 ,126(1):10-14.
[3]Stenberg AE,Wang H,Sahlin L,et al.Mapping of estrogen receptors alpha and beta in the inner ear of mouse and rat [J].Hear Res,1999,136 (1/2): 29-34.
[4]Horner KC,Troadec JD,Dallaporta M,et al. Effect of chronic estradiol administration on vimentin and GFAP immunohistochemistry within the inner ear[J]. Neurobiol Dis,2009,35(2):201-208.
[5]Saha S,Sadhukhan P,Sil PC.Genistein: a phytoestrogen with multifaceted therapeutic properties[J]. Mini Rev Med Chem,2014,14:920-940.
[6]Polkowski K,Mazurek AP.Biological properties of genistein. A review of in vitro and in vivo data[J].Acta Pol Pharm,2000,57(2):135-155.
[7]茅犁春,赵荣祥,叶再元.天麻素对噪声性聋听觉脑干诱发电位及耳蜗毛细胞的影响[J]. 医学研究杂志,2013,42(7):80-83.
[8]韩维举,陈星睿.噪声暴露引起耳蜗损伤机制的研究[J]. 中华耳科学杂志,2013,11(3):357-362.
[9]杨卫平,胡博华.噪声暴露后耳蜗凋亡与坏死毛细胞琥珀酸脱氢酶活性的变化[J]. 中华耳科学杂志,2007,5(2):198-201.
[10]Kosus N,Kosus A,Turhan NO.Discrepancy in improvement of hearing loss between left and right ears after postmenopausal hormone therapy[J].Med Hypotheses,2011,76(3):447-449.
[11]Liu M,Kelley MH,Herson PS,et al.Neuroprotection of sex steroids[J]. Minerva Endocrinol,2010,35(2):127-143.
[12]Stenberg AE,Wang H,Fish J 3rd,et al. Estrogen receptors in the normal adult and developing human inner ear and in Turner syndrome[J].Hear Res,2001,157(1/2):87-92.
[13]Narod SA.Hormone replacement therapy and the risk of breast cancer[J]. Nat Rev Clin Oncol,2011,8(11):669-676.
[14]罗思,婧黄庆,任冬冬,等.染料木素的神经保护作用及其机制的研究进展[J]. 广东药学院学报,2011,21(1):94-97.
[15]黄志华,李良东,韩立民.染料木素的脑保护作用及机制研究进展[J]. 中国药理学与毒理学杂志,2015,29(1):141-146.
(本文编辑杨美琴)
Protection of genistein against noise-induced hearing loss
XIAOBing,JIANGMing-chun*,KANGSong-jian*,SUNXian-chang*.
Tai’anFouthSanatoriumforRetiredCadres,Tai’anMilitarySubarea,Tai’an271000,China
【Abstract】ObjectiveTo investigate the effects of genistein on preventing noise-induced hearing loss(NIHL) in guinea pigs. MethodsThirty healthy guinea pigs with normal auricle reflex were randomly divided into the following 3 groups (10 guinea pigs in each group): treatment group with saline (1 mL/kg), treatment group with genistein (10 mg/kg), and normal control group treated with saline(1 mL/kg). The drug administration lasted for a consecutive 10 days. After 3 days of administration, all of the animals except for normal group were simultaneously exposed to steady white noise at 115 dB SPL for 4 h/d, and lasted for 7 days. Auditory brainstem response(ABR) was tested to study the variation of the auditory function. The morphological changes of hair cells were observed on the stretched preparation of basilar membrane. The variety of succinate dehydrogenase(SDH) of hair cells was observed by light microscope. The apoptosis of spiral ganglion cells was observed by terminal deoxynucleotide transferase-mediated deoxyuridine triphosphate-biotin nick end labeling method. ResultsThere was no significant difference(P>0.05) between ABR threshold values of the three groups before noise exposure.After noise exposure, the ABR threshold value was significantly increased in the simple noise group(P<0.01). However, animals that received genistein treatment showed a significantly lower ABR threshold(P<0.01) . The SDH chemical reaction color obviously disappeared in cochlear hair cells of guinea pigs in noise group;there was a light change of the SDH level in genistein-treated animals compared to normal animals.Compared to the noise group,the apoptosis of spiral ganglion cells were significantly lower in treatment group with genistein. ConclusionsGenistein can reduce the injury of the cochlear induced by NIHL and protect the vitality of mitochondrial respiratory enzyme in the cochlear hair cells. (Chin J Ophthalmol and Otorhinolaryngol,2016,16:84-87,95)
【Key words】Genistein; Noise-induced hearing loss; Estrogen; Hair cell; Succinate dehydrogenase;Apoptosis
(收稿日期2015-05-12)
DOI:10.14166/j.issn.1671-2420.2016.02.005
通讯作者:孙宪昌(Email: hotsss@163.com)
Corresponding author:SUN Xian-chang, Email: hotss@163.com
作者单位:泰安军分区第四干休所卫生所泰安271000;*泰山医学院生理教研室泰安271000
