Th17/Treg在儿童腺样体肥大发病机制中的作用△
2016-05-13倪坤赵利敏吴佳欐陈伟李晓艳
倪坤 赵利敏 吴佳欐 陈伟 李晓艳
·临床研究·
Th17/Treg在儿童腺样体肥大发病机制中的作用△
倪坤赵利敏吴佳欐陈伟李晓艳
【摘要】目的研究腺样体不同肥大程度患儿外周血及腺样体组织中辅助性T细胞17(Th17)和调节性T细胞(Treg)比值及相关因子白细胞介素17(IL-17)、IL-10、转化生长因子β(TGF-β)的含量是否有差异。方法将86例经多导睡眠监测(PSG)诊断为阻塞性睡眠呼吸暂停低通气综合征(OSAHS)的患儿根据腺样体大小分为中度肥大组(腺样体Ⅲ度肥大)、重度肥大组(腺样体Ⅳ度肥大)和轻度肥大组(腺样体Ⅰ~Ⅱ度肥大,即对照组)。采用流式细胞仪测定入组病例外周血及腺样体组织中的Th17、Treg含量,酶联免疫吸附试验测定IL-17、IL-10、TGF-β的含量。结果外周血及腺样体组织中,Th17/Treg比值在腺样体肥大组均增加,重度肥大组Th17/Treg比值升高程度比中度肥大组更明显(P<0.05)。TGF-β含量随着腺样体肥大的严重程度增加而明显降低(P<0.05),IL-17、IL-10含量变化与腺样体大小无明显关系(P>0.05)。结论Th17/Treg在腺样体肥大患儿外周血及腺样体局部均升高,并且与腺样体肥大程度相关。(中国眼耳鼻喉科杂志,2016,16:103-106,110)
【关键词】腺样体肥大;Th17/Treg;转化生长因子β;儿童
△基金项目:上海市卫生局青年科研项目(20124Y058);上海市科学技术委员会科研计划项目(12411952407)
腺样体肥大是我国儿童中的常见病、多发病,该病可导致分泌性中耳炎、鼻窦炎、鼾症等多种疾病的发生。腺样体组织属于上呼吸道黏膜相关淋巴系统,是咽淋巴环的重要组成部分,鼻咽部及其毗邻部位的炎症或腺样体自身的炎症反复刺激使腺样体发生病理性增生[1]。腺样体暴露于气道,受多种外界刺激后发生免疫激活,启动免疫反应,局部效应免疫细胞和调节免疫细胞之间平衡的异常导致炎症反应迁延不愈,久之引起腺样体增生、肥大。已有国内、外学者研究发现,腺样体肥大患者腺样体组织或外周血液中效应T细胞的数目和功能有变化,研究主要限于辅助性T细胞1 (helper T cell 1, Th1)/Th2平衡紊乱在发病中的意义。本课题以学龄前儿童为研究对象,通过对外周血及腺样体组织的检测分析,初步探讨Th17/调节性T细胞(regulatory T, Treg)在腺样体慢性感染导致增生肥大发病机制中的作用。
1资料与方法
1.1资料2013年9月~2014年12月,就诊于我院的患儿86例,其中男性42例、女性44例;平均年龄(5.37±1.21) 岁。经询问病史,排除分泌性中耳炎,心血管、内分泌、泌尿系统疾病,代谢性疾病及神经肌肉病;纤维鼻咽镜检查诊断为腺样体肥大。所选病例均无阿司匹林特异性反应、支气管扩张、自身免疫性疾病等病史,2周内无上呼吸道感染,无变应性鼻炎、哮喘等变应性疾病史,皮肤点刺试验结果为阴性。
对86例患儿进行多导睡眠监测(polysomnogram, PSG)检查,根据2007年《儿童阻塞性睡眠呼吸暂停综合征的治疗指南》,阻塞性呼吸暂停指数(obstructive apnea index,OAI)>1次/h或阻塞性呼吸暂停低通气指数(obstructive apnea hypopnea index,AHI)>5次/h,最低血氧饱和度<92%时可诊断为阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome, OSAHS)。纤维鼻咽镜检查:根据腺样体堵塞后鼻孔的程度进行分组,堵塞后鼻孔0~25%为Ⅰ度,26%~50%为Ⅱ度,51%~75%为Ⅲ度,76%~100%为Ⅳ度[2]。对86例儿童进行分组,Ⅲ度为中度肥大组,Ⅳ度为重度肥大组,Ⅰ~Ⅱ度为正常组。
1.2实验方法
1.2.1外周血Th17和Treg的测定
1)外周血单个核细胞(peripheral blood mononuclear cell, PBMC)的制备。肝素抗凝管采集静脉血3 mL,分2管装。采集后在4 h内加入等体积的Hank平衡盐缓冲液(Hank balanced salt solution, HBSS; pH=7.2~7.4)稀释血液;取与稀释后血液等体积的淋巴细胞分层液(Ficoll液),加入离心管中,将稀释血液小心地加到淋巴细胞分层液上,注意保持两者界面清晰,室温下离心20 min,2 000 r/min。用毛细吸管轻轻吸出单个核细胞层,加入含有5 mL HBSS的试管中,充分混匀;1 500 r/min,离心10 min,弃上清液后,再洗1次。弃上清夜,用RPMI-1640重悬单个核细胞,用台酚蓝染色计数活细胞数(应在95%以上)。调节细胞浓度为2×106细胞/mL。
2)细胞培养。取PBMC悬液(2×106/mL)加入T25培养瓶内,每瓶3 mL,加入佛波脂酸(PMA)(50 ng/mL,Sigma公司,美国),伊屋诺霉素(ionomycin caicium salt)(1 μg/mL,Sigma公司,美国)和布雷菲德菌素A(BFA,10 μg/mL)置培养箱中共刺激培养5 h,37 ℃,5%CO2。
3)上机进行人 Th17/Treg 的流式分选。实验操作按照BD公司(560762)说明书。
1.2.2腺样体组织Th17和Treg的测定手术摘除的腺样体先于75%乙醇溶液中冲洗10 s,或再用磷酸盐缓冲液 +10%双抗清洗组织。于RPMI-1640不完全培养液中冲洗10 s。无菌条件下剪除周围组织,将腺样体实质剪碎,用注射器针芯在40 mmol/L筛网中研磨,用10%胎牛血清+RPMI-1640制成单细胞悬液。通过密度梯度离心方法(Bicoll, Biochrom, 德国)纯化其中的单核细胞。倒置荧光显微镜下拍照、观察。单细胞悬液的培养及流式测定同外周血操作。
1.2.3酶联免疫吸附试验法测定白细胞介素-17、白细胞介素-10、转化生长因子-β抽取空腹静脉血3 mL,置于干管中,经2 000 r/min,离心15 min 后取上层清液,-20 ℃保存备用。制备腺样体单细胞悬液保存备用。酶联免疫吸附试验法( enzyme linked immunosorbent assay, ELISA) 测定白细胞介素17(interleukin 17, IL-17)、IL-10 转化生长因子β(transforming growth factorβ, TGF-β) 含量,ELISA 试剂盒购自EBIOSCIENCE公司,所有操作严格按照试剂盒说明进行。
1.3统计学处理各组数据经检验符合正态分布,两两比较Th17/Treg、IL-17、IL-10、TGF-β的水平。2组间比较采用独立样本t检验;3组间比较采用方差分析。所有统计学数据均由SPSS 17.0软件完成,组间差异用P<0.05判断。
2结果
2.1病例基本资料入组病例均为3~6岁学龄前儿童,各组间年龄差异无统计学意义。经PSG检查,对照组AHI及血氧饱和度在正常范围内,OSAHS组AHI均高于对照组(P<0.05),且夜间最低血氧饱和度与对照组相比,差异有统计学意义。然而,OSAHS组内,中度肥大组与重度肥大组,AHI差异不明显,缺氧程度的差异也不明显(表1)。

表1 86例患儿的基本资料
注:a示与对照组比较,差异有统计学意义(P<0.05);b示与对照组比较,差异有统计学意义(P<0.05)
2.2外周血样本Th17/Treg比值正常组Th17/Treg比值为0.69±0.68,中度肥大组为6.06±3.32,重度肥大组为12.24±4.58,3组间比较,差异有统计学意义(P=0.008,P<0.05);3组间两两比较,P值均<0.05,即外周血3组间的Th17/Terg差异显著(图1)。
2.3腺样体组织Th17/Treg比值Th17/Treg比值在对照组、腺样体中度肥大组及重度肥大组分别为0.80±0.72、6.88±5.87和14.29±1.29。3组间经方差分析,差异有统计学意义(P=0.033,P<0.05)。两两比较,P值均<0.05,即外周血3组间Th17/Terg比值是有差异的(图2)。
2.4外周血和腺样体组织内细胞因子测定结果检测结果详见表2。TGF-β含量随着腺样体肥大的严重程度而明显降低(P<0.05),IL-17、IL-10含量与腺样体大小无明显关系。
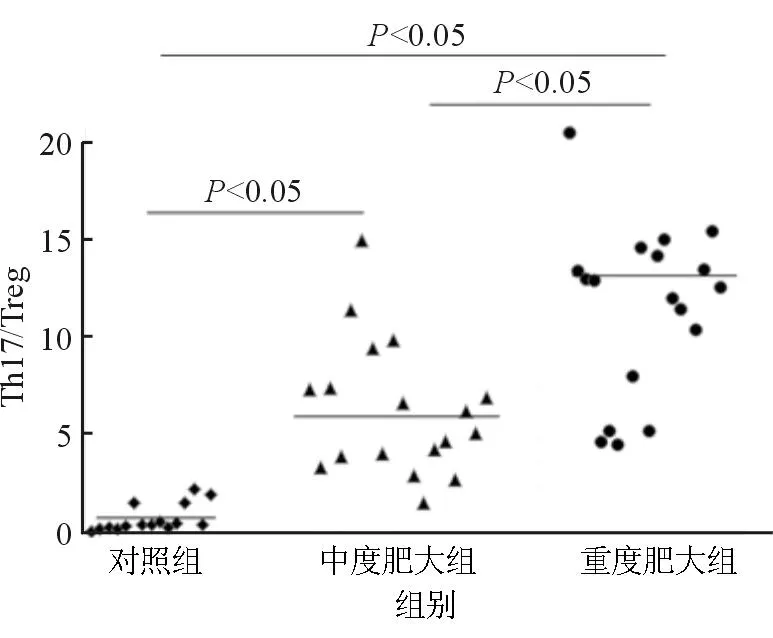
图1. 3组外周血样本Th17/Treg比值 图2. 3组腺样体组织Th17/Treg比值
注:a示中度肥大组与对照组相比(P=0.018 5,P<0.05);b示重度肥大组与对照组相比(P=0.000 64,P<0.01);c示重度肥大组与对照组及中度肥大组相比(P=0.0370,P<0.05)
3讨论
腺样体肥大的发病机制目前尚不清楚。有许多国、内外学者[3-6]研究发现,腺样体肥大患者腺样体组织或外周血中效应T细胞的数目和功能有变化,对腺样体肥大主要并发症——渗出性中耳炎的研究也提示腺样体局部Th1、Th2细胞亚群的变化对中耳炎发病有重要意义[7-10]。Th17细胞是一类独立于Th1、Th2的T细胞亚群,主要分泌IL-17A。Treg是不同于Th1和Th2细胞的一种免疫调节细胞,能使机体通过调节外周免疫耐受。Th17主要参与促炎反应,对抗细胞外致病因子的侵害。Treg则在自身免疫耐受及对抗排斥反应和过敏性疾病中发挥重要作用。Treg的抑制功能通过抑制性细胞因子IL-10和TGF-β介导。有研究[11]表明,在类风湿关节炎、细菌性肺炎、哮喘和实验性自身免疫性脑炎等炎症状态下,IL-17水平均显著升高,机体内除了Th1/ Th2 平衡外,还存在Treg /Th17 平衡[12]。Noack等[13]再次重申,Th17具有促炎作用,而Treg具有拮抗作用,二者的发展相互关联,它们之间存在一个可塑性的平衡关系。Th17/Treg平衡紊乱与许多自身免疫性疾病或炎症性疾病的发生有关,Th17的功能及其与Treg、Th1、Th2的相互关系越来越引起研究者的关注[14-15]。
在我们的研究结果中,Th17细胞数目在腺样体肥大组均明显增加,Th17/Treg比值与腺样体大小相关。全身免疫状态,即外周血Th17/Treg比值升高与腺样体肥大严重程度相关,腺样体局部Th17/Treg紊乱亦与腺样体肥大程度相关。早期研究[16]已知,睡眠紊乱可引起Treg数量和功能的降低。在一项成人阻塞性睡眠呼吸暂停综合征(obstructive sleep apnoea syndrome, OSAS)研究[17]中发现,OSAS患者外周血中Th17/Treg比值上调,并与OSAS严重程度呈正相关。该研究证实,睡眠紊乱可能是引起全身Th17/Treg平衡紊乱的一个触发因素,Th17/Treg比值升高最终引起持续性全身炎症状态。此研究结果揭示了成人OSAS的全身免疫状态。我们的结果也证实,腺样体肥大导致的OSAHS,患儿外周血Th 17/Treg比值升高,与以往研究结果一致。
小儿鼻咽部淋巴组织的研究[18-19]表明,肺炎链球菌感染组Treg数目增加,Treg的升高可能导致腺样体局部致病菌持续存在。Sade等[20]研究发现,腺样体肥大患儿腺样体组织局部Th17/ Treg比值与患儿的临床评分呈显著负相关,Th17/ Treg细胞亚群比例下降可能在腺样体肥大的发病中起作用。这与我们的结果不同,分析可能是存在病程的影响和(或)全身Th17/ Treg比例对局部Th17/ Treg的影响。急性感染时,局部组织炎性反应,其中IL-17可以促进CD4+T细胞分化为Th17,同时在TGF-β减少的环境中,抑制Treg的发育,导致Th17/Treg比例升高。若致病因素导致腺样体局部Th17下降或是Treg升高,局部慢性炎症持续存在,将导致腺样体增生肥大,此时腺样体局部Th17/Treg比值下降;而睡眠紊乱将随着腺样体增生明显而逐渐加重,势必引起全身Treg逐渐下降,即全身Th17/Treg比值持续升高。全身Th17/Treg比值的长期失衡可能会影响腺样体局部Th17/Treg比值,导致局部Th17/Treg比值升高,抗炎作用增强恢复。已经增生肥大的腺样体将继续阻塞上气道,睡眠紊乱没有解决,故全身Th17/Treg比值仍升高。因此,病程末局部及全身的Th17/Treg比值均升高。我们认为,Th17/Treg比值是一个揭示免疫状态的重要指标,与儿童腺样体肥大及OSAHS的严重程度密切相关。
TGF-β含量随着腺样体肥大的严重程度而明显降低,这提示重度肥大的腺样体组织中,TGF-β减少明显,符合长期全身炎症状态下,局部淋巴组织 Treg功能受抑制,Th17增多的免疫反应过程,从而间接支持重度肥大的腺样体组织中Th17/Treg升高更明显的结论。但我们也观察到,IL-17及Treg的重要功能因子IL-10的含量并不像其他文献报道的在各组间差异有统计学意义,分析可能是在免疫反应中,各因子之间的相互作用呈网状结构,并不是单纯的单向作用;并且在不同的病程阶段也发生不同的免疫反应,呈现不同的功能状态,故不能依靠单纯的细胞因子含量来解释病情。
本研究仍存在一定不足。研究病程未细化。本次纳入研究的对象病程长短不一,最短为6个月,最长为5年,平均2.3年。不同的病程可能对Th17/Treg比值影响不同。要考虑局部炎性刺激引起的淋巴细胞增生后自身免疫调节机制的作用,也应考虑和研究全身比值变化对局部的影响,这些可能与病程长短有重要关系。因为研究未将病程作为研究因素,故缺乏相关解释的科学依据。另外还应考虑治疗药物的影响,比如部分患儿有使用鼻用糖皮质激素史。此类药物是否改变局部Th17/Treg比值,还未可知。
综上所述,本研究提供了直接证据提示Th17/ Treg在腺样体肥大患儿外周血及腺样体局部均升高,并且与腺样体肥大程度相关,这为研究腺样体肥大发病机制提供了数据。在本研究结论基础上,可以进一步细化病程,研究Th17/ Treg比值在腺样体发病过程中的变化及其影响因素,从而明确Th17/ Treg比值对临床上儿童腺样体肥大的病情评估和治疗预后的评价作用。
参 考 文 献
[1]黄选兆,汪吉宝.实用耳鼻喉头颈外科学[M].2版.北京: 人民卫生出版社,2008: 307-308.
[2]张亚梅,张天宇.实用小儿耳鼻咽喉科学[M].北京:人民卫生出版社,2011: 313.
[3]Dyugovskaya L,Lavie P,Lavie L.Lymphocyte activation as a possible measure of atherosclerotic risk in patients with sleep apnea[J]. Ann N Y Acad Sci,2005,1051: 340-350.
[4]施俊, 吕静荣, 吴皓.OSAHS患儿血清Th1 /Th2细胞因子检测及临床意义[J].上海交通大学学报( 医学版),2010,30(10):1243-1245.
[5]赵娜, 韩在文, 徐禛,等.腺样体肥大伴阻塞性睡眠呼吸暂停低通气综合征患儿T淋巴细胞亚群的分布[J].临床合理用药,2010,3(2):23-24.
[6]Elazowska,Rutkowska B, Wysocka J, et al. Expression Bcl2 protein of lymphocytes T and B in hypertrophied adenoid in children with otitis media with effusion [J]. Otolaryngol Pol,2006, 60( 5) : 737-742.
[7]Ratomski K, Zelazowska-Rutkowska B, Wysocka J, et al. Expression of adhesion molecule CD28 on subpopulation s of lymphocytes in hypertrophied adenoids in children with otitis media with effusion [J]. Otolaryngol Pol,2006, 60( 6) : 873-877.
[8]张淑君,岳卓立. 分泌性中耳炎免疫学发病机制的研究进展[J].疑难病杂志,2010,9(1) : 72-73.
[9]Ratomski K, Zelazowska-Rutkowska B, Wysocka J, et al.CD80 and CD86 coreceptors expression on lymphocytes B in hypertrophied adenoids in children with otitis media with effusion[J].Otolaryngol Pol,2010,64(2):93-97.
[10]Chng SY, Goh DY, Wang XS, et al. Snoring and atopic disease: a strong association [J]. Pediatr Pulmonol,2004,38 ( 3 ):210 -216.
[11]Afzali B, Lombardi G, Lechler RI, et al. The role of T helper 17 (Th17) and regulatory T cells (Treg) in human organ transplantation and autoimmune disease[J]. Clin Exp Immunol,2007,148(1):32-46.
[12]Bettelli E,Carrier Y,Gao W,et al. Reciprocal developmental pathways for the generation of pathogenic effector Th17 and regulatory T cells[J]. Nature,2006,441(7090):235-238.
[13]Noack M,Miossec P.Th17 and regulatory T cell balance in autoimmune and inflammatory diseases[J] . Autoimmun Rev,2014,13(6):668-77.
[14]Kohno M,Tsutsumi A,Matsui H,et al. Interleukin-17 gene expression in patients with rheumatoid arthritis[J]. Mod Rheumatol,2008, 18(1):15-22.
[15]Wong CK,Lit LC,Tam LS,et al. Hyper production of IL-23 and IL-17 in patients with systemic lupus erythematosus: implications for Th17-mediated inflammation in auto-immunit[J]. Clin Immunol,2008,127(3): 385-393.
[16]Bollinger T,Bollinger A,Skrum L,et al.Sleep-dependent activity of T cells and regulatory T cells[J]. Clin Exp Immunol,2009,155(2): 231-238.
[17]Ye J, Liu H, Zhang G,et al. The treg/th17 imbalance in patients with obstructive sleep apnoea syndrome[J].Mediators Inflamm, 2012:1-11.
[18]Zhang Q,Leong SC,McNamara PS,et al.Characterisation of regulatory T cells in nasal associated lymphoid tissue in children: relationships with pneumococcal colonization[J].PLoS Pathogens,2011,7(8) : 1-10.
[19]Jiang XL,Zhang GL,Yang T,et al.Association of pneumococcal carriage and expression of Foxp3+ regulatory T cells and Th17 cells in the adenoids of children[J].Respiration,2015,90(1):25-32.
[20]Sade K,Fishman G,Kivity S,et al. Expression of Th17 and Treg lymphocyte subsets in hypertrophied adenoids of children and its clinical significance[J].Immunol Invest,2011,40(6) : 657-66.
(本文编辑杨美琴)
Role of Th17/Treg balance in the pathogenesis of adenoidal hypertrophy in children
NIKun,ZHAOLi-min,WUJia-li,CHENWei,LIXiao-yan.
DepartmentofOtolaryngologyHeadandNeckSurgery,ShanghaiChildren’sHospitalofShanghaiJiaotongUniversity,Shanghai200060,China
【Abstract】ObjectiveTo evaluate the ratio of help T cell 17(Th17) and regulatory T(Treg), as well as the expression of related interleukin 17(IL-17), IL-10, transforming growth factor β (TGF-β), in both peripheral blood and adenoid tissue in children with different degrees of hypertrophy. MethodsEighty-six children were included and were divided into three groups.All the children were grouped according to the polysomnogram( PSG) examination. The children who were diagnosed as obstructive sleep apnea hypopnea syndrome (OSAHS) combined with adenoid hypertrophy of Ⅲ degree were the moderate hypertrophy group, adenoid hypertrophy of IV degree were the severe group, and those who were not OSAHS but with adenoid hypertrophy of Ⅰ~Ⅱ degree were the control group.The peripheral blood and adenoid tissues of all children were collected.The determination of Th17 and Treg content was done by using flow cytometry, and the determination of content of IL-17, IL-10, TGF- β was done by using enzyme linked immunosorbent asscy (ELISA) method. ResultsThe ratioes of Th17/Treg in in peripheral blood and ad enoid tissue were all significantly increased in adenoid hypertrophy groups, especially in severe adenoid hypertrophy group(P<0.05). TGF-β content was decreased significantly with the severity of adenoid hypertrophy (P<0.05), but there was no significant relationship between IL-17, IL-10 content and adenoid size. ConclusionsThe rising of Th17/Treg ratio was observed in both the peripheral blood and adenoid tissues in children with adenoidal hypertrophy, and the increasing degree has a correlation with adenoid size. (Chin J Ophthalmol and Otorhinolaryngol,2016,16:103-106,110)
【Key words】Adenoid hypertrophy;Th17/Treg;Transforming growth factor β;Child
(收稿日期2015-05-11)
DOI:10.14166/j.issn.1671-2420.2016.02.010
通讯作者:李晓艳(Email: chhshent@163.com)
Corresponding author:LI Xiao-yan, Email: chhshent@163.com
作者单位:上海市儿童医院上海交通大学附属儿童医院耳鼻咽喉头颈外科上海200060
