环介导等温扩增技术快速检测肉中金黄色葡萄球菌
2016-05-11赵玥明满朝新曲艳艳姜毓君东北农业大学食品学院乳品科学教育部重点实验室哈尔滨50030东北农业大学国家乳业工程技术研究中心哈尔滨50086
赵玥明,满朝新,曲艳艳,姜 霞,姜毓君,(东北农业大学食品学院/乳品科学教育部重点实验室,哈尔滨 50030;东北农业大学国家乳业工程技术研究中心,哈尔滨 50086)
环介导等温扩增技术快速检测肉中金黄色葡萄球菌
赵玥明1,满朝新2,曲艳艳1,姜霞1,姜毓君1,2
(1东北农业大学食品学院/乳品科学教育部重点实验室,哈尔滨150030;2东北农业大学国家乳业工程技术研究中心,哈尔滨150086)
摘要:应用环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术建立了对肉中金黄色葡萄球菌检测的方法。实验中,使用了最新的Bst 2.0 WarmStart DNA聚合酶完成LAMP扩增反应,并针对金黄色葡萄球菌所特有的保守性耐热核酸酶基因(nuc)设计得到了一套LAMP扩增引物。对LAMP法和PCR法的检测灵敏度进行了比较,同时对人工污染肉中的金黄色葡萄球菌进行检测。结果表明:所建立的LAMP法能够特异性的检测金黄色葡萄球菌,并且检测金黄色葡萄球菌纯菌的灵敏度为2.01×100CFU/mL,是普通PCR检测灵敏度的100倍。在检测肉中金黄色葡萄球菌时,检测限为2.01×101CFU/mL。因此,本实验所建立的LAMP法检测肉中金黄色葡萄球菌的方法,具有灵敏、快速以及简便等的优点,是一种具有很好的发展前景的检测手段。
关键词:环介导等温扩增;金黄色葡萄球菌;肉
常见的食源性致病菌主要有金黄色葡萄球菌、沙门氏菌、单核增生性李斯特菌等,其中金黄色葡萄球菌是一类在人类和动物中常见的病原体[1],可以引起皮肤和软组织感染、败血症、骨髓炎和肺炎等疾病[2,3]。该菌种通过传染及毒素介导而导致食物中毒[2]。有文献已经报道了金黄色葡萄球菌在肉、牛奶以及奶酪等食品中导致了食源性疾病的暴发[4-6],因而检测肉中的金黄色葡萄球菌方法的建立有着很重要的作用。
进入21世纪以来,分子生物学技术已经应用在各个检测领域[7]。目前针对食源性致病菌的快速检测方法,主要集中在PCR技术、基因芯片技术、ELISA法、生物传感器技术等,但都存在着一定程度上的不足[8]。例如,PCR技术已经被应用于检测多种致病菌,但是PCR技术需要昂贵的热循环仪器,经验丰富的实验人员并且需要扩增几个小时[9]。为了克服PCR技术的不足,环介导等温扩增(LAMP)技术是近几年发展起来的一门新技术,在60~65℃之间进行恒温扩增[10]。该扩增反应通过自主序列复制和链置换的扩增方式,使得扩增产物形成类似花椰菜结构,电泳时呈现出阶梯式图谱,在1h内完成反应,因此缩减了检测时间,并且LAMP反应可在水浴锅中进行,极大的降低实验成本[11]。因此,该方法具有准确、快速、简便等的特点。
本实验应用最新研发出来的Bst 2.0 WarmStart DNA聚合酶进行LAMP反应体系的构建,使得较之前的大片段DNA聚合酶所构建的LAMP反应[9,12,13],该酶在2012年首次得以应用[14]。根据实验结果可知,该酶具有许多优点,例如,可以提高反应速率,提高持续的合成能力,较普通的Bst大片段DNA聚合酶具有更好的热稳定性[14-16]。本实验所建立的环介导等温扩增技术检测肉中金黄色葡萄球菌的方法,达到了更为稳定、快速、特异、灵敏的检测目的,具有更好的应用前景。
1 材料与方法
1.1材料与仪器
实验所用菌株见表1。
Bst 2.0 WarmStart DNA聚合酶,New England Biolabs;细菌基因组DNA提取试剂盒以及Taq PCR Master-Mix,北京天根生物技术有限公司;甜菜碱(Betaine),美国Sigma公司; dNTP,北京天根生物技术有限公司; DNA marker,北京百泰克生物技术有限公司;琼脂糖,西班牙Biowest公司; Tc-25/H型基因扩增仪,美国PCR Kin Elmer Gene Amp; DYY-10C型电泳仪,北京市六一仪器厂; UVP凝胶成像仪,美国UVP公司。
1.2实验方法
1.2.1不同菌种的培养以及DNA模板的提取取金黄色葡萄球菌ATCC13565作为标准菌株,3株金黄色葡萄球菌(ATCC25923、CMCC26074、CMCC26075)作为参考菌株以及其他25株非金黄色葡萄球菌菌株进行特异性实验。金黄色葡萄球菌及其他菌种,分别活化培养于NB以及复合增菌培养基BPW中,37℃培养过夜。分别吸取对数生长期的菌悬液1mL,采用细菌基因组提取试剂盒提取细菌DNA,将所得到的DNA模板于-20℃保存备用。

表1 实验所用菌株及来源
1.2.2 LAMP引物的设计与合成在GenBank中寻找到金黄色葡萄球菌耐热核酸酶基因(nuc),该基因具有特异性好的特点,并且具有高度的保守性。因此,本文应用此特异性基因nuc序列进行引物的设计[50,81]。采用在线的Primer Explorer4.0引物设计软件,针对特异性的目的片段设计得到了一套特异性引物,如表2所示。
1.2.3 LAMP反应体系的建立及反应条件的优化
LAMP反应体系(25μL)包括:内引物FIP和BIP、外引物F3和B3、MgCl2、脱氧核糖核苷酸(dNTPs)、甜菜碱、DNA模板、10×Buffer、Bst 2.0 WarmStart DNA聚合酶,灭菌水补足体系。将混合物在65℃恒温60min进行扩增,之后将体系加热到80℃持续5min以终止反应。选择对LAMP体系中的关键因素进行优化,包括镁离子浓度(2、4、6、8、10mmol/L)、dNTP浓度(0.4、0.8、1.2、1.6、2mmol/L)、外引物与内引物浓度比(1∶2、1∶4、1∶6、1∶8、1∶10)、甜菜碱浓度(0、0.4、0.8、1.2、1.6mol/L)、Bst 2.0 WarmStart DNA聚合酶(0.5、0.6、0.7、0.8、0.9、1μL),根据LAMP扩增后电泳图条带的有无和亮度选择最适条件,建立LAMP反应体系。
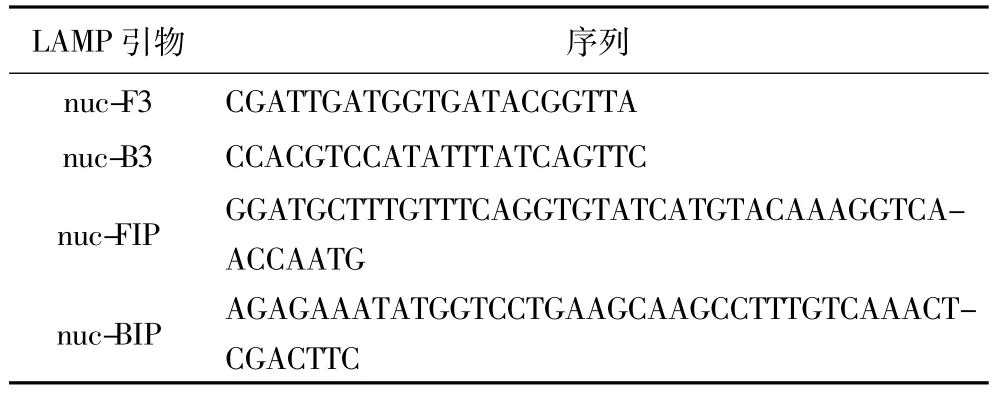
表2 金黄色葡萄球菌nuc基因LAMP引物序列
建立LAMP反应体系后,将反应体系分别在61℃、62℃、63℃、64℃及65℃条件下进行扩增反应,确定最适反应温度。并在确认的最适反应温度下,进行LAMP反应,分别扩增15、30、45、60、75min,扩增后进行2%琼脂糖凝胶电泳,确定LAMP反应的最适反应条件。
1.2.4 LAMP检测金黄色葡萄球菌的特异性按照1.2.1的方法,提取4株金黄色葡萄球菌以及其他26株非金黄色葡萄球菌的DNA,分别作为LAMP反应的模板,进行扩增反应,取扩增后的产物5μL进行2%琼脂糖凝胶电泳,观察实验结果。
1.2.5 LAMP及PCR方法检测金黄色葡萄球菌灵敏度的比较应用平板计数法得到初始菌液浓度为2.01× 109CFU/mL。取1mL处于对数生长期的金黄色葡萄球菌纯培养液,用0.85%生理盐水进行10倍梯度稀释。用试剂盒对不同浓度的金黄色葡萄球菌菌液提取基因组DNA,并作为模板分别进行PCR和LAMP反应。分别取5μL反应产物进行琼脂糖凝胶电泳,获得实验结果。
建立PCR法检测金黄色葡萄球菌的反应体系为25μL: 12.5μL of Taq PCR MasterMix,1μL F3以及1μL B3,2μL模板DNA,用蒸馏水补足体系至25μL。反应条件: 94℃预变性5min,94℃变性30s,64℃退火45s,72℃延伸30s,30个循环,72℃延伸5min。取5μL PCR反应产物,在1.5%琼脂糖凝胶上电泳,观察扩增效果。
1.2.6 LAMP检测人工污染肉中金黄色葡萄球菌购买鲜肉25g,经国标法确认肉中不含金黄色葡萄球菌。按照国标法GB 4789.10—2010,将所购买的25g鲜肉放入含有225mL BPW的无菌均质袋中,混匀后每25mL为1组,分装10组,分别添加109~100CFU/mL不同浓度的金黄色葡萄球菌2.5mL,制成金黄色葡萄球菌浓度为108~10-1CFU/mL的人工污染肉浆,应用试剂盒提取每组中的金黄色葡萄球菌DNA作为模板,分别进行LAMP反应。
2 结果与分析
2.1 LAMP反应体系的建立及反应条件的优化
通过优化LAMP反应体系,确立了最终LAMP反应体系为: 0.4mmol/L的F3及B3,2.4mmol/L的FIP和BIP,4mmol/L MgCl2,2mmol/L dNTPs,0.4mol/L甜菜碱,0.9μL的Bst 2.0 WarmStart DNA聚合酶(8U),2.5μL 10×Buffer及2μL模板。最佳反应条件为:在64℃条件下,对金黄色葡萄球菌标准菌株ATCC13 565采用优化的LAMP体系扩增60min。扩增后电泳结果如图1,阳性组呈现出LAMP产物所特有的梯状条带,而以灭菌水为模板的空白组,则未出现梯状条带。
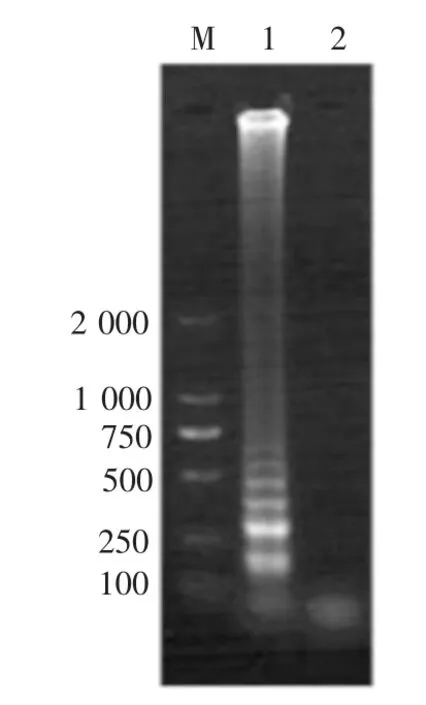
图1 金黄色葡萄球菌LAMP检测结果
2.2 LAMP检测金黄色葡萄球菌的特异性
4株金黄色葡萄球菌为模板的泳道均有LAMP特异性的条带产生,而其他26株非金黄色葡萄球菌均呈阴性,无特异性的梯形条带。结果如图2所示。
2.3 LAMP及PCR法检测金黄色葡萄球菌灵敏度的比较
原始金黄色葡萄球菌菌液浓度为2.01×109CFU/mL,从图3可知,2.01×109~2.01×100CFU/mL都有典型的LAMP扩增产物的梯形条带,而2.01×10-1CFU/mL未见LAMP扩增。由此可见,LAMP方法检测金黄色葡萄球菌的检测灵敏度为2.01×100CFU/mL。对比图4可知,PCR法检测金黄色葡萄球菌的灵敏度是2.01× 102CFU/mL。通过比较可知,本实验所建立的LAMP法检测金黄色葡萄球菌的检出限是PCR法的100倍。
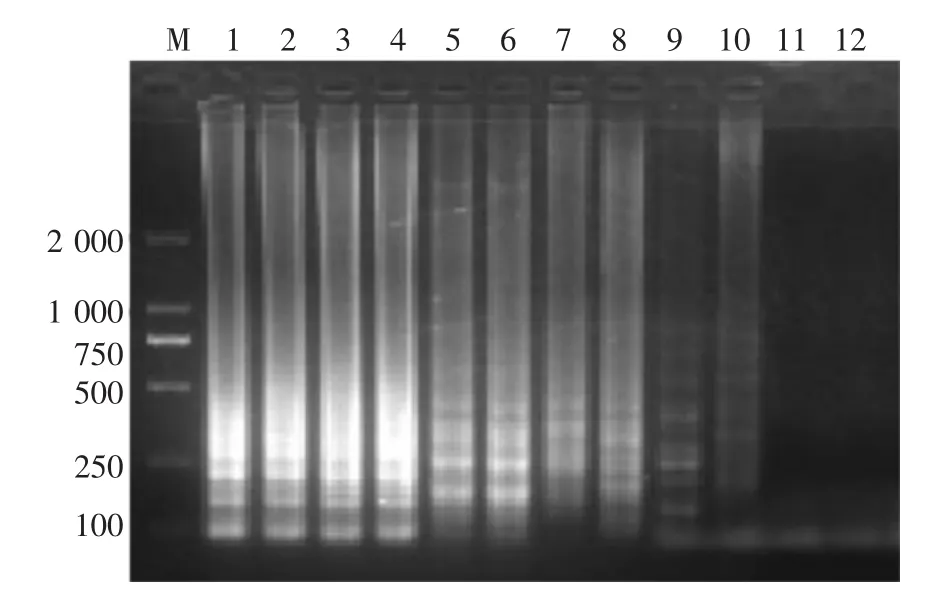
图2 LAMP检测金黄色葡萄球菌灵敏度电泳图
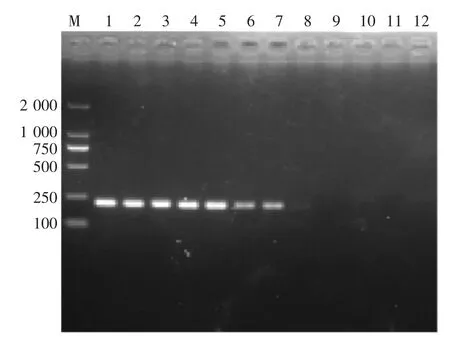
图3 PCR检测金黄色葡萄球菌纯菌的灵敏度电泳图
2.4 LAMP检测人工污染肉浆中金黄色葡萄球菌的灵敏度
如1.2.6中所示,人工污染肉浆中金黄色葡萄球菌的浓度为2.01×108~2.01×10-1CFU/mL,分别进行LAMP扩增反应,LAMP法检测人工污染肉浆中金黄色葡萄球菌的检出限为2.01×101CFU/mL (图4)。

图4 LAMP检测人工污染肉中金黄色葡萄球菌的灵敏度电泳图
3 讨论
目前,基于核酸扩增检测食源性致病菌的方法已得到了飞速的发展。针对于金黄色葡萄球菌的检测方法,主要围绕着传统的分离培养和生化鉴定相结合的方法、PCR法以及荧光定量PCR法[17-19]。近几年已有应用Bst大片段DNA聚合酶进行LAMP扩增检测金黄色葡萄球菌,但都未从肉基质中进行检测[19]。而本文应用了Biolab公司最新研发出的Bst 2.0 WarmStart DNA聚合酶进行LAMP扩增。该酶较传统的Bst大片段DNA聚合酶的优点在于,该酶是热启动酶,无需低温条件下配制反应体系,即可保证酶催化反应的特异性,从而使反应更适合于现场的食源性致病菌检测,为该方法的实际应用创造了更大的可能。经比较得知传统的分离培养检测方法需要5d左右,PCR及荧光定量PCR法需要3~4h,LAMP方法只需1h即可扩增109倍从而达到检测目的[10]。同时,也有报道称LAMP反应不易受食品基质中成分的抑制作用,对DNA模板纯度要求不高[20]。因此可知,LAMP检测方法具有快速、特异、灵敏等的优点。然而,正因为LAMP方法的高灵敏性,导致了该方法易产生假阳性的污染问题。因此,要特别注意实验的分区操作,从而防止假阳性的产生。此外,LAMP检测方法所具有的高特异性,是由于该方法识别了目的片段的6个区域,需要设计4条特异性引物,因而导致了反应复杂因素增多。
本研究应用了最新的Bst 2.0 WarmStart DNA聚合酶建立了LAMP技术检测肉中金黄色葡萄球菌的方法。由于该方法具有灵敏、快速以及简便的优点,使得该方法为基层检测提供了一个新的思路,具有很好的发展前景,在食品安全检测领域有望得到广泛的应用。
参考文献
[1]Spanu,V.,et al.Virulence factors and genetic variability of Staphylococcus aureus strains isolated from raw sheep's milk cheese[J].International Journal of Food Microbiology,2012.153(1-2) :53-57.
[2]Crago,B.,et al.Prevalence of Staphylococcus aureus and methicillin-resistant S.aureus (MRSA) in food samples associated with foodborne illness in Alberta,Canada from 2007 to 2010[J].Food Microbiology,2012,32(1) :202-205.
[3]Talan,D.A.,et al.Comparison of Staphylococcus aureus From Skin and Soft-Tissue Infections in US Emergency Department Patients,2004 and 2008[J].Clinical Infectious Diseases,2011.53(2) :144-149.
[4]O'Brien,M.,et al.Occurrence of foodborne pathogens in Irish farmhouse cheese[J].Food Microbiology,2009,26 (8) :910-914.
[5]Asao,T.,et al.An extensive outbreak of staphylococcal food poisoning due to low-fat milk in Japan: estimation of enterotoxin A in the incriminated milk and powdered skim milk [J].Epidemiology and Infection,2003,130(1) :33-40.
[6]Pu,S.H.,F.F.Han,and B.L.Ge.Isolation and characterization of methicillin-resistant Staphylococcus aureus strains from Louisiana retail meats[J].Applied and Environmental Microbiology,2009,75(1) :265-267.
[7]周巍,等.HDA法用于检测肉中金黄色葡萄球菌的研究[J].现代食品科技,2014,1:185-189.
[8]李春梅,陶小春.食源性致病菌快速检测方法研究进展[J].医学理论与实践,2014,5:590-592.
[9]Nguyen Tien,H.,et al.Development of a single-tube loopmediated isothermal amplification assay for detection of four pathogens of bacterial meningitis[J].Fems Microbiology Letters,2012,337(1) :25-30.
[10]Notomi,T.,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12) : E63.
[11]Tomita,N.,et al.Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products[J].Nature Protocols,2008,3(5) :877-882.
[12]Zhao,X.,et al.Loop-Mediated Isothermal Amplification Assay Targeting the femA Gene for Rapid Detection of Staphylococcus aureus from Clinical and Food Samples[J].Journal of Microbiology and Biotechnology,2013,23(2) :246-250.
[13]徐义刚,等.食品中金黄色葡萄球菌DNA环介导恒温扩增快速检测方法的建立与应用[J].中国农业科学,2010,8:1655-1663.
[14]Tanner,N.A.,Y.Zhang,and T.C.Evans Jr,Simultaneous multiple target detection in real-time loop-mediated isothermal amplification[J].Biotechniques,2012,53(2) :81-89.
[15]Niessen,L.,et al.The application of loop-mediated isothermal amplification (LAMP) in food testing for bacterial pathogens and fungal contaminants[J].Food Microbiology,2013,36(2) :191-206.
[16]Denschlag,C.,et al.Niessen.Hyd5gene based analysis of cereals and malt for gushing-inducing Fusarium spp.by realtime LAMP using fluorescence and turbidity measurements [J].International Journal of Food Microbiology,2013,162 (3) :245-251.
[17]汪学荣,彭祥伟.PCR技术检测肉中食源性病原菌的研究进展[J].肉类工业,2010,7:52-55.
[18]苏明权,等.实时荧光定量PCR检测金黄色葡萄球菌方法的试验研究[J].国际检验医学杂志,2010,8: 794-796.
[19]荣蓉,等.实验动物金黄色葡萄球菌LAMP检测方法的建立[J].中国比较医学杂志,2012:4,68-72.
[20]Kaneko,H.,et al.Tolerance of loop-mediated isothermal amplification to a culture medium and biological substances [J].Journal of Biochemical and Biophysical Methods,2007,70(3) :499-501.
(责任编辑李燕妮)
Rapid Detection of Staphylococcus aureus in Raw
Meat Samples by Loop-mediated Isothermal Amplification
ZHAO Yue-ming1,MAN Chao-xin2,QU Yan-yan1,JIANG Xia1,JIANG Yu-jun1,2
(1Key Lab of Dairy Science,Ministry of Education,College of Food Science,Northeast Agricultural University,Harbin 150030,China;2National Research Center of Dairy Engineering and Technology,Northeast Agricultural University,Harbin 150086,China)
Abstract:We established a method to detect Staphylococcus aureus in meat by loop-mediated isothermal amplification.During the experiment,using the latest Bst 2.0 WarmStart DNA polymerase to finish the LAMP amplification reaction,and against S.aureus-specific nuclease resistant conserved gene (nuc) designed LAMP amplification primers.the detection sensitivity of LAMP and the PCR method were compured,while was detect Staphylococcus aureus.the artificially contaminated meat The results showed that the built LAMP method could specifically detect Staphylococcus aureus,and Staphylococcus aureus bacteria in pure sensitivity 2.01×100CFU / mL,which was 100 times the normal PCR detection sensitivity.the detection limit of detecting Staphylococcus aureus in meat was 2.01×101CFU / mL.Thus,the LAMP method to detect Staphylococcus aureus in meat was established,which had the advantage of sensitive,rapid and simple,which was a kind of good prospects for development of testing methods.
Keywords:loop-mediated isothermal amplification; Salmonella aureas; meat
通讯作者:姜毓君(1971—),男,博士,教授,研究方向:食品科学。
作者简介:赵玥明(1990—),女,在读博士研究生,研究方向:食品科学。
基金项目:国家科技支撑计划课题(项目编号: 2012BAD28B02、2013BAD18B11、2012BAD29B07)。
