依那西普滴眼液用于小鼠干眼症的效果及其机制
2016-05-10冯刚李世玮李晖
冯刚,李世玮,李晖
(1 锦州医科大学附属第一医院,辽宁锦州121000;2 上海健康医学院附属第六人民医院东院)
依那西普滴眼液用于小鼠干眼症的效果及其机制
冯刚1,李世玮2,李晖2
(1 锦州医科大学附属第一医院,辽宁锦州121000;2 上海健康医学院附属第六人民医院东院)
目的 观察依那西普滴眼液用于小鼠干眼症的效果,并探讨其作用机制。方法 将苯扎氯铵溶液诱导的30只干眼症小鼠随机分为干眼组、PBS组、依那西普组,每组10只。干眼组不予任何处理,PBS组、依那西普组分别给予PBS、0.1%依那西普滴眼液滴眼,连用14天。滴眼前(第0天)及滴眼第7、14天检测泪液分泌量、泪膜破裂时间和角膜荧光素钠染色评分(角膜染色评分)。滴眼第14天处死小鼠,检测结膜组织IL-1β、IL-17、TNF-α表达。结果 各组滴眼前泪液分泌量、泪膜破裂时间和角膜染色评分比较差异无统计学意义(P均>0.05)。与滴眼前比较,依那西普组滴眼第7、14天泪液分泌量增加、泪膜破裂时间明显延长,角膜染色评分明显降低(P均<0.05),干眼组各指标变化不明显(P均>0.05);与PBS组、干眼组滴眼第7、14天比较,依那西普组同时间点泪液分泌量增加、泪膜破裂时间明显延长,角膜染色评分明显降低(P均<0.05),而PBS组、干眼组同期上述各指标比较差异均无统计学意义(P均>0.05)。滴眼第14天,依那西普组结膜组织上清液炎症因子IL-1β、IL-17和TNF-α水平明显低于干眼组(P均<0.05),而PBS组、干眼组比较差异均无统计学意义(P均>0.05)。结论 依那西普滴眼液可减轻苯扎氯铵诱导的干眼症小鼠的临床症状,其机制可能与抑制IL-1β、IL-17、TNF-α等炎症因子水平有关。
干眼症;依那西普;炎症因子;小鼠
干眼症是指任何原因造成的泪液质或量异常,或泪液的动力学异常,导致泪膜稳定性下降,并伴有眼部不适和(或)眼表组织病变特征的多种疾病的总称[1]。主要表现为眼睛干涩,有异物感、痒感、烧灼感,并有畏光、眼部充血、视物模糊、易疲劳等。目前对干眼症的常规治疗是人工泪液滴眼,但仅能缓解症状。已有研究证实,炎症因子(如TNF-α、IL-1等)可参与眼部多种疾病的发生、发展。在某些眼部炎症性疾病,如难治性葡萄膜炎、巩膜炎、周边溃疡性角膜炎等,全身应用TNF-α抑制剂治疗效果较好[2,3]。但全身应用TNF-α抑制剂对干眼症的效果尚不一致[4~6]。鉴于TNF-α在干眼症动物结膜组织中高表达,我们推测局部应用TNF-α抑制剂可改善干眼症状,并避免全身用药引起的肝肾损伤等。2015年9~12月,我们观察了TNF-α抑制剂依那西普滴眼液对苯扎氯铵诱导的小鼠干眼症的治疗效果。现报告如下。
1 材料与方法
1.1 材料 健康雄性BALB/c小鼠50只,8周龄,体质量(18±3)g,由锦州医科大学动物实验中心提供,动物许可证号:SYXK(辽)2014-0010。常规饲养,自由摄食、饮水。饲养环境:室温(25±1)℃,相对湿度40%,模拟灯光昼夜更替(9:00~21:00)。主要仪器及试剂:S350S型裂隙灯显微镜,上海美沃精密仪器有限公司;酚红棉线,日本Yokota公司;722型可见光分光光度计,上海光学仪器一厂;苯扎氯铵粉末,上海瑞齐生物科技有限公司;PBS,美国Gibco公司;依那西IFN-γ普,辉瑞制药有限公司;戊巴比妥钠,美国Sigma公司;荧光素钠溶液,广西梧州制药(集团)股份有限公司;小鼠IL-17、TNF-α ELISA试剂盒,上海酶联生物科技有限公司;小鼠IL-1β ELISA试剂盒,上海逸峰生物科技有限公司。
1.2 干眼模型制备 所有小鼠适应性喂养1周制备干眼症模型:每日8:00、18:00给予0.2%苯扎氯铵溶液5 μL(0.2 g苯扎氯铵粉末溶于99.8 mL去离子水)滴眼,连用14天。第15天评估干眼情况,记录泪液分泌量,取最接近均数的30只小鼠纳入后续实验。
1.3 动物分组及药物干预 选取干眼小鼠30只,随机分为干眼组、PBS组、依那西普组,每组10只。PBS组次日开始给予PBS 2 μL滴眼,依那西普组给予0.1%依那西普滴眼液(依那西普25 mg加入25 mL PBS中)2 μL滴眼,6 h滴眼1次,连用14天。干眼组不予任何处理。
1.4 相关指标观察
1.4.1 泪液分泌量、泪膜破裂时间和角膜荧光素钠染色评分(角膜染色评分) 泪液分泌量:滴眼前(第0天)及滴眼第7、14天当日15:00,腹腔注射1%戊巴比妥40 mg/kg全身麻醉后拉开下睑,用眼科显微镊夹持酚红棉线,将其置于下结膜囊中外1/3处,停留60 s取出。显微镜下读取湿润变红的酚红棉线长度(mm)。泪膜破裂时间:泪液分泌量检测后用玻璃棒蘸取1%荧光素钠溶液1 μL,滴入结膜囊内,手动瞬目3次,扒开睑裂,裂隙灯显微镜钴蓝光下观察。秒表计时,记录最后一次瞬目到角膜第1个黑斑出现的时间。重复3次,取平均值。角膜染色评分:上述荧光素钠滴入90 s时,裂隙灯显微镜钴蓝光下观察角膜上皮荧光素钠染色情况。参照Lemp等[7]评分标准:0分为无着染;1分为点状着染;2分为斑块状着染,并有部分融合区;3分为大量融合的斑块状着染或片状着染。角膜分为中央区、鼻侧区、颞侧区、上区、下区,5个区得分相加即为染色评分。最低0分,最高15分。得分越高表示干眼症越严重。
1.4.2 结膜组织IL-1β、IL-17、TNF-α水平 滴眼第14天,所有动物断头处死,立即摘除眼球,取下结膜组织,置于含蛋白酶抑制剂的裂解液中30 min,以3 000~4 000 r/min离心15 min,收集上清,储存于-70 ℃,备测。采用双抗体夹心ELISA法检测结膜组织IL-1β、IL-17、TNF-α,所有操作严格按试剂盒说明书进行。

2 结果
2.1 各组泪液分泌量、泪膜破裂时间、角膜染色评分比较 见表1。
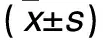
表1 各组泪液分泌量、泪膜破裂时间、角膜染色评分比较
注:与同组第0天比较,*P<0.05;与同组第7天比较,△P<0.05;与干眼组同时间比较,#P<0.05;与PBS组同时间比较,▲P<0.05。
2.2 各组结膜组织IL-1β、IL-17、TNF-α水平比较 见表2。
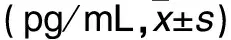
表2 各组结膜组织IL-1β、IL-17、TNF-α水平比较
注:与干眼组比较,*P<0.05;与PBS组比较,#P<0.05。
3 讨论
苯扎氯铵滴眼可以造成小鼠泪液分泌量减少,泪膜破裂时间缩短,眼表上皮损伤以及角膜上皮鳞状化生、杯状细胞减少等眼表结构功能的变化,是一种较好的干眼动物模型制作方法[7]。近年研究表明,免疫性炎症可能在干眼症的发病中具有重要作用,特别是美国FDA批准了免疫制剂——环孢素A可用于干眼症的治疗,使免疫制剂在干眼症的研究中越来越受到关注。TNF-α是众多免疫性炎症因子之一,多种自身免疫性炎性疾病可通过抑制内源性TNF-α的产生来进行治疗。研究发现,胶原诱导的关节炎小鼠全身应用TNF-α抑制剂可增加淋巴结内Th1、Th17细胞数量,减轻关节炎症状[8];抗TNF-α抗体可用于炎症性肠道疾病和银屑病等自身免疫性疾病的治疗[9,10];TNF-α是干眼症患者泪液中主要的炎症因子之一[11~13],TNF-α及其受体在干眼症的发生、发展过程中有重要作用[14]。但关于TNF-α抑制剂全身用药对实验性及临床干眼症患者的效果尚存争议。Zhu等[15]在兔干眼模型中发现,TNF-α抑制基因转染可抑制干眼症的症状。而Vosters等[8]研究发现,TNF-α抑制剂对干眼症小鼠的治疗效果一般。临床研究也发现,口服或皮下注射TNF-α抑制剂对干眼症患者的疗效并不一致[4,6]。而局部应用TNF-α抑制剂治疗干眼症的研究鲜见报道。局部应用TNF-α抑制剂与全身用药相比,可避免全身用药的局部注射斑块、疼痛、靶器官药物浓度无法精准控制等缺点。本研究通过局部应用TNF-α抑制剂——依那西普,观察了依那西普滴眼液局部应用对干眼症的临床效果。
依那西普可通过拮抗TNF-α的功能,从而抑制炎症反应。本研究结果显示,各组滴眼前泪液分泌量、泪膜破裂时间和角膜染色评分比较差异均无统计学意义,说明三组动物的干眼症病情基本一致,后续结果的差异主要来自于用药的不同。与滴眼前相比,依那西普组滴眼第7、14天泪液分泌量增加、泪膜破裂时间明显延长、角膜染色评分明显降低,PBS组、干眼组各指标变化不明显;与PBS组、干眼组滴眼第7、14天比较,依那西普组滴眼同期泪液分泌量增加、泪膜破裂时间明显延长、角膜染色评分明显降低,而PBS组、干眼组同期上述各指标比较差异均无统计学意义。滴眼第14天,依那西普组结膜组织上清液炎症因子IL-1β、IL-17和TNF-α水平均明显低于PBS组、干眼组,而PBS组、干眼组比较差异均无统计学意义。表明依那西普滴眼液可改善苯扎氯铵诱导的干眼症小鼠的临床症状。局部应用TNF-α抑制剂可直接作用于炎性眼表,效果好于全身用药[14,16]。而干眼组、PBS组泪液分泌量、泪膜破裂时间、角膜染色评分及结膜组织中炎症因子在用药前后并无明显变化。表明PBS对干眼症状无缓解或改善作用。
依那西普制成滴眼液局部应用与以往全身用药对干眼症的作用差异可能与以下几个方面有关:①干眼模型的差异。既往全身应用TNF-α抑制剂的研究中,应用的是自身免疫性疾病干燥综合症动物模型或患者[4,6,8,15]。干燥综合征是一个主要累及外分泌腺体的慢性炎症性自身免疫性疾病,虽然干燥综合症与干眼症的临床表现有部分重合,但干燥综合症还伴有除泪腺以外的其他外分泌腺功能障碍。因此,干燥综合症与干眼症病理机制、临床表现等各方面的差异可能是造成本文与既往研究结果存在差异的原因。②用药方式的不同。本研究采用依那西普滴眼液局部用药,既往研究多采用全身用药,全身用药导致靶器官的药物浓度无法精确控制,而依那西普的不同浓度对炎症的作用并不相同,因此不排除全身用药后眼结膜局部的依那西普浓度与本研究0.1%依那西普的浓度差异导致结果的差异[17]。
分析本研究结果,依那西普滴眼液可改善干眼症的临床症状,其机制可能与抑制TNF-α及其他炎症因子水平有关。但本研究观察时间较短,其长期疗效还需进一步观察,且用于临床还需要临床病例进行验证。
[1] Nichols KK, Redfern RL, Jacob JT, et al. The definition and classification of dry eye disease: report of the definition and classification subcommittee of the international dry eye workshop(2007)[J]. Ocul Surf, 2007,5(2):75-92.
[2] Odorcic S, Keystone EC, Ma JJ. Infliximab for the treatment of refractory progressive sterile peripheral ulcerative keratitis associated with late corneal perforation: 3-year follow-up[J]. Cornea, 2009,28(1):89-92.
[3] Joseph A, Raj D, Dua HS, et al. Infliximab in the treatment of refractory posterior uveitis[J]. Ophthalmology, 2003,110(7):1449-1453.
[4] Sankar V, Brennan MT, Kok MR, et al. Etanercept in Sjogren′s syndrome: a twelve-week randomized, double-blind, placebo-controlled pilot clinical trial[J]. Arthritis Rheum, 2004,50(7):2240-2245.
[5] Zandbelt MM, de Wilde P, van Damme P, et al. Etanercept in the treatment of patients with primary sjogren's syndrome: a pilot study[J]. J Rheumatol, 2004,31(1):96-101.
[6] Moutsopoulos NM, Katsifis GE, Angelov N, et al. Lack of efficacy of etanercept in sjogren syndrome correlates with failed suppression of tumour necrosis factor alpha and systemic immune activation[J]. Ann Rheum Dis, 2008,67(10):1437-1443.
[7] Lin Z, Liu X, Zhou T, et al. A mouse dry eye model induced by topical administration of benzalkonium chloride[J]. Mol Vis, 2011(17):257-264.
[8] Vosters JL, Yin H, Roescher N, et al. Local expression of tumor necrosis factor-receptor 1: immunoglobulin G can induce salivary gland dysfunction in a murine model of sjogren′s syndrome[J]. Arthritis Res Ther, 2009,11(6):R189.
[9] Ghosh S, Panaccione R. Anti-adhesion molecule therapy for inflammatory bowel disease[J]. Therap Adv Gastroenterol, 2010,3(4):239-258.
[10] Lowes MA, Bowcock AM, Krueger JG. Pathogenesis and therapy of psoriasis[J]. Nature, 2007,445(7130):866-873.
[11] Lam H, Bleiden L, de Paiva CS, et al. Tear cytokine profiles in dysfunctional tear syndrome[J]. Am J Ophthalmol, 2009,147(2):198-205.
[12] Massingale ML, Li X, Vallabhajosyula M, et al. Analysis of inflammatory cytokines in the tears of dry eye patients[J]. Cornea, 2009,28(9):1023-1027.
[13] Yoon KC, Jeong IY, Park YG, et al. Interleukin-6 and tumor necrosis factor-alpha levels in tears of patients with dry eye syndrome[J]. Cornea, 2007,26(4):431-437.
[14] Taylor PC, Feldmann M. Anti-TNF biologic agents: still the therapy of choice for rheumatoid arthritis[J]. Nat Rev Rheumatol, 2009,5(10):578-582.
[15] Zhu Z, Stevenson D, Schechter JE, et al. Tumor necrosis factor inhibitor gene expression suppresses lacrimal gland immunopathology in a rabbit model of autoimmune dacryoadenitis[J]. Cornea, 2003,22(4):343-351.
[16] Chan KF, Siegel MR, Lenardo JM. Signaling by the TNF receptor superfamily and T cell homeostasis[J]. Immunity, 2000,13(4):419-422.
[17] Dong Y, Liu Y, Kou X, et al. The protective or damaging effect of Tumor necrosis factor-α in acute liver injury is concentration-dependent[J]. Cell Biosci, 2016(6):8.
上海健康医学院种子基金项目(HMSF-16-21-013)。
李晖(E-mail: lky0110@126.com)
10.3969/j.issn.1002-266X.2016.24.012
R777
A
1002-266X(2016)24-0037-03
2016-04-20)
