23株耐碳青霉烯类肠杆菌科细菌耐药基因分析
2016-05-10刘萍闫雪苗张坚磊穆红
刘萍,闫雪苗,张坚磊,穆红
(1天津市第一中心医院,天津300192;2天津医科大学)
23株耐碳青霉烯类肠杆菌科细菌耐药基因分析
刘萍1,闫雪苗2,张坚磊1,穆红1
(1天津市第一中心医院,天津300192;2天津医科大学)
目的 分析耐碳青霉烯类肠杆菌科细菌(CRE)的耐药情况及其耐药基因,为临床防治CRE感染提供依据。方法 收集23株CRE,采用全自动微生物分析系统行菌株鉴定和药敏试验,采用改良Hodge试验检测碳青霉烯酶表型,PCR扩增和基因测序技术检测其耐药相关基因(包括blaKPC、blaNDM、blaOXA、blaVIM、blaIMP)及分布。结果 23株CRE中,肺炎克雷伯菌11株,大肠埃希菌7株,阴沟肠杆菌2株,产酸克雷伯杆菌2株,枸橼酸杆菌1株。药敏试验结果显示,对碳青霉烯类抗生素亚胺培南的耐药率为95.65%,对美罗培南的耐药率为86.95%;23株菌株均对哌拉西林、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦耐药,耐药率为100%;对阿米卡星的耐药率为65.21%,对环丙沙星的耐药率为86.96%,对氨曲南的耐药率为91.30%。改良Hodge试验阳性16株、阴性7株。PCR法检出blaKPC型基因6株、blaNDM型基因6株、blaOXA型基因9株、blaVIM型基因2株,未检出blaIMP型基因。结论 23株CRE对多种抗生素耐药率均较高,其主要耐药基因型为OXA、KPC、NDM、VIM型碳青霉烯酶基因。
碳青霉烯酶肠杆菌科细菌;药物敏感试验;耐药基因
碳青霉烯类抗菌药物(如亚胺培南、美罗培南等)是β-内酰胺类抗菌药物,具有抗菌谱广、抗菌活性强等特点。但近年来由于碳青霉烯类抗菌药物的滥用,导致其耐药菌株广泛蔓延,尤其耐碳青霉烯类肠杆菌科细菌(CRE)的出现,使碳青霉烯类抗菌药物作为抗肠杆菌科细菌用药受到冲击。CRE的耐药机制极为复杂,已在世界范围内引起广泛关注[1,2]。2010年1月~2015年2月,我们分离了23株不重复的CRE,并检测其耐药相关基因。现分析结果,旨在为临床防治CRE感染提供依据。
1 材料与方法
1.1 材料 收集同期天津市第一中心医院从临床送检标本中分离出的23株CRE,不包括同一患者、同一部位、同一时期分离的重复菌株。细菌标本来源:痰液、尿液、胆汁、引流液、腹水、咽拭子及静脉血。试剂及仪器:Premix Taq、DNA Marker(DL-2000),日本TaKaRa公司;Vitek-2 Compact全自动微生物分析系统,法国生物梅里埃公司;ABI7500 PCR仪,美国ABI公司;电泳仪、凝胶成像分析系统,美国Bio-Rad公司。
1.2 实验方法
1.2.1 菌株鉴定和药敏试验 收集所有菌株,参照《全国临床检验操作规程》,采用Vitek-2 Compact全自动微生物分析系统进行细菌分离、鉴定。同时对菌株进行药敏试验,观察其对哌拉西林、哌拉西林/舒巴坦、头孢哌酮/舒巴坦、头孢他啶、亚胺培南、美罗培南、阿米卡星、环丙沙星、氨曲南的耐药情况。质控菌株为大肠埃希菌ATCC25922。
1.2.2 碳青霉烯酶表型检测 采用改良Hodge试验。使用无菌生理盐水将大肠埃希菌ATCC25922菌悬液调至0.5麦氏浊度,1∶10稀释后接种于M-H琼脂平板,干燥3~10 min,在平板中心贴敷含10 μg厄他培南的纸片,用接种环挑取3~5个待测菌株从纸片边缘向平板边缘划线,长度20~25 mm,35 ℃温箱孵育16~20 h。若待测菌产碳青霉烯酶,其接种线与大肠埃希菌菌ATCC25922抑菌环交界处会产生向抑菌圈内增强生长的现象,即改良Hodge试验阳性;反之则为阴性。阳性质控株为Hodge(+)肺炎克雷伯菌,阴性质控菌株为肺炎克雷伯菌ATCC700603。
1.2.3 细菌耐药相关基因检测 收集细菌接种至血琼脂平板,置于孵箱内35 ℃过夜,分离培养获得单个菌落。挑取单个菌落,加入50 μL无菌双蒸水混匀,100 ℃沸水浴10 min,裂解细菌释放DNA,12 000 r/min离心5 min,检测上清液OD260/OD280,计算DNA含量,所得上清液分装并-20 ℃保存备用。根据GenBank数据库收录的序列设计引物,扩增碳青霉烯酶基因片段,包括blaKPC、blaNDM、blaOXA、blaVIM、blaIMP基因。扩增引物:blaKPC:上游引物5′-TGTCACTGTATCGCCGTC-3′,下游引物5′-CTCAGTGCTCTACAGAAAACC-3′,片段长度900 bp;blaNDM:上游引物5′-GCAGCTTGTCGGCCATGCGGGC-3′,下游引物5′-GGTCGCGAAGCTGAGCACCGCAT-3′,片段长度782 bp;blaOXA:上游引物5′-GCGTGGTTAAGGATGAACAC-3′,下游引物5′-CATCAAGTTCAACCCAACCG-3′,片段长度438 bp;blaVIM基因:上游引物5′-GTTTGGTCGCATATCGCAAC-3′,下游引物5′-AATGCGCAGCACCAGGATAG-3′,片段长度389 bp;blaIMP:上游引物5′-GAAGGCGTTTATGTTCATAC-3′,下游引物5′-GTACGTTTCAAGAGTGATGC-3′,片段长度587 bp。反应体系为25 μL,引物终浓度分别为blaKPC、blaVIM、blaIMP为0.3 μmol/L,blaNDM为0.4 μmol/L,blaOXA为0.5 μmol/L,模板量为1 μL。扩增条件:95 ℃预变性5 min,95 ℃变性45 s、60 ℃退火45 s、72 ℃延伸1 min,共35个循环,最后72 ℃延伸8 min。将扩增出的序列送上海立菲生物技术有限公司北京分公司测序,结果经美国国家生物技术信息中心行基本局部对比搜索工具(Blast)比对。
2 结果
2.1 菌株鉴定及药敏试验 本研究共收集CRE 23株,其中肺炎克雷伯菌11株、大肠埃希菌7株、阴沟肠杆菌2株、产酸克雷伯杆菌2株、枸橼酸杆菌1株。药敏试验结果显示,对碳青霉烯类抗生素亚胺培南耐药22株、中介1株,耐药率为95.65%;对美罗培南耐药20株、中介3株,耐药率为86.95%;23株菌株均对哌拉西林、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦耐药,耐药率为100%;对阿米卡星耐药15株,耐药率为65.21%;对环丙沙星耐药20株,耐药率为86.96%;对氨曲南耐药21株,耐药率为91.30%。
2.2 碳青霉烯酶表型 23株CRE中,改良Hodge试验阳性16株、阴性7株,阳性率为69.56%。
2.3 细菌耐药相关基因 23株CRE均扩增出阳性条带。其中blaOXA型基因9株,阳性率为39.13%;blaKPC型基因6株,阳性率为26.09%;blaNDM型基因6株,阳性率为26.09%;blaVIM型基因2株,阳性率为8.70%;未扩增出blaIMP型基因。扩增出的序列经Blast软件(http://www.ncbi.nlm.nih.gov/)比对,证实为KPC、NDM、OXA、VIM型碳青霉烯酶基因。各菌株耐药基因型分布见表1。
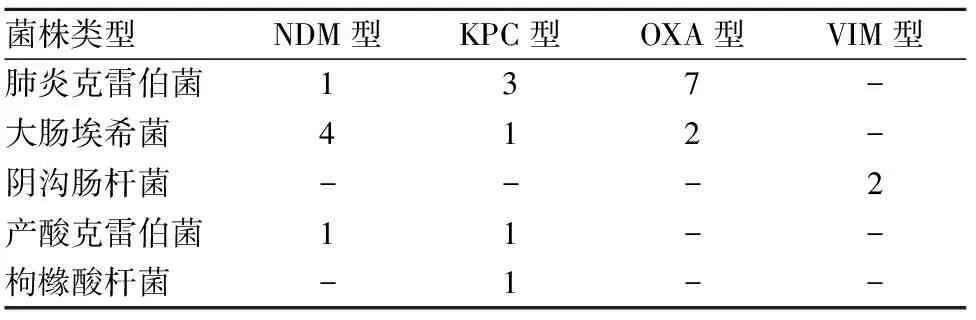
表1 23株CRE耐药基因型分布(株)
注:“-”表示该菌株无对应的耐药基因型。
3 讨论
近年来,随着广谱抗菌药物的广泛使用,细菌耐药性尤其是多重耐药性给抗感染治疗带来巨大困难,已成为全球关注的重要公共卫生问题之一。CRE已有许多国家和地区报道,我国某些地区也出现过耐碳青霉烯类药物的肺炎克雷伯菌暴发流行。其耐药机制主要有产生碳青霉烯酶、主动外排系统活跃、产生ESBLs或AmpC酶、外膜蛋白的缺失或数量减少,其中产碳青霉烯酶是主要耐药机制[3,4]。
本研究从临床送检标本中分离出23株CRE,其中肺炎克雷伯菌11株、大肠埃希菌7株,与纪明宇等[5]报道的耐药菌株流行情况基本一致。药敏试验结果显示,对碳青霉烯类抗生素亚胺培南的耐药率为95.65%,对美罗培南的耐药率为86.95%;对头孢菌素类抗生素头孢他啶、头孢哌酮/舒巴坦、半合成青霉素类抗生素哌拉西林全部耐药;对阿米卡星的耐药率为65.21%;对环丙沙星的耐药率为86.96%,对氨曲南的耐药率为91.30%。表明23株CRE均表现为多重耐药且耐药率均较高。
改良Hodge试验是美国临床实验室标准化协会(CLSI)推荐的碳青霉烯酶表型检测方法[6,7]。改良Hodge试验基于产酶菌株对美洛培南或厄他培南的耐药,是CLSI推荐的检测碳青霉烯酶表型的惟一筛查方法。本研究23株CRE,改良Hodge试验阳性16株。其阳性菌株较少的原因可能与某些菌株的碳青霉烯酶产量较低有关。
目前,在肠杆菌科细菌中,已发现的碳青霉烯酶主要是A、B、D类酶[8]。A类碳青霉烯酶水解碳青霉烯类、头孢菌素类、青霉素类和氨曲南等抗菌药物,包括SME、IMI、NMC、GES和KPC型等,其中KPC型最多[9]。KPC型碳青霉烯酶可水解碳青霉烯酶类抗菌药物的β-内酰胺酶,迄今为止全球已发现13个亚型[10]。我国自2007年起陆续有肠杆菌科细菌产KPC型碳青霉烯酶的报道,且主要为产KPC-2型[11]。本研究23株CRE菌株中,有7株携带blaKPC基因,可见KPC型碳青霉烯酶基因检出率较高。这7株菌均对碳青霉烯酶类、青霉素类、头孢菌素类和氨曲南等抗菌药物耐药,其耐药机制可能与A类碳青霉烯酶的水解机制有关。B类酶包括IMP、VIM和NDM等金属酶[12,13],其活性位点有Zn2+,能灭活青霉素类、头孢菌素类和碳青霉烯酶类抗生素,对氨曲南无水解活性。本研究23株CRE中,2株携带blaVIM基因,均为阴沟肠杆菌;6株携带blaNDM基因,4株为大肠埃希菌、1株为肺炎克雷伯菌、1株为产酸克雷伯菌;均对碳青霉烯类抗菌药物耐药,只有1株产酸克雷伯菌对氨曲南敏感,其他均耐药。在肠杆菌科细菌中发现D类酶中的OXA型酶,且不同细菌产OXA型酶亦不相同[14]。该类酶的底物谱狭窄,不能水解广谱头孢菌素和氨曲南,对亚胺培南的亲合力较高[15]。但水解效能较低,其耐药性表现有赖于膜通透性降低等其他耐药机制的协同作用[16,17]。本研究检测到9株OXA型酶菌株。这些菌株对碳青霉烯类、头孢菌素类、青霉素类和氨曲南以及氟喹诺酮类等抗菌药物均呈现耐药趋势。
本院23株CRE的耐药基因主要为KPC型、NDM型和OXA型碳青霉烯酶基因,为我院CRE院内感染的防控提供了依据。
[1] Arias CA, Murray BE. Antibiotic-resistant bugs in the 21st century-a clinical super-challenge[J]. N Engl J Med, 2009,360(5):439-443.
[2] 汪明,孙自镛,陈中举,等.碳青霉烯类耐药肠杆菌科细菌耐药机制研究[J].中华检验医学杂志,2012,35(4):339-334.
[3] Walther-Rasmussen J, Hoiby N. Class A carbapenemases[J]. J Antimicrob Chemother, 2007,60(3):470-482.
[4] Queenan AM, Bush K. Carbapenemases: the versatile beta-lactamases[J]. Clin Microbiol Rev, 2007,20(3):440-458.
[5] 纪明宇,耿大影,裴凤艳,等.KPC型碳青霉烯酶研究概况及进展[J].临床检验杂志,2013,31(4):282-285.
[6] Amjad A, Mirza Ia, Abbasi S, et al. Modified Hodge test: A simple and effective test for detection of carbapenemase production[J]. Iran J Microbiol, 2011,3(4):189-193.
[7] 胡丽庆,石玉波,等.宁波地区肠杆菌科细菌碳青霉烯酶基因的检测研究[J].中国微生态学杂志,2011,23(6):529-532.
[8] Martinez-Martinez L, Pascual A, Hernandez-Alles S, et al. Roles of beta-lactamases and porins in activities of carbapenems and cephalosporins against Klebsiella pneumoniae[J]. Antimicrob Agents Cheemother, 1999,43(7):1669-1673.
[9] 刘瑛,俞静,费奇力,等.产气肠杆菌对碳青霉烯酶类抗生素的耐药机制研究[J].上海交通大学学报(医学版),2013,33(3):275-279.
[10] Bornet C, Chollet R, Mallea M, et al. Imipenem and expression of multidrug efflux pump in Enterobacter aerogenes[J]. Biochem Biophys Res Commun, 2003,301(4):985-990.
[11] Zhang R, Zhou HW, Cai JC, et al. Plasmid-mediated carbapenem-hydrolysing beta-lactamase KPC-2 in carbapenem-resistant serratia marcescens isolates from Hangzhou, China[J]. J Antimicrob Chemother, 2007,59(3):574-576.
[12] 王丽娟,李武平,等.76例耐亚胺培南铜绿假单胞菌菌B类碳青霉烯酶与耐药现状研究[J].国际检验学杂志,2013,34(5):559-561.
[13] Kruttgen A, Razavi S, Imohl M, et al. Real-time PCR assay and a synthetic positive control for the rapid and sensitive detection of the emerging resistance gene New Delhi Metallo-β-lactamase-1(blaNDM-1)[J]. Med Microbiol Immunol, 2011,200(2):137-141.
[14] Ruiz E, Ocampo-Sosa AA, Alcoba-Florez J, et al. Changes in ciprofloxacin resistance levels in enterobacter aerogenes isolates associated with variable expression of the aac(6′)-Ib-cr gene[J]. Antimicrob Agents Chemother, 2012,56(2):1097-1100.
[15] 李文青,吴伟元,卢月梅,等.碳青霉烯不敏感鲍曼不动杆菌耐药性与碳青霉烯酶耐药基因检测[J].实用预防医学,2013,20(5):549-552.
[16] 钱菁菁,周翠,陈栎江,等.鲍曼不动杆菌OXA型碳青霉烯酶基因型检测分析[J].疾病检测,2014,29(7):556-559.
[17] 李智伟,王玲玲,秦文.鲍曼不动杆菌OXA碳青霉烯酶基因检测分析[J].中华医院感染杂志,2013,23(20):4868-4871.
国家临床重点专科建设项目(2013-544)。
穆红(E-mail: tjmuhong@sina.com)
10.3969/j.issn.1002-266X.2016.24.035
R37
B
1002-266X(2016)24-0091-03
2015-08-10)
